

Dr. Enric Contreras Barbeta
[Índice] [Objetivos] [Introducción] [Conceptos básicos] [Factores pronósticos] [F.P. paciente] [F.P. neoplasia] [Indices pronósticos] [Conclusiones] [Bibliografía]
Factores pronósticos dependientes del linfoma
SUBTIPO HISTOLÓGICO
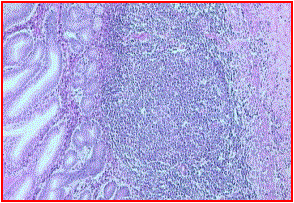
Es el factor pronóstico individual más importante en los linfomas no hodgkin. Su importancia ya se detectó en el estudio de las primeras grandes series de pacientes.
El patrón arquitectónico (folicular o difuso) y el aspecto citológico de las células dividen a los linfomas en grupos de significado pronóstico claramente diferenciados.
La importancia del subtipo histológico ha comportado múltiples intentos de clasificación de los diferentes tipos histológicos en grupos de pronóstico similar:
- Clasificación de Kiel (1974 y actualizaciones 1975, 1988, 1992)
- Clasificación de la Working Formulation (1982)
- Clasificación REAL (1994)
- Clasificación de la OMS (1997)
A modo de resumen podemos establecer una serie de principios pronósticos aplicados a la histología de los linfomas no hodgkin:
El patrón folicular confiere un buen pronóstico
Los linfomas formados mayoritariamente por células grandes, en general, presentan un comportamiento más agresivo que los de células pequeñas
Los linfomas linfoblásticos y los de Burkitt revisten un peor pronóstico debido a su comportamiento más agresivo.
En aquellos linfomas en los que coexisten histologías divergentes el pronóstico estará condicionado por la forma histológica más agresiva.
EXTENSION DE LA ENFERMEDAD (ESTADIO)
 El
estudio de extensión de los linfomas y su posterior clasificación por estadios
ha representado, hasta hace muy poco tiempo, la mejor valoración pronóstica
del enfermo.
El
estudio de extensión de los linfomas y su posterior clasificación por estadios
ha representado, hasta hace muy poco tiempo, la mejor valoración pronóstica
del enfermo.
El método más utilizado para la clasificación de los linfomas no Hodgkin en estadios es la sistematización de Ann Arbor, aunque este método fue desarrollado inicialmente para la enfermedad de Hodgkin.
Desde el año 1965 la enfermedad de Hodgkin se clasificaba según los estadios clínicos de Rye, pero esta clasificación tenía el inconveniente de no tener en cuenta las localizaciones extralinfáticas, por lo que en la reunión sobre enfermedad de Hodgkin que se celebró en 1971 en la localidad americana de Ann Arbor se incluyeron estas localizaciones, denominándose desde esta fecha clasificación de Ann Arbor.
Clasificación de Ann Arbor (1971)
Estadio I Afectación de una sola región ganglionar (I), de un solo órgano o de un único lugar extralinfático (IE)
Estadio II Afectación de dos o más regiones ganglionares del mismo lado del diafragma (II), o afectación localizada de un órgano o lugar extralinfático y de una o más regiones ganglionares del mismo lado del diafragma (IIE). Puede incluirse el bazo (IIS o IIES)
Estadio III Afectación de regiones ganglionares situadas a ambos lados del diafragma (III). Puede incluir afectación de un lugar extralinfático (IIIE), del bazo (IIIS) o de ambos (IIIES)
Estadio IV Afectación diseminada o difusa de uno o más órganos extraganglionares, con o sin afectación ganglionar asociada (IV)
La sistematización de Ann Arbor, diseñada para la enfermedad de Hodgkin, es imperfecta para ser usada en los linfomas no hodgkin, pero nos proporciona una clasificación por estadios de gran valor pronóstico, como han validado la mayoría de los trabajos.
Está claro que una misma entidad en estadio I presenta un pronóstico mucho mejor que en estadio IV, pero las diferencias se reducen cuando comparamos estadios próximos (I y II, II y III, III y IV). Además, hay aspectos que tienen importancia pronóstica y escapan a la clasificación por estadios de Ann Arbor.
En que estadio estarán estos dos pacientes?
A: Adenopatía cervical única de 2 cm y adenopatía axilar derecha de 1,5 cm.
B: Conglomerado adenopático cervical bilateral y masa mediastínica.
Los dos pacientes del ejemplo anterior están en estadio II, aunque intuitivamente podemos afirmar que el pronóstico de B es peor que el de A.
Posiblemente el complemento necesario a la clasificación de Ann Arbor sea la carga tumoral.
|
El estadio de Ann Arbor tiene un
valor pronóstico relativo. |
SÍNTOMAS B
 La
sistematización de Ann Arbor tiene en cuenta para la clasificación de los
linfomas no sólo la extensión de la enfermedad sino la presencia de los
síntomas B
La
sistematización de Ann Arbor tiene en cuenta para la clasificación de los
linfomas no sólo la extensión de la enfermedad sino la presencia de los
síntomas B
Qué se conoce con el nombre de síntomas B?
- Fiebre
Superior a 38 º C, durante un mínimo de tres días consecutivos sin causa infecciosa aparente.
- Pérdida de peso
Superior al 10 % del peso corporal
- Sudoración
Episodios nocturnos de sudoración profusa
|
Aunque hay estudios que discuten la incidencia de los síntomas B en el pronóstico, en general podemos afirmar que la presencia de síntomas B comporta un peor pronóstico. |
CARGA TUMORAL

Posiblemente el factor pronóstico con una mayor incidencia en la supervivencia y en la respuesta a la terapéutica.
La carga tumoral podemos mediarla de una manera directa, a partir de la medición de los volúmenes de las masas adenopáticas o de una forma indirecta, a través de parámetros de laboratorio íntimamente relacionados con la masa del tumor.
a) Medición directa: valoración del volumen tumoral
Como hemos visto anteriormente el concepto de carga tumoral fue utilizado por primera vez en la revisión de Linfomas Difusos de Células Grandes realizada en el MD Anderson y publicada en el Journal of Clinical Oncology en 1986. Los autores delimitan la carga tumoral a partir de dos parámetros, las áreas nodales extensas y el número de áreas extranodales afectadas.
Cual sería el concepto de área nodal extensa?
| - Anillo de Waldeyer: | Tumor T3/T4 de la TNM |
| - Ganglios periféricos: | > 7 cm. |
| - Mediastino: | Presencia de masa mediastínica (de cualquier tamaño) |
| - Abdomen: |
Cualquier masa abdominal palpable Si hay desplazamiento de órganos por masas Afectación de ganglios paraaórticos y pélvicos Masa > 7 cm. |
Cálculo de la carga tumoral
|
|
0 |
1 |
>1 |
|
|
|||
|
0 – 1 |
B A J A |
INTERMEDIA |
A L T A |
|
2 |
B A J A |
A L T A |
A L T A |
|
> 2 |
A L T A |
A L T A |
A L T A |
b) Medición indirecta: parámetros de laboratorio
Los dos parámetros más utilizados son la LDH y la ß2-microglobulina, ya que son los que reflejan la carga tumoral más fielmente.
Ambos parámetros tienen una relación lineal con la carga tumoral, es decir, cuanto mayor es su valor mayor es el tamaño del linfoma.
Cálculo de la carga tumoral
|
|
LDH |
ß2-MICROGLOBULINA |
|
ALTA |
E L E V A D A |
E L E V A D A |
|
INTERMEDIA |
UNO DE LOS DOS PARÁMETROS ELEVADO |
|
|
BAJA |
N O R M A L |
N O R M A L |
PARÁMETROS DE LABORATORIO
 Hemograma
Hemograma
La disminución de la Hemoglobina fue una de las primeras variables con significación pronóstica en relación a la supervivencia de los linfomas, aunque con el tiempo su importancia ha ido decreciendo.
La anemia, así como la leucopenia y la trombopenia presentan un valor pronóstico muy escaso, aunque confieren mal pronóstico en aquellos casos de linfoma con afectación comprobada de la médula ósea.
Parámetros bioquímicos
- LDH
Los niveles incrementados de LDH provienen de la fabricación de la enzima por las células tumorales.
Su valor está directamente relacionado con la capacidad proliferativa del linfoma.
- ß2-microglobulina
La ß2-microglobulina es un polipéptido de bajo peso molecular que se encuentra en la membrana celular.
Los niveles elevados de ß2-microglobulina presentan significado pronóstico en una gran variedad de tumores, entre ellos los linfomas.
El significado pronóstico de la elevación de la ß2-microglobulina está directamente relacionado con la masa tumoral.
- Cupremia
La relación entre el cáncer y los niveles de cobre es conocida desde hace casi 40 años. Parece que los niveles de cupremia guardan una estrecha relación con la masa tumoral y en algunos estudios también se ha encontrado relación directa con la actividad proliferativa del linfoma.
Se desconoce el mecanismo exacto que produce un incremento de la cupremia en los tumores y concretamente en los linfomas, aunque se ha postulado una alteración en el metabolismo de la ceruloplasmina.
- Albúmina
Los niveles de Albúmina en relación al pronóstico de los linfomas han sido analizados en varias series de pacientes y aunque generalmente presenta valor pronóstico, son pocos los estudios que le conceden influencia como factor independiente.
La hipoalbuminemia se relaciona con un peor pronóstico y posiblemente refleja un deterioro del estado nutricional del paciente.
- Citoquinas
La elevación de los niveles de algunas citoquinas se relaciona con un peor pronóstico. La relación más claramente establecida es con los niveles de IL-6, aunque también podrían tener significado las elevaciones de la IL-10 y del receptor soluble de la IL-2
INMUNOFENOTIPO
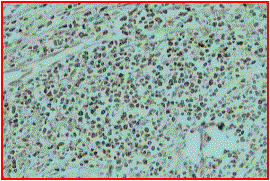 Fenotipo B / T
Fenotipo B / T
Desde los años 60 se conoce la existencia de las variedades B y T de los linfocitos. Su estudio ha ayudado a conocer el origen y la biología de los linfomas.
En relación al valor pronóstico de las variedades B, T y nula, los primeros trabajos comparativos mostraron un escaso valor pronóstico, aunque se ha de tener en cuenta que, en general, las series de pacientes eran pequeñas.
Los trabajos más recientes, con mayores series de pacientes, parecen concluir que ante un mismo tipo histológico el inmunofenotipo T confiere un peor pronóstico. Este hecho es más evidente en linfomas en estadios avanzados (III y IV de Ann Arbor).
Moléculas de adhesión
Las moléculas de adhesión son un conjunto de glicoproteínas de membrana directamente implicadas en numerosos procesos orgánicos, entre ellos la respuesta inmune y los fenómenos de recirculación y homing linfocitario.
Los linfomas no hodgkinianos son proliferaciones incontroladas de un linfocito detenido en un determinado estadio madurativo. El análisis de la expresión de las diferentes moléculas de adhesión nos ayuda a incrementar nuestros conocimientos en relación a la etiopatogenia de los linfomas.
Se han identificado diversas familias de moléculas de adhesión: selectinas, integrinas, superfamilia de las inmunoglobulinas y CD44.
La presencia o ausencia de algunas de estas moléculas de adhesión puede repercutir en el pronóstico de la entidad. En general, podemos hacer las siguientes consideraciones:
- La expresión de la selectina LAM-1 confiere un pronóstico desfavorable.
- La expresión de la integrina NCAM confiere un peor pronóstico, en especial en los linfomas de origen T
- La pérdida de ICAM-1 (superfamilia de las inmunoglobulinas) está relacionada con una tendencia a la leucemización.
- La expresión de CD44 se relaciona con un comportamiento más agresivo y una menor supervivencia.
Antígenos del sistema mayor de histocompatibilidad
La ausencia de expresión del antígeno HLA-DR se asocia a peor pronóstico.
ÍNDICE PROLIFERATIVO
La capacidad proliferativa de las células que forman un tumor es un parámetro que clásicamente siempre se ha relacionado con el comportamiento clínico – biológico de cualquier neoplasia y por tanto se espera que influya directamente en el pronóstico.
Para estudiar la capacidad proliferativa de las células de un linfoma disponemos de varias técnicas, de entre las que podemos destacar:
- Porcentaje de células en fase S (labelling index)
La citometría de flujo nos permite disponer de este parámetro, que ha demostrado una buena correlación pronóstica en la mayoría de los estudios.
Como regla general podemos afirmar que cuanto mayor es el porcentaje de células en fase S peor es el pronóstico del linfoma.
- Determinación de la proteína Ki67 (inmunohistoquímica)
La proteína Ki67 está asociada a la proliferación celular y se puede detectar en las células que se encuentran en las fases G1,S, G2 y M del ciclo celular.
Un alto índice proliferativo (células Ki67 positivas) se asocia con un peor pronóstico.
La actividad proliferativa de un tumor también puede estudiarse por otros métodos:
- Índice de incorporación de Timidina
- Contenido de ARN
- Niveles de actividad de enzimas relacionadas con el metabolismo de las bases púricas y pirimidínicas
ALTERACIONES CITOGENÈTICAS

A diferencia de otras patologías con un índice proliferativo muy alto, como las leucemias agudas, el estudio citogenético de los linfomas es más difícil, por la dificultad de obtener un número aceptable de metafases, pero podemos afirmar que la presencia de anomalías citogenéticas en los linfomas no hodgkin es un hecho frecuente.
La relación de las diferentes alteraciones descritas aumenta constantemente, pero lo que es difícil es establecer el valor pronóstico, independiente de otros factores, de cada una de ellas.
En el linfoma de Burkitt es típica la traslocación (8;14) pero es muy difícil valorar si el mal pronóstico está ligado a la traslocación o a que dicha anomalía se produce en una entidad que ya tiene implícito en ella misma el mal pronóstico.
El caso inverso lo encontramos con la traslocación (14;18), típica de los linfomas foliculares.
Como idea general podemos afirmar que la presencia de anomalías citogenéticas se acompaña de un peor pronóstico
Entre las alteraciones citogenéticas que en algunos estudios se han asociado a peor pronóstico podemos destacar:
- Alteraciones del cromosoma 1
- Alteraciones del cromosoma 2 en linfomas difusos
- Alteraciones del cromosoma 3 en linfomas foliculares
- Trisomía del cromosoma 5
- Trisomía del cromosoma 6
- Alteraciones del cromosoma 7 (monosomía, alteraciones estructurales)
- Alteraciones del cromosoma 17 (monosomía, alteraciones estructurales)
- Trisomía del cromosoma 18
PROTEÍNAS REGULADORAS DEL CICLO CELULAR

La proliferación celular normal está regulada por un equilibrio entre genes activadores del ciclo, promueven el crecimiento celular (protooncogenes) y genes inhibidores del ciclo, que suprimen el crecimiento celular (antioncogenes).
Una de las grandes diferencias entre las células normales y las neoplásicas radica en la dotación genética encargada de la proliferación celular y la homeostasis tisular.
Los últimos avances de la biología molecular han permitido un mayor conocimiento del ciclo celular y de las proteínas involucradas en su regulación.
Hay más de 100 mutaciones genéticas descritas implicadas en el desarrollo de cáncer, algunas de las cuales relacionadas con neoplasias del hombre.
Si nos centramos en el campo de los linfomas, hay algunas de éstas mutaciones que parece que pueden tener influencia pronóstica.
- gen del Retinoblastoma (Rb)
Aunque la presencia de la proteína Rb se asocia, en general, a un mayor índice proliferativo, en los linfomas no se ha podido demostrar una asociación clara con un peor pronóstico.
- c-myc
Las traslocaciones que implican al oncogen c-myc se relacionan con el linfoma de Burkitt y los linfomas en pacientes inmunodeprimidos (Sida o trasplantados).
Su sobreexpresión parece asociarse a peor pronóstico en los linfomas difusos de células grandes.
- bcl-2
Las traslocaciones del gen bcl-2 están asociadas a los linfomas foliculares, aunque su presencia no se asocia a peor pronóstico.
Su sobreexpresión en otros linfomas, por ejemplo en los linfomas de células grandes parece asociarse a peor pronóstico.
- bcl-6
Las traslocaciones de bcl-6 se observan con frecuencia en linfomas primarios de células grandes. No suele observarse en los casos secundarios, por lo que su presencia comporta un mejor pronóstico.
- p16
Las mutaciones del gen p16 parecen asociarse a la progresión de los linfomas.
La inactivación de este gen supresor es un hecho relativamente frecuente en linfomas transformados.
- p53
El gen supresor p53 codifica la proteína p53, que en condiciones normales es prácticamente indetectable debido a su vida media extremadamente corta. Las mutaciones de este gen supresor producen proteínas de vida media más larga, lo que permite su detección.
La detección de proteína p53 es sinónimo de mutación de dicho gen, hecho que se asocia a peor pronóstico en la mayoría de neoplasias humanas.
La detección de p53 en linfomas parece asociarse a estadios tumorales avanzados, pobre respuesta a la quimioterapia y menor supervivencia. Las mutaciones del gen p53 también son más frecuentes en linfomas transformados.
- MDR
El gen MDR está implicado en la resistencia que presentan ciertas clonas celulares tumorales a algunas drogas.
La presencia de proteína MDR está asociada a una peor respuesta al tratamiento.
[Índice] [Objetivos] [Introducción] [Conceptos básicos] [Factores pronósticos] [F.P. paciente] [F.P. neoplasia] [Indices pronósticos] [Conclusiones] [Bibliografía] |