El VEB es un patógeno ubicuo que ha infectado y permanece en más del 90% de la población adulta, de forma que la mayoría de los adultos son seropositivos para el VEB. La infección por el VEB usualmente ocurre de forma subclínica en la infancia temprana. La primoinfección clínicamente aparente es la mononucleosis infecciosa, que generalmente afecta a individuos que no han tenido contacto con el VEB hasta la juventud, siendo un cuadro autolimitado la mayoría de las veces. La puerta de entrada del virus es la orofaringe.
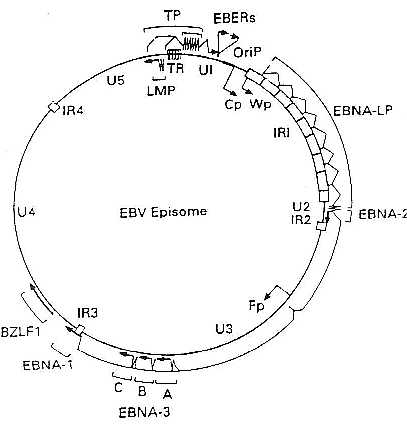
El genoma del VEB está constituido por una molécula de ADN bicatenario de una longitud aproximada de 172 kb que codifica aproximadamente unas 100 proteínas. La molécula de ADN está flanqueada en ambos extremos por un número variable de repeticiones terminales, cada una de ellas de una longitud aproximada de 500 pb. La recombinación entre estas repeticiones terminales origina la formación de una molécula extracromosómica cerrada covalentemente o episoma, que es la estructura que el virus adopta en el núcleo de las células infectadas de forma latente. El número de repeticiones que queda en cada episoma tras la unión de los extremos se utiliza como marcador de clonalidad.
Figura 1. Genoma del VEB: Episoma
INFECCIÓN Y RESPUESTA INMUNE FRENTE AL VEB
La forma de transmisión tradicionalmente aceptada sostiene que el VEB infecta inicialmente las células epiteliales de la orofaringe y posteriormente pasa a los linfocitos B del tejido linfoide adyacente. El receptor para el VEB de las células epiteliales y de los linfocitos B es el CD21. En las células epiteliales se realiza un ciclo vital productivo en el que el virus se replica produciendo viriones e induciendo la lisis de la célula huésped. Durante los estadios iniciales de la primoinfección se induce una marcada respuesta inmunitaria frente a los antígenos de la capside viral (VCA) que tiene capacidad neutralizante y que previene la viremia generalizada. En principio, este tipo de infección lítica o productiva se observa sólo en la primoinfección y en los individuos inmunodeprimidos.
Recientemente se está cuestionando este modelo en el que las células epiteliales de la orofaringe serían el foco primario y el reservorio de la infección por el VEB y en el que los linfocitos B se infectarían de forma secundaria. Trabajos recientes confirman la costante ausencia del VEB de la células epiteliales normales de los individuos inmunocompetentes y demuestran la existencia de infección latente y productiva exclusivamente en los linfocitos presentes en el epitelio bucal y nasofaríngeo, por lo que parece posible que el VEB infecte directamente a los linfocitos B, y no de forma secundaria a la infección replicativa de las células epiteliales.
Para comprender el papel patogénico que puede tener el VEB en el desarrollo de algunas neoplasias es importante conocer que después de la infección primaria, el VEB nunca es erradicado completamente del organismo, permaneciendo presente en una pequeña población de linfocitos B en una situación de relativa inactividad conocida como infección latente.
En el individuo normal existen clones de linfocitos T citotóxicos (CTL) que reconocen de forma específica a las células B infectadas de forma latente por el VEB siendo esta respuesta T fundamental para el mantenimiento de la vigilancia inmune frente al virus.
Una de las características del VEB es su capacidad de transformar in vitro los linfocitos B estableciendo las llamadas líneas celulares linfoblastoides. De los muchos genes codificados por el virus sólo 11 se expresan en estas líneas celulares infectadas de forma latente. Se trata de seis antígenos nucleares denominados EBNA-1, -2, -3A, -3B. -3C, -LP, tres antígenos de membrana llamados LMP-1, -2A y -2B y dos ARNs de pequeño tamaño que se localizan en el núcleo en un elevado número (106- 107 copias por célula) y que se conocen como EBER 1 y EBER 2 (EBERs).
Las diferencias existentes entre los genes que codifican las proteínas nucleares EBNA-2 y EBNA-3A, -3B y -3C distinguen dos tipos diferentes del VEB denominados VEB-1 y VEB-2 que se diferencian en la mayor capacidad para trasformar los linfocitos B in vitro del VEB tipo 1.
Dependiendo de los genes expresados en la célula huésped, se han descrito tres formas diferentes de latencia del VEB, que se observan en las distintas líneas celulares y en las diversas patologías asociadas al VEB (tabla 1):
Tabla 1. Formas de latencia del VEB.
| EBNA-1 | EBNA-2, -3(A-C),-LP |
LMP-1 | LMP-2A/B | EBERS | BHRF1 | |
| Latencia I LB |
+ | - | - | ? | + | ? |
| Latencia II EH, CNF |
+ | - | + | + | + | ? |
| Latencia III TLP-PT TLP-VIH LCLs |
+ | + | + | + | + | + |
CNF: carcinoma nasofaríngeo; EH: enfermedad de Hodgkin; LB: linfoma Burkitt; TLP-PT: trastornos linfoproliferativos postransplante; TLP-VIH: trastornos linfoproliferativos asociados al SIDA; LCLs: líneas celulares linfoblastoides.
La forma de latencia I se observa en el linfoma Burkitt (LB) y en los linfocitos B infectados que circulan en la sangre periférica. En esta forma de infección la expresión del genoma viral queda limitada a los EBERs y a la proteína EBNA-1 cuya función es indispensable para mantener el episoma pero que carece de capacidad inmunógena. Este patrón tan restringido de expresión génica permitiría a las células infectadas escapar a la vigilancia inmune por CTL, favoreciendo así la persistencia de la infección latente.
La forma de latencia tipo III es la que caracteriza a las líneas linfoblastoides y se observa también en la mononucleosis infecciosa y en la gran mayoría de los trastornos linfoproliferativos B asociados a inmunodeficiencia. La inmunosupresión actuaría permitiendo que los linfocitos B infectados expresen todas las proteínas asociadas a la infección latente sin que sean reconocidos y eliminados por los CTL.
La forma de latencia tipo II se asocia fundamentalmente a neoplasias. En esta forma se expresan la proteínas EBNA-1 y LMP-1, LMP-2A y 2B y los EBERs. Es la que caracteriza a la enfermedad de Hodgkin (EH) y al carcinoma nasofaríngeo (CNF).
Investigaciones recientes demuestran que el espectro fenotípico o morfológico de las celulas B que portan el VEB in vivo es mucho mas amplio que in vitro abarcando desde el linfocito pequeño hasta la célula plasmática pasando por el inmunoblasto. Se postula así la hipótesis de que el VEB persiste in vivo integrando su biología con la de la célula B normal en la que reside y que la célula B normal le provee de todos los medios necesarios para que el VEB mantenga su ciclo vital. Es decir, el VEB es un parásito de la biología normal de la célula B. Esta nueva forma de entender la relación entre el VEB y el linfocito B sostiene que el tipo de latencia del VEB podría depender del estado de la célula B en la que el virus reside y propone una nomenclatura nueva para los diferentes tipos de latencia basada en la conducta del virus en las células normales, desechándose la nomenclatura anterior para la latencia viral que se basaba en la diferente expresión de los productos virales en tumores asociados al VEB y en líneas de células B inmortalizadas in vitro; es decir, en estados no fisiológicos. Esta nueva teoría parte de que el ciclo vital del VEB está limitado a las células linfoides B ya que únicamente se ha detectado en ellas y es en ellas donde persiste y se replica. El VEB persistiría en las células B en reposo de la sangre periférica. La expresión viral quedaría limitada a LMP-2 y probablemente a EBNA-1. La función de LMP-2 es bloquear las señales que permiten al virus reactivarse. Y aunque LMP-2 es una proteína inmunógena, como la célula esta en reposo no puede ser detectada por los CTL ya que le falta la mólecula HLA-I co-estimuladora B7. En esta situación, el virus es invisible para el sistema inmune del huésped y las células infectadas no son una amenaza para el individuo ya que ni proliferan ni replican virus. Este sería el programa de latencia del VEB en los linfocitos B en reposo.
La regulación de la persistencia de células B infectadas se realizaría en el ganglio linfático mediante señales que provienen del virus o del ambiente. Para mentener la persistencia de la infección latente los linfocitos B infectados por el VEB de la sangre periférica podrían recibir señales en el ganglio linfatico que le cambien al programa de EBNA-1. En este programa se expresaría sólo esta proteína, que es necesaria para replicar el episoma y, por lo tanto, para la proliferación. La ventaja de este programa es que EBNA- 1 es la única proteína codificada por el virus que contiene una secuencia peptídica no reconocible por los CTLs. Este programa es un mecanismo que mantiene el nivel de células infectadas de forma latente favoreciendo que éstas no sean detectadas por el sistema inmune. Es el equivalente al tipo de latencia I del otro modelo.
Durante la infección aguda y probablemente en las reactivaciones es necesaria la expansión y la diseminación de la infección, para ello se induciría en los linfocitos B el programa de crecimiento, que es análogo al tipo de latencia III del modelo anterior, y que permitiría la expansión del virus, pero que, a su vez, al generar células inmortales podría constituir una amenaza para el huésped. Sin embargo, cuando la célula B entra en este programa expresa diferentes proteínas inmunógenas (EBNAs y LMPs) que inducen una respuesta. El papel de los CTLs sería impedir la supervivencia de los linfocitos B infectados por el VEB que expresen un programa de crecimiento y así minimizar el riesgo de acontecimientos secundarios que favorezcan el desarrollo de linfomas.
Tabla 2. Fenotipo in vivo de los linfocitos B infectados por VEB.
| Latencia | Programa EBNA1 |
Programa de crecimiento |
Fenotipo in vitro |
|
| Nombre antiguo | - | Lat. I | Lat. III | Lat. III |
| Localización | Periferia | Tej. linfoide | Tej. linfoide | Cultivo tisular |
| Fenotipo celular | B7 neg Reposo |
Activado Proliferación |
Activado Proliferación |
Activado Proliferación |
| Genes del VEB Expresados |
LMP2 EBNA1?* |
EBNA1 | EBNA1-6 LMP1,2 |
EBNA1-6 LMP1,2 |
| Vida media | Persistente? | Limitada | Limitada | Inmortal |
| Reconocimiento Por CTL |
Invisible | No presentado | Efectivo | Efectivo |
B7: molécula HLA-I ausente de linfocitos B y necesaria para que los CTL puedan reconocer la célula infectada. CTL: linfocitos T citotóxicos. * El antiguo patrón de latencia de tipo II, típico de CNF y EH, sería similar al patrón de latencia, pero con expresión aberrante de LMP-1.
ASPECTOS PATOGÉNICOS DEL VEB
Como en el ciclo lítico se produce la muerte de célula infectada, los genes que se expresan exclusivamente en éste no parecen tener demasiada importancia en la tumorogénesis, con la excepción de ellos los genes BHRF1 y BCRF1 que sí podrían tener un papel en el desarrollo de tumores. Por el contrario, los genes que se expresan en la infección latente son de especial interés en la patogénesis de las neoplasias asociadas al VEB (tabla 3).
Los mecanismos patogénicos por los que el VEB es capaz de inducir la aparición de tumores se relacionan con las proteínas codificadas por algunos de los genes expresados en la infeccion latente. Dichos productos inducen diferentes efectos sobre la célula huésped infectada (tablas 3 y 4) que facilitan el desarrollo de tumores.
Tabla 3. Genes del VEB cuyos productos podrían estar implicados en la tumorogenesis.
| EBNA 1 | Factor transcripcional, esencial para el mantenimiento del VEB. Induce la expresión de RAG1 y RAG2 in vitro |
| EBNA 2 | Factor transcripcional, esencial para la transactivación de LMP-1 |
| EBNA
3A (3B, EC) |
Factores transcripcionales, que favorecen una potente respuesta inmune |
| EBNA LP | Proteína que interfiere con la función normal de las proteínas p53 y pRb |
| LMP-1 | Única proteína del VEB con capacidad oncogénica demostrada, interacciona con factores asociados a la familia de los receptores del TNF (TRAF); causa sobrexpresión de la proteína Bcl-2, A20 y de la IL-10 |
| LMP 2 A/B | Proteína relacionada con la familia src de las tirosín kinasas, pudiendo controlar la actividad del ciclo lítico del VEB |
| EBER 1/2 | Fragmentos de ARN no traducidos, que se expresan muy abundantemente y cuya función es desconocida |
| BHRF 1 | Proteína homóloga de Bcl-2, capaz de inhibir la apoptosis |
| BCRF 1 | Proteína homóloga de la IL-10, capaz de estimular la proliferación celular B e inhibir la capacidad citotóxica de los linfocitos T (CTL) |
Tabla 4. Patogenia del VEB
| Inhibición de apoptosis | BHRF 1 y LMP-1 |
| Inducción de porliferación celular | LMP-1, EBNA-2, BCRF 1, EBNA-LP |
| Inducción de traslocaciones | EBNA-1 |
| Escape a la respuesta inmune | BCRF 1, mutantes delecionados de LMP-1 |
Mecanismos patogénicos del VEB
Son básicamente cuatro:
1. El mantenimiento de las poblaciones celulares infectadas mediante la inhibición de la muerte celular por apoptosis:
- BHRF1, debido a su homología con bcl-2 podría interferir en el balance entre bcl-2 y bax y, por este mecanismo, inhibir la apoptosis.
- LMP-1, una de cuyas acciones consiste en aumentar los niveles de bcl-2 y así inhibir la apoptosis.
2. La inducción de proliferación celular mediante:
- LMP-1, esencial para la transformación de los linfocitos B primarios.
- EBNA2, cuya actividad muy probablemente consiste en mediar la transactivación de LMP-1 y de otros genes celulares implicados en la proliferación.
- BCRF1, proteína análoga a la IL-10 humana que actuaría como un factor de crecimiento autocrino de células B.
- EBNA-LP, que puede formar complejos con p53 y pRb, y al secuestrar los productos de estos genes supresores de tumores, activaría la proliferación celular.
3. La inducción de recombinasas que posibilitan translocaciones mediante:
- EBNA-1, que induce la expresión de los genes RAG-1 y RAG-2, lo que podría favorecer la producción de recombinaciones aberrantes (translocaciones).
4. La evasión de la respuesta inmune mediada por células T:
- Las proteínas virales más antigénicas para los linfocitos T son: EBNA3A, 3B y 3C, pero los linfocitos T responden también frente a EBNA-2, EBNA-LP, LMP-1. Los métodos que utiliza el VEB para escapar a la respuesta inmune son :
- Regular a la baja las proteínas virales con mayor poder antigénico.
- Inhibir a las células T mediante la secreción de algunas citoquinas por la células infectadas como IL-10 y TGF.
DETECCIÓN DEL VEB EN LOS TEJIDOS
Técnicas moleculares para la detección del genoma viral:
Southern Blot: Se necesitan grandes cantidades de ADN de alto peso molecvular lo que obliga a utilizar tejido congelado y se realiza con marcaje radiactivo; permite la demostración de clonalidad (hibridando la región terminal repetida).
PCR: puede utilizarse ADN extraído de parafina, es más sensible que la técnica anterior; permite tipificar la cepa del VEB (Tipo 1 o 2) y detectar la presencia de deleción en el oncogén LMP-1.
Ninguna de estas dos técnicas permite identificar las células infectadas por el virus.
Técnicas moleculares de Hibridación in situ (HIS) para ADN o ARN:
Ambas se pueden realizar sobre cortes de tejido fijado en formol e incluido en parafina; permiten utilizar un sistema de detección no-radiactivo combinando la hibridación in situ con la inmunohistoquímica; y posibilitan la identificación de la célula infectada.
En concreto, la HIS para la determinación de los EBERs (ARN) es un método muy sensible ya que éstos están presentes en las células infectadas de forma latente en un gran número de copias. Es la técnica más recomendada para el diagnóstico histológico.
Técnicas inmunohistoquímicas para la detección de diferentes proteínas virales
Existen anticuerpos comerciales para la detección de LMP-1, EBNA-1, EBNA-2 . Algunos de estos antígenos se pueden detectar en tejidos procesados de forma rutinaria; estos métodos permiten identificar a la célula infectada y valorar la expresión de los productos del VEB en la población tumoral.
Tabla 5. Técnicas moleculares empleadas para la detección del VEB
¿Cómo detectar el VEB en un tejido?
| ¿Qué detecta? | Ventajas | Inconvenientes | |
Southern blot |
Genoma viral (ADN) | Clonalidad | Sólo congelación No localizador |
PCR |
Genoma viral (ADN) | Sensibilidad Parafina y cong. |
No localizador |
Hibridación in situ |
ARN o ADN | Sensibilidad Localizador |
Caro |
Inmunohistoquímica |
LMP-1, EBNA-1, ZEBRA, etc. |
Localizador Demostración de funcionalidad |
No siempre se detecta expresión |