
 |
Madrid, 28 al 30 de Marzo de 2001
[OBJETIVO] [COMITÉS] [PARTICIPANTES] [ÁREAS] [ACTIV.INTERNACIONALES] [PROGRAMA] [MESAS REDONDAS] [S.CIENTÍFICAS] [S.TECNOLÓGICAS] [PÓSTERS] [INSCRIPCIÓN]
A. Muñoz1, M. Pascual1,
MA. González1, L. Sanz2, L. Álvarez-Vallina2,
CH. Salvador1
1 Laboratorio de Bioingeniería y
Telemedicina. Hosp. Univ. Clínica Puerta de Hierro
2
Servicio de Inmunología. Hosp. Univ. Clínica Puerta de Hierro
Resumen
Se ha desarrollado un sistema de procesamiento automático de grupos de imágenes (incógnita y controles) para un modelo ‘in vitro’ de angiogénesis estandarizado y miniaturizado. Se determina en cada una de las imágenes parámetros morfológicos presentes en los procesos angiogénicos: número de nodos, canales conectados/no conectados y sus longitudes; a partir de ellos se obtiene un caracterizador morfológico de referencia (CMR). Aplicando, tanto individual como colectivamente, criterios estadísticos y comparativos homogéneos, se obtiene el índice relativo de inhibición (IRIh) como una estimación del grado de inhibición angiogénica relativo a los controles establecidos. El sistema diseñado permitirá el "screenning" en tiempos muy cortos de un gran número de reactivos para la evaluación de su capacidad moduladora en la formación de canales de interconexión celular.
Palabras clave: Angiogénesis, procesamiento de imagen, evaluación cuantitativa
1. Introducción
El conocimiento preciso de los mecanismos moleculares que controlan el proceso de formación de los vasos sanguíneos (angiogénesis) (1) es un área de intensa investigación, ya que la posibilidad de inhibir el crecimiento vascular puede ser una importante herramienta terapéutica para, por ejemplo, interrumpir el crecimiento de tumores (2).
En la actualidad ha habido un cambio de estrategia en la búsqueda de reactivos para la inhibición de ciertos procesos celulares. Mientras que anteriormente se tomaba como punto de partida el propio fenómeno en estudio, intentando descubrir sus causas y basándose en éstas desarrollar nuevos reactivos inhibidores, en la actualidad la estrategia parte de los efectos diferenciados que se observan a partir de la experimentación masiva con grupos de reactivos para, desde ahí, intentar determinar las causas del fenómeno. Por todo ello, es prioritario el desarrollo de nuevos sistemas de estudio que permitan un análisis detallado, en el ámbito molecular y celular, de las diversas etapas de estos procesos, así como el desarrollo e incorporación de sistemas informáticos que permitan el "screenning" en tiempos muy cortos de un gran número de reactivos como soporte que agilice estas nuevas estrategias de trabajo.
En este contexto, se ha desarrollado un sistema de procesamiento automático de grupos de imágenes para un modelo ‘in vitro’ de angiogénesis en el que, partiendo de la determinación en cada imagen de ciertos parámetros morfológicos presentes en los procesos angiogénicos, y aplicando criterios estadísticos y comparativos homogéneos de forma individual y colectiva, se obtiene una estimación del grado de inhibición angiogénica ocasionado por cada reactivo relativo a los controles establecidos. El sistema permitirá la aplicación de metodologías de "screenning" para el análisis en tiempos muy cortos de la capacidad inhibidora de un gran número de reactivos.
2. Material y métodos
2.1. Preparación del experimento
En el modelo estandarizado y miniaturizado "in vitro" de angiogénesis utilizado como objetivo para la generación/análisis de reactivos con capacidad moduladora angiogénica, se emplea una línea celular humana derivada de endotelio microvascular e inmortalizada mediante la transfección con SV40, reescalando los ensayos para adecuarlos a un formato microplaca "Terasaki" (ver Fig.1).
Figura 1. Microplaca de trabajo.
La organización y especificación del experimento contiene cuatro niveles jerárquicos (ver Fig.2). El nivel superior es el nivel experimento, descriptivo de los aspectos globales, en el que se especifican los elementos constantes fijándose: matriz extracelular, medio y células utilizados. El segundo nivel es el nivel serie; cada experimento se compone de un número determinado de series, caracterizadas particularmente por el antígeno objetivo y la genoteca utilizada. A su vez, cada serie la compone un cierto número de placas, nivel placa, conteniendo cada una de ellas un conjunto de pocillos, nivel pocillo.
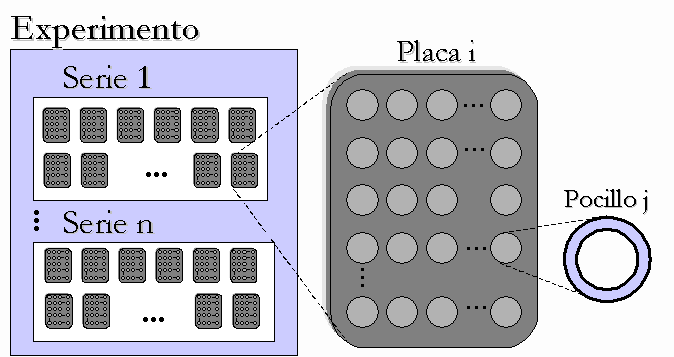
Figura 2. Jerarquía del experimento.
Los dos niveles superiores (experimento, serie) tienen un carácter más organizador que operativo; los dos niveles inferiores (placa, pocillo) son en los que se trabaja durante el procesamiento. Dentro de una placa se pueden encontrar tres tipos de pocillos: 1) no usados, marcados previamente y que no intervienen en los procedimientos posteriores; 2) pocillos de control, en número determinado y repartidos de forma dispersa pero predeterminada en la placa, en los que las células han sido cultivadas en ausencia de inhibidores; y 3) pocillos incógnita, en los que se pretende determinar el grado de inhibición producido por el reactivo introducido, relativo al conjunto de los pocillos control.
2.2 Adquisición de las imágenes
Los grupos de imágenes de trabajo (incógnita y control) se obtienen a través de un microscopio invertido Axiovert 100 (Carl Zeiss, Germany) y una cámara digital SPOT (Diagnostic Instruments, Inc.). Se fijan las condiciones óptimas de adquisición en cuanto a luminosidad, contraste, número de aumentos, tiempo de exposición, etc. Las imágenes son adquiridas secuencialmente con 10 aumentos y 256 niveles de gris, lo que resulta en un tamaño por imagen de 328x256 puntos, y un tamaño de fichero imagen (formato bmp) de 84K. Cada microplaca genera 72 imágenes de las que 12 son controles y el resto incógnitas. Las imágenes son almacenadas ordenadamente, creándose automáticamente un árbol de directorios semejante a la jerarquía del experimento: experimento -> serie -> placa. Como ya se comentó, la ubicación de los pocillos de control está protocolizada, por lo que en un experimento estándar no se necesita hacer "a priori" un marcado para la localización de las imágenes control.
2.3 Procesamiento de las imágenes
La aplicación de procesamiento se apoya en las librerías Matlab 5.3 complementadas con las "toolboxes" de procesamiento de señal y de imágenes. El procesamiento (3) (4) presenta dos fases: la primera tiene como objetivo el procesado individual de la imagen capturada en cada pocillo para la determinación de su CMR; la segunda fase consiste en la determinación del IRIh de cada imagen incógnita como resultado del análisis combinado de los CMRs obtenidos en la fase 1, tanto de las imágenes incógnita como de las control.
Seguidamente se realiza una exposición detallada de cada una de estas fases.
2.3.1. Fase 1. Procesamiento individual
De cada una de las imágenes (ver Fig.3) se pueden extraer una serie de parámetros consensuados como significativos en los procesos angiogénicos. En todas las imágenes se puede observar la presencia de canales (cerrados y abiertos) de diferentes longitudes y con su característica intrínseca de linealidad, células aisladas, grumos de células, fondo de textura uniforme y un halo circundante de mayor brillo que es una interferencia incorporada por condiciones de contorno en la adquisición. El procesamiento individual se puede dividir a su vez en 3 partes: 1) pre-procesamiento, 2) realce de las morfologías de interés, y 3) post-procesamiento.
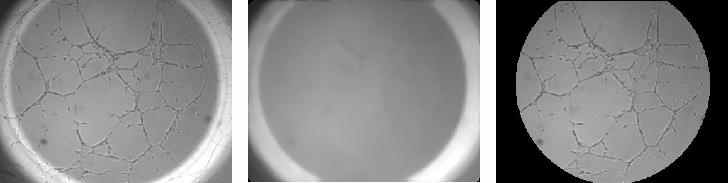
Figura 3. Imagen original. Figura 4. Detección de halo. Figura 5. Area de trabajo
1) El pre-procesamiento tiene como objetivo la determinación del área de trabajo. Se eligió como área de trabajo, la zona de la imagen inscrita en el halo sobreiluminado circundante. El halo se caracteriza por ser un anillo provocado por la reflexión de la luz en el menisco que origina el líquido sobrante en cada pocillo. Se aplica a la imagen original un filtro de mediana de [15x15] que realza el anillo suavizando a la vez las estructuras interiores (ver Fig.4) de forma que se destaca la frontera interior entre éste y el área de interés. Tomando los perfiles de la imagen que siguen las dos diagonales entre vértices, se determina mediante las respectivas derivadas de primer grado, y tomando como apoyo el histograma de grises, los cuatro límites fronterizos puntuales. Se calculan los centros y radios de las cuatro posibles circunferencias que pasan por estos puntos, y si se cumplen las condiciones de proximidad/agrupación adecuadas, se elige como circunferencia delimitadora del área de trabajo la que tiene por centro el promedio de los cuatro y radio el mínimo de las cuatro. En el caso de que no se den dichas condiciones de proximidad, se fija el área de trabajo como la intersección de las cuatro circunferencias determinadas. En cualquier caso y como final del pre-procesamiento, queda determinado el área de trabajo (ver Fig.5) mediante una matriz de índices que funciona como máscara.
2) El siguiente paso es el realce de las interconexiones celulares o canales. Para destacar los canales se adopta una estrategia indirecta, ya que no se aborda el problema identificando directamente los canales, sino que se discrimina el fondo de las imágenes que tiene una textura uniforme y regular en comparación con los canales. Para diferenciar el fondo del resto de la imagen, se realzan los bordes de la imagen en magnitud (ver Fig.6) y fase (ver Fig.7) mediante derivadas perpendiculares (método de Sobel). Tomando agrupaciones relativamente grandes de puntos [15x15], se efectúa un análisis no lineal de la imagen, determinando la media y varianza de la magnitud absoluta de los bordes. Se obtiene de esta forma una sencilla referencia estadística diferenciadora del fondo y los canales. Para mejorar la diferenciación es necesario incluir un criterio de fase teniendo en cuenta la linealidad de los canales; se procesa la imagen de fases, indicadora de la dirección de los bordes, de forma que se destacan las zonas que mantienen un determinado criterio de linealidad. Como resultado se obtiene una imagen binaria (ver Fig.8) en la que quedan marcadas las zonas alineadas con apertura inferior a 20º.
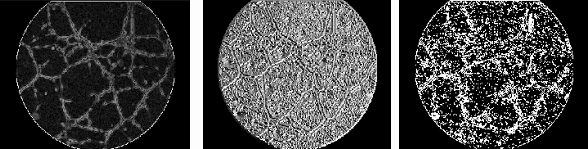
Figura 6. Detección bordes: magnitud Figura 7. Detección bordes:
fase Figura 8. Umbral de
linearidad
A partir de la media/varianza de referencia obtenida anteriormente en la matriz de amplitudes absolutas de bordes y de la imagen obtenida del criterio de linealidad, la discriminación del fondo se realiza aplicando este triple criterio a cada píxel del área de trabajo: umbral de media, umbral de varianza y linealidad, de forma que un píxel pertenece al fondo si en su vecindario de [3x3] sólo cumple uno de ellos o ninguno. El resultado de la aplicación de este criterio de forma directa es el que se puede ver en la figura 9, que posteriormente se somete a un filtrado no lineal de forma que se eliminan los píxeles aislados siendo el resultado final el mostrado en la figura 10.
Figura 9. Discriminación del fondo Figura 10. Filtrado para limpieza fondo
El siguiente procedimiento es aplicar un proceso de binarización (ver Fig.11), seguido de otro de esqueletonización (ver Fig.12), de forma que quedan perfectamente delineados los canales detectados. En la figura 13 se puede observar la superposición de la imagen resultantes del pre-procesamiento (paso 1) y del procesamiento (paso 2); se marcan en negro los canales conectados y en blanco los canales aislados (no conectados).

Figura 11. Binarización Figura 12. Esqueletonización
3) El post-procesamiento final se encarga de analizar la imagen binaria/esqueleto resultante para la extracción de los siguientes parámetros: número de nodos, canales conectados/no conectados y sus longitudes, longitud media de los canales conectados y no conectados y área total analizada. Los canales de escape, es decir, aquellos que se pierden en el borde del área de trabajo, se consideran conectados si superan un umbral de longitud predeterminado.
Figura 13. Superposición de imagen con trazado de canales detectados.
2.3.2. Fase 2. Procesamiento combinado (CMR - IRIh)
A partir de los parámetros morfológicos determinados para cada uno de los pocillos de la placa en la fase anterior, se determina un CMR. Actualmente se está trabajando con cuatro expresiones para la determinación del CMR más adecuado.
Teniendo en cuenta las definiciones expuestas anteriormente, la expresión general para el CMR es siempre la misma [1] variando para cada caso únicamente el conjunto de canales seleccionados para el cálculo:
[1]
Los conjuntos de canales seleccionados para cada caso son:
[2]
[3]
[4]
[5]
La cuarta variante [5] es la que muestra una mayor capacidad discriminatoria para diferenciar y estratificar procesos angiogénicos. La necesidad de introducir un umbral U de longitud de canal es debido a la aparición en algunos casos de nodos y caminos ficticios de corta longitud, comparada con el resto, dentro de acúmulos o grumos celulares, y que deben ser excluidos del estudio.
Una vez concluida la determinación del CMR para cada pocillo, se procede a realizar el estudio combinado para la determinación del IRIh en los pocillos incógnita. El IRIh refleja el grado de inhibición angiogénica sufrido por la acción del reactivo respectivo en cada pocillo incógnita, relativo al grado de angiogénesis promedio desarrollada en los pocillos control. Por lo tanto, en primer lugar hay que calcular el promedio del CMR en los pocillos control [6].
[6]
El CMRP refleja el grado de angiogénesis desarrollado en ausencia de agente inhibidor en las condiciones de contorno de la placa y se hace corresponder con el 100% (0% de inhibición). Para finalizar con la fase de procesamiento se determina el IRIh a través de la expresión [7] para cada pocillo incógnita.
[7]
2.4 Almacenamiento
Como complemento, el sistema incluye herramientas para el almacenamiento y gestión de los grupos de imágenes y sus parámetros relevantes (individuales y colectivos). Ello permite la realización a posteriori de estudios cruzados comparativos para los experimentos y aporta un valor añadido a nuevos estudios. Para el almacenamiento se utiliza una base de datos MSAccess con una estructura que refleja la jerarquía de experimento ya comentada en apartados anteriores: experimento -> serie -> placa -> pocillo. De forma resumida, para cada nivel se almacenan los siguientes campos:
La mayor parte de estos datos son cumplimentados previamente a la fase de adquisición/procesamiento, mientras que otros son introducidos automáticamente a la finalización de la fase de procesamiento. Respecto a las imágenes, como ya se ha comentado, se almacenan en formato bmp incluyendo un identificador real de la imagen (reflejado en la base de datos) en las cabeceras de la propia imagen como un ‘tag’ específico. Dicho identificador, compuesto por la adición sucesiva de sufijos relativos a los identificadores que en la base de datos se han asignado a los experimento-serie-placa a los que pertenece el pocillo, permite identificar correctamente una imagen fuera de la estructura de directorios. Aparte de la posibilidad de inspeccionar detalladamente el experimento bajando hasta el nivel de pocillo, se incluye la generación automática de informes a nivel experimento, serie y placa.
3. Conclusiones
En este momento no es posible la presentación de resultados definitivos sobre este proyecto puesto que está comenzando la fase de evaluación del prototipo. En cualquier caso, las primeras experiencias están mostrando una alta sensibilidad y especificidad de la metodología expuesta en la discriminación y estratificación de los procesos inhibitorios angiogénicos. Hay que señalar que con el prototipo actual no se alcanzarán todas las metas propuestas por no disponerse actualmente de una motorización para el microscopio invertido, aunque el diseño se ha realizado teniendo como perspectiva su utilización. Por lo tanto, las adquisiciones se están realizando de forma manual y en estas condiciones no es posible evaluar el sistema en todos los aspectos necesarios para su utilización en ‘screenings’ masivos automatizados. Con el prototipo actual sí se está en condiciones de evaluar: 1) los métodos para la cuantificación del grado de inhibición que conduzcan al establecimiento de criterios y protocolos unificados, y 2) la validez del procesamiento digital de imágenes obtenidas a partir de un sistema de angiogénesis "in vitro", para la determinación cuantitativa del grado de inhibición en la formación de canales o tubos de conexión intercelular. Una vez se demuestre la viabilidad de las dos premisas anteriores, y para una siguiente fase, se abordará el desarrollo del sistema de "screenning" automatizado, incluso la posibilidad de extender o adaptar este concepto para el análisis de otros parámetros morfológicos o biológicos en otros sistemas biológicos complejos.
Agradecimientos
Este proyecto ha sido financiado por el Fondo de Investigación Sanitaria FIS 00/0496
Bibliografía
[OBJETIVO] [COMITÉS] [PARTICIPANTES] [ÁREAS] [ACTIV.INTERNACIONALES] [PROGRAMA] [MESAS REDONDAS] [S. CIENTÍFICAS] [S. TECNOLÓGICAS] [PÓSTERS] [INSCRIPCIÓN]
Última actualización: miércoles, 04 de abril de 2001