|
B.- Muestras de ecopsia
fiogf49gjkf0d Dividimos las muestras en sólidas, líquidas y para cultivos microbiológicos.
Las muestras sólidas corresponden a fragmentos de tejidos que son fijados, incluidos, cortados y teñidos para ser diagnosticados al microscopio.( Fig.1-3). La figura uno muestra un corte de cerebro a bajo aumento, la dos corresponde a la ecografía cerebral de un hombre adulto en la que se demuestran dos metástasis de un carcinoma de pulmón cuya imagen microscópica se ve en la figura 3. Las muestras de líquidos se procesan para estudio citológico. ( Fig.4), en ella se puede apreciar un derrame pleural crónico. Las muestras para cultivos se obtienen con una metodología especial.
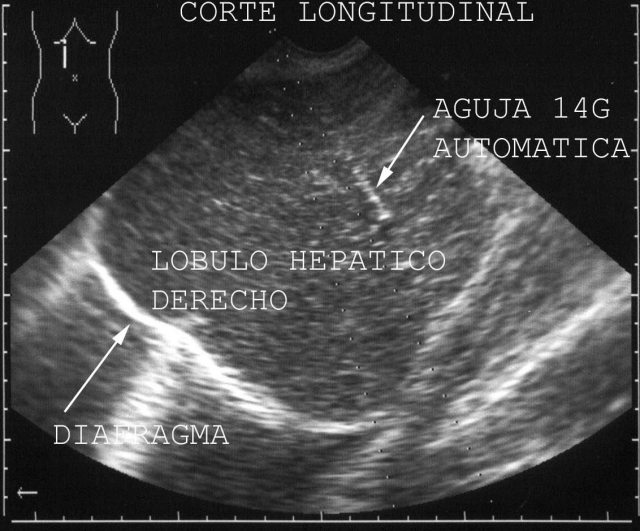
En todos los casos la toma de muestras del órgano, estructura o líquido, irá precedida de la visualización en la pantalla del ecógrafo ( Fig.5). Así haremos la comprobación de que está en su lugar y de que su tamaño y forma son habituales.
Nos fijaremos si hay zonas más oscuras y hasta negras o más claras y con aspecto brillante, en lugar de la morfología habitual, o si hay nódulos o quistes. En general, en la ecografía el color negro corresponden a líquido; zonas de aspecto claro, blanco o brillante son aire u otro gas, calcio o el metal de la aguja de punción. Los tonos oscuros o grises intermedios indican estructuras y órganos sólidos.
B.1- MUESTRAS SÓLIDAS Y AGUJAS UTILIZADAS:
Las muestras sólidas son las más frecuentes y en ellas la mayoría de las veces se fundamenta el diagnóstico de la ecopsia. Proceden entre otros, del hígado, riñón, bazo, páncreas, tubo digestivo corazón, pulmones, cerebro, músculo, próstata, mama, testículo, tiroides, suprarrenales, ganglios linfáticos y vasos sanguíneos.
Las muestras sólidas son en general fáciles de obtener con escaso entrenamiento. Pero hay que tener en cuenta ciertas particularidades en algunos órganos:
Así, la mama y el testículo deben ser fijados con la mano y tener cuidado para que no se pinche el patólogo o técnico que realiza la ecopsia.
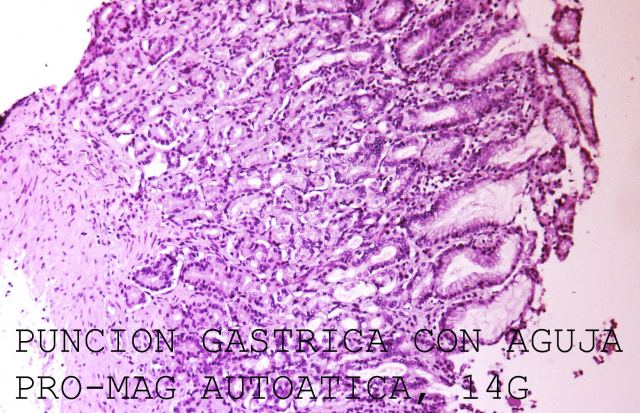
Las paredes de los órganos huecos, como tubo digestivo, vejiga, vesícula y vasos sanguíneos, tienen movilidad, por lo que lo más práctico es abordar la pared con la aguja en diagonal a ella. ( Fig.6), en ella se puede ver una muestra de estomago obtenida con una aguja automática de 14G de diámetro. Afortunadamente, en casos de patología inflamatoria o tumoral la toma de muestra es más fácil porque la infiltración del tejido disminuye la movilidad.
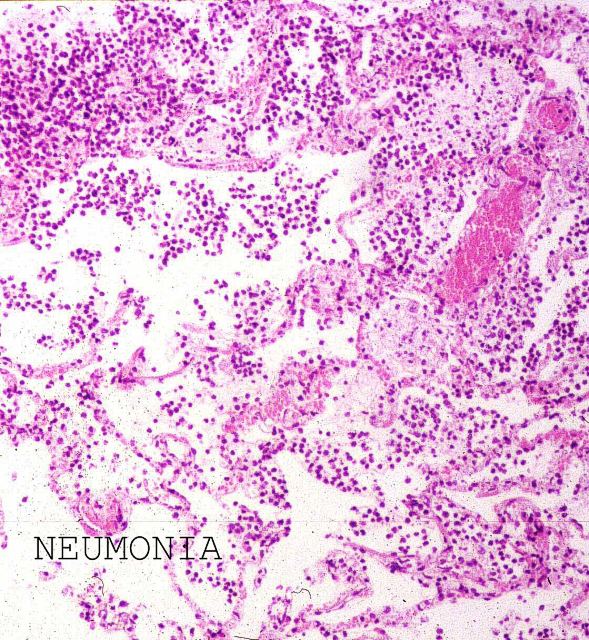
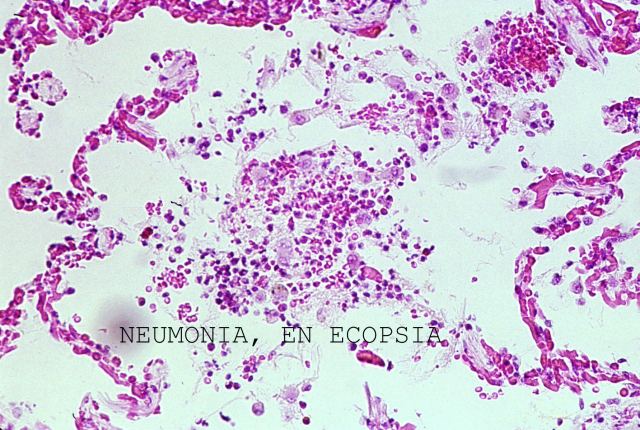
En caso de normalidad histológica en el pulmón el material obtenido puede ser escaso y muy estrecho, pero cuando hay infiltración tumoral, hemorragia o neumonía ( Fig.7), los cilindros son grandes y consistentes y es muy fácil su obtención. En todos los casos las muestras se hunden al introducirlas en el formol haya o no patología, porque los alveólos se han comprimido y cortado por la aguja y son anegados por el fijador. Pero esto también explica que en las muestras pulmonares de ecopsia los, hematíes u otras células y sobre todo el edema sean más escasos que los observados en muestras de autopsia clásica. Esto lo comprobamos repetidas veces durantela puesta a punto de la técnica de ecopsia en un estudio doble ciego realizado en 300 ecopsias seguidas de las correspondienes autopsias entre los años 1994 a 1998. ( Fig.8), corresponde a una muestra de ecopsia de un alveolo con escaso contenido de células inflamatorias de una neumonía.
El páncreas se ve bien cuando no hay gas, y por eso iniciamos la toma de muestras por este órgano. A lo largo de la ecopsia puede producirse gas, lo que impediría su visibilidad al no poderse obtener la imagen ecográfica.
Las suprarrenales normales en los niños son muy visibles pero no en los adultos. Cuando hay patología en ambos suelen estar aumentadas de tamaño y entonces se observan. No obstante,si no se observan pero queremos obtener muestra debemos hacer punción entre riñón y bazo en lado izquierdo; y riñón, hígado y vena cava inferior en el derecho.
Los ganglios linfáticos, cuando tienen inflamación, tumor o hemorragia son evidentes, pero pueden pasar desapercibidos si son normales.
Para estudiar el cerebro en niños se toman muestras desde las fontanelas. En niños mayores o en adultos hacemos artificialmente una neofontanela, aproximadamente donde estuvo situada la fontanela anterior. Para ello hacemos con la sierra un orificio cuadrado de unos 6cm de lado. Retiramos la piel, hueso y dura y ponemos la sonda. Desde esta neofontanela( Fig.9) se ve muy bien el SNC y con gran sencillez se obtienen las muestras en condiciones óptimas. En la figura 10 se observa el redondeamiento ventricular por atrofia cerebral, en un caso de enfermedad de Alzheimer. El rojo congo, tiñe intensamente las paredes de los vasos cerebrales y las placas( Fig.11).
En el tiroides ( Fig.12), hay que tener en cuenta que es estrecho y que puede ser fácilmente atravesado, y que la aguja puede alcanzar la luz de la tráquea sin obtener muestra. Por ello, solemos acompañar el estudio tisular con aspiración citológica con aguja espinal de 20G.
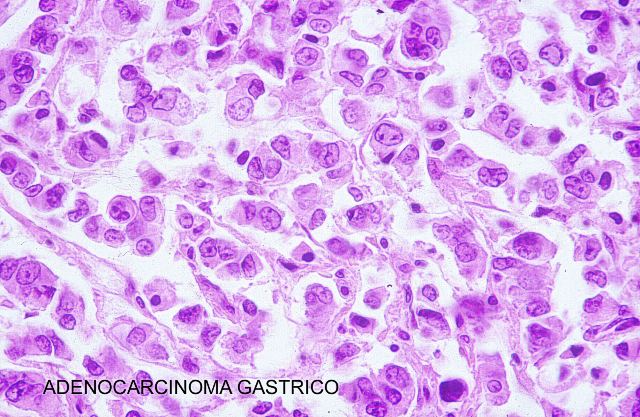
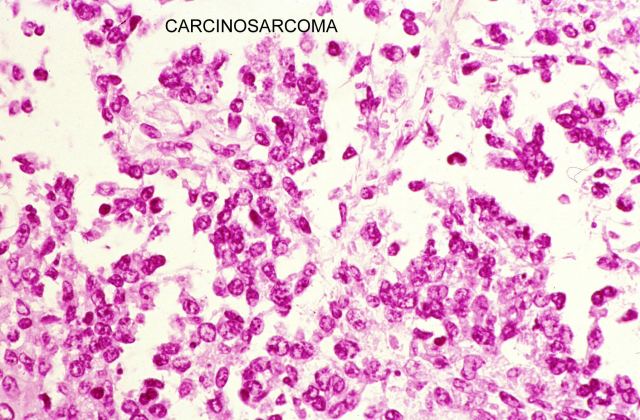
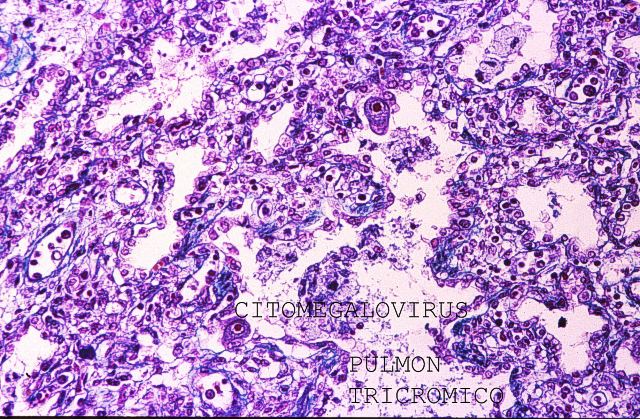
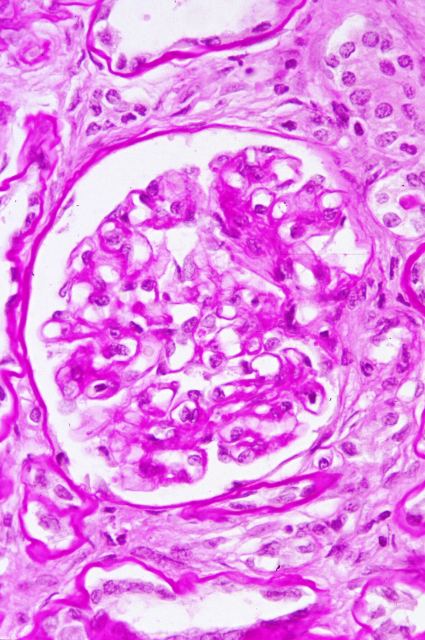
Las técnicas histopatológicas en la ecopsia, tanto la hematoxilina eosina habitual, ( Fig.13-18) como otras más sofisticadas( Fig.19-20), presentan una coloración magnífica y muy superior a la de la mayoría de las autopsias. Los resultados son particularmente buenos en la inmunohistoquímica. ( Fig. 21-22).
La aguja que utilizamos para obtener muestras tisulares es la Pro-Mag TM I 2.5 ( Fig.23-25), cuyo nombre comercial es Pro-Mag TM I Biopsy Needle. Esta aguja, de diámetro 14G y longitud de 20cm, se coloca en el mango automático Pro-Mag TM I 2.5 (Pro-Mag TM I 2.5 Automatic Biopsy Instrument), que se carga, es decir, se pone en disposición de disparo. A continuación se introduce en el órgano, y cuando comprobamos que la aguja está en el sitio adecuado se dispara dándole a un botón. Esto permite hacer la toma de forma automática con exactitud y en buena cantidad. En la figura 26 se ve dentro del tórax del cadáver la aguja de punción empujar la pleura y comprimir el pulmón, antes de penetrar en él. Una vez alcanzado el sitio accionaríamos el botón para recoger la muestra.
Hay otras agujas, como la clásica y manual Tru-cut 14G, que necesitan entrenamiento, pero con la que también se consigue buen material para el estudio histológico, y ha sido la que nosotros hemos utilizado durante varios años. ( Fig.27).
Tanto con una aguja como con la otra, pero más fácilmente con la automática, las muestras que se obtienen son cilindros de unos de 3 o 4cm. de largo por unos 2 a 3 mm. de ancho, ( Fig.28). En esta imagen se observa un cilindro renal teñido con el tricrómico de Masson.
Una vez sacada la aguja del cadáver, ésta se abre para comprobar visualmente que hay material. A continuación se introduce en un frasquito de plástico rotulado señalando la procedencia de la muestra. El fijador es formol tamponado al 10%, en el que agitamos la aguja para que se desprenda el cilindro. Así queda lista para ser cargada de nuevo y hacer otra punción.
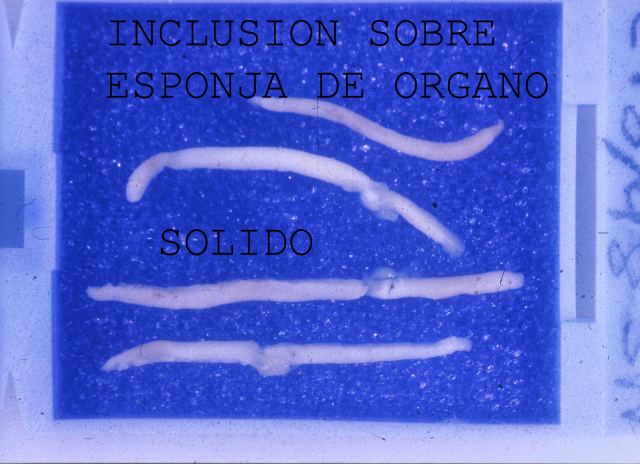
Habitualmente usamos dos agujas Pro-Mag o Tru-cut por adulto. A las pocas horas, las muestras estan listas para la iclusión. Habitualmente las introducimos en cápsulas protegidas por una lámina de esponja artificial ( Fig.29)
En cada bloque de parafina se suele incluir material de hasta cuatro o cinco cilindros grandes o de múltiples trocitos cuando el material se presenta fragmentado( Fig.30).
Así el tiempo de procesamiento de las muestras de ecopsia desde que son cogidas del cadáver, incluidas las de cerebro, es igual al tiempo que tardamos en procesar las muestras de biopsias.
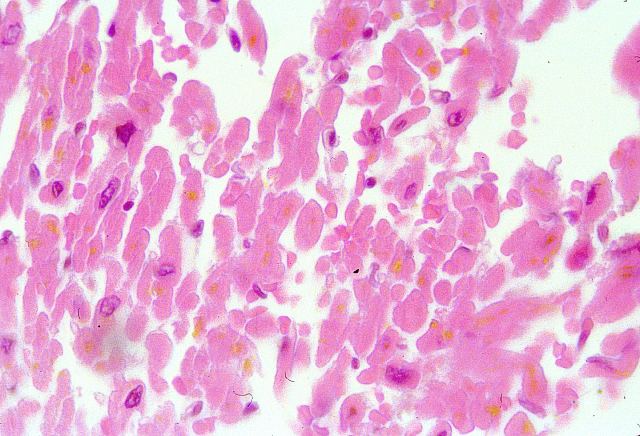
Hemos comprobado que en la infección de músculo estriado y en la necrosis isquémica del corazón hay desmenuzamiento del tejido en pequeños fragmentos que no debemos despreciar en el momento de la inclusión porque son los que mejor reflejan la patología ( Fig.31). Por el contrario, cuando obtenemos cilindros grandes cardíacos suelen presentar normalidad histológica. En el pulmón ocurre a la inversa.
Si está indicado, se puede reservar material para técnicas de inmunohistoquímica, estudios de ácidos nucleicos, de M/E o demostración de grasa. La ecopsia facilita especialmente la obtención de muestras en buenas condiciones para toxicológia.
B.2- MUESTRAS LÍQUIDAS Y AGUJAS UTILIZADAS:
Las muestras líquidas se obtienen de las cavidades anatómicas, los quistes y los órganos huecos.
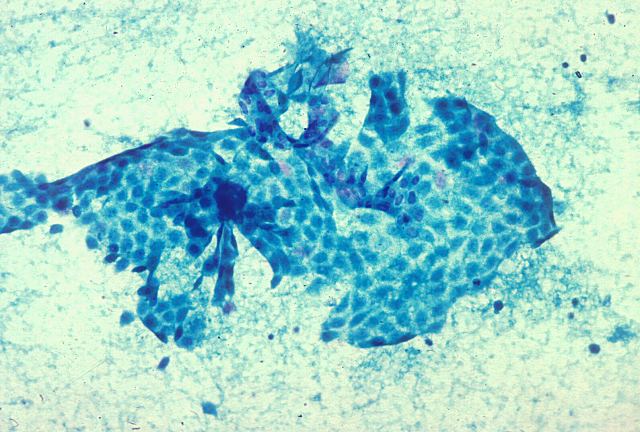
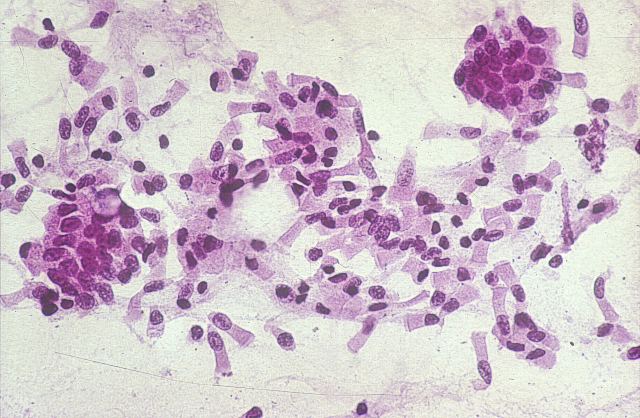
Los estudios de ecopsias han demostrado que en el cadáver las células de la superficie interna de las cavidades y de las mucosas del tubo digestivo muy pocas de ellas se necrosan in situ, sino que empiezan a caer a la luz pocas horas después de la muerte. Estas células están generalmente bien conservadas y su valor es semejante al de una citología exfoliativa, informándonos fielmente del estado de la mucosa o cavidad “in vivo” ( figura 32-33). En la figura 32 se observa una gran placa de células mesoteliáles que se descamó en la cavidad pericárdica de una niña de tres años con insuficiencia cardíaca y una neumonía aspirativa. En la figura 33 se ven numerosas células caídas a la luz del intestino delgado en un joven infectado con VIH.
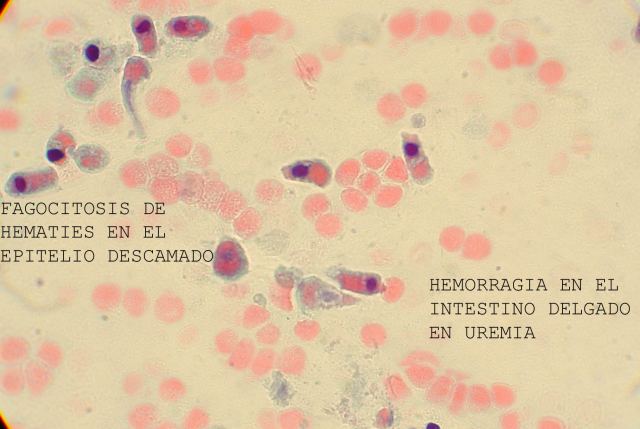
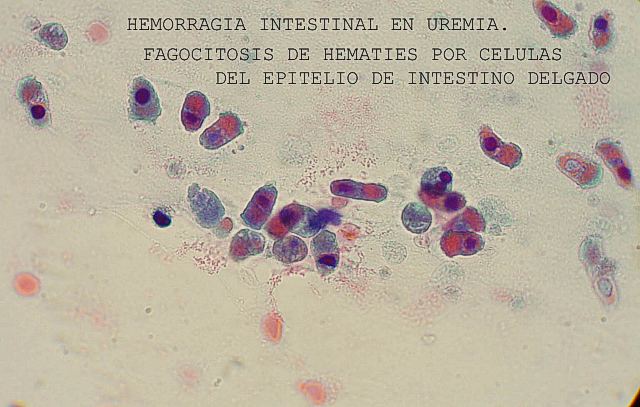
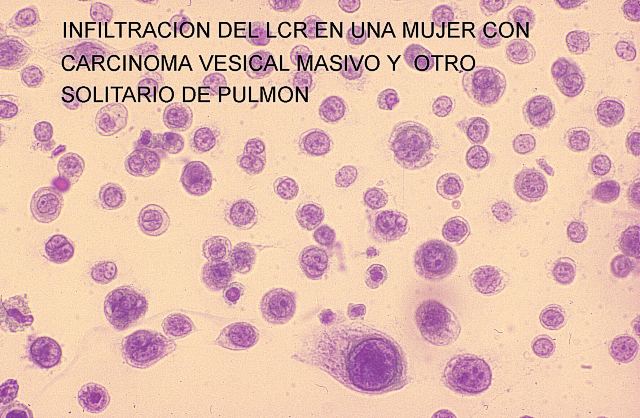
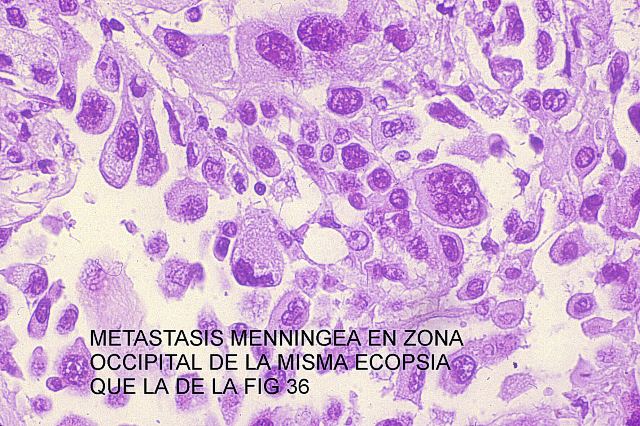
También de gran importancia práctica es la valoración en los cadáveres de las hemorragias gastrointestinal, peritoneal, pericárdica o en ventrículos cerebrales. Pueden ser la causa de muerte y su diagnóstico es inmediato. Después, el estudio citológico del contenido gastrointestinal y de las cavidades nos puede informar de otras patologías. Así, en las figuras 34 y 35 se muestra fagocitosis de hematíes por células del epitelio intestinal que en la imágen se observan descamadas en la luz del intestino delgado de una anciana con uremia crónica y hemorragia gastrointestinal. En las figuras 36 y 37 se puede comparar la toma de una metástasis de un carcinoma pulmonar con la citología encontrada en el líquido cefalorraquídeo.
Una vez localizado el líquido a aspirar se introduce la aguja y, visualizándola en la pantalla del ecógrafo, se retira el fiador y se acopla la jeringuilla. El líquido se remueve con la aguja y/o se aspira de zonas densas a la visión ecográfica, y en su defecto se aspira de zonas declives.
En varios trabajos ha quedado demostrado que la citología de las cavidades estudiadas por ecopsia es más fiable y evidencia más patología que la encontrada en la autopsia clásica.
En la ecopsia en general estudiamos los líquidos patológicos, lo que sospechamos porque haya más cantidad de líquido del habitual y/o por ser más denso. Se aspiran con la aguja conocida con el nombre de espinal, que tiene la punta tipo Quincke (BD Spinal Needle, de 20G de espesor x 90 mm de longitud. Esta aguja se une a una jeringuilla de 20 cc y se aspira el material en caso de que sea líquido. La figura 38 pertenece a una ecografía de intestino delgado que muestra un contenido líquido (negro), que se debe aspirar con esta aguja, mostrada en la figura 39. El asa situada más abajo en la imagen, tiene un contenido más denso que se aspirará con una aguja de mayor calibre, como la surecut tipo Menghini, de 15G x 150mm (Surecut TSK modified Menghini biopsy set).( Fig.40). En este caso, una vez alcanzada la zona a aspirar, retiramos la jeringa y el fiador que va unido al émbolo, y se acopla en su lugar una jeringuilla de 10 c.c.
El contenido con las jeringuillas se envía siempre directamente al laboratorio de citología para su procesamiento.
B.3- MUESTRAS PARA CULTIVOS MICROBIOLÓGICOS:
Lo primero es esterilizar la piel en la zona que vamos a hacer la punción, para lo que el área elegida se limpia y a continuación se frota la piel fuertemente repetidas veces con algodón impregnado en alcohol de 95 a 100%. Se espera a que se evapore y a continuación se aplica varias veces Betadine con una torunda gruesa de algodón siguiendo el mismo sentido, y pasados unos minutos pinchamos y cogemos las muestras a través de esa zona de entre 6-8cm. de diámetro, utilizando una aguja por punción. Los microbiólogos nos piden cilindros de al menos 2cm. de longitud en material sólido, y para cultivos desde líquidos hay que enviar al laboratorio de microbiología al menos 8 cc. En la figura 41 se ven frascos para cultivo de flora aerobia, anaerobia, hongos, micobacterias y con torunda el de virus. La fotografía la realizó el Dr. Miguel Angel Sáez cuando realizaba una ecopsia con patología infecciosa. Con el nombre de ilustración o figura 42 se muestra una película del Dr. Melchor Saiz-Pardo ( también disponible para conexiones hasta 56 bps) procedente del examen con el que obtuvo la Suficiencia para la Investigación con el tema, “Citología del líquido biliar en la ecopsia” (Universidad Complutense, Madrid 2003). (A ambos autores agradecemos su colaboración y el permiso para la reproducción de sus imágenes). Los resultados de los cultivos que se obtienen en la ecopsia son muy superiores a los que se consiguen en la autopsia clínica. Por ello, en nuestro Servicio la toma para cultivos en los casos de autopsia clásica se hace con control ecográfico.
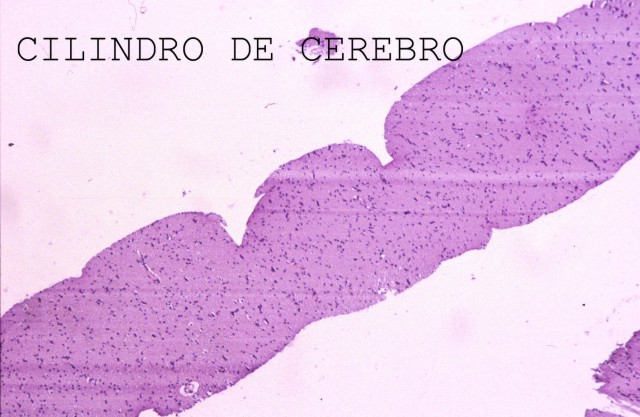 fiogf49gjkf0dFigura 1"> fiogf49gjkf0dFigura 1">
Fig.1-3 - fiogf49gjkf0d Figura 1
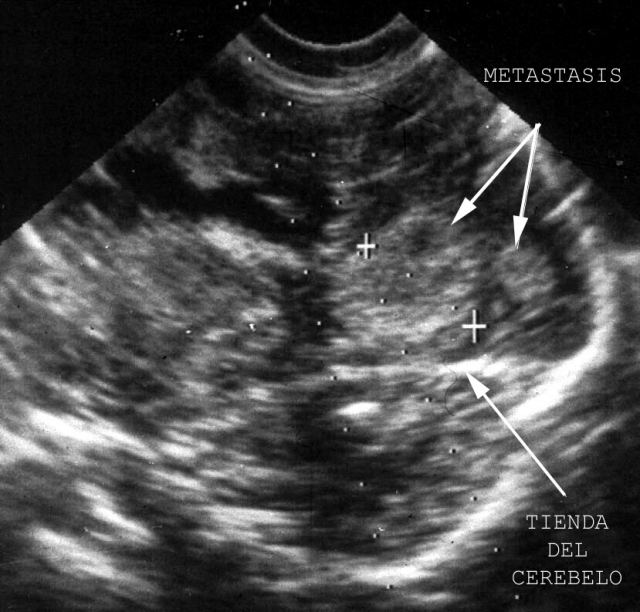 fiogf49gjkf0dFigura 2."> fiogf49gjkf0dFigura 2.">
Fig.2 - fiogf49gjkf0d Figura 2.
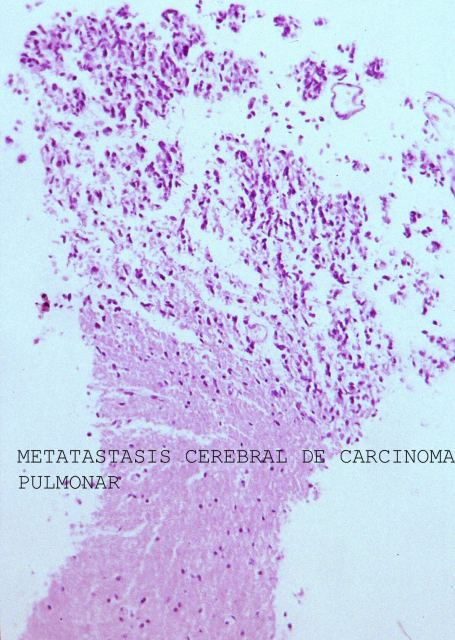 fiogf49gjkf0dFigura 3."> fiogf49gjkf0dFigura 3.">
figura 3 - fiogf49gjkf0d Figura 3.
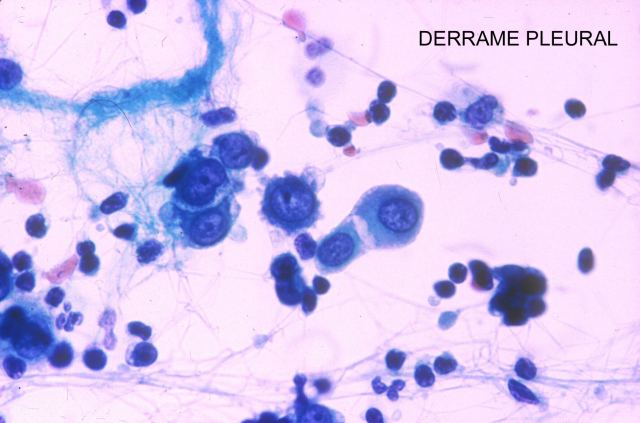 fiogf49gjkf0dFigura 4."> fiogf49gjkf0dFigura 4.">
Fig.4 - fiogf49gjkf0d Figura 4.
 fiogf49gjkf0dFigura 5."> fiogf49gjkf0dFigura 5.">
Fig.5 - fiogf49gjkf0d Figura 5.
 fiogf49gjkf0dFigura 6."> fiogf49gjkf0dFigura 6.">
Fig.6 - fiogf49gjkf0d Figura 6.
 fiogf49gjkf0dFigura 7"> fiogf49gjkf0dFigura 7">
Fig.7 - fiogf49gjkf0d Figura 7
 fiogf49gjkf0dFigura 8"> fiogf49gjkf0dFigura 8">
Fig.8 - fiogf49gjkf0d Figura 8
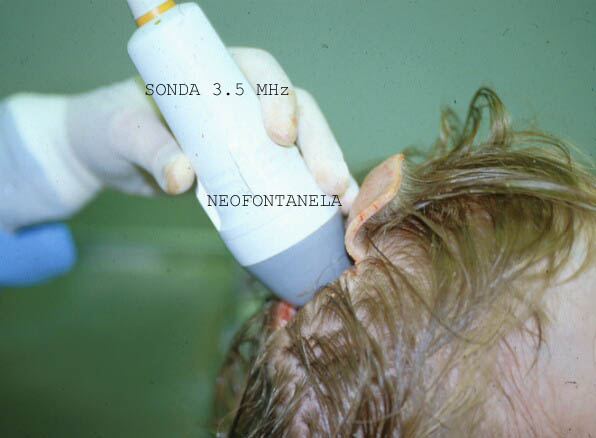 fiogf49gjkf0dFigura 9."> fiogf49gjkf0dFigura 9.">
Fig.9 - fiogf49gjkf0d Figura 9.
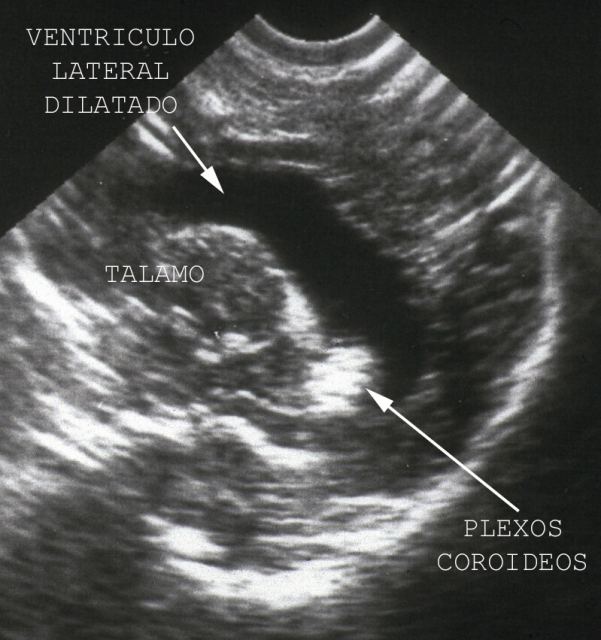 fiogf49gjkf0dFigura 10"> fiogf49gjkf0dFigura 10">
figura 10 - fiogf49gjkf0d Figura 10
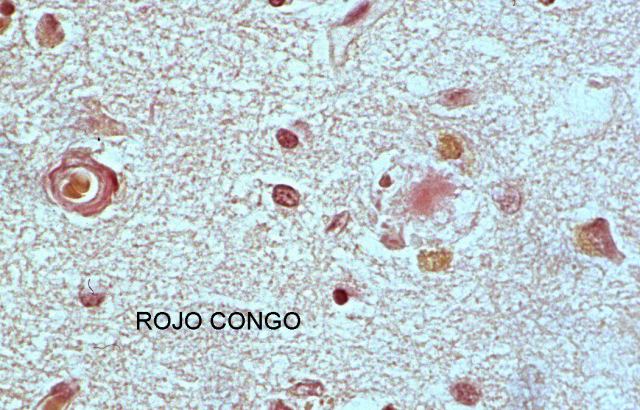 fiogf49gjkf0dFigura 11"> fiogf49gjkf0dFigura 11">
Fig.11 - fiogf49gjkf0d Figura 11
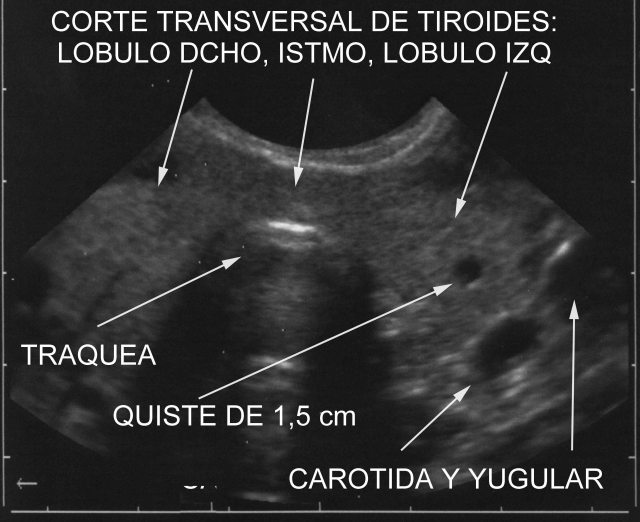 fiogf49gjkf0dFigura 12."> fiogf49gjkf0dFigura 12.">
Fig.12 - fiogf49gjkf0d Figura 12.
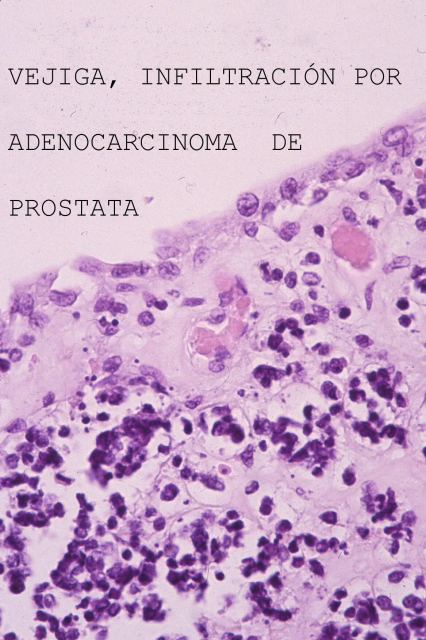 fiogf49gjkf0dFigura 13."> fiogf49gjkf0dFigura 13.">
Fig.13-18 - fiogf49gjkf0d Figura 13.
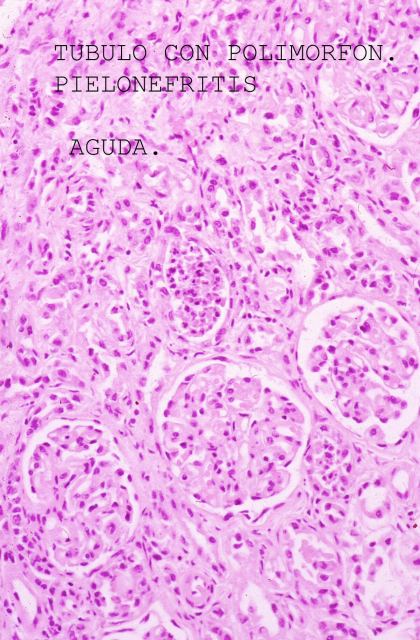 fiogf49gjkf0dFigura 14."> fiogf49gjkf0dFigura 14.">
Fig.14 - fiogf49gjkf0d Figura 14.
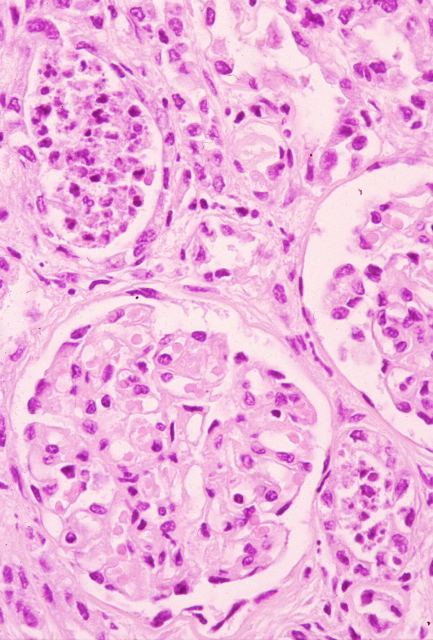 fiogf49gjkf0dFigura 15."> fiogf49gjkf0dFigura 15.">
Fig.15 - fiogf49gjkf0d Figura 15.
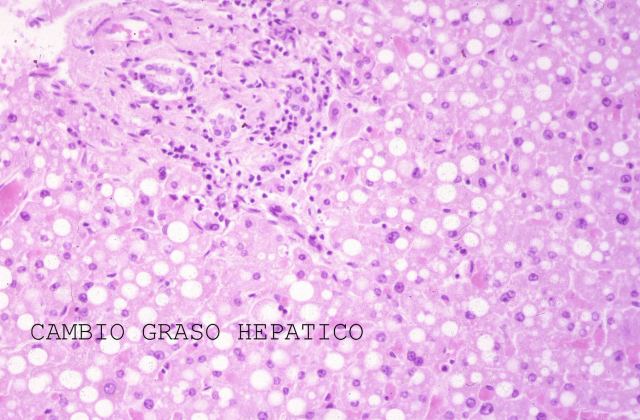 fiogf49gjkf0dFigura 16."> fiogf49gjkf0dFigura 16.">
Fig.16 - fiogf49gjkf0d Figura 16.
 fiogf49gjkf0dFigura 17."> fiogf49gjkf0dFigura 17.">
Fig. 17 - fiogf49gjkf0d Figura 17.
 fiogf49gjkf0dFigura 18."> fiogf49gjkf0dFigura 18.">
Fig.18 - fiogf49gjkf0d Figura 18.
 fiogf49gjkf0dFigura 19."> fiogf49gjkf0dFigura 19.">
Fig.19-20 - fiogf49gjkf0d Figura 19.
 fiogf49gjkf0dFigura 20."> fiogf49gjkf0dFigura 20.">
Fig.20 - fiogf49gjkf0d Figura 20.
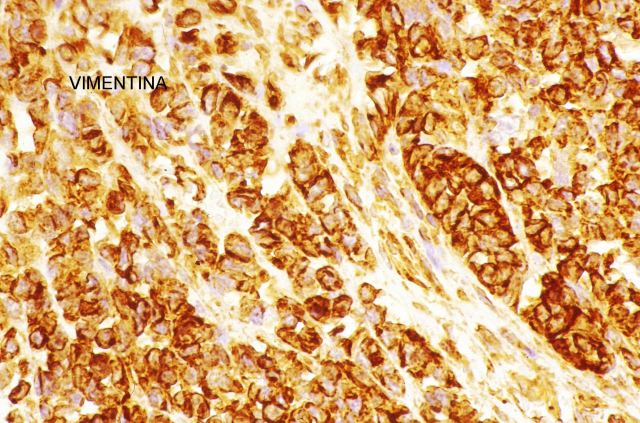 fiogf49gjkf0dFigura 21."> fiogf49gjkf0dFigura 21.">
Fig. 21-22 - fiogf49gjkf0d Figura 21.
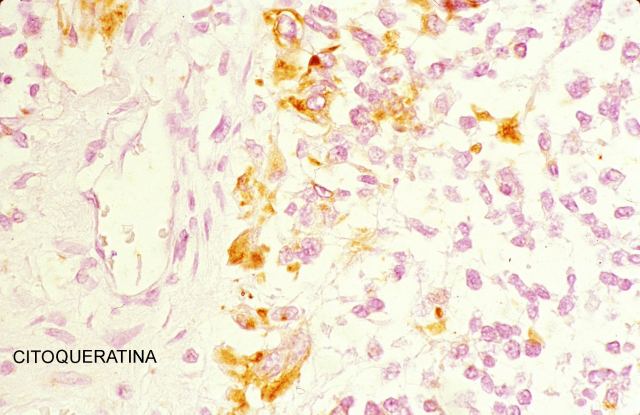 fiogf49gjkf0dFigura 22."> fiogf49gjkf0dFigura 22.">
Fig.22 - fiogf49gjkf0d Figura 22.
 fiogf49gjkf0dFigura 23."> fiogf49gjkf0dFigura 23.">
Fig.23-25 - fiogf49gjkf0d Figura 23.
 fiogf49gjkf0dFigura 24."> fiogf49gjkf0dFigura 24.">
Fig.24 - fiogf49gjkf0d Figura 24.
 fiogf49gjkf0dFigura 25."> fiogf49gjkf0dFigura 25.">
Fig.25 - fiogf49gjkf0d Figura 25.
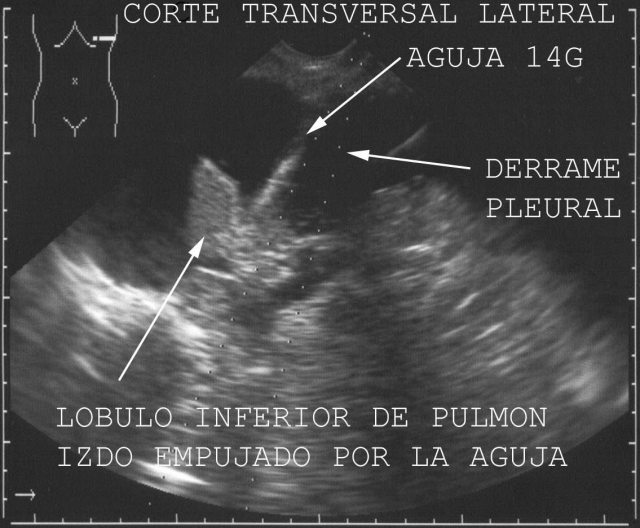 fiogf49gjkf0dFigura 26."> fiogf49gjkf0dFigura 26.">
figura 26 - fiogf49gjkf0d Figura 26.
 fiogf49gjkf0dFigura 27."> fiogf49gjkf0dFigura 27.">
Fig.27 - fiogf49gjkf0d Figura 27.
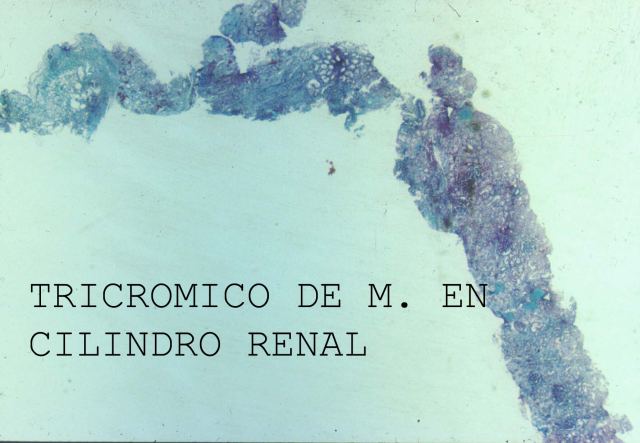 fiogf49gjkf0dFigura 28."> fiogf49gjkf0dFigura 28.">
Fig.28 - fiogf49gjkf0d Figura 28.
 fiogf49gjkf0dFigura 29."> fiogf49gjkf0dFigura 29.">
Fig.29 - fiogf49gjkf0d Figura 29.
 fiogf49gjkf0dFigura 30."> fiogf49gjkf0dFigura 30.">
Fig.30 - fiogf49gjkf0d Figura 30.
 fiogf49gjkf0dFigura 31."> fiogf49gjkf0dFigura 31.">
Fig.31 - fiogf49gjkf0d Figura 31.
 fiogf49gjkf0dFigura 32."> fiogf49gjkf0dFigura 32.">
figura 32 - fiogf49gjkf0d Figura 32.
 fiogf49gjkf0dFigura 33."> fiogf49gjkf0dFigura 33.">
figura 33 - fiogf49gjkf0d Figura 33.
 fiogf49gjkf0dFigura 34."> fiogf49gjkf0dFigura 34.">
figuras 34 - fiogf49gjkf0d Figura 34.
 fiogf49gjkf0dFigura 35."> fiogf49gjkf0dFigura 35.">
y 35 - fiogf49gjkf0d Figura 35.
 fiogf49gjkf0dFigura 36."> fiogf49gjkf0dFigura 36.">
figuras 36 - fiogf49gjkf0d Figura 36.
 fiogf49gjkf0dFigura 37."> fiogf49gjkf0dFigura 37.">
y 37 - fiogf49gjkf0d Figura 37.
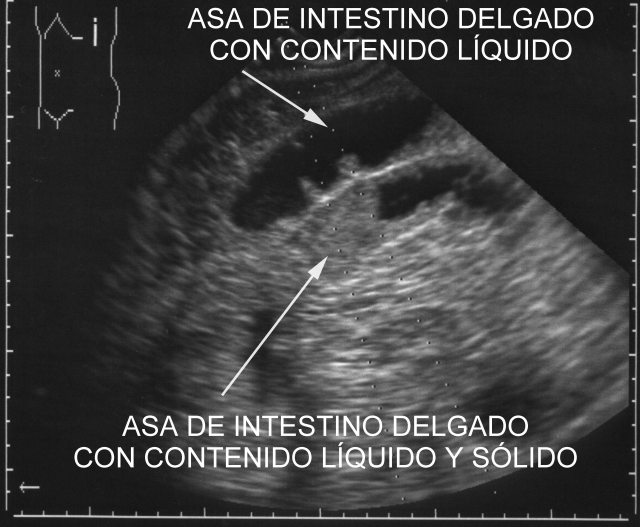 fiogf49gjkf0dFigura 38."> fiogf49gjkf0dFigura 38.">
figura 38 - fiogf49gjkf0d Figura 38.
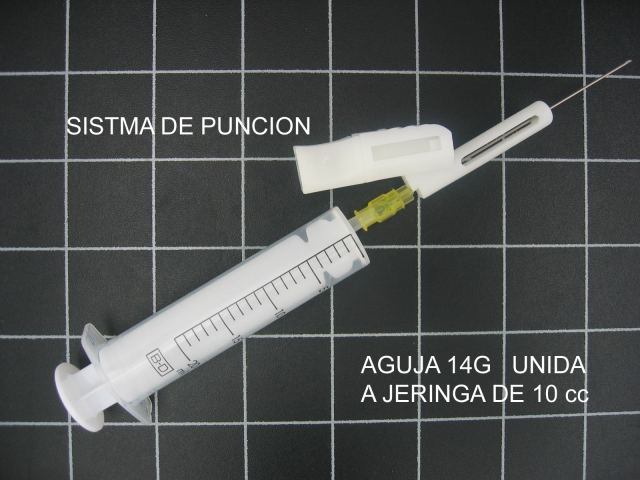 fiogf49gjkf0dFigura 39."> fiogf49gjkf0dFigura 39.">
figura 39 - fiogf49gjkf0d Figura 39.
 fiogf49gjkf0dFigura 40."> fiogf49gjkf0dFigura 40.">
Fig.40 - fiogf49gjkf0d Figura 40.
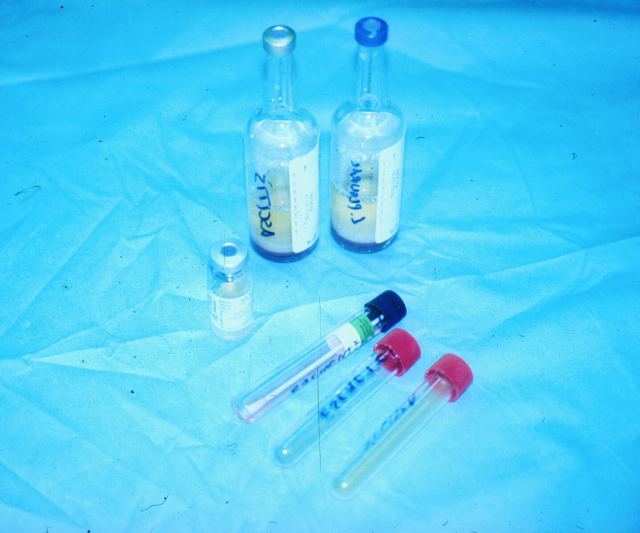 fiogf49gjkf0dFigura 41."> fiogf49gjkf0dFigura 41.">
figura 41 - fiogf49gjkf0d Figura 41.
|



