

|
Carcinoma Ductal in Situ de la Mama. Comunicación de 18 casos. Dr. José María González Ortega*, Dr. Mario Michel Gómez Hernández*, Dr. Mario Miguel Morales Wong*, Dra. Zoraida Caridad López Cuevas*, René Luis Escaig Olivares*, Marta Martín Torres** |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
El Carcinoma Ductal in Situ fue probablemente reconocido primero por cirujanos quienes observaron su pronóstico favorable. El término carcinoma intraductal puro se refiere a la ausencia de invasión detectable en la membrana basal, ilustrado por tinciones especiales. Los subtipos de este hoy en día son bien reconocidos. El Carcinoma Ductal Infiltrante es considerado en la actualidad un estado temprano de la enfermedad maligna, que surge del epitelio ductal y puede aproximadamente en el 25 al 30 % de las lesiones progresar a una enfermedad invasiva si no son sometidos a tratamiento. Nuestro objetivo fue determinar el comportamiento clínico-histológico de 18 pacientes femeninas diagnosticadas con Carcinoma Ductal in Situ en el Hospital Universitario “Dr. Mario Muñoz Monroy”. Colón. Provincia Matanzas. Cuba, en el período comprendido entre Enero de
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
El Carcinoma Ductal In Situ (C.D.I.S), Carcinoma Intraepitelial o Carcinoma No Invasivo, entre otros sinónimos, son generalmente aceptados como una enfermedad maligna que surge del epitelio ductal y que puede convertirse en invasiva e inclusive metastizar si no es tratada (Foto Nro 1). Hasta mediados de los años 70, los C.D.I.S fueron lesiones relativamente poco frecuentes. Con la aparición la mamografía, el cáncer intraductal se ha convertido en el tipo histológico in situ más frecuente en la mama (1-5). La incidencia del C.D.I.S es del 0.8% al 5% entre todos los cánceres de mama y del 3 al 9% del cáncer de mama en el hombre. Los índices de incidencia recientemente detectados alcanzan hasta un 20% en países desarrollados (3) y el subtipo microinvasivo es encontrado entre el 5 – 10% de los C.D.I.S (6). El rango de edad de aparición para este tipo de neoplasia es de 51 a 59 años, de donde se infiere que la existencia o duración del C.D.I.S no es muy prologada (7,8). La literatura más antigua reportaba que la mayoría de los casos de C.D.I.S se presentaban con una masa palpable, además debido a que puede estar dilatado el conducto puede existir descarga por el pezón (fundamentalmente serohemática y hemática). EL C.D.I.S está aumentando su incidencia desde que las microcalcificaciones que acompañan con frecuencia a esta variedad de enfermedad y se observan como “racimos de uva” están siendo detectados radiológicamente en los pesquizajes de mujeres asintomáticas (9,10). La Biopsia Estereotáxica consigue diagnósticos histopatológicos específicos, que son hechos sin cirugía y ha sido demostrado que son exactos y un método efectivo de diagnóstico de la enfermedad mamaria, particularmente en lesiones no palpables (11). Este método de investigación nos permite con mucha exactitud diagnosticar procesos de hiperplasia ductal atípica, el cual ha sido considerado un paso previo hacia los Carcinomas In Situ. El Mapeo Linfático y la Biopsia del Ganglio Centinela en pacientes con C.D.I.S representan técnicas novedosas, factibles y constituyen un método elevadamente exacto de estadiamiento de pacientes con enfermedad micrometastásica, no detectadas en los ganglios linfáticos regionales por tinciones de rutina con hemotoxilina y eosina (12,13). Otro hecho a destacar en estos tumores es la multicentricidad definida por Mc Divita como la presencia de 2 ó más focos separados de carcinoma dentro de la mama, los cuales se originan independientemente en respuesta al mismo estímulo carcinogénico (1). Lagios definió la multicentricidad como una lesión a 5 cm de distancia del tumor primario (1). La multicentricidad ha llegado a tener una incidencia del 30% en el C.D.I.S mucho menor que en el Carcinoma Lobular In Situ (C.L.I.S) (50-80%). La bilateralidad es otra cuestión no menos importante a señalar en el C.D.I.S y se ha reportado entre un 0 y un 30%, si no se diagnostica con mayor frecuencia es porque no se realiza sistemáticamente la biopsia contralateral. La frecuencia de metástasis ganglionares axilares en el C.D.I.S es del 0 al 9%, pudiendo tener áreas de microinvasión que frecuentemente pasan inadvertidas a la microscopía óptica y hacerse evidentes a la electrónica. Nuestro propósito fundamental fue determinar la incidencia y el estudio de otras variables relacionadas con el C.D.I.S en el Hospital Universitario “Dr. Mario Muñoz Monroy” de Colón, Provincia Matanzas. El presente trabajo es el complemento de otra investigación realizada donde se revisa el tema de los C.L.I.S en particular su concepto, biología y terapéutica.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Se realizó un estudio descriptivo de corte transversal y retrospectivo, realizado en el Hospital Universitario “Dr. Mario Muñoz Monroy” del Municipio de Colón, Provincia de Matanzas en el período comprendido entre Enero de 1976 hasta Diciembre del 2004, ambos incluidos. Nuestro Universo de estudio estuvo comprendido por 495 mujeres operadas de Cáncer Mamario en el Servicio de Cirugía General del referido centro, tomándose como Muestra de nuestro estudio a 18 pacientes cuyo diagnóstico histopatológico resultó ser un Carcinoma Ductal in Situ. Estudiamos las siguientes variables: Edad en el momento del diagnóstico, la Bilateralidad de la enfermedad, la presencia de Metástasis Ganglionares y el tipo de Técnica Quirúrgica utilizada. El procesamiento de la información se realizó mediante una Microcomputadora Pentium IV, utilizando los programas de Microsoft Access y Microsoft Word del paquete Microsoft Office 2003 en un ambiente de Windows XP. Se empleó el método estadístico porcentual y los resultados se presentan en tablas para su mejor comprensión.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
En nuestra investigación encontramos una incidencia del 3,6% (18 \ 495). La edad media fue de 51 años con un rango entre 22 a 77 años (Tabla Nro. 1). Tabla Nro. 1. “ Carcinoma Ductal in Situ. Edad promedio en el momento del diagnóstico y comparación con otros autores”.
Dos de los 18 casos presentados en este trabajo el 11% fueron bilaterales, ambos sincrónicos. (Tabla Nro. 2) Tabla Nro. 2 . “Bilateralidad del Carcinoma Ductal In Situ y comparación con otros autores.”
Existió evidencias de metástasis a ganglios linfáticos en solo 2 de pacientes (2/18) (11%). En ambos la enfermedad metastásica se presentó en un solo ganglio de los estudiados y en uno de ellos existió en la pieza dos áreas de microinfiltración, evidenciándose la multicentricidad. (Tabla Nro. 3) Tabla Nro. 3 “Carcinoma Ductal in Situ con Invasión ganglionar. Comparación con otros autores”.
En relación con el Tratamiento Quirúrgico empleado, debemos señalar que la mayoría de nuestros casos fueron intervenidos por una masa palpable o debido a una telorragia y en tan sólo 3 casos la indicación de cirugía estuvo supeditada a hallazgos mamográficos (lesiones no palpables) . Es por ello que se realizaron 9 Mastectomías Radicales (Halsted), todas ellas practicadas antes de Junio de 1984, pues ya en el año 1985 con la estandarización nacional de cirugías menos cruentas para este tipo de patología, se comenzó a realizar en nuestro Hospital la Mastectomía Radical Modificada (Mérola – Patey), efectuándose este tipo de técnica a 5 pacientes. Se llevó a cabo 1 Mastectomía Total Ampliada y 3 Cuadrantectomías. (Gráfico No. 1)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
La incidencia del C.D.I.S según la literatura revisada oscila entre el 0.8 y el 5% de todos los cánceres de mama en el sexo femenino, la reportada en nuestra casuística fue del 3,6% por lo que coincide con el rango internacionalmente señalado . El C.D.I.S puro en el hombre es extremadamente raro. La edad promedio en el momento del diagnóstico fue de 51 años, correspondiéndose con lo encontrado por Cutuli y cols que en una serie de 882 casos de C.D.I.S fruto de un estudio multicéntrico ( 9 Centros de Cáncer en Francia), encontró una edad media de 53 años (7), Fowble y cols del Centro de Cáncer Fox Chase en Filadelfia (8) expone una edad media de 56 años. Sin embargo existen series como la de Hiramatsu (14) de Bostonquier quien reporta en una serie de 76 casos de C.D.I.S una edad media de 48 años. La bilateralidad del C.D.I.S se presentó en nuestra serie en el 11% (2 pacientes), cifra que concuerda con la literatura revisada, la cual encuentra una media de bilateralidad que va desde 0% a un 30%. Entre los factores de riesgo para metástasis ganglionar en C.D.I.S con componente mínimo invasivo (micro infiltrantes) están: la variedad comedocarcinoma, el número de conductos involucrados en los C.D.I.S y el grado nuclear III de esta enfermedad (15,16). Según las recomendaciones de consenso de la Sociedad Oncológica Centroamericana y del Caribe (SOCECAR) del 2004, la disección axilar junto a la mastectomía debe ser valorada en lesiones voluminosas (>40 mm) (17). Solo dos pacientes de nuestra muestra tenían metástasis ganglionares axilares (11%), el rango encontrado mundialmente va desde el 0% al 9% (16). En relación con la multicentricidad existen numerosos estudios como los de Roseu, Wanebo, Contesso – Petit y Carter – Smith quienes sugieren una elevada incidencia de foco de Carcinoma Residual después de realizar una Biopsia Excisional como único tratamiento quirúrgico. Los investigadores han mostrado que ciertas características tumorales como: tumores grandes (Lesiones T2), los ganglios axilares positivos (N+), los tumores con un componente intraductal extenso, los tumores palpables y la histología tubular están correlacionadas con la mayor posibilidad de encontrar tumor persistente en la segunda escisión (18). Tuvimos una sola paciente que presentó áreas de multicentricidad en la pieza quirúrgica (5,5%), la incidencia de lesión multifocal es mucho menor que en C.L.I.S. La manera de enfrentar esta patología tiene un amplio espectro de modalidades, en nuestra pequeña serie la opción que predominó fue la cirugía radical de Halsted, pues cerca de la mitad de las pacientes se presentaron clínicamente con una “masa palpable” informando el patólogo en la Biopsia por Congelación la positividad de la lesión, sin especificar estirpe histológica, siendo hasta los primeros años de la década del 80 la operación de Halsted la indicada nacionalmente para el manejo de las patologías malignas mamarias, ya con el decursar de los años, el enfrentamiento terapéutico cambió a modalidades menos agresivas y combinadas. El tratamiento de este tipo de neoplasia se matiene muy controversial por lo que realizamos un resúmen de los elementos más relevantes encontrados en la literatura actualizada: Opciones de tratamiento para el C.D.I.S : 1) En el C.D.I.S unicéntrico se recomienda la exéresis amplia más radioterapia o la mastectomía subcutánea (con conservación del complejo areola – pezón) a)-En los tumores igual o menores de 3 cms se utiliza la cirugía preservadora más radioterapia a la mama. b)-Si la tumoración es de 3 a 4 cms. Se realizará cirugía preservadora según la relación volumen mamario / tumor más radioterapia. c)- En los tumores mayores de 4 cms y multicéntricos se recomienda la mastectomía. 2) El papel de la radioterapia después de la exéresis local permanece controversial (2,19). Según Julieu y cols reportan los primeros resultados de un ensayo en Fase III en relación con el uso de la radioterapia más cirugía preservadora de la mama en el C.D.I.S y concluyen que la radioterapia redujo el número global de recurrencias invasivas y no invasivas en la mama homoteral con un seguimiento medio de 4 años (20). 3) Sin embargo estudios retrospectivos indican que la radioterapia puede ser omitida de manera segura después de una exéresis local amplia, es decir, con márgenes libres mayores de 10 mm, en tumores menores de 15 mm, que no tengan alto grado de diferenciación nuclear, ni necrosis asociada, es decir, lo que corresponde al puntaje 3 – 4 en el índice pronóstico de Van Nuys (17). 4)La disección radical de la axila de manera formal, no es apropiada en el C.D.I.S . Sin embargo el papel potencial de la biopsia del ganglio centinela en casos seleccionados de alto riesgo adquiere cada día más adeptos. 5)Debe tenerse en cuenta que el C.D.I.S de tipo comedocarcinoma parece ser un tumor más agresivo y estar asociado con una mayor probabilidad de carcinoma ductal invasor. Este tipo de C.D.I.S se beneficiaría mucho más con una mastectomía (14,21). 6)El papel del Tamoxifen en el tratamiento del C.D.I.S continúa desarrollándose (22). Áreas de investigaciones futuras: ü El papel potencial de inhibidores de la aromatasa de 3ª generación (Vorozole) y moduladores de receptores de estrógeno selectivos de 3ª y 4ª generación en mujeres con C.D.I.S hormono dependientes. ü El papel potencial de inhibidores tipo 2 de ciclo-oxigenasa en el tratamiento y prevención del C.D.I.S. ü El valor de la Resonancia Magnética y la Imagenología con Medicina Nuclear. ü La relevancia clínica del perfil de expresión genética, la radiofrecuencia o ablación con Láser y la ductoscopía mamaria en el manejo del C.D.I.S (23, 24).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
1) Moreno de Miguel, LF. Cáncer Temprano de la mama. 1ra. Ed. La Habana: Editorial Ciencias Médicas. Centro Nacional de Información de Ciencias Médicas; 1993. 2) Mokbel K. Treatment of ductal carcinoma in situ of the breast: review of rocent advances and future prospects.Int. J. Fertil Womens Med. 2003 Sep – Oct; 48 (5): 217 – 25. 3) Gatete J, Duben J, Hnatek L. Surgical Therapy of the ductal carcinoma in situ. Roxhl chir. 2004 Nov; 83 (11): 597 – 603. 4) Baxter NN, Virnig BA, Burham SB. Trendes in the treatment of ductal carcinoma in situ of the breast. Am J. Surg. 2004; 192(8): 986-9. 5) Kotwall C, Bronker C, Covington D. Local and National trends over a decade in the surgical treatment of ductal carcinoma in situ. Am J. Surg. 2003 Dec; 186 (G): 723 – 8. 6) Rodríguez N, Carter D, Dillon D. Correlation of clinical and patología features with outcome in patients with ductal carcinoma in situ of the breast treated with breast – conserving surgery and radio therapy. Int J. Radiat Oucol Biol Phys. 2002 Dec 7) Cutuli B, Fay R, Cohen – Solal He Nir C. Ductal carcinoma in situ of the breast. Analysis of 882 cases. Presse Med. 2004 Jan; 33 (2): 83-9. 8) Fowble B, Haulon AL, Fein D A. Results of conservative surgery and radiation for mamographi cally detected ductal carcinoma in situ (CDIS). Int J. Radiat Oncol Biol Phys. 1997 Jul 15; 38 (5): 949 – 57. 9) Fentiman IS. Treatment of in situ breast cancer. Acta Oncol. 1989; 28 (6): 923-6. 10) Page DL, Dupond WD. Anatomía markers of herman prevealiguanay and risk of breast cancer. Cáncer 1990; 66: 1326 – 35. 11) Mendez I, Andreu F J, Saez E. Ductal carcinoma in situ and atypical ductal hiperplasia of the breast diagnosed at stereotactic core biopsy. Breast J. 2001 Jan – Feb; 7( 1): 14 – 18. 12) Pendas S, anway. E, Guiliano R. Sentinel node biopsy in ductal carcinoma in situ patients. Ann Surg Oncol. 2001 Sep; 8 (8): 617 – 19. 13) Klauber De More N, Tan L K, Liberman L. Sentinel lymph node biopy: Is it indicated in patients with high – resk ductal carcinoma in situ and ductal carcinoma in situ with microinvasion? Anie Surg Oncol. 2001 May; 8 (4); 380-4. 14) Hiramatsu H, Borntein BA, Recht A. Local recurrence after conservative Surgery and Radiation Therapy for Ductal carcinoma in situ. Cáncer J. Sci AM. 1995 May; 1 (1): 55. 15) Solín L J, Mc Cormick B, Recht A. Mammographically detected, clinically occult Ductal Carcinoma in situ. Treated with Breast – Conserving Surgery and Definitive Breast Irradiation. Cáncer J. Sci Am. 1996 May, 2 (3): 156-9. 16) Adamovich T L, Simmons RM. Ductal carcinoma in situ with microinvasión. Am. J. Surg 2003 Aug; 186 (2): 112 – 6. 17) Camacho R . Guía de recomendaciones, diagnóstico y tratamiento del cáncer de mama. 1ra.ed. Ciudad de La Habana: SOCECAR; 2004. 18) 19) Mirza NQ, Vlastor G, Meric Fetal. Ductal carcinoma in situ: Long term results of breast – conserving therapy. Ann Surg Oncol. 2000 Oct; 7 (9): 656 – 64. 20) Julieu JP, Bijker N, Feutiman. Radio therapy in breast – conserving treatment for ductal carcinoma in situ: First results of the EORTC randomized phase III trial 10853. Lancet. 2000 Jun 10; 355 (9220): 528 – 33. 21) Fisher B, Land E. Prevention of invasive breast cancer in women with ductal carcinoma in situ; an update of the national surgical adjuvant breast and bowel project experience. Semin Oncol. 2001 Aug; 28 (4): 400 – 18. 22) Hoaghton, George WD, Cuzick. Radio Therapy and Tamoxifen in women with completely excised ductal carcinoma in situ of the breast in the 23) Khau SA Baird C. Ductal Lavage and ductoscopy: the opportunities and the limitations. Clin Breast Cáncer. 2002 Aug; 3 (3): 185 – 91. 24) Horst KC, Snitt MC,
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
- Walter Marcial Martínez Rodríguez (09/10/2005 20:34:10)
- ELSIE BEATRIZ PICOTT RANGEL (12/10/2005 14:02:10)
- Walter Marcial Martínez Rodríguez (14/10/2005 22:37:01)
- Mario Miguel Morales Wong (22/10/2005 2:32:35)
- NATALIA MARTINEZ CASTILLO (26/10/2005 23:39:45)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 14:10:50
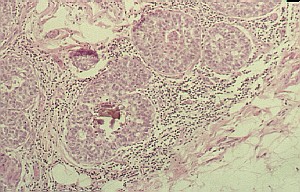 fiogf49gjkf0dFoto Nro 1. Carcinoma Ductal In Situ. Neoplasia que se encuentra en los conductos, su evolución natural es hacia la transformación invasiva. Tomado de: http://www.opolanco.es/Apat/Boletin13/ind100.htm
">
fiogf49gjkf0dFoto Nro 1. Carcinoma Ductal In Situ. Neoplasia que se encuentra en los conductos, su evolución natural es hacia la transformación invasiva. Tomado de: http://www.opolanco.es/Apat/Boletin13/ind100.htm
">