

|
Manuel Vaquero* |
|
|
El tumor MHI de las extremidades se describió en 1998 por dos grupos diferentes de patólogos (Montgomery y Meis-Kindblom) con diferente denominación. En cualquier caso se resaltaban los aspectos morfológicos y clínicos (tendencia a las recidivas con excepcionales metástasis y localización acral). En el presente caso el tumor, de 15 cm, se localizaba en la zona interna de la rodilla izquierda de un varón de 62 años. La había notado hacía unos meses. La TAC global no demostró otras lesiones. No había daño óseo ni cutáneo aunque histológicamente alcanzaba la fascia profunda y la dermis reticular. El patrón de crecimiento era vagamente nodular con tres componentes: mixoide con células gigantes tumorales multinucleadas peculiares, fibrohialino e inflamatorio. En el componente fibrohialino la celularidad era moderada, fusiforme con menos de 2 mitosis/10CGA y mínima atípia, excepto en dos pequeñas zonas con atipias y mitosis muy evidentes. El componente inflamatorio era el menos llamativo y tenía una distribución irregular. Predominaban los linfocitos maduros con algunos eosinófilos y escasas células grandes con núcleos uni o multilobulados y con nucleolos llamativos. No había necrosis. La inmunohistoquímica sólo resulto positiva para vimetina y, focalmente, para CD34. Los marcadores habituales de músculo liso, célula de Schwann, células de Hodgkin y ALK fueron negativos. El seguimiento posquirúrgico es de sólo dos meses. En la denominación del tumor transciende su aspecto morfológico y su localización. Sin embargo hay casos sin el componente mixoide y hay algún caso localizado en cabeza-cuello. Aunque las células con aspecto hodgkiniano o virocítico es el hecho morfológico que más se ha destacado, pueden ser escasas y se localizan preferentemente en las áreas inflamatorias. Por ello es probable que estos tumores sean más frecuentes de lo descrito ya que simulan muchas otras entidades que pueden afectar a tejidos blandos. En el presente caso hay zonas claramente atípicas con mitosis frecuentes si bien no hay definidos criterios morfológicos o clínicos que permitan predecir aquellos casos de mala evolución. Es aconsejable realizar estudio citogenético ya que están descritas translocaciones entre los cromosomas 1 y 10, así como cromosomas supernumerarios en anillo compuestos de fragmentos del cromosoma 3.
|
||
|
|
El tumor mixohialino inflamatorio (TMHI) fue descrito en 1998 por tres grupos diferentes de patólogos (1-3) con diferentes denominaciones. En todas ellas se resaltaban su localización preferente en la parte distal de las extremidades, su tendencia a las recidivas y sus aspectos morfológicos: multinodularidad, la mezcla de los componentes mixoide, hialino y epitelioide, así como la presencia de células con nucleolos prominentes que las conferían un aspecto hodgkiniano o virocítico.
Desde entonces han habido muy pocas comunicaciones en la literatura. En una se resalta la localización del tumor en el cuello (4) y en otras las alteraciones citogenéticos (5,6) o los hallazgos observados en la PAAF (7). Se comentan las peculiaridades de un caso también de presentación en una extremidad.
|
|
|
|
Un varón de 62 años consulta por una tumoración palpable en la zona interna de la rodilla izquierda que había notado desde hacía varios meses. El resto de la exploración clínica fue normal. La TAC de la zona demostró una tumoración de 15 cm con varias densidades y que se extendía desde la dermis hasta los tejidos profundos, contactando con el plano vasculonervioso de la pierna (figura 1). No había daño óseo ni ulceración. La TAC global no demostró otras lesiones.
Morfológicamente la tumoración alcanzaba la dermis reticular y el patrón de crecimiento era vagamente nodular (figura 2). Se visualizarón tres componentes: mixoide, fibrohialino e inflamatorio. El mixoide ocupaba la zona de los nódulos y contaba con células gigantes tumorales multinucleadas peculiares (figura 3); el fibrohialino tenía moderada celularidad epitelioide (figura 4), con 2 mitosis/10 CGA y mínima atipia, excepto en dos pequeñas zonas con atipias muy evidentes y mayor número de mitosis. El componente inflamatorio era el menos llamativo y tenía una distribución irregular. Predominaban los linfocitos maduros con algunos eosinófilos y escasas células grandes con núcleos uni o poli lobulados y con nucleolos llamativos (figura 5). No había necrosis. La inmunohistoquímica únicamente resultó positiva para vimentina y, focalmente, para CD34 (figura 3 y figura 4, recuadros). Los marcadores habituales de músculo liso (SMA), célula de Schwann (S-100), células de Hodgkin (CD30, CD15) y ALK fueron negativos. A los cuatro meses de la excisión quirúrgica con márgenes libres el paciente está sin enfermedad.
|
|
|
|
El TMHI (8-11) afecta por igual a ambos sexos y puede aparecer desde la primera década de la vida, aunque predomina en torno a la cuarta. El tumor presenta variaciones morfológicas importantes según la proporción de los distintos componentes. Hay casos con predominio de linfocitos y eosinófilos que obligan al diagnóstico diferencial con una enfermedad de Hodgkin o con infecciones virales, aunque pueden ser predominantes lás áreas mixoides y confundirse con liposarcomas mixoides o con histiocitomas fibrosos malignos mixoides. La localización acral y las áreas epitelioides recordarían a un sarcoma epitelioide pero no hay necrosis y las queratinas son negativas. En el presente caso la primera biopsia incluía la zona de hipodermis infiltrada por el tumor por lo que la cantidad de adipocitos y el aspecto mixoide recordaba a un liposarcoma, aunque no cumplía todos los criterios diagnósticos, por lo que se recomendó una biopsia de zonas más profundas que permitió orientar el diagnóstico definitivo. Aunque está publicado un estudio con PAAF (7) de tres casos en los que sólo uno no tenía los diversos componentes del tumor, la gran variabilidad de unas zonas a otras y la escasez de alguno de sus componentes en bastantes casos publicados hacen pensar en que esta técnica no es la idónea para orientar el diagnóstico. La inmunohistoquímica tampoco es de gran ayuda dada la negatividad o mínima positividad focal de los anticuerpos que frecuentemente se utilizan en las lesiones de partes blandas. En el caso actual la positividad con CD34 fue focal pero intensa. En cierto sentido semejante a la observable en sarcomas fibromixoides de bajo grado y en algunas proliferaciones fibroblásticas-miofibroblásticas. En cuanto a las células llamadas virocíticas son semejantes a los fibroblastos presentes en el corion de vejigas urinarias con irritación crónica o en el conectivo en torno a lesiones inflamatorias crónicas, como el que rodea las prótesis óseas.
Hay dos tumores con estudios citogenéticos. Lambert et al (5) encuentran un cariotipo complejo con una translocación t(1;10) (p22;q24) y pérdida de los cromosomas 3 y 13. Por su parte Mansoor et al (6) describen, por técnica de FISH, cromosomas en anillo de diverso tamaño y complejidad y con material del cromosoma 3, considerándolo como una forma peculiar de amplificación del material genético. Los cromosomas en anillo se han descrito asociados a tumores mesenquimales de bajo grado de malignidad como el dermatofibrosasrcoma protuberans, el osteosarcoma paraostal y el tumor lipomatoso atípico.
Las recidivas locales ocurren en más de la mitad de los pacientes y en la actualidad no hay criterios morfológicos o inmunohistoquímicos , incluidos la P53 y el MIB-1 (10), que permitan discernir entre los casos que sufrirán recaídas y los que no. Tan sólo hay un caso con metástasis en un ganglio regional (2). Se recomienda una excisión completa con los márgenes más amplios posibles.
|
|
|
|
1 - Montgomery EA, Davaney KO, Giordano TJ. Inflammatory mixohyaline tumor of distal extremities with virocyte or Reed-Sternbarg-like cells: A distinctive lesion with features simulating inflammatory conditions, Hodgkins disease, and varius sarcomas. Mod Pathol 1998; 11: 384-91 2 - Meis-Kindblom JM, Kindblom LG, . Acral myxoinflammatory fibroblastic sarcoma: a low-grade tumor of the hands and feet. Am J Surg Pathol 1998; 22: 911 3 - Michal M. Inflammatory myxoid tumor of the soft parts with bizarre giant cells. Pathol Res Pract 1998; 194: 529 4 - McFarlane R, Meyers AD, Glolitz L. Mixoinflammatory fibroblastic sarcoma of the neck. J cutan Pathol 2005; 32: 375-8 5 - Lambert I, Debrec-Rychter M, Guenlinckx P, Hamemeijei A, Sciot R. Acral myxoinflammatory fibroblastic sarcoma with unique clonal chromosomal changes. Virchows Arch 2001; 438: 509
7 - Pohar-Marinsek Z, Flezar M, Lamovec J. Acral muxoinflammatory fibroblastic sarcoma in FNAB samples: can we distinguish it from other myxoid lesions?. Cytopathology 2003; 14: 73-8 8 - Kindblom LG, Meis-Kindblom JM. Myxoinflammatory fibroblastic sarcoma. In: DM Fletcher, KK Uni, F Mertens. Eds. World Health Organization cassification of tumors: Pathology and genetics of tumours of soft tissue and bone. Lyon: IARC Press. 2002; 96 9 - Jursic V, Zidar A, Montiel MD et al. Myxoinflammatory fibroblastic sarcoma: a tumor not restricted to acral sites. Ann Diag Pathol 2002; 6: 272 10 - Sakaki M, Hirokawa M, Watatsuki S, Sano T, Endo K et al. Acral myxoinflammatory fibroblastic sarcoma: a report of five cases and review of the literature. Virchow Arch 2003; 442: 25-30 11 - Genevay M, Coindre JM, Guillon L. Entités récentes en pathologie tumorale des tissue mous (2e partie). Ann Pathol 2003; 23: 135-48
|
|
|
|
- Cesáreo Corbacho Cuevas (28/10/2005 15:16:19)
|
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 15:17:25
.jpg) fiogf49gjkf0dFigura 1- TAC de la rodilla en el que se observa una masa heterogénea que alcanza los planos profundos">
fiogf49gjkf0dFigura 1- TAC de la rodilla en el que se observa una masa heterogénea que alcanza los planos profundos">
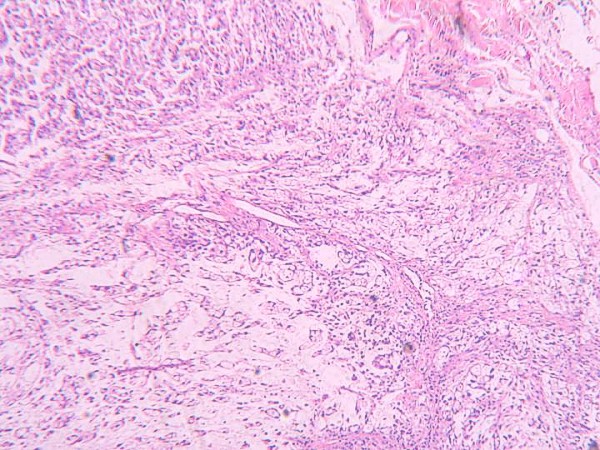 fiogf49gjkf0dFigura 2- Nodularidad de la tumoración y aspecto mixoide">
fiogf49gjkf0dFigura 2- Nodularidad de la tumoración y aspecto mixoide">
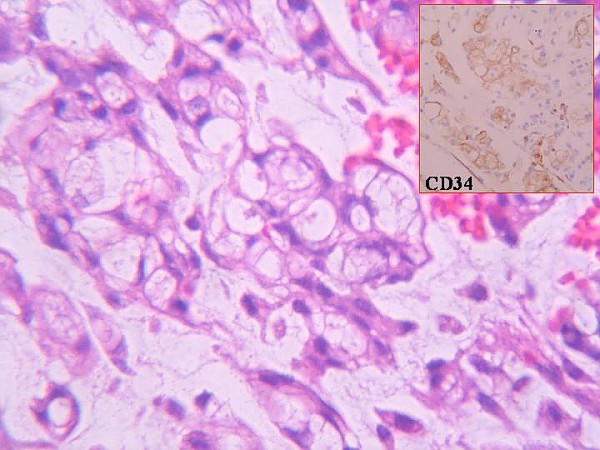 fiogf49gjkf0dFigura 3- Aspecto peculiar de las células gigantes tumorales de las áreas mixoides. Recuadro: CD34 en esas células">
fiogf49gjkf0dFigura 3- Aspecto peculiar de las células gigantes tumorales de las áreas mixoides. Recuadro: CD34 en esas células">
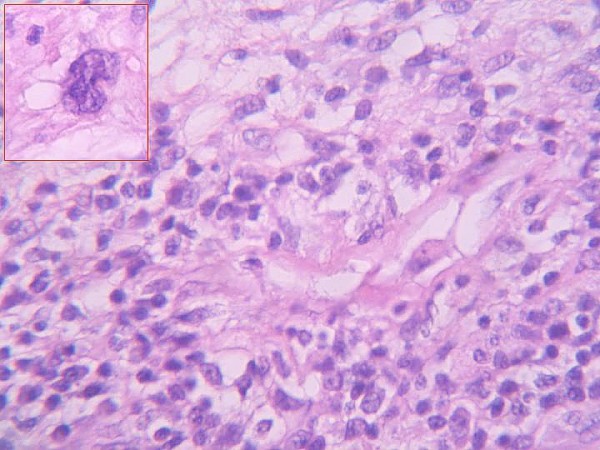 fiogf49gjkf0dFigura 4- Área inflamatoria con ocasionales célias sternbergoides (recuadro)
">
fiogf49gjkf0dFigura 4- Área inflamatoria con ocasionales célias sternbergoides (recuadro)
">
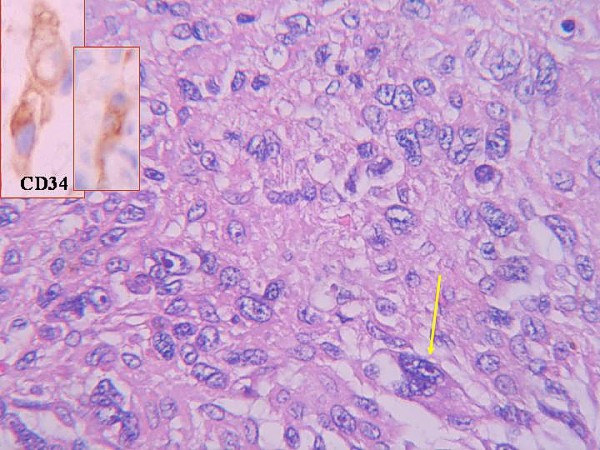 fiogf49gjkf0dFigura 5- Celularidad epitelioide pleomófica (flecha) y positividad para CD 34 (recuadro)
">
fiogf49gjkf0dFigura 5- Celularidad epitelioide pleomófica (flecha) y positividad para CD 34 (recuadro)
">