|
LOS TUMORES DE CÉLULAS GERMINALES DEL OVARIO. AVANCES
ANATOMOCLÍNICOS
Francisco
Nogales
Catedrático y Jefe de Departamento de Anatomía Patológica
Departamento de Anatomía Patologica,
Facultad de Medicina, Universidad de Granada. 18012 Granada, España
Colaboradores:
Julio Merino, Francisco Jiménez Burgos (Médicos
Residente de Anatomía Patológica), María
Luisa Musto1, Susana Ciani2 (Médicos
Becarios de Anatomía Patológica. Universidad de Montevideo,
Uruguay1 y Mendoza, Argentina2).
Los éxitos quimioterápicos en el tratamiento de los
tumores germinales producidos en la década de los 80 condujeron
a una notable perdida de interés anatomopatológico
y clínico acerca estas neoplasias, condicionándose
subsiguientemente una disminución en el número de
las aportaciones científicas en torno a estos tumores. En
esta nueva situación de excelentes respuestas al tratamiento,
el diagnóstico histopatológico aparentemente perdió
parte del gran valor predictivo que contuvo en la época prequimioterápica.
Otro dato que contribuyó a disminuir el interés en
el campo de los tumores de células germinales ha sido la
ausencia de hallazgos “dramáticos” mediante la
aplicación de técnicas de biología molecular
tal y como ha ocurrido en los tumores neurales, de mama, linfomas,
etc. Solamente, quizás en el terreno de la citogenética
se hayan producido algunas respuestas en lo referente al origen
de los tumores germinales, especialmente en lo referente al peculiar
fenómeno de la partenogénesis1,2.
A pesar de esta supuesta pérdida de atractivo clinicopatológico
y científico, quedan aún temas candentes en tumores
germinales todavía sin responder; Algunas de estas interrogantes
pueden ser:
- ¿Cómo se explica la falta de respuesta quimioterápica
de hasta un 10% de los tumores germinales? ¿hay factores
moleculares que puedan justificarla?
- Si los tumores germinales son característicamente una
caricatura de la embriogénesis: ¿qué papel
tienen en la misma los genes supresores y los homeóticos
organizadores?
- Si bien en el testículo conocemos las lesiones precursoras
germinales (neoplasia germinal intratubular), ¿cuáles
serían estas a nivel ovárico?
- ¿Cómo podemos explotar de modo terapéutico
y extrapolar a otros tipos de tumores la capacidad de maduración
espontánea y autorregulación de estos tumores?
- Si aceptamos que los tumores de células germinales representan
un experimento natural embriológico de diferenciación,
que papel jugaría el estudio de estos tumores en la comprensión
de la actual investigación de células madre embrionarias3-6
?
- Finalmente, aún quedan candentes temas de interés
tales como la descripción y reclasificación de nuevas
entidades y como consecuencia, nuevos problemas en la nomenclatura.
Los recientes progresos en tumores germinales ováricos quedan
resumidos en tres de nuestras recientes publicaciones7,7b,8.
Arriba
Pasaremos seguidamente a detallar algunos de los avances ocurridos
en estas neoplasias:
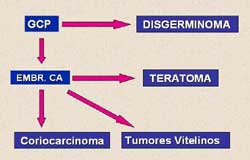
1- HISTOGÉNESIS
Los tumores de células germinales del ovario forman un amplio
abanico de entidades tumorales que reflejan la pluripotencialidad
de las células madre (germinales) presentes en el ovario.
La hipótesis histogenética aceptada hasta el final
de la década de los 80 ha sido radicalmente modificada en
base a nuevos conocimientos introduciéndose los siguientes
conceptos:
- La histogénesis de los distintos tumores germinales no
es unívoca, ya que para tumores morfológicamente
similares puede ser diferente en función de la edad de
presentación y de la topografía del tumor. Así
pues, las neoplasias testiculares, ováricas y extragonadales
posiblemente se originan a distintos niveles en la maduración
de la célula germinal o incluso a expensas de células
madre no germinales presentes en tejidos ya diferenciados de tipo
somático (regresión embriológica)
- Los germinomas (disgerminoma-seminoma)9, son capaces
de experimentar fenómenos ulteriores de diferenciación
y podrían ser de hecho, un estadío morfológico
precursor en el desarrollo de otros tumores germinales de tipo
teratoide10,11. Esto explicaría la alta frecuencia
de tumores mixtos de células germinales casi invariablemente
con un componente germinomatoso.
- Los tumores germinales primitivos muestran un solapamiento difuso
de características histológicas, a veces tan íntimamente
mezcladas que dificultan la delimitación de entidades histopatológicas
dentro de un esquema histogenético8.
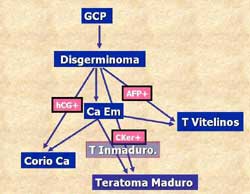
Los nuevos conceptos de histogénesis dinámica han
sido agrupados en un modelo tridimensional tetraédrico propuesto
por Srigley12 que interrelaciona los diferentes tipos
histológicos de tumores de células germinales, ahora
comprendidos como entidades dinámicas desde un punto de vista
madurativo. En este modelo se determinan las distintas tendencias
diferenciativas de los tipos de tumor germinal, en función
especialmente de la expresión de los distintos marcadores
proteicos de diferenciación:(citoqueratinas-diferenciación
epitelial, AFP- diferenciación hacia endodermo primitivo,
hCG- diferenciación hacia trofoblasto).
El grado de potencial maligno guarda una relación inversamente
proporcional al grado de desarrollo embriológico10,
así pues, las estructuras pobremente diferenciadas, primitivas
o transicionales, tales como trofoblasto, saco vitelino o tejido
somático embrionario, son casi invariablemente malignos.
Finalmente, incluso es posible que tumores teratoides completamente
maduros diferenciadores de estructuras viscerales (piel, estómago,
tiroides etc.) puedan desarrollar neoplasias secundarias benignas
o malignas tal y como ocurre en ciertos teratomas maduros. ( por
ejemplo: Carcinomas epidermoides, carcinoides o adenomas tiroideos
originados sobre “dermoides”)13.
Citogenética y aspectos de genética molecular.
La partenogénesis, al menos en los teratomas quísticos
benignos, es un hecho claramente probado mediante estudios ya clásicos
y apoyado por un paralelismo evidente con sistemas experimentales
en ratones endogámicos con alta susceptibilidad al desarrollo
de teratomas (ratones LT/ Sv desarrollados por Stevens) 1,14.
Se ha propuesto un origen de los distintos tumores de células
germinales a diferentes niveles de la reducción meiótica.
Así, se sugiere que los tumores primitivos tipo disgerminoma
se originen sobre células germinales premeióticas,
mientras que los teratomas maduros lo hagan sobre células
meióticas y los teratomas inmaduros sobre postmeióticas15.
Mediante la citogenética no ha sido posible encontrar un
marcador cromosómico relativamente constante como i (12p)
tan característico de los tumores germinales del testículo.
Este marcador se encuentra en algunos disgerminomas. En esta zona
de cromosoma se encuentra un oncogen tan importante como es c-ki-ras.
Se han encontrado con cierta frecuencia trisomía 12, delecciones
de 1p y translocaciones 10,12. El cromosoma 12 es el
lugar donde se halla el importante gen c-kit15. Dicho
gen es de capital importancia en la migración y desarrollo
de células germinales primitivas e interviene en la formación
del acrosoma. Este oncogen se halla mutado en tumores testiculares
primitivos y en pacientes femeninos ha sido comunicado ocasionalmente
en disgerminomas y tumores vitelinos asociados sobre disgerminoma
(¿posiblemente originados en intersexos con genotipo XY?)17,18.
Arriba
2- EPIDEMIOLOGIA.
Si bien en distintos países occidentales y en nuestro país,
los datos extraídos de los Registros de Tumores han mostrado
una reciente tendencia a la elevación de las tasas de incidencia
de los tumores testiculares19, este hecho sin embargo,
no se produce en los tumores germinales ováricos, sino todo
lo contrario. La disminución en las tasas de tumores germinales
del ovario se relaciona seguramente con la mínima natalidad
y el consecuente envejecimiento poblacional español.
Arriba
3- DISGERMINOMA.
Como se mencionó en la introducción, el disgerminoma
muestra similitudes morfológicas al seminoma testicular y
al germinoma extragonadal sin tener que compartir necesariamente
un mismo origen histogenético. Al igual que en el testículo,
en el ovario se han demostrado la presencia de tanto diferenciación
focal a células sincitiotrofoblasticas capaces de secretar
hCG, como secreción de AFP, indicando la capacidad de diferenciarse
hacia otros tipos tumorales germinales (teratomas, coriocarcinoma
y tumores vitelinos). La presencia de antígenos de diferenciación
somática tales como los de grupo sanguíneo, las citoqueratinas
o la proteína ácida glial fibrilar refuerza esta posibilidad11.
En los pacientes portadores de disgerminoma, las alteraciones somatosexuales
tienen lugar en 5-12% de los casos. En la mayoría de estos,
el disgerminoma se origina sobre un gonadoblastoma, una peculiar
lesión situada en la frontera entre las malformaciones y
tumores y asociada, casi invariablemente, a intersexos con un cariotipo
conteniendo genotipo XY. En estos casos, técnicamente corresponde
considerarlos más como seminomas de tipo testicular 7 que
como verdaderos disgerminomas ováricos asociados a genotipo
XX. Posiblemente esta es la razón de encontrar, en este tipo
de pacientes, tumores de células germinales de fenotipo testicular
(germinomas, carcinoma embrionario etc.)
En el 3% de los casos de disgerminoma con diferenciación
focal sincitiotrofoblástica puede acompañarse por
una sintomatología de pseudopubertad precoz isosexual o bien
pseudogestación en jóvenes sexualmente maduras
20. Se han descrito, infrecuentemente, agrupamientos familiares
21, y de forma ocasional asociación con síndromes
de riesgo de desarrollo tumoral tales como ataxia-telangiectasia22
y Li-Fraumeni23. Algunos síndromes paraneoplásicos
tales como hipercalcemia, hipoglucemia y enfermedades autoinmunes
ceden tras la exéresis del tumor24. Inmunohistoquímicamente
muestran positividad para la fosfatasa alcalina de tipo placentario
(PLAP) de distribución membranosa. Otros antígenos
marcadores tales como la ferritina son muy inespecíficos
siendo su positividad inconsistente. El CD117 (c-kit), puede ser
positivo, así como en los seminomas, reforzando su similitud
con éstos25. La positividad focal de AFP o bien
de citoqueratinas o incluso proteína acídica glial
fibrilar (GFAP), no invalida el diagnóstico de disgerminoma.
No hay un panel de marcadores bioquímicos homogéneo,
aunque la HCG muestra niveles elevados en solo 2-3% de los casos,
estos pueden ser lo suficientemente elevados como para simular una
enfermedad trofoblástica 20. La AFP suele ser negativa o
ligeramente elevada (hasta 10 ng/ml)25.
A pesar de su excelente supervivencia por su respuesta tanto radio
como quimioterápica, nunca hay que olvidar que el disgerminoma
es un tumor muy maligno y por tanto debe insistirse en la necesidad
de un adecuado estadiaje quirúrgico debido a que la recidiva
de un tumor inadecuadamente valorado y consecuentemente mal tratado,
puede tener una respuesta adversa a la quimioterapia.
La valoración histopatológica debe ser realizada
no en base a la descripción de los subtipos histológicos
–que carecen de valor pronóstico, incluido en el disgerminoma
anaplásico- sino en función de los posibles diagnósticos
diferenciales, pues la indicación del tratamiento depende,
al igual que ocurre en el testículo, de delimitar si se trata
de un verdadero disgerminoma o bien de un tumor germinal con diferenciación
(teratoma, carcinoma embrionario). También se han de tener
en cuenta otras posibilidades diagnósticas tales como linfomas,
tumor de células de la granulosa, de células pequeñas
con hipercalcemia cuyo pronóstico y tratamiento son radicalmente
distintos.
Arriba
4- TUMORES VITELINOS. (Tumores Endodérmicos
Primitivos)
Desde su descripción por Teilum en los años 50 estas
neoplasias han evolucionado desde un simple concepto embriológico-morfológico
(tumor del seno endodérmico)27 hasta una pléyade
de subtipos histológicos que varían en un continuo
que comprende aquellos que recuerdan a las estructuras de la placenta
murina (senos endodérmicos, membranas basales de Reichert)28
hasta diferenciaciones de tejidos somáticos derivados del
endodermo tales como hígado, intestino y pulmón29-31.
El complejo análisis histopatológico de estas neoplasias
hace considerar a los tumores vitelinos como un grupo morfológicamente
muy heterogéneo cuyo único denominador común
es la diferenciación de estructuras primitivas o inmaduras
derivadas del endodermo (Tabla 1).
| Zona
diferenciada
| Tejido
diferenciado
| Patrón
histológico
|
| Endodermo
Extraembrionario
| Endodermo
primitivo y saco vitelino secundario
| Reticular
Sólido Seno Endodérmico
|
| Alantoides
| Polivesicular
|
| Saco
vitelino parietal de tipo murino
| Parietal
|
| Endodermo
Somático
| Intestino
y pulmón primitivos (?)
| Glandular
|
| Hígado
embrionario
| Hepático
|
|
Tabla 1. Tumores vitelinos:Equivalencias
estructurales de los distintos patrones morfológicos
con el desarrollo embriológico de estructuras endodérmicas4
|
Recientemente, el el libro azul de la OMS7 hemos propuesto
reformar la actual terminología denominando tumores endodérmicos
primitivos de modo similar a lo propuesto para los tumores primitivos
neurales.
El término “tumor del seno endodérmico”,
si bien consagrado por el uso en algunos ambientes clínicos,
debe ser evitado pues no refleja ningún fenómeno biológico
o histogenético sino sólo la accidental similitud
morfológica con la placenta coriovitelina de los roedores
(¡!)27,31.
Los tumores vitelinos son altamente malignos y de rápido
crecimiento. Sólo en rarísimos tumores vitelinos bien
diferenciados (que por razones diversas no han sido sometidos a
quimioterapia) se ha detectado un buen pronóstico en ausencia
de tratamiento. Los subtipos histológicos de este complejo
grupo tienen una interesante equivalencia con las distintas derivaciones
del endodermo (ver tabla 2).
|
Gradación clásicaRef48
| Gradación
simplificadaRef 49
| Estadio
| Quimioterapia
|
|
Tumor ovárico Gr 1
| Bajo
grado
| Ia
| No
|
|
Tumor ovárico
Grs 2&3
| Alto
grado
| Ia
| Necesaria
|
|
Implantes Grs
2&3
| Alto
grado
| ≥II
| Necesaria
|
|
Solo implantes Gr 0
| -
| ≥II
| No
|
| Tabla 2 Manejo de los teratomas
inmaduros en relación con el grado histológico
y estadío clínico(4)
|
El análisis histológico de estos tumores posee un
interés sobre todo histogenético y embriológico
más que de un verdadero valor pronóstico. En ellos
es muy infrecuente encontrar patrones histológicos puros,
existiendo, siempre que se realice un extenso muestreo, áreas
diagnósticas de los patrones habituales (tipo reticular)
que proveen la segura clave sobre su identificación diagnóstica.
El interesante dato de la respuesta histológica a la quimioterapia
se refleja en extensas áreas de necrosis y ulterior cicatrización.
Infrecuentemente, puede ocurrir una progresión tumoral con
quimioconversión; fenómeno debido a la negativización
de los niveles séricos de AFP por destrucción quimioterápica
de las zonas epiteliales secretoras de AFP y permanencia de otras
áreas epiteliales no secretoras32. Igualmente,
es posible inducir con la radio o quimioterapia, un crecimiento
de extensas zonas del mesénquima no destruido por la quimioterapia,
el cual a su vez puede sufrir una transformación sarcomatosa
de tipo rabdomiosarcoma33.
Otro fascinante aspecto de estos tumores radica en su asociación
con tumores hematopoyéticos34, habitualmente leucemias
de tipo mieloide. Este curioso hecho, inicialmente descrito en tumores
vitelinos extragonadales ocurre igualmente en el tumores del ovario35.
Para explicarlo, es necesario considerar que tanto el saco vitelino
como los tumores que lo reproducen poseen la capacidad de producir
células hematopoyéticas sobre las que se pueden originar
distintos tipos de leucemias.
Una especial consideración clínica merecen los raros
tumores vitelinos ováricos de histogénesis no germinal
originados sobre carcinomas endometrioides. En nuestra experiencia35,
estos tumores muestran un comportamiento distinto al de los tumores
vitelinos germinales. Aparte de las claras diferencias en la edad
de presentación (pacientes peri y postmenopáusicos
frente a pacientes jóvenes), estos tumores se diagnostican
en estadios avanzados y exhiben una pobre respuesta quimioterapica
a las combinaciones habitualmente utilizadas en los tumores vitelinos.
Son por tanto, tumores de invariable mal pronóstico.
La AFP constituye el patrón oro de los marcadores
en este grupo tumoral37. Su excelente relación
clínica, habitualmente con cifras muy elevadas, hace innecesario
el uso de otros marcadores alternativos. Es muy importante considerar
que la elevación determinada por los tumores vitelinos habitualmente
supera cifras de 500-1000ng/ml. Sin embargo, la elevación
de niveles de AFP no es en absoluto exclusiva de los tumores vitelinos
(ver tabla 3), pues pueden ocurrir elevaciones ligeras de la misma
en teratomas inmaduros38 y disgerminomas. En los primeros
la secreción de la AFP es debida a elementos intestinales
inmaduros o a bien a focos de diferenciación hepatocitica.
Igualmente, la AFP puede hallarse elevada en algunos tumores infrecuentes
de origen no germinal tales como tumores de cordones sexuales. (variedad
retiforme del tumor de Sertoli-Leydig)39,40. En estos
tumores la fuente del marcador es la sorprendente presencia de elementos
hepáticos heterotópicos. Finalmente, existen elevaciones
de la AFP en los rarísimos carcinomas hepatoides de ovario,
neoplasias que contienen tejido hepático metaplásico
asociado sobre todo con carcinoma endometrioide. En estos casos
puede ser interesante diferenciar la isoforma de la AFP de tipo
hepático frente a la de tipo vitelino41,42.
| Niveles séricos
AF
| Tipo Tumoral
|
| >1000
ng/ml
| Tumores
vitelinos
|
<500 ng/ml
| Teratoma
Inmaduro
Carcinoma Embrionario
Carcinoma Hepatoide
|
| <50
ng/ml
| Disgerminoma
Tumor de Sertoli-Leydig
Retiforme
|
| Tabla 3. Niveles de AFP en distintos tipos de
tumores ováricos
|
Arriba
5- CORIOCARCINOMAS.
En estos rarísimos tumores germinales en forma pura, los
avances más interesantes residen en su diferenciación
con los coriocarcinomas de tipo gestacional43 ya que
en los trabajos más antiguos se acreditaba una mala respuesta
quimioterápica en los de tipo teratoide frente una excelente
respuesta en los de tipo gestacional. Parece sin embargo, que en
casos recientes tratados con modernos regímenes, la respuesta
a la quimioterapia es similar. La diferencia entre coriocarcinoma
gestacional y teratoide puede hacerse mediante la identificación
en el tejido tumoral de secuencias de ADN43, que son
exclusivamente paternas en el coriocarcinoma de tipo gestacional,
mientras que en los tumores teratoides lo serán de tipo materno.
Arriba
6- CARCINOMA EMBRIONARIO.
Existe cada vez un mayor acuerdo entre los autores en que este
tipo de tumor es casi totalmente exclusivo del testículo
y algunas localizaciones extragonadales. Por tanto, es muy posible
que la mayor parte de casos de carcinoma embrionario comunicados
en el ovario correspondan a tumores originados en gónadas
disgenéticas puras o mosaicos XY. Su histología y
evolución es totalmente idéntica a su contrapartida
masculina. Inmunohistoquímicamente, la positividad citoplasmática
a CD3045 lo diferencia de algunos disgerminomas con un
patrón similar sólido o anaplásico.
Un rasgo histológicamente curioso y ocasionalmente comunicado
en estos tumores es la presencia de pequeñas caricaturas
de embriones presomáticos determinando una forma especial
del tumor: el llamado poliembrioma46,47.
Arriba
7- TERATOMA INMADURO.
Este tumor, de pronóstico variable, representa la mezcla
desorganizada de numerosos tejidos, habitualmente neurales, en distintos
estadios de progresión embriológica diferenciativa.
Merecen la pena destacar algunos nuevos aspectos en torno a teratomas
inmaduros del ovario:
1- Nuevos hallazgos citogenéticos en relación
con su histogénesis.
Distintos estudios citogenéticos han demostrado la naturaleza
partenogenética a expensas de las células germinales
activadas. Se ha demostrado un origen a distintos niveles de la
reducción meiótica: es posible que los teratomas
inmaduros prepuberales, habitualmente de alto grado, se originen
sobre células premeióticas48,49, mientras
que los postpuberales habitualmente de mayor madurez y benignidad
corresponden a un origen a nivel postmeiótico. Las formas
maduras son habitualmente euploides y solo las muy inmaduras presentan
aneuploidía con triple cromosoma X. Frecuentemente, se
han comunicado trisomías50. El ocasional hallazgo
de heteromorfismos se explica a expensas de la fusión de
dos células germinales diferentes.
2-Valoración y gradación histológica de
los tumores.
Desde que a principios de los años 60 se estableció
el estudio histológico como el parámetro más
eficaz de comportamiento tumoral, se han sucedido distintos sistemas
de gradación que tienen en cuenta la cantidad y atipia
de tejidos inmaduros presentes en un tumor. Huelga decir que sin
un muestreo extenso del tumor (al menos un bloque por cada centímetro
de diámetro del tumor) es totalmente imposible delimitar
el grado histológico debido a las enormes variaciones de
tipos tisulares y de diferenciación del tejido presente.
Si bien la mayor parte de los tejidos son de tipo neural, es preciso
reconocer otros tipos de tejidos embrionarios que puedan hallarse,
tales como aquellos de origen endodérmico (posible fuente
de AFP), componentes mesenquimatosos inmaduros que puedan ser
agresivos per se, etc. Actualmente existen dos sistemas
de gradación:el primero con tres subcategorías51
y otro simplificado a dos52. Estos sistemas, ambos
equivalentes, van a determinan el manejo quimioterápico
de los tumores (tabla 2) teniendo en cuenta el grado histológico
de ambos tumor primario y metástasis. Insistimos en un
muestreo exhaustivo tanto quirúrgico (máximo número
de tomas de implantes peritoneales) como anatomopatológico.
3-Nuevas formas de teratoma inmaduro, incluidos los monodérmicos
El estudio histológico de grandes series ha considerado
separadamente, por su peculiar comportamiento e histología,
a algunos tipos de teratomas inmaduros:
- Teratomas endodérmicos inmaduros38:
este tipo de teratoma reproduce casi exclusivamente estructuras
endodérmicas tipo intestino primitivo, pulmón,
hígado, etc. Puede poseer un extenso componente neuroendocrino
y relacionarse morfológicamente con los infrecuentes
carcinoides mucinosos (adenocarcinoides) de tipo apendicular53.
Característicamente poseen capacidad de secretar niveles
bajos de AFP38.
- Un subtipo interesante de teratoma inmaduro es aquel en el
que predominan histológicamente patrones tumorales
neurológicos54 tanto centrales como periféricos.
Estos tumores habitualmente se corresponden con tumores de alto
grado (grado histológico II-III) que pueden reproducir
cualquier tipo histológico de tumor del SNC (meduloblastoma,
neuroblastoma, glioblastoma, etc.) o periféricos (neuroblastoma)55-57.
Recientemente hemos podido observar casos del llamado tumor
neuroectodermico primitivo de tipo periférico (PNET).
Estos tumores presentan el dilema quimioterapico de tratarlos
como tumor germinal o bien como tumor de estirpe neural. Habitualmente
son tumores de rápida y letal evolución.
- Otros tipos infrecuentes de tumores de teratomas inmaduros
del ovario corresponden a diferenciaciones monodérmicas
tales como el tumor de Wilms ovárico puro58,
que casi seguramente es de origen germinal y que representa
el cambio neoplásico del blastema metanéfrico
que ocasionalmente se encuentra en teratoma inmaduro del ovario59.
4-Fenómenos de invasión y maduración en
los teratomas inmaduros.
Si bien la vía habitual de invasión de los teratomas
inmaduros del ovario es la siembra peritoneal60,61,
se han comunicado igualmente metástasis de tipo linfático
y hemático62 que pueden indicar una cirugía
y estadiaje más completos incluyendo linfadenectomía.
Los implantes peritoneales son de dos tipos de acuerdo con su
grado de maduración: los totalmente maduros se hallan compuestas
por pequeños nódulos de neuroglía madura
(gliomatosis peritonei) carentes de capacidad de crecimiento
y que se consideran como benignos a pesar de la preocupante imagen
clínica de siembra peritoneal. Es muy posible que se originen
por pequeñas roturas capsulares que conducen a la implantación
de tejidos inmaduros que ulteriormente maduran a nivel del peritoneo.
Un curioso y reciente trabajo63, utilizando técnicas
biomoleculares propone que la gliomatosis peritonei no provenga
del tumor ovárico sino que represente un fenómeno
metaplásico local del peritoneo. Sin embargo, el número
de casos estudiado es muy pequeño y además, no explica
porque la gliomatosis siempre se produce en el contexto de un
teratoma inmaduro del ovario y nunca espontáneamente.
Finalmente, merece la pena señalar que se han comunicado
algunas rarísimas formas de implantación peritoneal
constituidas por melanocitos maduros bien diferenciados (melanosis
peritonei)64,65.
El pronóstico de las metástasis maduras en el peritoneo
es habitualmente excelente, si bien, en paralelismo con los tumores
testiculares puede existir algunos casos de “growing teratoma
syndrome”66 presentes, por ejemplo, en metástasis
del hilio hepático.
5- Cambios vasculares en teratomas.
Tras nuestra descripción inicial realizada en 198354,
se ha llamado recientemente la atención sobre los extensos
cambios vasculares presentes en teratoma inmaduro67.
El tejido neural presente en teratomas es capaz de producir factores
angiogénicos suficientes para estimular una gran proliferación
vascular. Este fenómeno es idéntico al que ocurre
en los tumores cerebrales y periféricos pobremente diferenciados
(PNET, glioblastomas, etc). La extensa angiogénesis presente
en el tumor determina grandes hemorragias, e incluso puede estar
presente en los implantes gliales peritoneales68, donde
puede acompañarse de una hemorragia intraperitoneal ocasionalmente
letal.
Arriba
8- TERATOMA MADURO.
Estas neoplasias han servido en distintos estudios citogenéticos
para demostrar la partenogénesis en tejidos humanos. Su origen
es a expensas de ovocitos69. Al contrario que en el testículo
no ha sido posible demostrar ninguna lesión precursora de
los teratoma maduro del ovario similar a la que ocurre en los ratones
con alta tendencia al desarrollo de teratomas (folículos
con cambios análogos a los primeros estadios del desarrollo:
mórulas, blastocistos, etc). Los infrecuentes folículos
con ovocitos polinucleares al parecer no tienen relación
con la génesis de los teratomas maduros del ovario70.
El amplio uso de la ecografía en las últimas décadas
ha tenido como resultado el desarrollo del diagnóstico temprano
de estos tumores, conllevando una menor incidencia actual de bilateralidad
y tamaño tumoral así como de complicaciones tales
como los fenómenos de torsión71.
Del mismo modo, se observa hoy en día una menor cantidad
y variedad de tejidos y de reacciones granulomatosas a la queratina
y sebo, fenómeno que puede estar en relación con el
tiempo de evolución intraabdominal. Por la misma razón,
cada día es más infrecuente hallar tejidos de larga
evolución tales como dientes y hueso. Finalmente, el diagnostico
precoz seguido de cirugía (endoscópica o abierta)
ha supuesto una reducción de fenómenos de malignidad
secundaria tipo carcinoma epidermoide en el seno de este tipo de
tumores pues estos tienen lugar en neoplasias de una larga evolución
posiblemente determinados por la exposición a factores carcinogénicos
presentes en el contenido.sebáceo del quiste72.
Otra sorprendente situación es la inexplicable presencia
ocasional en estos tumores de tejido prostático73,
evidentemente desconocido en el sexo femenino - salvo excepciones
muy especiales74. Se ha pretendido dar una explicación
a este fenómeno especulando acerca de una posible impresión
genómica del componente paterno del genotipo XX de las portadoras.
Recientemente, hemos comunicado fenómenos de virilización
debidos a la estimulación ovárica de tipo periférico
por parte de teratomas maduros75. Como colofón,
añadir que prácticamente se han comunicado en los
tejidos de los teratomas maduros, cualquier tipo de situaciones
patológicas: desde placas seniles tipo Alzheimer en el tejido
neural del teratoma, hasta tejidos tales como timo y mama lactante76,77.
Creemos que un hipotético premio a la entidad más
original comunicada sería, ¿por qué no?, la
presencia de úlceras pépticas en la mucosa gástrica
teratomatosa78.
Arriba
Referencias
1.Stevens LC, Varnum DS. The development of teratomas from parthenogenetically
activated ovarian mouse eggs. Develop Biol 1974; 37:369-380.
2.Padilla SL, Boldt JP, McDonough P G. Possible parthenogenesis
with in vitro fertilization subsequent to ovarian cystic teratoma.
Am J Obstet Gynecol 1987; 156:1127-1129.
3.Sperger JM, Chen X, Draper JS, Antosiewicz JE, Chon CH, Jones
SB, Brooks JD,Andrews PW, Brown PO, Thomson JA. Gene expression
patterns in human embryonic stem cells and human pluripotent germ
cell tumors.Proc Natl Acad Sci U S A. 2003; 100:13350-5.
4.Donovan PJ, de Miguel MP. Turning germ cells into stem cells.Curr
Opin Genet Dev. 2003;13:463-71.
5.Nakashima K, Colamarino S, Gage FH. Embryonic stem cells: staying
plastic on plastic. Nat Med. 2004; 10:23-24.
6.Gerecht-Nir S, Fishman B, Itskovitz-Eldor J. Cardiovascular potential
of embryonic stem cells.Anat Rec. 2004; 276:58-65.
7.Nogales FF. Talerman A, Kubik-Huch RA, Devouassoux-Shisheboran
M, Tavassoli FA. Ovarian germ cell tumours (2.3). WHO Classification
of Tumours (Blue Books). III. Pathology and Genetics of Tumours
of the Breast and Female Genital Organs. Edited by F.A. Tavassoli
and M.R. Stratton. IARC Lyon 2003.
7b. Nogales FF, Merino J, Musto ML, Botticelli L. La patología
de los tumores germinales del ovario. Avances anatomoclínicos
en los ultimos tres lustros. Revisiones en Cancer (Madrid). 2003;17:175-183
8.Nogales FF. The Pathology of Germ Cell Tumours. In: Haines and
Taylor’s. Obstetrical and Gynaecological Pathology. 5th Edition
(Fox H. Ed.) Churchill Livingstone. London 2002.
9.Damjanov I. Is seminoma a relative or a precursor of embryonal
carcinoma?. Lab Invest 1989; 60:1-3.
10.Nogales FF, Favara BE, Major F. J, Silverberg SG. Immature teratoma
of the ovary with a neural component ("solid" teratoma):
A clinicopathologic study of 20 cases. Hum Pathol 1976; 7: 625-642.
11.Parkash V, Carcangiu ML. Transformation of ovarian dysgerminoma
to yolk sac tumor:evidence for a histogenetic continuum. Mod Pathol
.1995; 8:881-887.
12.Srigley J R, Mackay B, Toth P, Ayala A. The ultrastructure and
histogenesis of male germ cell neoplasia with emphasis on seminoma
with early carcinomatous features. Ultrastr Pathol. 1988; 12:67-86.
13.Amerigo J, Nogales FF, Fernández-Sanz J, Oliva H, Velasco
A. Squamous cell neoplasms arising from ovarian benign cystic teratoma.
Gynecol Oncol. 1979; 8:277-283.
14.Hoppe P C, Illmensee K. Full-term development after transplantation
of parthenogenetic embryonic nucluei into fertilized mouse eggs.
Proc Natl Acad Science USA. 1982; 79:1912.
15. Inoue
M, Fujita M, Azuma C, Saji F, Tanizawa O. Histogenetic analysis
of ovarian germ cell tumors by DNA fingerprinting. Cancer Res. 1992;
52:6823-6.
16. Tsuura Y, Hiraki H, Watanabe K, Igarashi S, Shimamura K, Fukuda
T, Suzuki T, Seito T. Preferential localization c-kit product in
tissue mast cells, basal cells of skin, epithelial cells of breast,
small cell lung carcinoma and seminoma/dysgerminoma in human:immunohistochemical
study on formalin fixed, paraffin embedded tissues. Virchows Arch
1994; 424:135-141.
17.van Echten J, van Doorn LC, van der Linden HC, van der Veen
AY, Burger CW, de Jong B. Cytogenetics of a malignant ovarian germ-cell
tumor. International Journal Cancer. 1998; 77:217-218.
18.Bussey KJ, Lawce HJ, Olson S B, Arthur DC, Kalousek DK, Krailo
M, Giller R, Heifetz S, Womer R, Magenis R E. Chromosome abnormalities
of eighty-one pediatric germ cell tumors:sex-, age- site-, and histopathology-related
differences- -a Children´s Cáncer Group study. Genes
Chromosomes Cancer. 1999; 25:134-146.
19.McGlynn KA, Devesa SS, Sigurdson AJ, Brown LM, Tsao L, Tarone
RE. Trends in the incidence of testicular germ cell tumors in the
United States. Cancer. 2003 97:63-70.
20.Brettel J R, Mils PA, Herrera G, Greenberg H. Dysgerminoma with
syncitiotrophoblastic giant cells presenting as a hydatidiform mole.
Gynecol Oncol 1984; 18:393-401.
21.Talerman A, Huyzinga WT, Kuipers T. Dysgerminoma:clinicopathologic
study of 22 cases. Obstetrics and Gynecology 1973; 41:137-147.
22.Goldsmith C I, Hart WR. Ataxia-telangiectasia with ovarian gonadoblastoma
and contralateral dysgerminoma. Cancer 1975; 36:1838-1842.
23.Kleihues P, Schauble B, zur Hausen A, Esteve J, Ohgaki H. .
Tumors associated with p53 germline mutations. A synopsis of 91
families. Review. Am J Pathol. 1997;150:1-13.
24.Le Thi Duong DU, Wechsler B, Lefebvre G, Piethe JC, Darbois
Y, Godeau P. Lupus erythemateux disseminé et séminome
de l´ovaire. Rev Med Int 1988. 9:133-135.
25.Sekiya S, Inaba B, Takanizawa H, Nagao K. Human chorionic gonadotropin
and AFP in sera and tumor cells of a patient with pure dysgerminoma
of the ovary:a case report with radio immunoassay and immunoperoxidase.
Acta Obstet Gynecol Scand .1987; 66:75-78.
26.Teilum G. Classification of endodermal sinus tumor (mesoblastoma
vitellinum) and so-called “embryonal carcinoma” of the
ovary. Acta PatholMicrobiol Scand (A) 1965; 64:407-429.
27.Nogales FF, Silverberg SG, Bloustein PA, Martínez-Hernández
A, Pierce GB. Ultrastructure and histogenesis of gonadal and extragonadal
tumors in comparison with normal human yolk sac. Cancer 1977; 39:1462-1474.
28.Nogales FF, Matilla A, Nogales Ortiz F, Galera Davidson H. Yolk
sac tumors with pure and mixed polyvesicular vitelline patterns.
Hum Pathol 1978;9:553-566.
29.Nogales FF, Beltran E, Pavcovich M, Bustos M. Ectopic somatic
endoderm in secondary human yolk sac. Hum Pathol 1992; 23:921-924.
30.Nogales FF. Embryological clues to the yolk sac tumor group;The
Robert Mayer Festschrift. Int J Gynecol Pathol 1993; 12:101-107.
31.Damjanov I, Amenta P S, Zarghmi F. Transformation of and AFP
positive yolk sac carcinoma into and AFP negative neoplasm. Cancer
1984;53:1902-1907.
32.Michael H, Ulbright T M, Brodhecker A. The pluripotential nature
of the mesenchyme like component of yolk sac tumor. Arch Pathol
Lab Med. 1989; 113:1115-9.
33.Takashina T. Histology of the secondary human yolk sac with
special reference to hematopoiesis. In:Nogales F. F. (ed) The human
yolk sac and yolk sac tumors. Springer, Berlin. 1993; 48-69.
34.Mascarello J T, Cajulis T R, Billman G F, Spruce W E. Ovarian
germ cell tumor evolving to myelodisplasia. Genes Chromosomes and
Cancer 1993; 7:227-230.
35.Nogales F F, Bergeron C, Carvia R E, Alvaro t, Fulwood H R.
Ovarian endometrioid tumors with yolk sac tumor component, an unusual
form of ovarian neoplasm. Analysis of six cases. Am J of Surg Pathol
.1996; 20:1056-1066.
36.Nogales FF The Human Yolk Sac and Yolk Sac Tumours. Nogales
FF. Ed. Springer-Verlag. Berlin 1993.
37.Nogales FF, Ruiz Avila I, Concha A, Del Moral A. Immature endodermal
teratoma of the ovary:Embryologic correlations and immunohistochemistry.
Hum Pathol 1993; 24:364-369.
38.Mooney EE, Nogales FF, Tavassoli FA. Hepatocytic differentiation
in retiform Sertoli-Leydig cell tumors:distingushing an heterologous
element from Leydig cells. Hum Pathol .1999; 30:611-617.
39.Mooney EE, Nogales FF, Bergeron C, Tavassoli FA. Retiform Sertoli-Leydig
cell tumours:clinical, morphological and immunohistochemical findings.
Histopathol. 2002; 41:110-7.
40.Okamoto T. Immunohistochemical differentiation of yolk sac-type
alpha-fetoprotein from hepatic-type alpha-fetoprotein. Acta Pathol
Jpn 1989; 39:51-54.
41.Okamoto T, Hirabayashi K, Ishiguro T. Immunohistochemical type
distinction of alpha-fetoprotein in various alph-fetoprotein-secreting
tumors. Jpn J Cancer Res 1993; 84:360-364.
42.Axe S R,Klein V R Woodruff J D Choriocarcinoma of the ovary.
Obstet Gynecol 1985; 66:111-114.
43.Shigematsu T, Kamura T, Arima T, Wake N, Nakano H. DNA polymorphism
analysis of a pure non-gestacional choriocarcinoma of the ovary:case
report. Eur J Gynaecol Oncol 2000; 21:153-154.
44.Pallesen G, Hamilton-Dutoit SJ. Ki-I (CD30) antigen is regulary
expressed by tumor cells of embryonal carcinoma. Am J Pathol 1988;
133:446-450.
45.Nakashima M, Fukatsu T, Nagasaka T . Characterstics of “embryoid
body” in human ganadal germ cell tumors. Hum Pathol 1988;
19:1144-1154.
46.Prat J, Matias Guiu X, Scully RE. Hepatic yolk sac differentation
in an ovarian polyembrioma. Surg Pathol 1989; 2:147-150.
47.King ME, Di Giovanni LM, Young JK, Clarke-Pearson E. Immature
teratoma of the ovary grade 3 with karyotype analysis. Int J Gynecol
Pathol.;1990.9:178-184.
48.Damjanov I. Pathobiology of human germ cell neoplasia. Recent
Results Cancer Res. 1991;123:1-19.
49.López Gines C, Gil R, Pellin A, Martorell M, Vilar F,
Llombart-Bosch A. Trisomy 12 and translocation (7;9) in an ovarian
immature teratoma. Int J Gynecol Pathol 1989; 8:277-285.
50.Steeper TA, Mukai K. Solid ovarian teratomas:an immunocytochemical
study of thirteen cases with clinicopathologic correlation. Pathol
Annu 1984. (Part 1) 19:81-92.
51.O´Connor DM, Norris HJ. The influence of grade in the
outcome of stage I ovarian immature (malignant) teratomas and the
reproducibility of grading. Int J Gynecol Pathol. 1994;13:283-289.
52.Baker PM, Oliva E, Young RH, Talerman A, Scully RE. Ovarian
mucinous carcinoids including some with a carcinomatous component:a
report of 17 cases. Am J Surg Pathol 2001; 25:557-568.
53.Nogales FF Neural Tissue in Human Teratomas. In:The Biology
of Teratomas. (Damjanov I. & Solter D. Eds.) Humana Press. Clifton
N.J. 1983
54.Kleinman G, Young RH, Scully RE. Primary neuroectodermal tumors
of the ovary:a report of 25 cases. Am J Surg Pathol 1993; 17:764-778.
55.Carr KA, Roberts JA, Frank TS. Progesterone receptors in bilateral
ovarian ependymoma presenting in pregnancy. Hum Pathol 1992; 23:962-965.
56.Guerrieri C, Jarlsfelt I. Ependymoma of the ovary:a case report
with immunohistochemical, ultrastructure and DNA cytometric findings
as well as histogenetic considerations. Am J Surg Pathol. 1993;
17:623-632.
57.Isaac MA, Vijayalakshmi S, Madhu CS, Bosincu L, Nogales FF.
Pure cystic nephroblastoma of the ovary with a review of extrarenal
Wilms’ Tumors. Hum Pathol 2000; 31:761-764.
58.Nogales FF, Ortega I, Rivera F, Armas JR. Metanephrogenic tissue
in immature ovarian teratoma. Am J Surg. Pathol 1980; 4:297-299.
59.Nogales FF, Oliva H. Peritoneal Gliomatosis produced by ovarian
teratomas. Gynecol Oncol 1974; 43:915-920.
60.González-Campora R, Nogales FF, Galera H, Mendez JA.
Ultrastructure of mature neurogenic implant from ovarian immature
teratoma. Histopathol 1979; 3:233-240.
61.McLaughlin JE, Diebold M, Figaud C. Blood borne metastasis from
an immature teratoma of the ovary in a 36 year old woman. Histopathol
1989; 15:546-550.
62.Ferguson AW, Katabuchi H, Ronnett B M, Cho K R. Glial implants
in gliomatosis peritonei arise from normal tissue, not from the
associated teratoma. Am J Pathol. 2001; 159:51-55.
63.Gocht A, Lohler J, Scheidel P, Stegner HE, Saeger W. Gliomatosis
peritoei combined with mature ovarian teratoma:Immunohistochemical
observations. Pathol Res Pract. 1995; 191:1029-1035.
64.Nogales FF, Luna MA, Vergara E. Small cell epidermoid carcinoma
with melanocyte colonization arising in a mature ovarian cystic
teratoma. Arch Pathol Lab Med 1995; 119:551-559.
65.Geisler J P, Goulet R, Foster R S, Sutton GP. Growing teratoma
syndrome after chemotherapy for germ cell tumors of the ovary. Obstet
Gynecol. 1994; 84:719-721.
66.Baker P M, Rosai J, Young RH. Ovarian teratomas with florid
benign vascular proliferation:a distinctive finding associated with
the neural component of teratomas that may be confused with a vascular
neoplasm. Int J Gynecol Pathol. 2002; 21:16-21.
67.Nogales F F, Aguilar D.(Letter). Florid vascular proliferation
in grade 0 glial implants from ovarian immature teratoma. Int J
Gynecol Pathol 2002; 21:305-307.
68.Dahl N, Gustavson K H, Rune C, Gustavson I, Peterson U. Benign
ovarian teratomas:an analysis or their cellular origin. Cancer Genetics
and Cytogenetics 1990; 26:115-123.
69.Sherrer C W, Gerson B, Woodruff J D. The incidence and significance
of polynuclear follicles. Am J Obstet Gynecol 1977; 28:6-10.
70.Zannol M, Schiavo M, De Agostini I, Chiarelli S. The evolving
spectrum of Ovarian cystic teratomas:Comparison between two pre
and post ultrasonography clinicopathological series. International
Multidisciplinary seminar of germ cell Tumours. Padova. Febrero
2003.
71.Amérigo J, Fernández-Sanz J, Oliva H, Velasco
A. Squamous cell neoplasms arising form ovarian benign cystic teratoma.
Gynecol Oncol 1979; 8:277-283.
72.Nogales FF, Vergara E, Medina MT. Prostate in ovarian benign
cystic teratoma. Histopathol 1995; 26:373-375.
73.Smith CET, Toplis PJ, Nogales FF. Ovarian prostatic tissue originating
from hilar mesonephric rests. Am J Surg Pathol 1999; 23:232-236.
74.López Beltrán A, Carvia RE, Nogales FF, Virilizing
Mature Ovarian Cystic Teratomas. Virchows Arch 1997; 431:149-51.
75.Ulirsch RF, Goldman RL. An unusual teratoma of the ovary:neurogenic
cyst with lactating breast tissue. Obstet Gynecol 1982; 60:400-402.
76.Nogales FF. Critical commentary to Thymus in teratoma. Possible
clues to its histogenesis. Path Res Pract 2000; 196:798-799.
77.Tiltman AJ, Glass DR, Duffield MS. Peptic ulceration in a mature
cystic teratoma of the ovary. Histopathol 1995; 26:375-377.
Arriba
--------------------------------------------------------------------------------
|