|
DIAGNÓSTICO HISTOPATOLÓGICO DE LAS MICOSIS
Emilio
Mayayo Artal
Hospital Universitario Juan XXIII y Facultad de Medicina, Universidad
Rovira i Virgili. Tarragona.
Introducción
A lo largo de las dos últimas décadas, la patología
fúngica ha experimentado un considerable aumento, sobre todo
en pacientes inmunocomprometidos, pero no exclusivamente en ellos
(1). Su incidencia se ha tasado en un aumento de más del
300% en este corto periodo de tiempo (2). Hay múltiples factores
que favorecen la instauración de las micosis, sobre todo
cambios médicos, climatoecológicos, socioeconómicos
y migratorios, entre los que podemos destacar a: enfermos muy debilitados
inmunológicamente, el SIDA, el uso y abuso de antibióticos
o de fármacos inmunosupresores, los trasplantes, las leucemias/linfomas,
o la realización de una medicina cada vez más agresiva,
estos y otros factores hacen que las micosis tengan esta alta incidencia,
como hemos comentado anteriormente.
Clínicamente o a partir de preparaciones citológicas
y/o biópsicas, es difícil diferenciar e identificar
correctamente los más de 400 especies de hongos descritos
hasta el momento, como patógenos para el hombre (3). Sin
embargo tras un detallado estudio se pueden distinguir en algunos
casos características morfológicas clave, que son
las que ayudan a diferenciar estos géneros o especies (4-7).
Con ello se puede conseguir un diagnóstico preciso y en consecuencia
se puede realizar un tratamiento más efectivo. Recordemos
que las micosis sistémica tienen una alto porcentaje de mortalidad,
cifrado para algunas especies en el 100%, por lo que se deduce que
es muy importante un diagnóstico rápido y la histopatología
puede contribuir a ello (8).
Para un más correcto diagnóstico es muy importante
la colaboración entre clínicos, microbiólogos
y patólogos, sobre todo profundizando en su estudio e innovando
su metodología de diagnóstico.
La metodología de estudio del patólogo, se basa fundamentalmente
en reconocer la morfología del hongo para su identificación,
pero también observar determinados aspectos de su patogenicidad,
la respuesta orgánica y las estructuras tisulares afectadas.
Dichas estructuras se pueden observar en preparaciones citológicas,
secciones biopsicas y en los estudios autópsicos, que son
los tres campos de trabajo básicos del patólogo (9-12).
La citología es una metodología muy útil, ya
sea obtenida por extensión o por Punción Aspiración
con Aguja Fina (PAAF) pudiendo conseguir un diagnóstico muy
rápido, que la hace óptima en pacientes graves que
precisan de un tratamiento precoz y específico (13-17). Los
otros métodos de estudio, debido a que en el protocolo de
manipulación de la muestra implica la fijación, procesado,
corte y tinción de la misma, hacen que la respuesta se demore,
pero ofrecen una información más valiosa, ya que muestran
la afectación orgánica y el tipo de respuesta tisular,
así como la presencia del agente infeccioso, su abundancia
y morfología. Es precisamente esta última característica
la que nos permite identificar, al menos, a nivel de género
y en determinados casos también de especie, el hongo causante
de la lesión.
Algunos hongos tales como Aspergillus, Candida, zigomicetos
o criptococos, no son difíciles de identificar con la ayuda
de determinadas técnicas como Grocott, P.A.S., mucicarmin,
Fontana-Masson (18). Todas ellas son tinciones que realzan detalles
morfológicos o morfoquímicos, como se indica más
adelante(19).
Hay nuevos avances técnicos, sobre todo técnicas
inmunológicas (inmunoflorescencia e inmunohistoquímica),
de hibridación “in situ” o bien de biología
molecular mediante PCR o secuenciación de DNA, que se están
instaurando en los laboratorios de patología y son un gran
avance para el diagnóstico de las micosis. Sin embargo hay
que acabar de adecuar estas técnicas a las muestras parafinadas,
en las que aún obtenemos unos resultados poco satisfactorios
(20-30).
El patólogo además de diagnosticar el agente causante
de una patología concreta, puede tipificar las lesiones observadas
en granulomatosas, necróticas o purulentas y puede determinar
si se trata de una infección local o difusa y a su vez clasificarla
en superficiales, cutáneas, subcutáneas y profundas
o sistémica (31,32).
En este artículo describimos la metodología utilizada
por el patólogo, las principales características morfológicas
que presentan los hongos en los tejidos y la respuesta orgánica,
así como los nuevos avances técnicos que el patólogo
tiene a su alcance para poder realizar un diagnóstico más
preciso, de la infección fúngica.
Arriba
Las micosis bajo el microscopio del patólogo
Hay dos grandes grupos de hongos que afectan al hombre, los saprófitos
y los patógenos (3-6,31-33). Se considera a un hongo como
patógeno cuando produce daño tisular y ninguna lesión
es específica de las micosis, pudiéndose hallar un
variado espectro de lesiones inflamatorias. Es muy importante valorar
el grado inmunológico del paciente, que en muchos casos suele
estar disminuido debido a que las micosis son mucho más frecuentes
en pacientes inmunodeprimidos, este déficit de defensas varía
el grado de respuesta del organismo ante estos agentes patógenos.
Como ya se ha comentado, para que se produzca lesión hay
una serie de factores que la favorecen como son la inmunidad del
huésped, la virulencia, la cantidad de células fúngicas
y la coexistencia de otras enfermedades. La primera respuesta que
el organismo produce es una inflamación supurativa por el
infiltrado de polinucleares, para posteriormente pasar a una respuesta
de células mononucleares y si evoluciona, presenta macrófagos,
células epitelioides y células gigantes multinucleadas,
dando lugar a infección crónica y fibrosis, pero todo
esto puede estar atenuado si en el paciente coexiste enfermedad
inmunosupresora. La lesión más característica
es granulomatosa con células gigantes multinucleadas, estimulada
por una respuesta inmune tipo IV o respuesta celular (9).
El patólogo puede observar de dos formas morfológicas
básicas a los hongos, la primera con una disposición
tubular o hifas (multicelular) y la segunda de forma redondeada
u oval que son las esporas (unicelular). Estas formas a su vez pueden
ser pigmentadas o no (3-7). Conocidos los cambios tisulares que
se producen en los tejidos y las formas morfológicas, podemos
pasar a clasificarlos. Varias son las clasificaciones realizadas,
por su tamaño, su forma, sus características morfológicas,
su localización, pero expondremos una sencilla y práctica
y es agruparlos en cuatro grupos por sus características
clínicas y el patólogo puede ser clave diagnóstica:
un primer grupo de hongos dimórficos; un segundo grupo de
hongos clásicos más habituales; un tercer grupo de
hongos oportunistas emergentes y un cuarto grupo donde incluimos
una serie de hongos a los que el patólogo puede llegar a
su diagnóstico empleando su metodología de trabajo
(4-8,31,32).
Arriba
1-Hongos dimórficos
En este grupo describimos las cuatro micosis ya clásicas,
frecuentes en otras latitudes, sobre todo América . A pesar
de ser inusuales en nuestro entorno, son fáciles de diagnosticar
por su particular morfología, pudiéndose realizar
a un preciso diagnóstico tanto en las muestras citológicas
como en las biopsicas.
-Histoplasmosis. Hay dos formas, la clásica americana
y la africana, con rasgos morfológicos bien diferenciales
entre ellas. La americana producida por Histoplasma capsulatum
es el hongo más pequeño que se observa en el ámbito
humano y de otros animales, cuya infección se produce por
inhalación y rápida diseminación hematológica
con infección intracelular. Su tamaño de entre 1-3
μmμm, que adopta forma de levadura, lo hace claramente
diferencial de otros hongos. Siempre lo observaremos en el interior
de macrófagos. En forma de pequeñas células
con fino halo alrededor. El diagnóstico diferencial primordial
es con leishmania, pero esta se tiñe con la tinción
de Giemsa y el histoplasma es positivo a PAS y Grocott, dejando
un halo claro alrededor de la células en Giemsa. La otra
forma de presentación es la africana producida por el H.
duboisii, de mayor tamaño, entre 7 y 12 μm, siendo
esporas gemantes con gruesa pared y alguna inclusión lipídica.
Estos no son intracelulares, salvo que estén fagocitados
por células gigantes multinucleadas, en el contexto de lesión
granulomatosa. El diagnóstico diferencial de esta especie
se realiza con la lobomicosis, sin embargo el tipo de lesión
que produce y su habitat geográfico son muy importantes para
el diagnóstico (34-35).
- Blastomicosis. Como todas las micosis de este grupo la
localización principal es a nivel pulmonar, ya que la infección
se produce por la inhalación de los conidios. Blastomyces
dermatitidis puede diseminar por vía hematógena
a otros órganos, especialmente a la piel. En las secciones
teñidas con H-E, entre un componente inflamatorio crónico
granulomatoso o supurativo, se observan estructuras ovales o redondeadas
de entre 7-15 μm con pared gruesa de doble contorno (dato muy
importante y diferencial) y en su citoplasma se puede observar material
basofílico amorfo destaca algún núcleo.
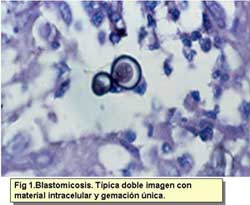
Pueden verse gemaciones unipolares únicas con amplia base
de implantación, todo ello más manifiesto con las
tinciones de PAS y Grocott. El diagnóstico diferencial más
importante es con H. duboisii se realiza por su gemación,
que en este caso es la base es muy estrecha y también a tener
en cuanta la zona geográfica donde se origina la infección.
Así mismo puede confundirse con Paracoccidiodes brasiliensis,
pero en esta última especie las gemaciones son múltiples
(4,5,8).
- Paracoccidioidomicosis. A pesar de tener área de
distribución localizada en centro y Sudamérica, se
están describiendo casos importados de infecciones por Paracoccidioides
brasiliensis en nuestro país y en otros países
europeos (citas). Nosotros hemos tenido la oportunidad de estudiar
recientemente una infección en partes blandas en un inmigrante
de Ecuador. La afectación principal es la pulmonar, seguida
por las mucosas bucal o nasal y la piel. En las lesiones se puede
hallar un componente inflamatorio crónico con fibrosis, células
gigantes multinucleadas y células fúngicas de gruesa
pared (10- 60 μm) con pequeñas y múltiples gemaciones
de base de implantación estrecha dispuestas en forma de "timón
de barco" muy fácilmente reconocibles, en Grocott, donde
muestran su mejor expresión.
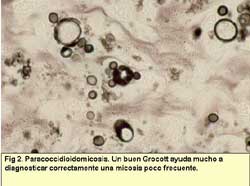
Esta técnica de plata es imprescindible para el diagnóstico
ya que en algunos casos el mencionado caso observado por nosotros,
las características mencionadas no se observaban en las tinciones
de H-E y de PAS (16,36,37).
- Coccidioidomicosis. Producida por Coccidioides immitis,
se localiza fundamentalmente en América, tanto del norte
como del sur, aunque también se están describiendo
casos en otros países como España (38). La afectación
más importante es a nivel pulmonar, donde pueden observarse
granulomas supurativos, consistentes en una reacción inflamatoria
crónica con células gigantes a la que se le unen elementos
polinucleares. Esta lesión es debida a que las esférulas
de los hongos (hallazgo típico), pueden llegarse a romper
y liberan endosporas que infiltran los tejidos dando la respuesta
inflamatoria aguda. Las esférulas son de gran tamaño,
20-200 μm, observándose en diferentes estadios evolutivos,
siendo visibles en H-E, pero consiguiendo una observación
más detallada con las tinciones de PAS y Grocott. En su interior
se pueden observar múltiples endosporas redondeadas de 2-5
μm.
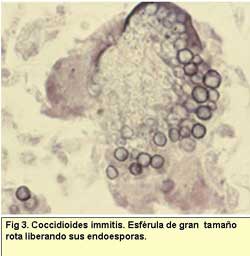
Hay que diferenciarlas de Rhinoporidium seeberi, cuya localización
orgánica es en zonas nasales u oculares, produciendo típicas
lesiones polipoides. También hay que tener presentes a otra
micosis como la adiaspiromicosis y la infección por algas
del género Prothoteca spp., pero ambas tienen características
morfológicas diferentes (13,38,39).
Arriba
2- Hongos más frecuentes en
nuestro entorno.
Queremos describir en este apartado algunas peculiaridades de los
hongos más conocidos y con mayor incidencia en nuestro país
como son Candida spp, Aspergillus spp, Cryptococcus spp y
las zigomicosis.
- Candidiasis. Candida es el género más
habitual que suele observar el patólogo, ya sea en citologías
o biopsias, siendo muchas veces hallazgos en portadores sanos. Es
un importante agente infeccioso que se localiza en mucosas. Es fácil
observarlo en citologías ginecológicas donde se puede
encontrar células levaduriformes, hifas o pseudohifas acompañadas
de polimorfonucleares, dispuestas entre células escamosas
que suelen mostrar cambios reactivos inflamatorios. Son menos frecuentes
en esputos o secreciones pulmonares, pero pueden ser observadas
en pacientes mayores, con alguna patología inmunodepresora.
En biopsias de tracto respiratorio alto o gastrointestinal, no son
infrecuentes hallarlas colonizando a otros procesos patológicos
como ulceras o tumores. En piel presentan el aspecto histológico
de una dermatitis subaguda o crónica, pudiendo el hongo ser
observado en capas córneas, sobre todo con PAS y Grocott.
La candidiasis sistémica se puede hallar en múltiples
localizaciones orgánicas, o presentarse como sepsis diseminada,
no solo en adultos, sino también en niños prematuros
sometidos a cuidados intensivos (40). Su diseminación es
hematógena, como la práctica totalidad de las micosis
y no es infrecuente observar embolizaciones vasculares, aunque estas
son más habituales en aspergillosis y zigomicosis. Se puede
observar focos de necrosis con mayor o menor respuesta inflamatoria
(en dependencia del estado inmunitario) y células ovales
de 4 a 8 μm con una o varias gemaciones, acompañadas
por hifas o pseudohifas finas y tabicadas ya visibles con H-E y
también con tinción de Gram, aunque son más
facilmente observables con PAS o Grocott. Las características
morfológicas de Candida facilitanl su diagnóstico,
pero siempre debería ser confirmado por los cultivos, sobre
todo para diferenciar las diferentes especies patógenas.
Una de ellas, C. glabrata, se suele observar en tomas citológicas
ginecológicas y se presenta como pequeñas células
de 2-4 μm, sin presencia de formas pseudomiceliares y poca
respuesta inflamatoria. El diagnóstico diferencial, sobre
todo en el material obtenido a nivel pulmonar, debe de realizarse
con Histoplasma capsulatum y Pneumocystis carinii,
el observar los hongos intracelularmente son específicos
de H. capsulatum y poseer forma oval y zona densa central
es rasgo de P. carinii. En muestras cutaneas, se tiene que
diferenciar de los dermatofitos.
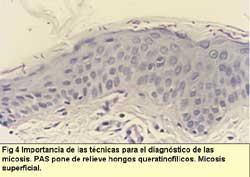
Estos poseen hifas mayores y pleomórficas. Para confirmar
el diagnóstico, además del cultivo, podemos realizar
técnicas de inmunohistoquímica con anticuerpos monoclonales
específicos de género, siendo uno de los pocos anticuerpos
comercializados y que tienen un notable poder de resolución
(8,31,32).
- Aspergilosis. Aspergillus además de ser
causa de patologías alérgicas o de otros procesos
patológicos, es un agente colonizador de cavidades y productor
de aspergilosis invasora. El patólogo ocasionalmente se encuentra
con aspergillomas o masas fúngicas con asiento en patologías
crónicas cavitadas, como pueden ser las cavernas tuberculosas,
bronquiectasias, así como en senos paranasales obstruidos.
Histológicamente se observa multitud de hifas apelotonadas
pudiendo observar también la presencia de las cabezas conidiales,
que permiten reconocer la especie más frecuente, A. fumigatus.
Las cabezas conidiales solamente las hallaremos si la lesión
tiene o ha tenido contacto con aire. Un dato muy importante en los
aspergilomas, es que no invaden el parénquima vecino comportándose
como saprófitos. La aspergillosis invasora es una
micosis importante en nuestro medio y grave en pacientes inmunodeprimidos,
sometidos a cuidados intensivos, trasplantes o terapias agresivas.
Su localización principal es la pulmonar, produciendo unos
característicos infartos hemorrágicos, que ya hacen
sospechar esta patología cuando observamos macroscópicamente
el pulmón. En su estudio histológico presenta una
disposición radiada de las hifas, con tejido necrohemorrágico
a su alrededor y cantidad variable de respuesta inflamatoria, sobre
todo crónica con células gigantes multinucleadas,
que pueden estar fagocitando las células fúngicas.
Las hifas son de contornos paralelos, septadas, con una distribución
a intervalos regulares, de entre 3 y 6 μm de grosor y muchas
veces con ramificaciones en ángulo agudo de 45º, siendo este detalle interpretado por muchos patólogos como
determinante para su diagnóstico, aunque hay un buen grupo
de hialohifomicosis que tienen idéntica apariencia, como
son Fusarium, Scedosporium, Trichoderma y de ellos
se deben diferenciar. Por su capacidad angioinvasora puede diseminarse
a otros órganos como cerebro, riñones, bazo, hígado
y es donde se localizan las metástasis en las necrópsias.
En esta fase, con los tejido en fresco, se debe realizar extensiones,
confirmar la presencia de hongos, proceder a su cultivo y guardar
tejido en fresco. Hay que recordar que es sumamente raro poder observar
cabezas conidiales en las secciones histológicas de las muestras.
Para su confirmación son esenciales los cultivos y ayudan
a realizar el diagnóstico, aunque en el momento actual se
dispone de anticuerpos específicos para la realización
de estudios de inmunohistoquímica, que son altamente resolutivos
(4,5,6,41).
siendo este detalle interpretado por muchos patólogos como
determinante para su diagnóstico, aunque hay un buen grupo
de hialohifomicosis que tienen idéntica apariencia, como
son Fusarium, Scedosporium, Trichoderma y de ellos
se deben diferenciar. Por su capacidad angioinvasora puede diseminarse
a otros órganos como cerebro, riñones, bazo, hígado
y es donde se localizan las metástasis en las necrópsias.
En esta fase, con los tejido en fresco, se debe realizar extensiones,
confirmar la presencia de hongos, proceder a su cultivo y guardar
tejido en fresco. Hay que recordar que es sumamente raro poder observar
cabezas conidiales en las secciones histológicas de las muestras.
Para su confirmación son esenciales los cultivos y ayudan
a realizar el diagnóstico, aunque en el momento actual se
dispone de anticuerpos específicos para la realización
de estudios de inmunohistoquímica, que son altamente resolutivos
(4,5,6,41).
- Zigomicosis. Frecuentemente llamada mucormicosis por muchos
patólogos, es una de las micosis más fácilmente
reconocibles ya con H-E. La presencia de hifas irregulares, anchas,
de pared delgada y no septadas, con ramificaciones irregulares,
normalmente en ángulo de 90º, son los rasgos morfológicos
que destacan en la tinción de Grocott.
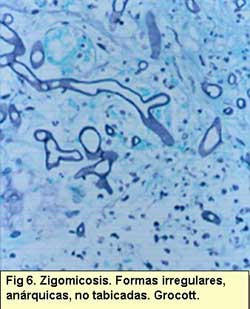
Es muy frecuente hallarlas embolizando vasos, acompañadas
de necrosis, donde las hifas atraviesan las paredes o se disponen
entre las capas musculares. Son hifas anchas de entre 15-30 μm,
pudiendo observarse también algunos esporangios. 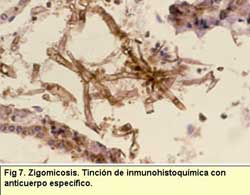 Se
localiza frecuentemente en la región rinosinusal, sobre todo
en pacientes diabéticos con acetosis. Puede llegar a invadir
la base de cráneo y afectar el SNC. Sin embargo, cualquier
localización es posible incluso la gastrointestinal. Esta
puede producirse por ingestión, como nosotros hemos observados
en varios casos. Su confirmación la realizamos por medio
de inmunohistoquímica y por cultivos, que ayudaron con el
diagnóstico definitivo de género y especie, imposible
de realizar por estudios histológicos (8,17,31). Se
localiza frecuentemente en la región rinosinusal, sobre todo
en pacientes diabéticos con acetosis. Puede llegar a invadir
la base de cráneo y afectar el SNC. Sin embargo, cualquier
localización es posible incluso la gastrointestinal. Esta
puede producirse por ingestión, como nosotros hemos observados
en varios casos. Su confirmación la realizamos por medio
de inmunohistoquímica y por cultivos, que ayudaron con el
diagnóstico definitivo de género y especie, imposible
de realizar por estudios histológicos (8,17,31).
- Criptococosis. La especie causante Cryptococcus neoformans
posee una característica única que la hacen fácilmente
distinguible, como ya hemos indicado antes es su cápsula
de mucina de entre 2-20 μm. Dicha estructura se pone de relieve
con las tinciones histoquímicas para mucoproteinas, como
es la técnica de mucicarmin en cambio no se colorea con Giemsa,
Gram, PAS o Grocott. En H-E se observa una célula encapsulada
de tamaño considerable, entre 3-8 μm con gemación
uni o multipolar, de pared no muy gruesa y un gran halo claro a
su alrededor que la separa del tejido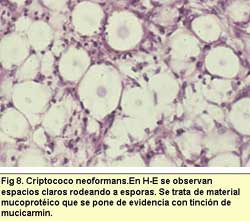 ,
donde hay una mayor o menor respuesta inflamatoria de polinucleares,
en dependencia del estado inmunitario del huésped. Normalmente
la respuesta inflamatoria es escasa, ya que la mayor incidencia
de esta micosis se da en pacientes con SIDA . Otra de las características
es su gran tropismo por el SNC, sobre todo las meninges, pudiendo
ser diagnosticada la infección por medio de un estudio citológicos
de LCR, con una coloración con tinta china, aunque en un
50% puede que no sea efectiva. Si la afectación es cerebral
produce abcesos, granulomas o inclusive pequeños quistes
gelatinosos. Son poco frecuentes los casos diseminados con afectación
multiorgánica, presentandose sobre todo en pacientes con
SIDA, en estos casos se observa las mismas características
morfológicas pero ubicadas en pulmón, riñón,
hígado, bazo, etc. Su diagnóstico diferencial no tiene
dificultad por las peculiaridades descritas que son únicas,
pero hay que tener en cuenta que B. dermatitidis y R.
seeberi pueden también dar positiva la tinción
de mucina. Ene estos casos la realización de una tinción
de Fontana-Masson ayuda mucho en su diferenciación, ya que
C. neoformans es positivo para la tinción de pigmento
melánico. Para finalizar, comentar que la variante gattii
tiene las mismas características, pero cuando se observa
a gran aumento su forma es más alargada (5,11,14,19). ,
donde hay una mayor o menor respuesta inflamatoria de polinucleares,
en dependencia del estado inmunitario del huésped. Normalmente
la respuesta inflamatoria es escasa, ya que la mayor incidencia
de esta micosis se da en pacientes con SIDA . Otra de las características
es su gran tropismo por el SNC, sobre todo las meninges, pudiendo
ser diagnosticada la infección por medio de un estudio citológicos
de LCR, con una coloración con tinta china, aunque en un
50% puede que no sea efectiva. Si la afectación es cerebral
produce abcesos, granulomas o inclusive pequeños quistes
gelatinosos. Son poco frecuentes los casos diseminados con afectación
multiorgánica, presentandose sobre todo en pacientes con
SIDA, en estos casos se observa las mismas características
morfológicas pero ubicadas en pulmón, riñón,
hígado, bazo, etc. Su diagnóstico diferencial no tiene
dificultad por las peculiaridades descritas que son únicas,
pero hay que tener en cuenta que B. dermatitidis y R.
seeberi pueden también dar positiva la tinción
de mucina. Ene estos casos la realización de una tinción
de Fontana-Masson ayuda mucho en su diferenciación, ya que
C. neoformans es positivo para la tinción de pigmento
melánico. Para finalizar, comentar que la variante gattii
tiene las mismas características, pero cuando se observa
a gran aumento su forma es más alargada (5,11,14,19).
Arriba
3- Hongos emergentes.
Nos referimos especialmente a aquellos hongos que en la actualidad
están adquiriendo gran relevancia por su mayor frecuencia.
Son oportunistas, habitualmente no patógenos, pero los pacientes
neutropénicos, inmunodeprimidos, sometidos a agresiones médicas
o trasplantes, frecuentemente pueden ser infectados por estos hongos,
no por su especial virulencia, sino por el deficiente estado de
las defensas, ya sean primarias o secundarias. Se pueden presentar
bien como micosis localizadas bien sistémicas. La mayoría
de ellos son hongos miceliares hialinos (hialohifomicosis), aunque
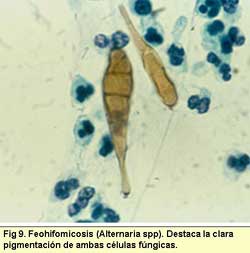
también pueden ser causados por pigmentados (feohifomicosis).
No describiremos en este apartado los hongos levaduriformes que
causan lesiones superficiales y que en casos excepcionales han llegado
a desarrollar micosis sitémicas como Malassezia furfur,
Saccharomyces cerevisiae, o Rhodotorula rubra entre
otros. Nos vamos a ceñir a los emergentes más frecuentes
como Fusarium, Scedosporium, Paecilomyces, Scopulariopsis,
Acremonium, Trichoderma, Alternaria, Cladophialophora,
etc.
Precisamente es con estos hongos con los que nuestro grupo tiene
una larga expeciencia, tanto en el ámbito clínico
como en el experimental (40-45,46-50). Histológicamente son
muy difíciles de diagnósticar y diferenciar entre
ellos, es más probable que sean confundidos con Aspergillus.
El rasgo morfológico más importante para su diferenciación
consiste en la observación de los conídios, pero otros
rasgos morfológicos y que pueden ser fundamentales para su
identificación como la conidiogénesis es difícil
de poderla observar en biopsias o citologías. En nuestra
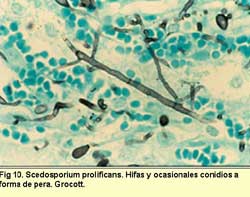
experiencia Scedosporium prolificans es uno de los que permite
poder observar células conidiógenas y conidios y facilita
su diagnósticola suele mostrar y es cuando se puede llega
a un diagnóstico por parte del patólogo. La característica
de hifas monomorfas, septadas y presencia de ocasionales conidios
con forma de pera, emergiendo de células conidiógenas,
son indicativos de esta especie. Estos hongos muestran cierto tropismo
por SNC y riñon (51), siendo las lesiones que produce de
tipo granulomatoso. También, aportar que son más sensibles
a nuevos farmacos azólicos que a tratamientos convencionales
con amphotericina B (52,53). Otro de ellos, Fusarium spp.
es muy difícil o casi imposible de diferenciar ya que ni
en biopsias o en estudios con animales de experimentación
se ha observado formación de macro o microconídios
(54), aunque si se ha podido constatar tropismo por tejido muscular
estriado(cardíaco o voluntario) en la primera semana de infección
y posteriormente tropismo por SNC, riñón e inclusive
ojo (55). Paecylomices, Scopulariopsis, han reportado poca
información en nuestras experimentaciones, salvo el tipo
de lesión y su tropismo por riñón (56). Si
tenemos claro que ante un hongo de caracterísitcas miceliares,
debe de realizarse estudio IHQ con anticuerpo específico
para Aspergillus, para lograr su diferenciación y
una tinción de histoquímica de Fontana-Masson o bien
de IHQ con HMB-45 para detectar pigmento melánico en la pared
de los hongos y etiquetarlos como feohifomicosis, que también
están emergiendo sobre todo Alternaria, Cladophialophora,
Phaeoacremonium (43). Estas técnicas son imprescidibles
ya que con H-E es muy raro observar pigmentación e imposible
con PAS y Grocott.
Indudablemente, la posibilidad de realizar cultivo o técnicas
de biología molecular, en el momento actual constituye una
gran ayuda para poder realizar un diagnóstico preciso sobre
cualquier hongo de los mencionados en este apartado. Sin duda si
se consiguen nuevos anticuerpos monoclonales o aplicar las técnicas
de biología molecular a las muestras parafinadas, podría
ser posible llegar a un diagnóstico similar al que se realiza
por medio de los cultivos.
Arriba
4- Hongos potencialmente diagnosticables.
En este apartado describimos una serie de micosis que por sus rasgos
morfológicos, hacen posible su diagnóstico. Entre
los más destacables son los siguientes:
- Cromomicosis. Son infecciones en piel y tejido celular
subcutáneo presentandose en forma de nódulos o lesiones
verrucosas de evolución crónica, especialmente afectando
extremidades inferiores. En zonas tropicales o subtropicales, individuos
que tiene contacto con restos vegetales como son los campesinos
y frecuentemente pueden sufrir microtraumas o pinchazos, de una
manera lenta pueden desarrollar esta micosis. Son hongos pigmentados
(pertenecientes a las especies Fonsecaea pedrosoi, Cladosporium
carionii, Phialophora verrucosa, Fonsecaea compacta, Rhinocladiella
aquaspera). En H-E se observa hiperplasia seudoepiteliomatosa
con hiperqueratosis, microabcesos epidérmicos y en dermis
e hipodermis inflamación granulomatosa supurativa con células
gigantes y epitelioides, así como neutrofilos, linfocitos
y plasmocitos. En el interior de células gigantes multinucleadas
o libremente se observan estructuras esféricas de color pardo
de 10-15 μm con doble pared y tabiques transversales, que habitualmente
se disponen agrupadas en varios elementos dando formación
de los cuerpos esclerotales o fumagoides (forma de mórula)
que diagnostican a esta micosis(4,5,31).
- Esporotricosis. Producida por un hongo dimórfico
que puede causar lesiones subagudas o crónicas. La especie
causal es Sporothrix schenckii que forma conidios
pequeños, fusiformes de 2 x 8 μm, que produce lesiones
subcutáneas. Las lesiones son múltiples y adquieren
un patrón lineal o disposición linfática. Producen
granuloma mixto de centro supurativo o necrótico con células
epitelioides, gigantes multinucleadas y corona linfoplasmocitaria.
Es en el centro donde se pueden observar las células fúngicas
con forma de cuerpos asteroides, más visibles en estadios
iniciales de la lesión o en enfermos con marcada inmunosepresión
ya que son difíciles de hallar en las biopsias convencionales,
ya que se deben realizar muchas secciones para su observación.
Son de apariencia globosa con una corona de elementos radiados acidófilos
que producen fenómeno de Splendore-Hoeppli. Con PAS
se tiñen fuertemente de color rojo púrpura (4,8,31).
- Lobomicosis. Infección producida por Lacazia
loboi es un hongo que no ha podido ser cultivado y produce lesiones
queloides en hombres y delfines. Su habitat es acuático,
y la mayoria de pacientes infectados tiene relación con este
medio. Se localiza frecuentemente en la zona baja de espalda y caausan
lesiones elevadas, nodulares, en ocasiones ulceradas. La epidermis
tiene hiperplasia con atrófia de anejos y la dermis superficial
posee una nítida banda de tejido colágeno que separa
la epidermis del infiltrado inflamatorio crónico profundo.
Pueden hallarse células gigantes multinucleadas que fagocitan
las células fúngicas. Estos elementos son muy abundantes,
esféricos de 5-8 μm con pared de doble contorno y de
tamaño uniforme que producen una peculiar caracteristica
consiste en la formación de pequeñas cadenas de 3-5
elementos, son poco visibles en H-E y si con PAS o Grocott. Si se
observan a gran aumento muchos de ellos tiene forma de casquete
o media luna, que los hace fácilmente diferenciables de Histoplasma.
duboisii, aunque la clínica y la zona geográfica,
son datos importantes ya que Lacazzia loboi se localiza en
la zona central de América del sur, sobre todo Brasil y Venezuela
(8,11,12).
- Rinosporidiosis. Producida por Rhinosporidum sebeeri,
que presenta también su habitat en aguas estancadas. Produce
lesiones verrucosas, nodulares o polipoides en las mucosas, preferentemente
nasal u ocular. Bajo un epitelio poco modificado se observa presencia
de endosporas, esporangios, esporangios rotos o formas inmaduras
con mayor o menor respuesta inflamatoria crónica. Las endosporas
miden 7 μm, pero las formas más características
y específicas son los esporangios de gran tamaño,
250-350 μm, que contienen numerosas endosporas (Fig
11). La pared de los esporangios es de 5 μm y tiene una
cubierta interna que se tiñe con mucicarmin. Se observan
bien con H-E, pero como en toda micosis, son más específicas
PAS y Grocott. El diagnostico diferencial se debe de realizar con
Coccidioides immitis y adiaspiromicosis (8,31).
- Adiaspiromicosis. Está causada preferentemente
por Chrysosporium spp. Presenta un solo elemento con endosporas
en diferentes fases de maduración o degeneración.
Posee respuesta granulomatosa alrededor de cada elemento que puede
medir desde 500 μm a 2 mm. En ellas destaca la presencia de
una gruesa pared con tres capas concéntricas visibles con
las tres tinciones básicas para el estudio de las micosis,
H-E, PAS y Grocott (4,5,8,31).
- Micetomas. Clinicamente se presentan como nódulos
subcutaneos persistentes, de localización básica en
pies o piernas, que llegan a fistulizarse produciendo una secreción
purulenta en la que se observan numerosos gránulos de color
blanco-amarillento que corresponden a microcolonias. Las lesiones
progresan por contiguidad y se hacen confluyentes y más grandes,
llegando a deformar la zona de afectación. Se observa una
marcada respuesta inflamatoria mixta, pero sobre todo de células
gigantes multinucleadas. En el centro de la lesión hay agrupamientos
de hifas de hongos, dispuestos de forma radiada y que en periferia
producen fenómeno de Splendore-Hoeppli (Fig
12). Los agentes causantes son diversos hongos pigmentados o
no pigmentados, a destacar Madurella spp. o Scedosporium
apiospermum, entre muchos otros, que producen el llamado eumicetoma.
Debe de diferenciarse de los actinomicetomas (producidos por actinomices)
y los botriomicomas por bacterias (estafilococos, pseudomonas) (11,12,32).
- Pneumocistosis. Pneumocystis carinii o actualmente
Pneumocystis jiroveci, fue considerado por bastante
tiempo como un parásito. Con PAS y sobre todo con Grocott,
se observa presencia de agrupamientos de diversas esporas ovales
con una muesca central, de 5-7 μm, siempre acompañadas
por material mucoproteico (Fig 13).
Son visibles en citologías de esputos inducidos o mejor de
lavados broncoalveolares y en las biopsias pulmonares se observan
a nivel intraalveolar y también entre material proteico.
Pueden hallarse fuera de pulmón, habiendose descrito en ganglios,
bazo e inclusive en SNC, como nosotros pudimos observar hace unos
años en el estudio autópsico de un paciente con SIDA(57).
Finalmente, para realizar un buen estudio histopatológico
en las micosis, es necesario proceder con cautela en el diagnóstico,
realizar muchas secciones ya que la morfología puede variar
dependiendo de la zona, disponer de buenas técnicas para
obtener óptimas morfologías, tener mucha paciencia
y buscar detalles mínimos y profundizar en su estudio(58,59,60).
Con todo esto se puede llegar a identificar varios de los géneros
y especies, como se ha relatado, pero sobre todo hay que ser prudentes
y correlacionar los resultados con los cultivos y la clínica.
Indudablemente, las nuevas técnicas moleculares y de IHQ
que se están instaurando en los laboratorios de patología,
van a ayudar mucho en la realización de un diagnóstico
correcto.
Arriba
Agradecimientos:
A los profesores J Guarro y J Cano por la revisión del manuscrito
y sus criticismos. A todos aquellos que me han hecho pasar buenos
momentos revisando los casos que me han enviado (Dra. Gómez-Aracil,
Dr. Zaror, Dr.Azua, Dr. Martinez, Dr. F.Fernandez, Dr.Ortiz, Dr.
Arrinda... y a los que mi frágil memoria haya podido olvidar)
Arriba
Bibliografía
1- Quindós G. Las micosis en el amanecer del siglo XXI.
Rev Iberoam Micol 2002;19:1-4
2- Bouza E, Munoz P.Invasive infectious causad by Blastoschizomyces
capitatus and Scedosporium spp. Clin Microbiol Infect
2004;10S:76-85.
3- De Hoog GS, Guarro J, Gené J, Figueras MJ. Atlas of Clinical
Fungi 2on Ed.
Baarm/Reus, Centralbureau voor Schimmelcultures/Universitat Rovira
i Virgili 2000.
4- Dismukes WE, Pappas PG, Sobel JD. Clinical Mycology. Oxford
University Press 2003.
5- Anaissie EJ, McGinnis MR, Pfaller MA. Clinical Mycology. Churchill
Livingstone New York 2003.
6- Larone DH. Medically important fungi. 4th Ed. ASM Press. Washington
DC 2003.
7- Richardson MD, Johnson EM. The pocket guide to Fungal Infection.
Blackwell Science. London 2000.
8- Salfelder K. Atlas of Fungal Pathology. Kluwer Academic Publishers.
Dordrecht 1990.
9- Kumar V, Cotran RS, Robbins SL. Robbins Patología Humana
7ª Ed. Elsevier Madrid 2004.
10- Elder D, Elenitsas R, Jaworsky C, Jonhson B. Lever Histopatología
de la piel 8ª Ed. Intermédica Buenos Aires 1999.
11- Da Silva Lacaz C, Porto E, Costa Martrus JE, Heins-Vaccari
EM, Takahashi de Melo N. Tratado de Micologia Mèdica Lacaz.
Sarvier Sao Paulo 2002.
12- Costa Sidrim JJ, Bezerra Moreira JL. Fundamentos clinicos e
laboratoriais da micologia mèdica. Guanábana Koogan
Ed. Rio de Janeiro 1999.
13- Caraway NP, Fanning CV, Stewart JM, Tarrand JJ, Weber KL. Coccidioidomycosis
osteomyelitis masquerading as a bone tumor: A report of 2 cases.
Acta Cytol 2003;47:777-82.
14- Kumar S, Ferns S, Jativa L. A rare case of crytococcosis diagnosed
by fine needle aspiration cytology. Acta Cytol 2003;47:528-9.
15- Gupta S, Sidhani P, Jain S. Macroconidia of Fusarium
species. An unusual finding in cervical smears. Acta Cytol 2001;45:411-4.
16- Drut R. Paracoccidioidomycosis: diagnosis by fine needle aspiration
cytology. Diagn Cytopathol 1995;13:52-3.
17- Deshpande AH, Munshi MM. Rhinocerebral mucormycosis diagnosis
by aspiration cytology. Diagn Cytopathol 2001;23:97-100.
18- Garcia del Moral R. El laboratorio de Anatomía Patológica.
Interamericana, McGraw-Hill. Madrid 1993.
19- Torres Rodríguez JM y cols. Micología Médica.
Masson Barcelona 1993.
20- Jensen HE, Salonen J, Ekfors TO. The use of immunohistochemistry
to improve sensitivity and specificity in the diagnosis of systemic
mycoses in patients with haematological malignancies. J Pathol 1997;181:100-5.
21- Hamilton AJ, Gomez BL. The application of monoclonal antibodies
to the diagnosis of disseminated mycoses. Rev Iberoam Micol 1998;15:118-24.
22- Kaufman L, Standard PG, Jalbert M, Kraft DE. Immunohistologic
identification of Aspergillus spp. And other hyaline fungi
by using polyclonal fluorescent antibodies. J Clin Microbiol 1997;35:2206-9.
23- Kaufman L. Immunohistologic diagnosis of systemic mycoses:
an update. Eur J Epidemiol 1992;8:377-82.
24- Saeed GN, Hay RJ. Immunoperoxidase staining in the recognition
of Aspergillus infections. Histopathology 1981;5:437-44.
25- Moskowitz LB, Ganjei P, Ziegels-Weisman J, Cleary TJ, Penneys
NS, Nadji M. Immunohistologic identification of fungi in systemic
and cutaneous mycoses. Arch Pathol Lab Med 1986:110:433-6.
26- Chan PKS, Chan DPC, To KF, Yu MY, Cheung JLK, Cheng AF. Evaluation
of extraction methods from paraffin wax embedded tissues for PCR
amplification of human and viral DNA. J Clin Pathol 2001;54:401-3.
27- Schofield DA, Westwater C, Paulling EE, Nicholas PJ, Balish
E. Detection of Candida albicans nRNA from formalin-fixed,
paraffin-embedded mouse tissues by nested reverse transcription-PCR.
J Clin Microbiol 2003;41:831-4.
28- San Millan R, Quindos G, Garaizar J, Salesa R, Guarro J, Ponton
J. Characterization of Scedosporium prolificans clinical
isolates by randomly amplified polymorphic DNA analysis. J Clin
Microbiol 1997;35:2270-4.
29- Hagari Y, Ishioka S. Cutaneous infection showing sporotrichoid
spread caused by Pseudallescheria boydii (Scedosporium apiospermum):
Successful detection of fungal DNA in formalin-fixed, paraffin-embedded
sections by seminester PCR. Arch Dermatol 2002;138:271-2.
30- Hayden RT, Qian X, Procop GW, Roberts GD, Lloyd RV. In situ
hybridization for the identification of filamentous fungi in tissue
section. Diagn Mol Pathol 2002;11:119-26.
31- Rippon JW. Medical Mycology. 3th Ed. WB Saunders Co. Philadelphia
1988.
32- Ellis DH. Clinical Mycology. The human opportunistic mycoses.
Pfizer Inc. New York 1994.
33- Ponton J. Diagnóstico microbiológico de las micosis.Rev
Iberoam Micol 2002;19:25-9.
34- Flor A, Estivill D, Pérez R, Ordeig J, Ramos F, Soler
J, Puig X. Histoplasmosis pulmonar aguda en un viajero español
a Nicaragua: Ejemplo de enfermedad importada. Rev Iberoam Micol
2003;20:24-8.
35- Molina L, Garau M, Gracía J, Odriozola M, del Palacio
A. A propósito de tres casos de histoplasmosis importada
en nuestro hospital. Rev Iberoam Micol 2002;19:204-7.
36- Garcia Bustinduy M, Guimera FJ, Arevalo P, Castro C, Saez M,
Dorta Alom S, Noda A, Diaz-Flores L, Garcia Montelongo R. Cutaneous
primary paracoccidioidomycosis. J Eur Dermatol Venereol 2000;14:113-7.
37- Ginarte M, Pereiro M, Toribio J. Imported paracoccidioidomycosis
in Spain. Mycoses 2003;46:407-11.
38-Hernandez JL, Echevarria S, Garcia-Valtuille A, Mazorra F, Salesa
R. Atypical coccidioidomycosis in an AIDS patient successfully treated
with fluconazole. Eur J Microbiol Infect Dis 1997:16:592-4.
39- Petrini B, Skold CM, Bronner V, Elmberger. Coccidioidomycosis
mimicking lung cancer. Respiration 2003;70:651-3.
40- Mayayo E, Moralejo J, Camps J, Guarro J. Fungal endocarditis
in premature infants. Clin Infect Dis 1996;26:366-8.
41- Pontón J. editor. Aspergilosis invasora, guía
de bolsillo. Rev Iberoam Micol. Bilbao 2003.
42- Cabañes FJ, Rourax X, Gracia F, Domingo M, Abarca ML,
Pastor J. Nasal granuloma caused by Scedosporium apiospermum
in a dog. J Clin Microbiol 1998;36:2755-8.
43- Liu K, Howell DN, Perfect JR, et al. Morphologic criteria for
the preliminary identification of Fusarium, Paecilomyces, and
Acremonium species by histopathology. Am J Clin Pathol
1998;109:45-54.
44- Guarro J, Alves SH, Gene J, Grazziotin NA, Mazzuco R, Dalmagro
C, Capilla J, Zaror L, Mayayo E. Two cases of subcutaneous infection
due to Phaeoacremonium spp.. J Clin Microbiol 2003;41:1332-6.
45- Pujol I, Aguilar C, Gene J, Guarro J. In vitro antigungal susceptibility
of Alternaria spp. and Ulocladium spp. J Antimicrob
Chemother 2000;46:357.
46- Guarro J, Gene J, Stchigel AM. Developments in fungal taxonomy.
Clin Microbiol Rev 1999;12:454-500.
47- Aguilar C, Pujol I, Guarro J. In vitro antifungal susceptibilities
of Scopulariopsis isolates. Antimicrob Agents Chemother 1999;43:1520-2.
48- Ortoneda M, Pastor FJ, Mayayo E, Guarro J. Comparation of the
virulence of Scedosporium prolificans strain from different
origins in a murine model. J Med Microbiol 2002;51:924-8.
49- Fernandez-Torres B, Mayayo E, Boronat J, Guarro J. Subcutaneous
infection by Microsporum gypseum. Brit J Dermatol 2002;146:311-3.
50- Guarro J, Cano J, Tapiol J, Aguilar C, Mayayo E. Microsphaeropsis
olivacea as an etiological agent of human skin infection. Med
Mycol 1999;37:133-7.
51- Cano J, Guarro J, Mayayo E, Fernandez-Ballart J. Experimental
infection with Scedosporium inflatum. J Med Vet Mycol 1992;30:413-20.
52- Capilla J, Yustes C, Mayayo E, Fernandez B, Ortoneda M, Pastor
FJ, Guarro J. Efficacy of Albaconazole (UR-9825) in treatment of
disseminated Scedosporium prolificans infection in rabbits.
Antimicrob Agents Chemother. 2003;47:1948-51.
53- Ortoneda M, Capilla J, Pujol I, Pastor FJ, Mayayo E, Fernandez-Ballart
J, Guarro J. Liposomal amphotericin B and granulocyte colony stimulating
factor theraphy in a murine model of invasive infection by Scedosporium
prolificans. J Antimicrob Chemother 2002; 49:525-9.
54- Guarro J, Pujol I, Mayayo E. In vitro and in vivo experimental
activities of antifungal agents againts Fusarium solani.
Antimicrob Agents Chemother. 1999;35:245-7.
55- Mayayo E, Guarro J, Pujol I. Endogenous endophthalmitis by
Fusarium solani: an animal experimental model. Med Mycol
1998;36:249-53.
56- Aguilar C, Pujol I, Sala J, Guarro J. Antifungal susceptibilities
of Paecilomyces species. Antimicrob Agents Chemother 1998;42:1601-4.
57- Mayayo E, Vidal F, Alvira R, Gonzalez J, Richart C. Pneumocystis
carinii in cerebral abscesses in a patient with AIDS. Lancet
1990;336:227.
58- Watts JC, Chandler FW. Morphologic identification of mycelial
pathogens in tissue sections. A caveat. Am J Clin Pathol 1998;109:1-2.
59- Watts JC, Chandler FW. The surgical pathologist's role in the
diagnosis of infectious
diseases. J Histotechnol 1995;18:191-3.
60- Schwartz J. The diagnosis of deep mycoses by morphologic methods.
Hum Pathol 1982;13:519-33.
Arriba
--------------------------------------------------------------------------------
|
|
|