|
 DESORDENES
FUNCIONALES DEL ENDOMETRIO DESORDENES
FUNCIONALES DEL ENDOMETRIO
Dr.
David García Marqués
Jefe del Departamento de Anatomía Patológica.
Hospital docente Gineco-Obstétrico Provincial "Julio
R. Alfonso Medina".
Matanzas, Cuba.
INTRODUCCIÓN
La patología endometrial desafortunadamente no goza de un
gran favoritismo entre los patólogos, muchos de los cuales
ven las muestras de endometrio con ansiedad e incluso temor o aversión(1).
La escasez de ponencias sobre este tema en los diferentes eventos
de nuestra especialidad lo demuestra fehacientemente.
Esto quizás no tuviera demasiada importancia si por un lado,
la biopsia endometrial no figurara entre las más abundantes
en los departamentos de Anatomía Patológica de hospitales
generales con servicio de Ginecología y por supuesto en los
de hospitales ginecológicos donde representa aproximadamente
del 40 al 50% del material biópsico anual y; por el otro
porque aproximadamente sólo una cuarta parte de la patología
endometrial se corresponde con carcinoma o hiperplasia, entidades
a las que sí se les han dedicado mayores empeños por
la preocupación que engendran al poner en peligro de una
forma más dramática la vida de las pacientes(2,
3).
Pero ¿qué sucede con la patología disfuncional,
desatendida con mucha frecuencia tanto por ginecólogos como
patólogos y en cuyos predios reina gran confusión?.
Es precisamente esta la parte de la patología del endometrio
que más necesita de la relación clínico-patólogo,
de los que se recaba dominio de la histo-fisiología endometrial
para arribar a un diagnóstico lo más certero posible.
Probablemente en la falta de comunicación y en el desinterés
por el estudio de las relaciones endocrinas algo complejas a las
que está sujeto este tejido estribe en gran medida este abandono(2).
Además, abundan tanto las contradicciones, escabrosidades
y tortuosidades de conceptos y términos en la literatura
que más que un estímulo al estudio constituyen una
invitación a la renuncia, sin embargo, más del 20%
de las mujeres en la etapa reproductiva acuden al médico
por infertilidad o aquejadas de un sangrado vaginal anormal. De
ellas, el 70% tiene como base un trastorno funcional y a la mayor
parte se les realiza una biopsia endometrial, proceder relativamente
sencillo pero que invariablemente entraña riesgos y sobre
cuyo resultado descansa en gran medida la terapéutica correcta.
Estas son indudablemente razones poderosas para adentrarse en el
análisis de este grupo de entidades.
Arriba
CONCEPTOS Y DEFINICIONES.
“Un sangrado anormal es funcional si no existen lesiones
macroscópicas en genitales externos, porción vaginal
uterina ni de la mucosa del útero o, si están presentes,
son consecuencia de un alto control neurohormonal o de una reacción
patológica local de la mucosa uterina” (4).
“...hemorragia anormal procedente del útero no acompañada
de tumor, inflamación ni embarazo” (5).
“...por ser el endometrio exquisitamente sensible a los niveles
cambiantes de las hormonas ováricas, muchas desviaciones
de lo normal pueden ser clasificadas bajo el término de trastornos
funcionales que van desde la aparente quiescencia de un endometrio
inadecuadamente estimulado por un lado, a la sobrestimulación
que resulta en hiperplasia o carcinoma por otro” (6).
"Sangrado uterino disfuncional es un término clínico
usado para describir una hemorragia no atribuida a una condición
orgánica patológica"(7).
“Sangrado uterino disfuncional es el término clínico
que describe un sangrado anormal del endometrio que ocurre como
consecuencia de una estimulación hormonal anormal en vez
de por cualquier lesión endometrial intrínseca”
(8).
“El sangrado uterino disfuncional ocurre durante los años
reproductivos no relacionado con anomalías estructurales
uterinas” (9).
“El sangrado uterino disfuncional se define como un sangrado
endometrial anormal sin patología estructural” (10).
Estas definiciones hechas en diferentes épocas tienen en
común que:
- Excluyen las lesiones orgánicas uterinas. Esta es la
condición sine qua nom de estos procesos, cuyo diagnóstico
es de exclusión(11, 12), es decir, una vez descartados
un gran número de causas de sangrado uterino anormal como
las relacionadas con el embarazo, el carcinoma de cuello y endometrio,
las hiperplasias endometriales, la endometritis, leiomiomas submucosos,
adenomiosis y pólipos entre otras. Sin embargo ya esta
simple regla se complica con el hecho de que las alteraciones
funcionales se asocian frecuentemente a lesiones orgánicas;
que en ocasiones la etiología de las primeras lo es también
para las segundas y que la evolución natural de ciertas
alteraciones funcionales conduce a lesiones orgánicas.
Tales son los casos de la hiperplasia o el carcinoma, que pueden
surgir y desarrollarse en el seno de un desequilibrio hormonal
que primero produce un sangrado disfuncional. Esta es posiblemente
la causa por la que algunos autores incluyen las hiperplasias
entre los trastornos funcionales mientras que otros las excluyen(6,
7, 8, 13, 14, 15, 16).
- Responsabilizan a los desequilibrios hormonales de los cambios
endometriales. La infertilidad y el sangrado uterino resultantes
de un disbalance hormonal permanecen como una de las áreas
menos comprendidas de la endocrinología ginecológica
y de la patología endometrial, posiblemente porque muchos
patólogos muestran cierto desgano en el estudio de la fisiología
del sistema reproductor, sin embargo, en la mayoría de
los casos la morfología sigue a la función. El endometrio
puede parecer cualitativa o cronológicamente anormal pero
generalmente como consecuencia de una respuesta normal a una estimulación
hormonal anómala(8). Los cambios endometriales
producidos por la administración hormonal exógena
no se incluyen en este acápite pudiendo agruparse bajo
el término de cambios iatrogénicos del endometrio.
- Usualmente utilizan el término “sangrado uterino
disfuncional” para rubricar esta entidad. La forma más
dramática de presentarse una alteración endometrial
es la hemorragia y como casi siempre existe un patrón anormal
de sangrado uterino acompañando un desequilibrio de la
dinámica del eje hipotálamo-pituito-ovárico,
el término de sangrado disfuncional ha sido utilizado como
presentador de estos fenómenos. No obstante esta no es
siempre la manera de manifestarse un desequilibrio hormonal. Con
frecuencia la paciente puede acudir a consulta por amenorrea o
incapacidad para concebir y referir ciclos menstruales aparentemente
normales. De esto podemos deducir que la infertilidad y el sangrado
uterino asociados a un desequilibrio hormonal son dos formas de
ver un mismo problema y que dependiendo de la edad de la paciente,
del riesgo de desarrollar una neoplasia endometrial o del deseo
de concebir, el clínico debe orientar el estudio hacia
una u otra de estas manifestaciones(8).
No cabe dudas de que el término “sangrado uterino
disfuncional” carece de un significado biológico o
diagnóstico específicos y de que muchos patólogos
y ginecólogos permanecen confundidos respecto al mismo, sin
embargo debido a lo arraigado que se encuentra en la literatura
y en el pensamiento médico es difícil obviarlo totalmente.
Es preferible usar el término de desórdenes funcionales
del endometrio, que sugiere múltiples formas de presentación
y etiología y definir el problema como sigue:
Desórdenes funcionales del endometrio: Grupo de trastornos
de la mujer en etapa reproductiva caracterizados clínicamente
por sangrado uterino anormal, infertilidad o ambos, no relacionados
con lesión orgánica o acción iatrogénica
y que usualmente son la consecuencia de una respuesta normal del
endometrio a una estimulación hormonal anómala.
Arriba
CONSIDERACIONES CLÍNICAS.
La imperiosa necesidad de establecer estrechas relaciones clínico-patológicas
para el correcto diagnóstico de los desórdenes funcionales
endometriales nos induce a comentar algunos aspectos sobre la infertilidad
y el sangrado uterino relacionados con desequilibrios hormonales
desde un enfoque clínico para luego analizar los diferentes
procesos desde el ángulo de la histopatología.
Infertilidad y desequilibrio hormonal.
Se pueden distinguir tres patrones básicos de desequilibrio
hormonal que resultan en infertilidad:
- Amenorrea
- Ciclos anovulatorios
- Ciclos ovulatorios con una fase folicular o lútea deficientes
Amenorrea. La amenorrea es frecuentemente clasificada como
primaria si nunca ha existido la menstruación o secundaria
si las reglas después de ocurrir cesan por al menos 6 meses.
Las causas son múltiples, situadas a distintos niveles (hipotálamo,
hipófisis, ovario, útero o sistémicas) y pueden
ser hormonales o mecánicas.
Nos importan fundamentalmente los casos de amenorrea causados por
defectos endocrinos, en la mayoría de los cuales los niveles
de gonadotropinas son bajos debido a una lesión hipotalámica
o hipofisaria y consecuentemente hay una pobre estimulación
de la producción ovárica tanto de estradiol como de
progesterona. La amenorrea asociada a un defecto ovárico
se caracteriza por gonadotropinas elevadas y de nuevo bajos niveles
de estradiol y progesterona.
De esta manera, la biopsia endometrial de una mujer con amenorrea
es frecuentemente insuficiente para el diagnóstico o muestra
un endometrio atrófico; inactivo o débilmente proliferativo
(8).
Ciclos anovulatorios. En contraste con la amenorrea que
es una condición infrecuente, los ciclos anovulatorios son
comunes y constituyen aproximadamente el 40% de las causas de infertilidad
en la mujer. Mientras que la amenorrea necesita de una casi total
disrupción del eje hipotálamo-pituito-ovárico,
trastornos sutiles en la sincronización de la secreción
de gonadotropinas hipofisarias pueden hacer fracasar la ovulación.
La mayor frecuencia de anovulación ocurre en los extremos
de la etapa reproductiva. Después de la menarquia, los ciclos
anovulatorios son la regla por algunos años hasta que se
establece la secreción pulsátil normal de las Gn-RH
(hormonas liberadoras de gonadotropinas) por el hipotálamo.
Las mujeres perimenopáusicas fallan en ovular cuando se pierde
la sincronización entre la maduración del folículo
dominante y la oleada de LH. Además, muchos de los trastornos
hipotalámicos e hipofisarios que finalmente producen amenorrea
pueden inicialmente causar anovulación. Por ejemplo, el estrés,
la ansiedad, la pérdida brusca de peso, la anorexia nerviosa
y la hiperprolactinemia pueden inhibir la secreción pulsátil
de Gn-RH e interferir consecuentemente con la liberación
de gonadotropinas necesarias para la oleada ovulatoria de LH. Así
mismo el hipo o hipertiroidismo, las neoplasias ováricas
o adrenales productoras de estrógenos o la obesidad alteran
la secreción, el catabolismo o la conversión periférica
de estrógenos causando señales de retroalimentación
anormales en el eje pituito-ovárico las cuales pueden impedir
la ovulación. Una causa importante de anovulación
es el síndrome del ovario poliquístico en el que al
parecer entran a jugar diversos mecanismos fisiopatológicos.
Por cualquiera de las mencionadas causas de ciclo anovulatorio,
el endometrio exhibe en la biopsia evidencias de una estimulación
estrogénica mantenida sin oposición progestágena,
pudiendo mostrar una morfología de fase proliferativa; una
proliferación desordenada; hiperplasia e incluso en casos
de duración prolongada; adenocarcinoma.
El diagnóstico de ciclo anovulatorio no se hace solamente
sobre las bases de la morfología sino más adecuadamente
en el contexto de una situación clínica determinada.
La presencia de características proliferativas en una biopsia
endometrial tomada durante la fase lútea o secretora apunta
hacia una ausencia de ovulación que debe ser confirmada con
otras investigaciones como la determinación de la elevación
de la temperatura corporal basal, de la aparición de la oleada
de LH, del incremento de los niveles séricos de progesterona
y la determinación del momento de la ovulación por
ultrasonografía transvaginal (8).
Ciclos ovulatorios con fase lútea deficiente. Existe
una gran confusión acerca de la patogénesis, histopatología,
reproducibilidad entre observadores, que hasta se ha puesto en duda
la misma existencia de una fase lútea inadecuada.
En su descripción inicial, el defecto de la fase lútea
(DFL) se consideró consecutivo a una producción defectuosa
de progesterona por el cuerpo lúteo y causante de infertilidad
o abortos a repetición. Se sugirió que el diagnóstico
debe ser hecho por la identificación de un endometrio “fuera
de fase” (retrasado) en dos o más días de acuerdo
al próximo periodo menstrual por dos ciclos consecutivos.
Posteriormente las anomalías histológicas del DFL
fueron ampliadas para incluir casos con una divergencia significativa
entre la apariencia de las glándulas y el estroma (asincronía
glándulo-estromal) y otros con áreas de desarrollo
diferentes en el legrado (maduración dispareja). Las anomalías
endometriales usualmente se acompañaban de una elevación
anormalmente lenta de la temperatura corporal basal y una disminución
de la progesterona sérica. Se propuso que un grupo de factores
etiológicos pudieran resultar en una de cuatro situaciones
que conllevarían a este defecto: a) una función deficiente
del cuerpo lúteo con una producción inadecuada de
progesterona; b) una inadecuada preparación estrogénica
del endometrio; c) una proporción estrógeno: progesterona
anormal o d) una incapacidad del endometrio para responder a la
estimulación hormonal. Así, teóricamente, el
desorden fisiológico puede estar a nivel del hipotálamo,
pituitaria, ovario o del endometrio y podría originarse tanto
en la fase folicular como en la lútea.
Numerosos estudios sin embargo han demostrado que la frecuencia
de endometrios "fuera de fase" por al menos dos días
de retardo no es diferente entre las mujeres fértiles e infértiles.
También se ha comprobado que sólo la mitad de las
mujeres con una primera muestra anormal tendrá una segunda
con alteraciones, como se requiere para el diagnóstico, por
lo que pudiera inferirse que los especimenes "fuera de fase"
son comunes como eventos esporádicos entre las mujeres fértiles.
Por otro lado, una medición aislada de la progesterona sérica
puede indicar que ha ocurrido la ovulación pero generalmente
no es muy confiable como medidor cuantitativo ya que la secreción
de progesterona ocurre de forma pulsátil.
Las correlaciones realizadas entre los gráficos de la temperatura
basal corporal y los cambios morfológicos endometriales han
sido variables lo que concuerda con la inconstancia de las observaciones
hechas respecto a los niveles de progesterona ya que es precisamente
ésta la que actúa sobre el hipotálamo para
elevar el punto de ajuste del centro termorregulador.
Debe recordarse además que no sólo existe una variabilidad
significativa de la longitud de los ciclos y de la fase lútea
sino también entre distintos observadores, lo suficiente
importante como para que un espécimen al ser fechado por
un segundo patólogo cambie de un "fuera de fase"
a un "en fase" y viceversa lo que implica que la frecuencia
de hallar un endometrio "fuera de fase" en mujeres con
infertilidad, no es mayor que la encontrada al azar en ciclos normales.
Por lo anteriormente expuesto es aparente que las longitudes de
los ciclos menstruales y de las fases lúteas en las mujeres
fértiles varían en duración particularmente,
aunque no de forma exclusiva en los extremos de la vida reproductiva
y que algunos de estos ciclos aunque ovulatorios pueden adolecer
de una estimulación gonadotrópica óptima de
los folículos ováricos y mostrar una producción
deficiente de progesterona lo que conlleva a una implantación
defectuosa y a una incapacidad para el mantenimiento del embarazo.
La definición de DFL basada en el retardo de dos días
del desarrollo histológico del endometrio es poco específica
ya que se encuentra en los límites de la reproducibilidad
entre observadores y la variabilidad del ciclo. La especificidad
del diagnóstico aumenta en la medida que lo hace la diferencia
entre las fechas histológica y cronológica.
En contraste con la relativa inespecificidad del retardo histológico,
las biopsias endometriales que muestran tanto una asincronía
glándulo-estromal como una maduración irregular ofrecen
una apariencia anormal distintiva (8).
Sangrado uterino y desequilibrio hormonal.
A pesar de la relativa variabilidad del ciclo menstrual, un sangrado
a través de la vagina que ocurra con una frecuencia mayor
que cada 24 días o menor que cada 35, o es excesivo en cantidad
se considera un sangrado uterino anormal.
Clásicamente se describen los siguientes patrones de sangrado
anormal (8, 17):
- Menorragia: sangrado uterino excesivo tanto en cantidad como
en duración que ocurre a intervalos regulares (cíclico).
Usualmente relacionado con lesiones locales como miomas, pólipos
endometriales, hiperplasia y adenomiosis.
- Metrorragia: sangrado de cantidad normal o aumentada que ocurre
a intervalos irregulares (más de 24 horas antes de la aparición
de un periodo o después de su supuesta cesación).
Es más probablemente de causa local, especialmente carcinoma.
Incluye además el llamado “sangrado ovulatorio”,
episodio único de sangrado entre ciclos menstruales.
- Menometrorragia: es el sangrado frecuente, irregular, prolongado
y excesivo. La menstruación no puede ser identificada.
Generalmente los trastornos que producen meno y metrorragia pueden
provocar esta forma de hemorragia. También puede relacionarse
con trastornos del embarazo como aborto, mola y coriocarcinoma.
- Oligomenorrea: hemorragia uterina poco frecuente, usualmente
irregular que ocurre a intervalos mayores de 35 días. El
sangrado también puede estar disminuido en cantidad y duración.
La causa es mayormente endocrina o general.
- Polimenorrea: episodios de sangrado uterino frecuentes, usualmente
a intervalos regulares menores de 21 días. Puede ser anormal
o no en cantidad. Una causa frecuente es la anovulación
por fenómenos endocrinos o generales.
- Hipomenorrea o criptomenorrea: flujo menstrual muy escaso que
ocurre a intervalos regulares. El sangrado puede ser en forma
de manchas. Las causas pueden ser tanto endocrinas o generales
como orgánicas (obstrucción cervical, sinequias
uterinas, tuberculosis endometrial).
El sangrado uterino relacionado con desequilibrios hormonales es
usualmente una manifestación de anovulación crónica
pero también puede estar asociado a ciclos ovulatorios anormales
y pueden aplicársele cualquiera de los patrones de sangrado
anormal descritos anteriormente. Las condiciones que provocan un
sangrado uterino disfuncional son fundamentalmente la anovulación
crónica, la fase secretora deficiente, la descamación
irregular del endometrio y el manchado de mitad de ciclo.
Es útil considerar brevemente los mecanismos de sangrado
endometrial que ocurren en respuesta a las hormonas esteroideas
tanto endógenas como exógenas.
El sangrado menstrual normal es el resultado de una caída
de los niveles tanto de estrógeno como de progesterona en
la fase secretora tardía. La descamación endometrial
no menstrual por su parte puede ser una respuesta fisiológica
apropiada del endometrio a otras fluctuaciones de las hormonas esteroideas
y puede presentarse como: (8)
- Sangrado por privación estrogénica: ocurre inmediatamente
después de un cese o reducción del nivel de estrógenos
como puede ocurrir en la ooforectomía bilateral, radiación
de los ovarios o interrupción de la terapéutica
estrogénica posmenopáusica. La disminución
de la producción de estradiol por el folículo ovárico
que sigue a la oleada de LH puede provocar también un sangrado
a mitad del ciclo.
- Sangrado por exceso de estrógenos: refleja la incapacidad
de mantener una proliferación endometrial debida a una
producción estrogénica sostenida inadecuadamente
resultante de anovulación. La proliferación endometrial
excesiva requiere cantidades cada vez mayores de estrógenos
y cuando estos no están disponibles se produce descamación
parcial. El sangrado puede ser intermitente y ligero o profuso
después de meses de amenorrea.
- Sangrado por privación progestágena: acompañada
de niveles estrogénicos mantenidos, usualmente refleja
una terapia hormonal exógena. Se produce una descamación
significativa si ha habido una proliferación endometrial
previa causada por estrógenos exógenos o endógenos.
- Sangrado por exceso de progesterona: es el resultado de un
nivel estrogénico insuficiente para mantener el endometrio
decidualizado. Es usualmente consecuencia de una contracepción
prolongada con progestágenos solamente.
Cuando el sangrado ocurre por exceso de estrógenos o progesterona
son comunes las características histológicas de una
descamación no menstrual. En contraste con la descamación
universal y coordinada de la menstruación unida a regeneración
que se sucede después de la caída de los niveles de
estrógeno y progesterona, la descamación no menstrual
es un evento focal o multifocal. En ambos casos puede verse condensación
del estroma revestido por masas sincitiales de epitelio (Figura
1), hemorragia estromal, trombos vasculares, inflamación
y restos nucleares en el citoplasma de las células glandulares,
sin embargo existen características específicas que
pueden distinguir la descamación no menstrual de la menstrual
como son: a) evidencias de secreción activa o anterior (vacuolización
intracitoplasmática del epitelio glandular, secreción
luminal o predecidualización estromal) en los casos de descamación
menstrual; b) evidencias de proliferación encontradas en
la mayoría de los casos de descamación no menstrual
asociada a exceso de estrógeno, específicamente estratificación
nuclear y mitosis en células glandulares y c) la naturaleza
focal de la descamación no menstrual que usualmente resulta
en una muestra endometrial en la que se observan fragmentos sin
evidencias de descamación.
Figura 1
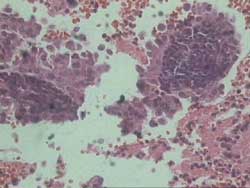
En los casos de descamación no menstrual asociados a acción
progestágena puede haber actividad secretora y cambio decidual
por lo que la distinción de la descamación menstrual
es más difícil y debe basarse en la historia clínica.
Arriba
CLASIFICACION E HISTOPATOLOGIA
Algunos autores, al tratar los trastornos funcionales del endometrio
se limitan a describir una serie de entidades a manera de una lista
sin relaciones o asociaciones etiológicas o fisiopatológicas
(6, 7), otros suelen dividirlos en ovulatorios y anovulatrios
(9, 15, 18) o en grupos dependiendo de una base etiológica
determinada (14). Es preferible clasificar estos trastornos
de acuerdo a las fases del ciclo menstrual pues para los patólogos
puede resultar más útil desde los puntos de vista
práctico y didáctico. De esta manera, tomado como
modelo la antigua clasificación empleada por Márquez
Ramírez(13) y sustituyendo la vieja terminología
por la actual, se propone la siguiente:
Alteraciones de la fase proliferativa
- Endometrio inactivo \ atrofia
- Endometrio débilmente proliferativo
- Endometrio proliferativo desordenado
- Hiperplasia endometrial sin atipia
Alteraciones de la etapa secretora
- Fase lútea insuficiente
- Retardo coordinado del desarrollo endometrial
- Asincronía glándulo-estromal
- Maduración irregular del endometrio
Alteraciones de la fase menstrual
- Descamación irregular del endometrio
Alteraciones de la fase proliferativa
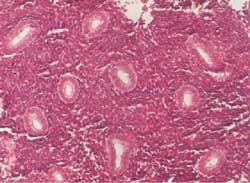
Endometrio inactivo (en reposo)
Es el resultado de una estimulación endometrial insuficiente
por deficiencias hipotálamo-hipofisarias u ováricas.
Los especimenes son generalmente escasos y fragmentados. Histológicamente
se aprecian glándulas con contorno tubular simple de escaso
diámetro, revestidas por una capa única de células
columnares con núcleos ovales de cromatina condensada sin
nucleolo evidente. El estroma está compuesto por células
pequeñas densamente empacadas muchas de las cuales tienen
aspecto alargado. Las figuras mitóticas en glándulas
y estroma están ausentes o extremadamente dispersas (Figura
2).
Figura 2
Las pacientes usualmente se presentan con amenorrea u oligomenorrea,
siendo la infertilidad el motivo más frecuente de consulta.
Obviamente, si la carencia de estimulación continúa
por un apreciable período de tiempo, el endometrio se tornara
atrófico e indistinguible del visto después de la
menopausia (6, 8, 15).
Endometrio débilmente proliferativo (proliferación
insuficiente)
Obedece a las mismas causas y presenta manifestaciones clínicas
semejantes a las del endometrio inactivo. Posee características
histológicas intermedias entre las de un endometrio en reposo
y las de un endometrio proliferativo normal.
Las glándulas siguen siendo tubos estrechos revestidos por
un epitelio columnar simple o estratificado. Los núcleos
son elongados, de cromatina densa y se observan figuras mitóticas
muy escasas y espaciadas. El estroma, que es densamente celular,
con pequeñas células poliédricas o fusiformes,
de escaso citoplasma y núcleo oval con cromatina densa, ayuda
a diferenciar al endometrio débilmente proliferativo del
de la fase proliferativa inicial normal cuyo estroma recuerda al
tejido de granulación con células fusiformes y una
matriz laxa basófila (8, 15). (Figura 3). Este
término ha suscitado cierta polémica en la actualidad
pues para algunos es inadecuado. Estos autores consideran que la
presencia de una sola mitosis en la preparación es suficiente
para considerar que un endometrio está proliferando adecuadamente.
Figura 3
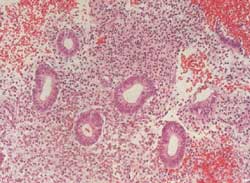
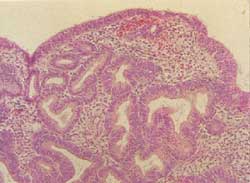
Endometrio proliferativo desordenado (proliferación irregular)
El endometrio proliferativo desordenado es un endometrio histológicamente
anormal que responde fisiológicamente de forma apropiada
a un estímulo estrogénico prolongado y sin oposición
progestágena como el que puede observarse en la producción
estrogénica excesiva por un folículo persistente,
en el síndrome del ovario poliquístico, en la hiperplasia
estromal ovárica y otros tumores del ovario. También
se ha sugerido una posible ausencia de receptores endometriales
para la progesterona. Las pacientes usualmente acuden a consulta
por infertilidad o sangrado anormal generalmente en forma de polimenorrea.
Es un patrón común, observado más frecuentemente
como consecuencia de ciclos anovulatorios repetidos. Puede describirse
como un endometrio proliferante que no parece apropiado para ningún
momento en el ciclo menstrual normal pero que no es lo suficiente
anormal para ser considerado hiperplástico. Representa por
tanto una exageración de la fase proliferativa normal en
la que el endometrio es de grosor variable dependiendo de la duración
e intensidad de la exposición a los estrógenos. Histológicamente
se observa un desarrollo endometrial no uniforme con glándulas
normales entremezcladas al azar con otras arquitecturalmente anormales.
Las glándulas tubulares van desde rectas a tortuosas, algunas
con bifurcaciones y evaginaciones, la mayoría muestra un
diámetro estrecho mientras que algunas están dilatadas.
El epitelio de revestimiento glandular es estratificado con abundancia
de figuras mitóticas. Los núcleos son elípticos
y regulares. El estroma es denso compuesto por células pequeñas,
poligonales o fusiformes con núcleos ovales que recuerdan
a los de la fase proliferativa (Figura 4). Con frecuencia se observan
signos de descamación no menstrual y fragmentación
glándulo-estromal.
Figura 4
Como la proliferación desordenada colinda con la hiperplasia
simple, la diferenciación entre ambas puede ser difícil
aunque probablemente ésta carezca de significado práctico
al tener ambas lesiones una probabilidad muy remota de evolucionar
al cáncer y pueden ser tratadas de la misma manera, sin embargo
en la mayoría de los casos la distinción no es difícil.
La proliferación desordenada se caracteriza por una mezcla
de glándulas normales con otras arquitecturalmente anómalas,
en contraste, las glándulas en la hiperplasia son uniformemente
anómalas y el volumen endometrial es mayor. Está considerándose
en la actualidad desdeñar este término y considerar
estos casos como hiperplasias simples del endometrio.
Debe hacerse también diagnóstico diferencial con
los pólipos endometriales cuyas glándulas pueden mostrar
ligeras anomalías arquitecturales, pero su estroma es usualmente
fibroso, con vasos sanguíneos de paredes gruesas (7,
8).
Hiperplasia endometrial
La inclusión de las hiperplasias dentro de los trastornos
funcionales es controversial, al encontrarse en la frontera entre
las entidades que tienen su origen en un desequilibrio hormonal
y otras como el carcinoma que, pudiendo tener un origen similar
se tornan lesiones primarias autónomas, lo que las excluye
de esta categoría.
Los numerosos estudios realizados en los últimos años
sobre la carcinogénesis endometrial pudieran ayudar a resolver
este dilema. Diversas alteraciones moleculares como mutaciones en
PTEN y ras y la expansión clonal parecen intervenir
en la transformación de una hiperplasia no atípica
en atípica la cual a su vez comparte todas estas alteraciones
con el carcinoma endometrioide de quien se considera precursor.
Especialmente estudios sobre la clonalidad han demostrado que la
hiperplasia atípica es una lesión clonal y que cuando
está asociada a carcinoma ambos derivan del mismo clón.
El endometrio normal y otros tipos de hiperplasia endometrial no
se muestran como clonales, por lo que si se considera la clonalidad
como una prueba de neoplasia, entonces la hiperplasia atípica
pudiera ser vista como una forma de neoplasia no invasiva (19).
Con estas evidencias como base, se propone incluir las hiperplasias
sin atipia dentro del grupo de las alteraciones funcionales de la
fase proliferativa y excluir de esta categoría a la hiperplasia
atípica.
La hiperplasia endometrial es una respuesta proliferativa a la
estimulación estrogénica. Esta proliferación
es anormal y se identifica por cambios en la arquitectura glandular
comparada con la fase proliferativa normal. La atipia nuclear puede
o no estar sobreañadida al patrón estructural anormal.
Puede definirse como una proliferación de glándulas
de tamaño y formas irregulares con un incremento en la proporción
glándula / estroma comparada con el endometrio proliferativo.
El proceso es difuso pero no necesariamente afecta todo el endometrio.
La clasificación vigente más aceptada es la propuesta
por las organizaciones FIGO, ISGP y la OMS (20):
- Hiperplasia sin atipia citológica:
- Simple
- Compleja
- Hiperplasia con atipia citológica:
- Simple
- Compleja
Las pacientes acuden al médico generalmente aquejadas de
sangrado vaginal anormal y excesivo en forma de polimenorrea y también
para ser atendidas por la incapacidad de concebir.
Los grados menores de hiperplasia se caracterizan por dilatación
glandular y evaginaciones saculares del epitelio glandular hacia
el estroma. En los grados mayores las glándulas se hacen
complejas y ramificadas con contornos irregulares e invaginaciones
o pliegues hacia las luces. Además las glándulas se
aglutinan disminuyendo considerablemente el estroma entre ellas
(back-to-back).
La característica más importante a evaluar es la
presencia o ausencia de atipia nuclear. Cuando no hay atipia, los
núcleos están orientados basalmente, tienen contornos
lisos y uniformes, su forma es oval y el aspecto general es similar
a los de las glándulas proliferativas normales.
Las células con atipia nuclear son estratificadas y muestran
pérdida de la polaridad así como un incremento de
la proporción núcleo / citoplasma. Los núcleos
están agrandados, de tamaño y forma irregulares, hipercromáticos,
con la cromatina en gránulos toscos, una membrana nuclear
gruesa y nucleolo prominente. Su forma tiende a ser redondeada comparada
con el núcleo oval de la fase proliferativa y de la hiperplasia
sin atipia. Con frecuencia tienen una apariencia clara o vesiculosa
con condensación de la cromatina alrededor de la membrana
nuclear.
La atipia nuclear es variable tanto cualitativa como cuantitativamente.
No todas las glándulas contienen células atípicas
y en una glándula individual puede haber células atípicas
y no atípicas. Si la atipia es escasa en células aisladas
debe ignorarse, pero si es evidente sin una búsqueda diligente,
debe hacerse el diagnóstico de hiperplasia atípica.
La gradación de la atipia en ligera, moderada y severa es
subjetiva y no reproducible.
El aumento en el grado de complejidad y aglutinamiento glandular
parece aumentar la posibilidad de malignización pero no tanto
como la atipia citológica. La clasificación descrita
anteriormente toma en cuenta tanto las anomalías citológicas
como arquitecturales.
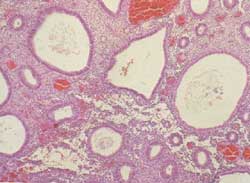
Hiperplasia simple: Su apariencia histológica es
la de un endometrio que está aumentado en volumen y cualitativamente
diferente de un endometrio cíclico normal. Tanto las glándulas
como el estroma participan en el proceso por lo que las glándulas
no están particularmente aglutinadas, son por lo general
uniformemente redondeadas, pero pueden mostrar marcada variación
en su forma y muchas presentan dilatación quística.
En otros casos las glándulas están sólo escasamente
dilatadas y focalmente aglutinadas. El epitelio que las reviste
es seudo estratificado a escasamente estratificado, con células
columnares, mitosis ocasionales y por definición carece de
atipia nuclear. Ocasionalmente las glándulas pueden mostrar
evaginaciones saculares.
El estroma es también reactivo, uniformemente celular, puede
presentar mitosis y contiene vasos sanguíneos pequeños
regularmente distribuidos que recuerdan las arteriolas espirales
vistas en el endometrio secretor tardío o los vistos en los
tumores del estroma endometrial de bajo grado (Figura 5).
Figura 5
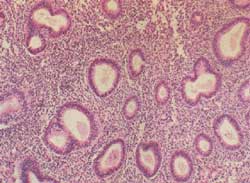
Hiperplasia compleja: Se distingue de la hiperplasia simple
por un mayor grado de proliferación glandular, con acentuada
aglomeración de las glándulas que reduce marcadamente
el estroma ínter glandular, el cual puede estar sólo
representado por pocas células aunque, por definición,
siempre se ven algunas células estromales normales. Usualmente
hay una gran variación en el tamaño y forma de las
glándulas, muchas de las cuales presentan evaginaciones saculares
y brotes laterales así como pliegues intraluminales (Figura
6).
Figura 6
La estratificación epitelial y la actividad mitótica
generalmente se corresponden con el grado de complejidad arquitectural
aunque pueden ser discordantes. La estratificación epitelial
promedia entre dos y cuatro capas de células aunque algunas
glándulas presentan poca o ninguna estratificación.
La actividad mitótica es variable aunque por lo general no
es muy abundante (menos de 5 mitosis por 10 HPF). No hay atipia
celular (7, 20, 21).
Alteraciones de la fase secretora
Faselútea Insuficiente
Usualmente las pacientes se presentan por infertilidad, abortos
a repetición o sangrado anormal frecuentemente a mitad del
ciclo.
Se describen tres patrones histológicos que sugieren el
diagnóstico de fase lútea insuficiente:
Retardo coordinado del desarrollo endometrial: Por las razones
expuestas anteriormente, una biopsia que exhibe un retardo coordinado
del desarrollo endometrial comparado con la fecha cronológica
del ciclo, brinda sólo una evidencia débil de DFL.
Microscópicamente el espécimen puede ser perfectamente
compatible con cualquier etapa de la fase secretora y muestra una
maduración coordinada de glándulas y estroma. El patólogo
debe brindar un diagnóstico descriptivo de una fase secretora
normal independientemente de la FUR. La fuente del diagnóstico
de Fase Lútea Insuficiente en estos pacientes está
en la buena correlación clínico-patológica.
La fecha cronológica del ciclo debe ser óptimamente
establecida, preferentemente por detección ultrasonográfica
de la ovulación, o al menos por la determinación sérica
de la oleada de LH más que por la fecha del último
período o la del próximo, o por la inspección
de la curva de la temperatura basal corporal. Mientras mayor sea
la diferencia entre la fecha histológica y una fecha cronológica
bien determinada, mayor será la probabilidad de identificar
un estado disfuncional. Se recomienda que esta diferencia sea al
menos de tres días y que este resultado se mantenga en dos
o más ciclos (8).
Asincronía glándulo-estromal: Puede ser definida
como una disparidad en la maduración de las glándulas
comparada con la del estroma, debiendo existir una diferencia entre
ambos de al menos dos días. Usualmente es el estroma el que
se encuentra en un estado más avanzado de maduración
por lo que uno puede identificar, por ejemplo, glándulas
con vacuolas subnucleares propias del día 17 del ciclo en
un estroma que contiene arteriolas espirales bien desarrolladas
como se observa en el día 23 (Figura 7). La presencia de
edema estromal es un indicador por si solo poco confiable de maduración
del estroma ya que puede ser un artefacto, por lo que debe usarse
con cautela para el diagnóstico de este trastorno. La biopsia
con una asincronía glándulo-estromal puede ser designada
histopatológicamente como tal independientemente de la fecha
cronológica (8).
Figura 7
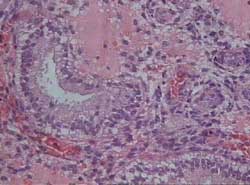
Maduración irregular del endometrio: Se reconoce
por la presencia de fragmentos de endometrio en los que se observa
una maduración sincrónica normal, pero las fechas
histológicas entre diferentes áreas o fragmentos difiere
en al menos dos días (Figura 8). La maduración del
endometrio secretor normal es lo suficientemente uniforme para que
no se identifique una discrepancia de dos días en diferentes
porciones del fundus. La maduración irregular es un patrón
de fase lútea deficiente extremadamente inusual y se debe
ser cuidadoso en no confundir fragmentos del endometrio ístmico
o de la capa basal con áreas de maduración retardada.
Los pólipos pueden ser también fuente de confusión.
El endometrio ístmico es reconocido por la mezcla ocasional
de glándulas de aspecto endocervical y un estroma menos celular
de aspecto fibroso. La capa basal tiene una apariencia prácticamente
invariable, con glándulas de epitelio débilmente estratificado,
con células hipercromáticas, ausencia de secreción
intracitoplasmática y un estroma densamente celular. Los
pólipos por su parte muestran típicamente glándulas
proliferantes en un estroma densamente fibroso con vasos sanguíneos
de mediano calibre de paredes engrosadas.
Figura 8
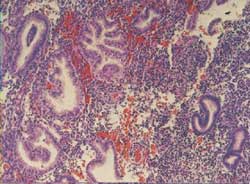
En ocasiones la biopsia endometrial tomada por sospecha de fase
lútea insuficiente muestra una maduración sincrónica
de glándulas y estroma que histológicamente compagina
con la fecha cronológica pero los cambios parecen débilmente
desarrollados. Las glándulas pueden mostrar un diámetro
estrecho, carecer de aspecto aserrado y tener escasa secreción
luminal en la fase intermedia. El significado funcional de estos
hallazgos es incierto pero merece al menos que sea descrito y comentado
en el reporte anatomopatológico (8).
Descamación Irregular del Endometrio
Es una entidad clínico-patológica caracterizada por
un flujo menstrual profuso y prolongado (menorragia) acompañado
en la biopsia de una mezcla de áreas endometriales secretoras,
otras en disociación menstrual y zonas regenerativas.
Las pacientes típicamente se encuentran en su edad reproductiva
media y muestran una fertilidad normal. El flujo menstrual puede
comenzar en el momento adecuado o antes o después de lo esperado
pero por definición continúa por más de cinco
días. El sangrado anormal puede limitarse a un solo episodio
o repetirse en cada ciclo. La patogénesis está relacionada
con alguna forma de sangrado por exceso de progesterona generalmente
producida por un cuerpo lúteo que no involuciona o lo hace
lentamente al final del ciclo menstrual. Es importante que la biopsia
sea tomada cuando el sangrado está bien establecido, aproximadamente
en su quinto día.
El endometrio muestra las características de descamación
menstrual sobre impuestas a una estimulación progestágena
mantenida, dando una apariencia histológica que puede ser
difícil de interpretar. El estroma muestra áreas de
transformación predecidual con numerosos granulocitos, mientras
que en otras se puede observar la hemorragia y fragmentación
propias de la menstruación. Las arteriolas espirales pueden
ser prominentes. Muchas glándulas por su parte pueden mostrar
actividad secretora pero la característica más llamativa
de este trastorno es la presencia de glándulas de aspecto
estrellado con luces estrechas debido al encogimiento del estroma
circundante (Figura 9). En algunos sitios puede verse el fenómeno
de Arias-Stella sobre todo en casos consecutivos a un evento gestacional.
Con cierta frecuencia pueden observarse zonas de endometrio en regeneración
que recuerdan a la etapa proliferativa temprana.
Figura 9
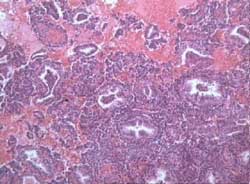
Esta bizarra combinación de apariencias es la que debe alertar
al patólogo sobre la posibilidad de una descamación
irregular del endometrio (6, 8, 14, 15).
En el momento en que este trastorno fue descrito, se consideró
un problema frecuente que causaba aproximadamente del 10 al 17%
de los casos de sangrado uterino disfuncional. Se describió
en el primer ciclo ovulatorio posterior a un embarazo intra o extrauterino,
mola hidatidiforme o aborto, también relacionado a poliovulación
espontánea o con terapia anticonceptiva o progestágena.
En la actualidad sin embargo ocupa un lugar limitado en el campo
de la ginecopatología, es un diagnóstico que requiere
una historia específica de sangrado menstrual por más
de cinco días y probablemente, esté restringido a
ese evento bastante raro de un cuerpo lúteo aberrante con
función persistente. Posiblemente la mayoría de los
casos de descamación irregular en la etapa reproductiva se
deban a los llamados abortos menstruales. Aproximadamente del 50
al 60% de los huevos fecundados son abortados en el ciclo de la
fecundación pudiendo quedar algunas células trofoblásticas
implantadas en la pared uterina, las cuales producen ciertas cantidades
de gonadotropinas coriónicas (hCG) que mantienen la actividad
del cuerpo lúteo más allá de su duración
normal. En las mujeres peri climatéricas, el fenómeno
pudiera estar en relación con tratamientos hormonales mal
llevados. Obviamente se necesitan nuevos estudios con el propósito
de aclarar aún más la patogenia de esta condición
(6, 8, 14, 15, 22).
Arriba
CONSIDERACIONES FINALES
La intención de este trabajo es la de proponer una guía
lo más sencilla, práctica y didáctica posible
que oriente al ginecólogo y al patólogo en el ejercicio
diagnóstico, en el que siempre debe tenerse presente que:
- Los desórdenes funcionales del endometrio, expresándose
ya sean como infertilidad, sangrado anormal o ambos constituyen
el trastorno básico en la mayoría de las mujeres
que acuden al ginecólogo en edad fértil.
- El diagnóstico de los mismos es siempre de exclusión
después de haberse descartado todas las demás causas
que pueden también provocar estas anomalías. Debe
evitarse aplicar el rótulo de trastorno disfuncional sin
antes haber realizado una investigación exhaustiva de la
paciente.
- Es de vital importancia la estrecha colaboración entre
ginecólogos y patólogos en la valoración
de cada caso.
- En muchas ocasiones existe poca correlación entre la
sintomatología y la morfología endometrial y que
el mismo cuadro histológico puede ser consecutivo a un
trastorno no funcional lo que enfatiza la importancia de los antecedentes
clínicos.
Arriba
BIBLIOGRAFÍA
- García D. Editorial: Patología Endometrial ¿por
qué no?. Revista Médica Electrónica. Matanzas.
Vol. 23. Número 3. 2001.
- García D y col. Importancia de la información
clínica en el diagnóstico de la biopsia endometrial.
Revista Médica Electrónica. Matanzas. Vol. 22. Número
2. 2000.
- García D y col. Mejorando la solicitud de biopsia endometrial.
Revista Médica Electrónica. Matanzas. Vol. 23. Número
1. 2001.
- Lászlo J; Gaál M. Gynecologic Pathology. Akadémiai
Kiadó. Budapest. Chapter V; p. 155. 1969.
- Novak ER. Tratado de Ginecología. Novena edición.
Edición Revolucionaria. La Habana. Cap. 31; p. 671. 1977.
- Anderson MC. Female Reproductive System. Systemic Pathology.
3 ed. Churchill Livingstone. Chapter 10; p. 147. 1991.
- Kurman RJ; Mazur MT. Benign Diseases of the Endometrium, en
Blaustein´s Pathology of the Female Genital Tract. 4 ed.
Springer-Verlag. New York. Chapter 10; p. 367. 1994.
- Zaino RJ. Interpretation of Endometrial Biopsies and Curettings.
Biopsy Interpretation Series. Lippincott-Raven. Chapters 5, 6,
9; p 100-239. 1996.
- Munro MG. Dysfunctional uterine bleeding: advances in diagnosis
and treatment. Curr Opin Obstet Gynecol, Oct; 13 (5): 475-89.
2001.
- BravenderT, Emans SJ. Menstrual disorders. Dysfunctional uterine
bleeding. Pediatr Clin North Am, Jun; 46 (3): 545-53. 1999.
- Apgar BS. Dysmenorrea and dysfunctional uterine bleeding. Prim
Care, Mar; 24 (1): 161-78. 1997.
- Bayer SR, De Cherney AH. Clinical manifestations and treatment
of dysfunctional uterine bleeding. JAMA, Apr 14; 269 (14):1823-8.
1993.
- González-Merlo J, Márquez Ramírez M. Patología
del Endometrio. Editorial Científico-Médica, Madrid.
Capítulo 5; p. 101. 1972.
- Dallenbach-Hellweg G. Histopathology of the endometrium. 3 rd
ed. New York: Springer-Verlag. p 94. 1981.
- Dallenbach-Hellweg G, Poulsen H. Atlas of Endometrial Pathology.
Second ed. Berlin. Springer-Verlag. p. 53. 1996.
- De Brux J. Histopatología Ginecológica. Segunda
edición. Edición Revolucionaria. La Habana. Cap.
VI; p. 174. 1983.
- Speroff L. Menstruación normal y anormal. En Diagnóstico
y Tratamiento Ginecoobstétricos. Ed. Ralph C. Benson. El
Manual Moderno. México DF. 4ta ed. Cap. 6. p 135. 1986.
- Vakiani M et al. Histopathological findings of the endometrium
in patients with dysfunctional uterine bleeding. Clin Exp Obstet
Gynecol, 23 (4): 236-9. 1996.
- Sherman ME. : Theories of endometrial carcinogenesis: A multidisciplinary
approach. Mod Pathol 2000; 13 (3): 295-308.
- Silverberg SG, Kurman RJ. Tumors of the uterine corpus and gestational
trophoblastic disease. Atlas of Tumor Pathology, Third Series,
Fascicle 3. Washington DC, Armed Forces Institute of Pathology;
p 13. 1992.
- Silverberg SG. Problems in the differential diagnosis of endometrial
hyperplasia and carcinoma. Mod Pathol 2000; 13 (3): 309-327.
- Nogales F. Comunicación personal. 2002.
Arriba
--------------------------------------------------------------------------------
|