|
 PATOLOGÍA
HEMATOLINFOPOYÉTICA PATOLOGÍA
HEMATOLINFOPOYÉTICA
Prof. Israel Borrajero Martínez
Presidente de la Sociedad Cubana de Anatomía Patológica.
Jefe del Departamento de Anatomía Patológica.
Hospital C.Q. Hermanos Ameijeiras.
San Lázaro No.701. Municipio Centro Habana. Ciudad Habana.
Cuba.
Introducción
Las enfermedades y procesos patológicos de los ganglios
y de la médula ósea, han constituido y aun constituyen
para los patólogos generales un campo problemático
por varias razones:
En primer lugar porque en muchos de los programas de formación
de los residentes de Anatomía Patológica esta temática
no se desarrolla siempre de forma rigurosa y los patólogos
se gradúan de especialistas con deficiencias teóricas
y prácticas en esa esfera, en segundo lugar porque la información
clínica y evolutiva de los casos y la correlación
clínico-hematológica de rigor no siempre se efectúa
adecuadamente en los Servicios y en tercer lugar porque los requerimientos
para el estudio de estos tejidos en cuanto a calidad y representatividad
de la muestra y el procesamiento técnico de rutina no siempre
se realizan con la calidad necesaria.
Por otra parte la patología linfoide y hematopoyética
es una rama con gran dinamismo, en cuanto a estudios básicos,
experimentales y clínicos en todo el mundo y como consecuencia
las clasificaciones de los procesos, los mecanismos patogénicos,
y los procederes terapéuticos, han variado considerablemente
en los últimos 30 años.
La tecnología a aplicar en estos estudios también
se ha hecho compleja, con la participación de varias especialidades
y ramas tecnológicas como la inmunología, la genética,
la biología molecular y la inmunohistoquímica.
Como consecuencia de todos estos factores esta rama de la patología
genera dificultades para los patólogos que se enfrentan a
una demanda creciente de los Servicios de Clínica, Hematología
y Oncología para el estudio y conclusión de los casos.
Durante muchos años el diagnóstico de las enfermedades
de la médula ósea y las diferentes hemopatías
se concluían en base a la clínica, a los estudios
de sangre periférica, la evaluación de los medulogramas,
la aplicación de técnicas de histoquímica enzimática
y la extensión de estos procesos a otros órganos y
tejidos.
Pero en los últimos 30 años la práctica de
la biopsia de médula ósea se ha introducido y extendido
considerablemente y ya constituye un examen de rutina obligado en
una extensa relación de afecciones linfohematológicas
de todo tipo.
La patología linfoide de estructuras nodales y extranodales
ha tenido también sus dificultades derivadas de iguales factores,
que en el estudio de la médula ósea.
Ambos tejidos, el medular y el linfoide son altamente sensibles
a las deficiencias técnicas del manejo en cualquiera de sus
etapas.
Entre estas deficiencias las más frecuentes son:
-muestras muy pequeñas, insuficientes, fragmentadas o no
representativas
-trauma de la muestra en la obtención, desecación
o hidratación o fijación tardía
-fijador no adecuado , no tamponado o excesivamente prolongado
-descalcificación insuficiente, excesiva o no suficientemente
lavada
-deshidratación insuficiente
-temperatura excesiva de la parafina o del baño histológico
-cortes gruesos o con estrías
-coloración irregular o no bien contrastada
El logro de la maestría en la obtención de las muestras,
una calidad de procesamiento técnico satisfactoria, incluyendo
los cortes semifinos y la microscopía óptica de alta
resolución, la Microscopía electrónica en los
casos requeridos, la Inmunohistoquímica como tecnología
de rutina obligada, el aporte de la Biología molecular y
el reordenamiento genético, los progresos de la hematología
clínica con enfoques interdisciplinarios y la constante correlación
clínico-hematológica, han fomentado un avance considerable
en el estudio y diagnóstico de estas enfermedades y procesos
que afectan el tejido linfohematopoyetico.
El patólogo comprometido con este campo de la patología
tiene que profundizar y manejar toda esta problemática relacionada
con los aspectos tecnológicos, clínicos e histopatológicos
de los procesos y mantenerse actualizado al respecto.
El desarrollo acelerado de la Medicina en los últimos años
en cuanto a nuevos procederes diagnósticos y terapéuticos
así como el surgimiento de enfermedades, emergentes o reemergentes,
de origen infeccioso, tóxico o de otra causa, han tenido
y tienen una gran repercusión en el sistema linfohematopoyético
en el orden funcional y estructural de sus órganos que se
expresan en los estudios cito o histopatológicos.
Arriba
Patología Hemolinfopoyética.
Condicionales Necesarias
- Calidad de la Muestra
- Representatividad
- Cantidad
- Manejo
- Calidad de la Técnica.
- Fijación
- Descalcificación
- Procesamiento
- Técnicas de Rutina: H/E, PAS, Retículo, Perl´s,
Luna
- Técnicas Especiales
- Inmunotinción para Serie Mieloide, Serie Linfoide,
Serie Megacariopoyética
- Microscopía Electrónica
- Biología Molecular y Citogenética
- Calidad Diagnóstica Anatomopatológica
- Patólogo entrenado
- Tiempo de observación
- No apresuramientos
- No concesiones
- Hematólogo Entrenado
- Valoración Clínica
- Valoración Imagenológica
- Valoración Humoral
- Valoración del Medulograma
- Correlación Clínico-Hematopatológica
- Trabajo en equipo
- Discusión sistemática de los casos difíciles
- Filosofía del seguimiento y la evolución
- Ante dudas o discrepancias repetir el examen
Arriba
Material y Métodos
Se revisaron todas las BMO procesadas en el Departamento de Anatomía
Patológica del Hospital Clínico-Quirúrgico
“Hermanos Ameijeiras” (HHA) entre Enero del año
2000 y Mayo del 2002, y además las recibidas para consulta
en el Centro Nacional de Referencia de Anatomía Patológica
(CENRAP) desde el año 1997 hasta Mayo del 2002. Se recopilaron
solo datos esenciales para la investigación: motivo por el
cual se le realizó la BMO, resultado del Medulograma (MG)
y diagnóstico emitido en la BMO. La BMO fue hecha por personal
médico especializado en Hematología en la cresta ilíaca
superior y posterior utilizando preferentemente agujas de Jamshidi
y no otro tipo de aguja para evitar fragmentación y artefactos
de compresión del tejido medular que dificultan la interpretación
histológica. El cilindro obtenido ideal debe tener más
de 1 cm. de longitud en Pediatría y ser mayor de 2cm. en
los adultos. Posteriormente a la BMO las muestras obtenidas fueron
fijadas en formol neutro al 10% por un mínimo de 10 horas,
se descalcificaron en solución a partes iguales de ácido
nítrico al 7% y después de lavado en agua corriente
se sometió el tejido a su procesamiento e inclusión
en parafina. Se realizaron además de la coloración
de rutina de Hematoxilina/Eosina(H/E) (para evaluar la celularidad
y citología medular) las siguientes tinciones de Histoquímica
especial: Perl´s ( para evaluar depósito de hierro
), PAS ( para determinar incremento celular de glucógeno
e infecciones ), Retículo ( para fibras de reticulina y mielofibrosis
) y Luna ( para eosinófilos )
Consideramos material útil para diagnóstico
cuando existieron al menos 5 espacios medulares arquitecturalmente
bien preservados sin distorsión ni aplastamiento. Informamos
material inadecuado para interpretación en aquellos
casos donde la biopsia estuvo constituida por otro tejido y no por
MO o la muestra era pequeña y/o hemorrágica. Concluimos
material insuficiente cuando la cantidad de tejido fue escaso
para interpretación.
Al finalizar la recolección de datos realizamos una distribución
en tablas por Grupos con similitud morfológica y/o clínica,
esto nos permitió realizar la comparación diagnóstica
entre el resultado del MG y la BMO partiendo de la base, que el
diagnóstico de esta ultima fue concluyente.
Posteriormente comparamos ambos procederes a través del
índice: Total de casos diagnosticados en las BMO / Total
de casos con igual diagnóstico en el MG.
Seguidamente analizamos puntualmente los resultados de cada tabla
y conocedores de los resultados numéricos y de los hallazgos
que de estos se desprenden decidimos conformar tres Categorías
acorde a la utilidad de la BMO:
Indispensable (Máxima Utilidad) : Cuando el diagnóstico
se realiza por la BMO y no por el MG.
Necesaria: Cuando el diagnóstico, Sugestivo, ya se
había realizado anteriormente por el MG. En este caso el
valor está dado porque la BMO permite confirmar, clasificar
y estadiar el proceso (Estadiamiento)
Complementaria: Cuando el diagnóstico que se realizó
en la BMO ya era Concluyente por el MG. En estos casos la BMO es
un valioso auxiliar para la adecuada clasificación del proceso
específico.
Por último, ilustramos los casos más representativos
de nuestra casuística.
Arriba
Resultados:
Acorde a las Categorías de Utilidad de la BMO antes mencionadas
Indispensable, Necesaria y Complementaria distribuimos
la muestra entre ellas como sigue:
Categoría INDISPENSABLE con un diagnóstico
sospechado en el MG menor de un 40% integrada por:
- Enfermedad de Hodgkin (Figura 1)
- Histiocytosis (Figura 2)
- Metástasis (Figura 3)
- Mielofibrosis (Figura 4)
Figura 1
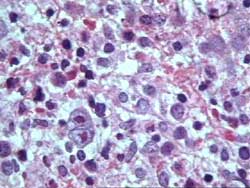
Figura 2
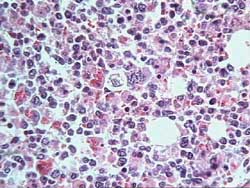
Figura 3
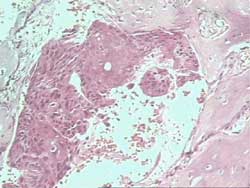
Figura 4
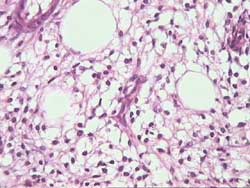
Categoría NECESARIA con diagnóstico sospechado
o concluyente en el MG entre 40% y 70% (zona gris) integrada por:
- LNH de bajo grado (Figura 5)
- LNH de alto grado (Figura 6)
Figura 5
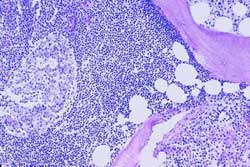
Figura 6
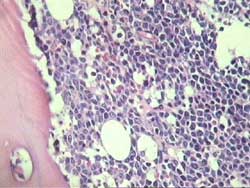
Categoría COMPLEMENTARIA con un por ciento de diagnóstico
concluyente en el MG mayor de 70% integrada por:
- Discrasias de Células Plasmáticas (Figura 7)
- Enfermedad Mieloproliferativa Crónica/SMPC (Figura 8)
- Leucemias Agudas y Síndromes Mielodisplásticos
(Figura 9)
- Hemopatías no malignas (Figura 10)
- Alteraciones de la Celularidad (Figura 11)
Figura 7
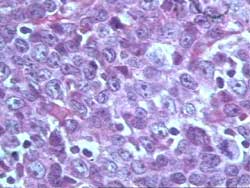
Figura 8
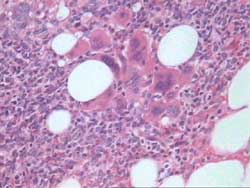
Figura 9
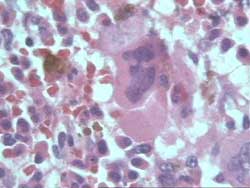
Figura 10
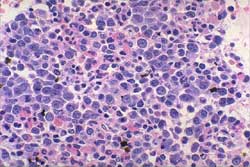
Figura 11
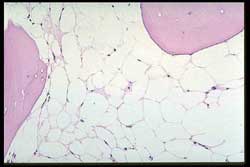
El grupo de entidades dentro de la categoría indispensable
se diagnosticaron o sospecharon por el medulograma en un 19.7%.
Como puede observarse todos los casos de Enfermedad de Hodgkin,
Histiocitosis y Granulomatosis corresponden a diagnósticos
de la BMO
El porciento de diagnósticos por medulograma de las entidades
dentro de la categoría necesaria fue de un 72.6% , no hubo
grandes diferencias en cuanto al diagnóstico de los linfomas
no Hodgkin de alto y bajo grado, siendo ligeramente mas elevado
el número de casos de alto grado diagnosticados por medulograma.
La categoría complementaria, es la que mayor número
de casos incluye con un total de 1187, siendo el mas elevado porcentaje,
92.9% de casos sospechados o concluidos. Las enfermedades incluidas
en este grupo habitualmente se diagnostican por el medulograma y
la BMO complementa el diagnóstico al permitir una adecuada
clasificación y estadiamiento. Dentro de ellas, las biopsias
correspondientes a comportamiento de la celularidad, 867, representa
algo mas de la mitad de la muestra total (52.4%). Nos explicamos
esta gran incidencia de biopsias de médula ósea normales,
hiper o hipocelulares y reactivas porque la indicación no
solo es realizada por el Servicio de Hematología sino que
en nuestra Institución constituye un arma diagnóstica
empleada por todos los Servicios del Hospital en mayor o menor grado.
Resumiendo, consideramos que la BMO siempre es útil de una
u otra forma y en manos expertas representa un pilar importante
en el diagnóstico de las hemolinfopatías malignas
y no malignas.
Arriba
Bibliografía
1-Rosas Uribe A, De Lima M et al. La Biopsia por punción
de la Médula Ósea en patología quirúrgica:
I Normal y no neoplásica. 2do Curso de Patología.
San Sebastian 1990.
2-Frisch B, Lewis SM, Burkhardt R. Biopsy Pathology of Bone and
Bone Marrow. Biopsy Pathology Series. Chapman and Hall Medical 1985.
3-Burkhardt R, Frisch B et al. Bone Marrow biopsy in hematologic
disorders. J. Clin Pathol 1982;35:257-84.
4-Brunning RD, McKenna RW. Tumors of the Bone Marrow. Atlas of
Tumors Pathology. AFIP. Third Series. Fascicle 14, Washington, DC,
1994.
5-Bearden JD, Ratkin GA et al. Comparison of the diagnostic value
of bone marrow biopsy and bone marrow aspiration in neoplastic disease.
J Clin Pathol 1974;27:738-740.
6-Wang J, Weiss LM. Diagnostic utility of bilateral bone marrow
examination: significance of morphologic and ancillary technique
study in malignant.Cancer. 2002 Mar 1;94(5):1522-31.
7-Brunning, RD. Bone Marrow. In Ackerman´s Surgical pathology.
J.Rosai Ed. The C.V. Mosby Co St. Louis, Toronto, Washington D.C
1989, pp.1379-1453.
8-Block M. Bone marrow examination, aspiration or core biopsy,
smear or section, hematoxilin-eosin or Romanowsky Stain wich combination?.
Arch path Lab Med 1976;100: 454-6.
9-Goldenberg AS, Tiesinga JJ. Clinical experiencie with a new specimen
capturing bone marrow biopsy needle. Am J Hematol 2001 Nov;68(3):189-93.
10-Harris NL, Jaffe ES et al. A revised European-American classification
of lymphoid neoplasms: a proposal from international lymphoma study
group. Blodd 1994; 84:1361-92.
11-Warnke RA, Weiss LM, Chan KC et al. Tumors of the Lymph nodes
and Spleen. Atlas of Tumors Pathology. AFIP. Third Series. Fascicle
14, Washington, DC, 1994.
12- Jancar J.Progress in the classification of myeloid and lymphoid
neoplasm. From REAL to WHO concept. Adv Clinc Pathol 2002 Apr;4(2):59-76.
13- Arber DA. Realistic pathologic classification of acute myeloid
leukemia. Am J Clin Pathol 2001, Apr;115(4):552-60.
14-Chan JK. The New World Health Organization classification of
Lymphomas: The past, the present and the future. Hematol Oncol 2001
Dec;19(4):129-50.
15-Harris NL, Jaffe ES, Diebold J. The World Health Organization
of neoplasms of the hematopoietic and lymphoid tissues: report of
the Clinical
Advisory Committee meeting-Airlie House, Virginiea, November, 1997.
Hematol J 2000;1(1):53-66.
16-Chen H et al. Clinicopathological studies on bone marrow involvement
of non-Hodgkin's lymphoma. Zhonghua Zhong Liu Za Zhi. 2000 Nov;22(6):513-5.
17-Oudat R et al. Significance of the levels of bone marrow lymphoid
infiltrate in chronic lymphocytic leukemia patients with nodular
partial remission. Leukemia 2002 Sep;16(10):167-220.
18-Alvaro Naranjo, Bosch Princep R et al. 5to Curso de Hematopatología.
Tortosa 13-14 Nov 1998.
19-Nowell PC. Studies of normal and neoplastic lymphocytes. Immunol
Rev. 2002;185(1):220-6.
20-Alvaro Naranjo T, Bosch Princep R et al. 3er Curso de Hematopatología.
Tortosa 8-9 Noviembre 1996.
21-Buckley RH. Primary immunodeficiency diseases: diseectors of
the immune system. Immunol Rev. 2002 Jul;185(1):206-19.
22-Luther JM et al. Utility of bone marrow biopsy for rapid diagnosis
of febrile illnesses in patients with human immunodeficiency virus
infection. South Med J. 2000 Jul;93(7):692-7.
23-Milosevi R. Histopathologic characteristics of bone marrow in
patients with aplastic anemia. Srp Arh Celok Lek. 2000 May-Jun;128(5-6):200-4.
24-Hsu HC, Lee YM, Su WJ. Bone marrow samples from patints with
aplastic anemia are not infected with parvovirus B19 and Mycobacterium
tuberculosis. Am J Clin Pathol 2002 Jan;117(1):36-40.
25-Thomas X, Le Q, Danai C et al. Bone marrow biopsy in adult acute
lymphoblastic leukemia: morphological characteristic and contribution
to the study of prgnostic factors. Leuk Res 2002 Oct;26(10):909.
26-Bhatnagar S, Chandra J, Narayan S. Hematological changes and
predictors of bone marrow recovery in patients with neutropenic
episodes in acute lymphoblastic leukemia. J Trop Pediatr 2002 Aug;48(4):200-3.
27-Konopleva M, Konoplev S. Stromal cell prevent apoptosis of LMA
cell by up-regulation of anti-apoptotic proteins. Leukemia 2002
Sep;16(9):1713-24.
28-Myelodysplastic Syndromes. Hematology-Oncology Clinical Management
Volume 05-2001 Medscape, Inc.
29-Nigans S et al. Clinical, hematological and histomorphological
profile of myelodysplastic syndrome.J Assoc Physicians India. 2001
Apr;49:430-4.
30-Ribatte D, Polimeno G, Vacca A. Correlation of bone marrow angiogenesis
and mast cell with tryptase activity in myelodysplastic syndromes.
Leukemia 2002 Sep;16(9):1680-4
31-Thiele J,et al. Chronic myeloproliferative disorders. The new
WHO classification.Pathologe. 2001 Nov;22(6):429-43.
32-Tsuboi K, komatsu H et al. Lymphoid blastic crisis of chronic
myelogenous leukaemia with inv(16)(p13;q22). Leuk Res. 2002 Aug;26(8):771.
33- Comenzo RL. Primary systemic amyloidosis. Curr Treat Options
Oncol 2000 Apr;1(1):83-9.
34-Munshi NC, Wilson C. Increased bone marrow microvessel density
in newly diagnosed multiple myeloma carries a poor prognosis. Sem
Oncol 2001 dec;28(6):565-9.
35-Gomez-Almaguer D, Ruíz-Arguelles GJ, et al. Role of bone
marrow examination in staging Hodgkin´s disease:expirience
in Mexico. Clin Lab Haematol 2002 Aug;24(4):221-3.
36- West RB, Warnke RA, Natkunam Y. The usefullness of immunohistichemistry
in the diagnosis of follicular lymphoma in bone marrow biopsy specimens.
Am J Clin Pathol 2002 Apr;117(4):636-43.
37-Vega F, Medeiros LJ, Bueso-Ramos C et al. Hepatosplenic gamma/delta
T cell lymphoma in bone marrow. A sinusoidal neoplasm with blastic
cytologic features. Am J Clin Pathol 2001 Sep;116(3):410-9
38-Brunning RD, Bloomfield CD. Bilateral trephine bone marrow biopsy
in lymphoma and other neoplastic disease. Ann Int Med 1975;82:365-6.
2002 Mar 1;94(5):1522-31.
39-Medini Manai Z, Meddeb B et al. Hairy cell leukemia: report
of 8 cases.Tunis Med. 2001 Dec;79(12):681-5.
40-Kent SA, Variakojis D, Peterson LC. Comparative study of marginal
zone lymphoma involving bone marrow. Am J Clin Pathol 2002 May;117(5):698-708.
41-Pangalis GA, Vassilakopoulus TP, Dimopoulou MN. B-chronic lymphocytic:
practical aspect. Hematol Oncol. 2002;20(3):103-46.
42-Cline MJ. Histiocytes and histiocytosis. Blood 84:2840-53,1994
43-Luis S. Diagnosis and treatment of tuberculosis of bone marrow.Zhonghua
Jie He He Hu Xi Za Zhi. 1998 Sep;21(9):559-61.
44-Bogoeva B et al. Immunohistochemical and ultrastructural features
of Gaucher's cells--five case reports.Acta Med Croatica. 2001;55(3):131-4.
45-Rao RD,Morice WG. Hemophagocytosis in a patient with chronic
lymphocytic leukemia and histoplasmosis.Mayo Clin Proc. 2002 Mar;77(3):287-90.
46-Allory Y et al. Bone marrow involvement in lymphomas with hemophagocytic
syndrome at presentation: a clinicopathologic study of 11 patients
in a Western institution.Am J Surg Pathol. 2001 Jul;25(7):865-74.
47-Allory Y et al. Bone marrow involvement in lymphomas with hemophagocytic
syndrome at presentation: a clinicopathologic study of 11 patients
in a Western institution. A J Surg Pathol 2001 Jul;25(7):865-74.
48-Kousimi K et al. The hemophagocytic syndrome in prostate cancer
revealed by disseminated carcinomatosis of the bone marrow. J Urol
2002. Sep;168(3):1101-2.
49-Vagunda V et al. Bone marrow micrometastases in patients with
stage I-II localised prostate cancer.Eur J Cancer. 2001 Oct;37(15):1847-52.
50- Anner RM, Drewinko B. Value of the bone marrow involvement
by metastatic solid tumors. Cancer 1977;39:1337-44.
51-McCarthy DM. Fibrosis of the bone marrow: content and causes.
Br J Hematol 1985;59:1-7
52-Kiss E, et al. Myelofibrosis in systemic lupus erythematosus.Leuk
Lymphoma. 2000 Nov;39(5-6):661-5.
53-Akin C, Jaffe ES et al. An immunohistochemical study of the
bone marrow lesions of systemic mastocytosis: expression of stem
cell factor by lesional mast cell. Am J Clin Pathol 2002 Aug;118(2):242-7.
54- Bass RD, Pullarkat V et al. Pathology of autoimmune myelofibrosis.
A report of three cases and a review of the literature. Am J Clin
pathol 2001 Aug;116(2):211-6.
55-Norgard MJ, Carpenterr JT. Bone marrow necrosis and degeneration.
Arch Int med 1979 :139:905-911.
Arriba
--------------------------------------------------------------------------------
|