| Información || Congresos || Cursos || Territoriales || Noticias || Patología || Telepatología |
Pamplona 16 de diciembre de 2005
H.U. MARQUÉS DE VALDECILLA. Santander (Cantabria)
C. González-Vela, I. Belaustegui, J.J. Gómez Román, F. Val-Bernal, F. Arce, S. Hermana.
TUMOR MIOFIBROBLÁSTICO INFLAMATORIO EN LA PIEL ASOCIADO AL VHH-8.
RESUMEN DE HISTORIA CLÍNICA
Varón de 10 años de edad que presentó una lesión indurada no dolorosa en el brazo izquierdo de 6 meses de evolución. No tenía antecedentes de traumatismo, intervenciones quirúrgicas previas ni picaduras de artrópodos. No tenía linfadenopatías ni síntomas constitucionales ni datos de laboratorio relevantes. Se extirpó completamente la lesión y se envió para estudio histopatológico.
DESCRIPCIÓN MACROSCÓPICA
La pieza quirúrgica medía 7 x 7 x 4 mm. y estaba constituída por piel y tejido subcutáneo. La piel estaba ligeramente elevada y al corte mostraba un nódulo en la dermis esférico, de coloración blanco-grisácea y de consistencia firme.
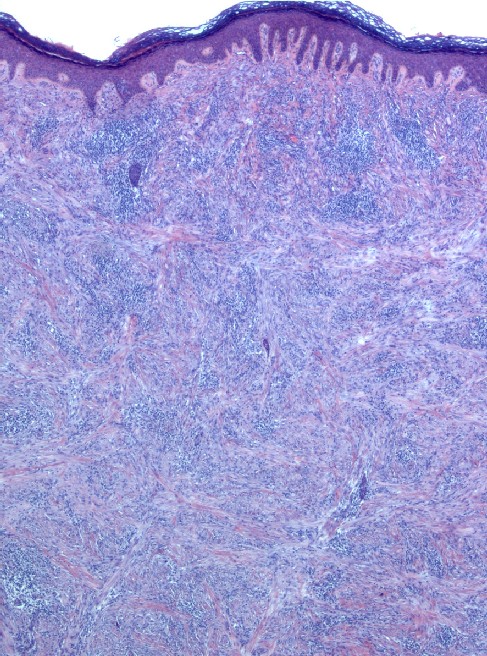
DESCRIPCIÓN MICROSCÓPICA
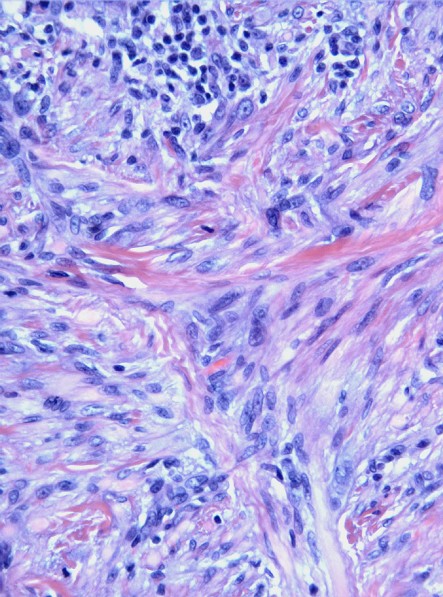
Microscópicamente, el nódulo estaba bien delimitado, no encapsulado, localizado en la dermis y sin extensión al tejido subcutáneo. El tumor estaba compuesto por proliferación de células fusiformes entremezcladas con células inflamatorias. Las células fusiformes tenían núcleos ovalados o elongados, vesiculares, con nucleolos pequeños y citoplasma claro. El componente inflamatorio estaba distribuido de manera difusa aunque también tendía a formar nódulos y mostraba abundantes linfocitos pequeños y células plasmáticas. La microscopía con luz polarizada para material extraño y las tinciones para hongos y bacilos fueron negativas.
INMUNOHISTOQUÍMICA
Las células fusiformes fueron reactivas para vimentina, actina de músculo liso, desmina y focalmente para IL-6.
pan CK, CD34, CD99, ALK, CD68, CD31, S-100, CD1a, factor XIIIa, mioglobina y CNA42 resultaron negativas.
Las tinciones IHQ demostraron la presencia de células plasmáticas y linfocitos maduros, que eran T (CD3 +) y B (CD20 +) en proporciones similares.
Se detectaron secuencias de DNA del VHH-8 mediante PCR. Tres tripletes que corresponden a tres regiones diferentes no solapadas del genoma del VHH-8. El control positivo era un caso de sarcoma de Kaposi. La última calle representa el control negativo.
DIAGNÓSTICO
Tumor Miofibroblástico Inflamatorio en la piel asociado al VHH-8.
DISCUSIÓN
El TMI o PI es una proliferación de células fusiformes con un doble componente fibroinflamatorio característico.
Se sabe que ocurre en casi cualquier localización pero sólo se han descrito algunos casos en la piel (tabla).
En esta tabla recogemos los datos de los 12 casos publicados y el que os presentamos hoy aquí. Las lesiones pueden aparecer en distintas edades y tanto en hombres como en mujeres. Clínicamente, se presentan como nódulos solitarios, firmes, dérmicos o dérmico-subcutáneo o como tumores exofíticos rojo-parduzcos y ulcerados que varían de tamaño entre 7 y 85 mm. Y se localizan con mayor frecuencia en las extremidades. Aproximadamente la mitad de los casos eran puramente dérmicos, y en la mitad afectaba a la dermis y al tejido subcutáneo. Ninguno de los 12 casos presenta síntomas constitucionales, recurrencia local o afectación linfática.
El TMI debe ser diferenciado del linfoma maligno cutáneo, la enfermedad de Castleman, el tumor folicular de células dendríticas, la hiperplasia angiolinfoide con eosinofilia (hemangioma epitelioide) y la enfermedad de Kimura:
1. linfoma maligno cutáneo: la diferencia principal radica en la monoclonalidad de las células tumorales, a diferencia del infiltrado polimorfo del TMI.. Además, está peor delimitado que éste.
2. enf de Castleman: hiperplasia linfoide poco frecuente que afecta predominantemente el mediastino en personas jóvenes que sólo se presenta ocasionalmente en la piel.
3. tumor folicular de células dendríticas: CD21 + (no en TMI).
4. hiperplasia angiolinfoide con eosinofilia (hemangioma epitelioide) y enfermedad de Kimura:
a. la 1ª llega a tejido profundo y tiene un componente vascular llamativo dispuesto en lóbulos y con células de aspecto epitelioide. El infiltrado inflamatorio contiene eosinófilos.
b. La enf de Kimura se presenta con eosinofilia, bordes mal definidos, centros germinales con vénulas de endotelio alto, presencia de eosinófilos y esclerosis.
Histológicamente, el TMI de la piel debe ser diferenciado también de:
- otras neoplasias cutáneas de células fusiformes, como el dermatofibroma (hiperplasia epidérmica, mal circunscrito, “keloidización” del colágeno y depósito de hemosiderina), miofibromatosis (no infiltrado inflamatorio), dermatofibrosarcoma protuberans (difuso, llega a tejido subcutáneo, no infiltrado inflamatorio), fibrosarcoma inflamatorio, tumor fibroso solitario y la fascitis nodular.
El aspecto histológico y el perfil IHQ son útiles para diferenciarlos.
- Además, el diagnóstico diferencial debe incluir también procesos infecciosos, reacciones a cuerpo extraño y la vasculitis crónica fibrosante.
ETIOPATOGENIA
La etiopatogenia y el comportamiento biológico del TMI no están claros. Hay controversia acerca de la patogénesis, si es un proceso reactivo exagerado ante determinados estímulos antigénicos o si es una verdadera neoplasia.
Por un lado, se sabe que el VHH-8 es capaz de codificar proteínas homólogas de proteínas reguladoras del ciclo celular y proteínas de señalización, como bcl-2, ciclina D1 e IL-6.
Por otra parte, los miofibroblastos son un componente fundamental en la curación de las heridas y están regulados por citokinas y factores de crecimiento, de los cuales la IL-6 es uno de los más importantes. El componente celular primordial del TMI son las células fusiformes miofibroblásticas.
La IL-6 viral produce activación celular y secreción de IL-6 humana, que provoca estimulación autocrina y, por medio de receptores de membrana, activa señales de transducción y activación del ciclo celular.
En TMI las partículas virales y la sobre-expresión de CK humanas probablemente favorecen la reactivación localizada de la replicación viral que puede conducir a la auto-perpetuación de la neoplasia miofibroblástica.
PRONÓSTICO
El potencial biológico de esta lesión es difícil de predecir con exactitud. No se ha descrito un comportamiento maligno en la piel. La extirpación local parece un adecuado manejo del TMI cutáneo. No hay casos de recurrencia local. Si los hubiere, desaparecerían también los síntomas generales.
BIBLIOGRAFÍA
1. Weiss SW. Histopatological typing of soft tissue tumors, 2 ed. New York: Springer-Verlag; 1994;48.
2. Coffin CM, Watterson J, Priest JR, Dehner LP. Extrapulmonary Inflamatory Myofibroblastic Tumor (Inflamatory Psuedotumor). A clinicopathologic and immunohistochemical study of 84 cases. Am J Surg Pathol 1995; 19(8):859-872.
3. Hurt MA, Santa Cruz DJ. Cutaneous inflammatory Pseudotumor or Plasma Cell Granulomas of extracutaneous sites. Am J Surg Pathol 1990;14(8):764-773.
4. Vadmal MS, Pellegrini AE. Inflammatory Myofibroblastic tumor of the Skin. Am J Dermatopathol 1999;21(5):449-453.
5. Carlson JA, Ackerman AB, Fletcher CD, Zelger B. A cutaneous spindle-cell lesion. Am J Dermatopathol 2001;23:62-66.
6. Nakajima T, Sano S, Itami S, Yoshikawa K. Cutaneous inflammatory pseudotumor (Plasma Cell Granuloma). Br J Dermatol 2001;444(6):1271-1273.
7. El Shabrawi-Caelen L, Kerl K, Cerromi L, Soyer HP. Cutaneous inflammatory Pseudotumor – a spectrum of various diseases? J Cutan Pathol 2004;31:605-611.
8. Matsubara O, Tn-liu NS, Kenney RM, Mark EJ. Inglammatory pseudotumor of the lung: progression from organizing pneumonia to fibrous hystiocytoma or to plasma cell granuloma in 32 cases. Human Pathol 1988;19:807-814.
9. Coffin CM, Humphrey PA, Dehner LP. Extrapulmonary inflammatory myofibroblastic tumor: a clinical and pathology survey. Sem Diagn Pathol 1988;15:85-101.
10. Kishimoto T, Akira S, Taga T. Interleukin-6 and its receptor: a paradigm for cytokines. Science 1992;258:593-597.
11. Gómez-Román JJ, Ocejo-Vinyals G, Sanchez-Velasco P. Hernández-Nieto E, Leyva-Cobian F, Val-Bernal JF. Presence of human herpesvirus-8 DNA sequences and overexpression of human IL-6 and cyclin D1 in inflammatory myofibroblastic tumor (Inflammatory Pseudotumor). Lab Invest 2000;80:1121-1126.
12. Yang M. Cutaneous inflammatory pseudotumor: a case report with immunohistochemical and ultrastructural studies. Pathology 1993;25:405-409.
13. Tsuzuki T, Magi-Galluzzi C, Epstein JI. ALK-1 expression in inflammatory myofibroblastic tumor of the urinary bladder. Am J Surg Pathol 2004;28:1609-1614.
14. Cesarman E, Knowles DM. Kaposi´s sarcoma associated herpesvirus: a lymphotropic human herpesvirus associated with Kaposi´s sarcoma, primary effusion lymphoma and multicentric Castleman´s disease. Sem Diagn Pathol 1997;14:54-56.
[Caso anterior] [Página Inicio de la Reunión Territorial] [Siguiente caso]