T6. DIAGNÓSTICO Y
CLASIFICACIÓN DE LOS SÍNDROMES MIELO-DISPLÁSICOS
Dra. Teresa Vallespí [PAT1], Dr. Guillermo F. Sanz*, Dr. Miguel
Angel Sanz*.
Servicios de Hematología.
Hospital Vall d´Hebrón, Barcelona y *Hospital La Fe, Valencia.
Título abreviado: Diagnóstico y clasificación de los SMD
Palabras clave: Síndromes mielodisplásicos, clasificación de la OMS
Introducción
Los síndromes mielodisplásicos (SMD) son un grupo de enfermedades de origen clonal que tienen su origen en células hematopoyéticas. Los SMD se caracterizan por presentar una médula ósea normo o hipercelular con alteraciones morfológicas que dan lugar a grados variables de citopenia(s) y disfunciones celulares.
Durante años, los SMD se han clasificado de acuerdo con los criterios establecidos por el denominado grupo FAB (French-American-British).1 Recientemente, en el marco de un ambicioso proyecto de la OMS para actualizar la clasificación y criterios diagnósticos de todas las neoplasias hematológicas, se ha propuesto una nueva clasificación de los SMD. En este trabajo se discuten brevemente los cambios introducidos en esta clasificación.
Diagnóstico
Una vez descartados otros procesos, que puedan alterar la morfología o producir una hematopoyesis ineficaz, el diagnóstico de los SMD se basa en un análisis cuidadoso de la morfología de las células de la sangre (hematíes, granulocitos y plaquetas) y de sus progenitores en médula ósea.
Las citopenias observadas en el hemograma pueden orientar hacia el grado de apoptosis que sufre cada línea y su relación con las anomalías morfológicas detectadas. Así, en la práctica, se considera que una alteración morfológica tiene verdaderamente valor diagnóstico y pronóstico si se traduce en una disminución o una disfunción de las células de la sangre periférica. El Grupo Cooperativo Español para el estudio de los SMD considera que son rasgos de mielodisplasia maligna la presencia de micromegacariocitos y los granulocitos degranulados con núcleo hiposegmentado (pseudo-Pelger-Huët). El cariotipo de las células malignas es en este momento indispensable tanto para el diagnóstico como para el pronóstico (International Scoring System for evaluating prognosis in myelodysplastic syndromes o IPSS).2
Clasificación
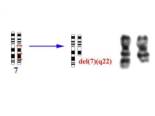
Las propuestas recientemente formuladas por la OMS (World Health Organization) tienen como objetivo separar entidades que, a pesar de tener un comportamiento biológico y clínico propios, eran incluidas hasta ahora dentro de un mismo subtipo. (Tabla 1).3 Así, la anemia refractaria (AR), en la que sólo deben existir rasgos diseritropoyéticos, se subdivide en dos grupos de acuerdo con la presencia (ARSA) o ausencia (AR) de sideroblastos en anillo.4,5 De esta forma la ARSA recupera su entidad6 y la AR deja de ser el “cajón de sastre de los SMD” para acoger sólo las anemias refractarias “puras”. El nuevo subtipo citopenia refractaria con displasia multilineal (CRDM) incluye todas las bicitopenias y pancitopenias refractarias con displasia de al menos dos líneas celulares.7 Los casos con displasia mieloide o megacariocítica aislada pasan a engrosar el grupo de SMD inclasificables.8 La anemia refractaria con exceso de blastos (AREB) se subdivide en dos grupos según la proporción de blastos en médula ósea (£10% y >10%),9 lo cual como demostraron Sanz et al. tiene valor pronóstico.10 Finalmente, el síndrome 5q-, caracterizado por la deleción aislada de 5q y el escaso número de blastos (<5%) en sangre y médula ósea, se considera una enfermedad con entidad propia.11-13
Una de las propuestas más interesantes de la clasificación WHO es considerar como LMA, independientemente del porcentaje de blastos en medula ósea, aquellos casos con alteraciones citogenéticas típicas de estos procesos, como son la t(15;17), t(8;21) e inv(16),14 cosa que de hecho venían haciendo ya desde hace algunos años bastantes grupos.
La inclusión de la leucemia mielomonocítica crónica (LMMC) como síndrome mielodisplásico/mielo-proliferativo (SMD/SMP)3 es lógica. Sin embargo, habrá casos de LMMC con leucopenia y monocitosis que deberán ser clasificados como SMD. La inclusión de la AREB en transformación (AREB-t) en el nuevo subtipo de leucemia mieloide aguda con displasia trilineal y con o sin fase previa de mielodisplasia está en consonancia con lo propuesto por algunos expertos,15 aunque ello ha sido objeto de crítica.16
Como inconvenientes principales de las propuestas de la OMS cabe destacar la escasa precisión del término “citopenia” cuyo valor pronóstico fue demostrado por Greenberg et al,2 el bajo dintel exigido para definir la diseritropoyesis (>10% de eritroblastos dismórficos), así como la falta de incorporación de otros hallazgos citogenéticos en la clasificación.2,10 En la Tabla 2 se muestra el IPSS para SMD.
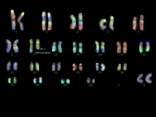
Citogenética
La necesidad del estudio del cariotipo de las células
malignas, evidente en algunas enfermedades hematológicas,14,17-19 es
también indiscutible en los SMD. La principal dificultad estriba en la obtención
de metafases y la demostración de que éstas corresponden a la celularidad
maligna.
En los SMD
se deben aplicar, además de la citogenética convencional, otras técnicas que
permitan detectar anomalías en células en interfase (como la hibridación in situ fluorescente o FISH), anomalías
crípticas (por FISH o por técnicas de biología molecular), y amplificaciones,
pérdidas o deleciones por hibridación genómica comparada (CGH). Una de las
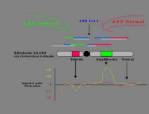
técnicas más reciente y espectacular es la cross-species
color bandings (RxFISH). La
RxFISH permite, entre otras, visualizar con mayor precisión los puntos de
rotura, detectar anomalías crípticas, así como diferenciar las deleciones
intersticiales de las terminales. La
relevancia pronóstica de las anomalías detectadas por estas técnicas más
complejas está por determinar.
|
|
Conclusiones
Aunque sólo el
tiempo demostrará si la nueva clasificación OMS es capaz de reemplazar en la
práctica clínica a la clasificación FAB, la propuesta de la OMS presenta
algunos avances desde el punto de vista conceptual. Por ello, además de la
clasificación FAB, es extremadamente conveniente utilizar la clasificación de
la OMS. De esa forma podría evaluarse prospectivamente ambas clasificaciones,
establecer comparaciones entre ellas y, aún más importante, mejorar los
criterios diagnósticos de los SMD. Además, tal como la OMS aconseja, debería
usarse el IPSS para establecer el pronóstico de los SMD.
Bibliografía
1.
Bennett
JM, Catovsky D, Daniel MT, Flandrin G, Galton DAG, Gralnick HR, et al. The
French-American-British Cooperative Group: proposals for the classification of
the myelodysplastic syndromes. Br J Haematol 1982; 51: 189-199.
2.
Greenberg
P, Cox C, LeBeau MM, Fenaux P, Morel P, Sanz G, et al. International Scoring
System for evaluating prognosis in myelodyspastic syndromes. Blood 1997; 89:
2079-2088.
3.
Brunning
RD, Head D, Bennett JM, Vardiman JW, Flandrin G, Harris NL, et al.
Myelodysplastic syndromes: introduction. En: Jaffe ES, Harris NL, Stein H,
Vardiman JW (eds.): Tumours of haematopoietc and lymphoid tissues. IARCPress, Lyon 2001; pp. 63-67.
4.
Brunning
RD, Head D, Bennett JM, Vardiman JW, Flandrin G, Harris NL, et al. Refractory anaemia. En: Jaffe ES, Harris
NL, Stein H, Vardiman JW (eds.): Tumours of haematopoietc and lymphoid tissues.
IARCPress, Lyon 2001; pp. 68.
5.
Brunning
RD, Head D, Bennett JM, Vardiman JW, Flandrin G, Harris NL, et al. Refractory
anaemia with ringed sideroblasts. En: Jaffe ES, Harris NL, Stein H, Vardiman JW
(eds.): Tumours of haematopoietc and lymphoid tissues. IARCPress, Lyon 2001; pp. 69.
6.
Rozman
C. Myelodysplastic syndromes: classification dilemmas and need for prospective
clinical trials (conference and personal remarks). Sindrome
mielodisplastiche 2000. Pavia, Italy. May 8, 2000.
7.
Brunning
RD, Head D, Bennett JM, Vardiman JW, Flandrin G, Harris NL, et al. Refractory
cytopenia with multilineage dysplasia. En: Jaffe ES, Harris NL, Stein H, Vardiman
JW (eds.): Tumours of haematopoietc and lymphoid tissues. IARCPress, Lyon 2001; pp. 70.
8.
Brunning
RD, Head D, Bennett JM, Vardiman JW, Flandrin G, Harris NL, et al.
Myelodysplastic syndrome, unclassifiable. En: Jaffe ES, Harris NL, Stein H,
Vardiman JW (eds.): Tumours of haematopoietc and lymphoid tissues. IARCPress, Lyon 2001; pp. 72.
9.
Brunning
RD, Head D, Bennett JM, Vardiman JW, Flandrin G, Harris NL, et al. Refractory
anaemia with excess blasts. En: Jaffe ES, Harris NL, Stein H, Vardiman JW (eds.):
Tumours of haematopoietc and lymphoid tissues. IARCPress, Lyon 2001; pp. 71.
10.
Sanz GF, Sanz MA, Vallespí T, Cañizo MC, Torrabadella
M, García S, et al. Two regression models and a scoring system for
predicting survival and planning treatment in myelodysplastic syndromes: a
multivariate analysis of prognostic factors in 370 patients. Blood 1989; 74:
395-408.
11.
Van
den Berghe H, Cassiman JJ, David G, Fryns JP, Michaux JL. Sokal G. Distinct
hematological disorder with deletion of long arm of no. 5 chromosome. Nature
1974; 251: 437-438.
12.
Vallespí
T, Imbert M, Mecucci C, Preudhomme C, Fenaux P. Diagnosis, classification, and
diagnosis of myelodysplastic syndromes. Haematologica 1998; 83: 258-275.
13.
Brunning
RD, Head D, Bennett JM, Vardiman JW, Flandrin G, Harris NL, et al.
Myelodysplastic syndrome associated with isolated del(5q) chromosome
abnormality (“5q- syndrome”). En: Jaffe ES, Harris NL, Stein H, Vardiman JW
(eds.): Tumours of haematopoietc and lymphoid tissues. IARCPress, Lyon 2001; pp. 73.
14.
Harris
NL, Jaffe ES, Diebold J, Flandrin G, Muller-Hermelink HK, Vardiman J, et al.
The World Health Organization classification of neoplastic diseases of the
hematopoietic and lymphoid tissues: report of the Clinical Advisory Committee
Meeting; Airlie House Virginia, November 1997. J Clin Oncol 1999; 17:
3835-3849.
15.
Oosterveld
M, de Witte T. Intensive treatment strategies in patients with high-risk
myelodysplastic syndrome and secondary acute myeloid leukemia. Blood Rev 2000;
14: 182-189.
16.
Greenberg
P, Anderson J, de Witte T, Estey E, Fenaux P, Gupta P, et al. Problematic WHO
re-classification of myelodysplastic syndromes. J Clin Oncol 2000; 18:
3447-3449.
17. Olavarria E, Kanfer E, Szydlo R, Kaeda J, Rezvani K, Cwynarski K, et al. Early detection of BCR-ABL transcripts by quantitative reverse transcriptase-polymerase chain reaction predicts outcome after allogenic stem cell transplantation for chronic myeloid leukemia. Blood 2001; 97: 1560-1565.
18.
Sanz MA, Martin G, Rayon C, Esteve J, Gónzalez M,
Díaz-Mediavilla J, et al. A modified
AIDA protocol with anthracycline-based consolidation results in high
antileukemic efficacy and reduced toxicity in newly diagnosed
PML/RARalpha-positive acute promyelocytic leukemia. PETHEMA group. Blood 1999;
9: 3015-3021.
19.
Döhner
H, Stilgenbauer S, Benner A, Leupolt E, Krober A, Bullinger L, et al. Genomic
aberrations and survival in chronic lymphocytic leukemia. N Engl J Med 2000;
343: 1910-1916.
Tabla 1.
Clasificación de la OMS para los
SMD: principales características de los distintos subtipos2
|
Subtipo |
Sangre
|
Médula ósea |
|
Anemia refractaria (AR) |
Anemia Blastos: <1% |
Diseritropoyesis Blastos: <5% Sideroblastos en anillo: <15% |
|
Anemia refractaria con sideroblastos en anillo (ARSA) |
Anemia Blastos: 0% |
Diseritropoyesis Blastos: <5% Sideroblastos en anillo: ³15% |
|
Citopenia refractaria con displasia multilineal (CRDM) |
Citopenias (bicitopenia o pancitopenia) Blastos: <1% sin bastones de Auer Monocitos: <1x109/L |
Displasia en ³10% de células de dos o más líneas (series) Blastos: <5% sin bastones de Auer Sideroblastos en anillo: <15% |
|
Citopenia refractaria con displasia multilineal y sideroblastos en anillo (CRDM-SA) |
Citopenias (bicitopenia o pancitopenia) Blastos: <1% sin bastones de Auer Monocitos: <1x109/L |
Displasia en ³10% de células de dos o más líneas (series) Blastos: <5% sin bastones de Auer Sideroblastos en anillo: ³15% |
|
Anemia refractaria con exceso de blastos – 1 (AREB-1) |
Citopenias Blastos: <5% sin bastones de Auer Monocitos: <1x109/L |
Displasia en una o más líneas (series) Blastos: 5-9% sin bastones de Auer |
|
Anemia refractaria con exceso de blastos – 2 (AREB-2) |
Citopenias Blastos: <5-19% con o sin bastones de Auer Monocitos: <1x109/L |
Displasia en una o más líneas (series) Blastos: 10-19% con o sin bastones de Auer |
|
Síndrome mielodisplásico inclasificable (SMD-I) |
Citopenias Blastos: <1% sin bastones de Auer |
Displasia en una sola línea (que no sea serie eritroide) Blastos: <5% sin bastones de Auer |
|
Síndrome mielodisplásico con 5q- (como única anomalía) |
Anemia Plaquetas: normales o aumentadas Blastos: <5% |
5q- (única anomalía) Megacariocitos con núcleo hipolobulado Blastos: <5% sin bastones de Auer |