S5. LINFOMA DIFUSO DE CÉLULA
GRANDE B.
Dr. Tomás Álvaro Naranjo / Dr. Joaquín Jaén
Martínez.
Servicio de
Patología. Hospital de Tortosa Virgen de la Cinta.
ÍNDICE
·
ICONOGRAFÍA
·
ALTERACIONES
GENÉTICAS DEL LDCG-B
·
LINFOMA NODAL
/EXTRANODAL
·
CÉLULA CENTRO
GERMINAL / CÉLULA B ACTIVADA
·
HALLAZGOS
INMUNOFENOTÍPICOS INFRECUENTES
·
PRONÓSTICO
·
CONCLUSIÓN
·
DATOS ADICIONALES
·
BIBLIOGRAFÍA
S5C3
Paciente varón
de 60 años con ausencia de síntomas B
que consulta por presentar adenopatías laterocervicales unilaterales.
Ausencia de visceromegalias y presencia
de un pico IgG monoclonal.
Estadio IV por afectación ósea. LDH i beta-2-microglobulina normales. VSG 36. Hb 13,8. Leucos 7200 con fórmula
normal. Plaquetas 250.000. ECOG 0 (Karnofsky 100%). Banda monoclonal IgG-K (0.6
g/dL). IPI:1.
En la evolución, tras
recibir CHOP,
recidiva al cabo de un año. Tras la administración de quimioterapia de segunda
y tercera línea se consiguieron varias respuestas parciales, falleciendo a los
18 meses del diagnóstico por infiltración hepática por el linfoma, ahora ya
refractario.
S5C4
Antecedentes
personales: DMID, resto sin interés.
Mujer de 81
años ingresada por adenopatías generalizadas y masa laterocervical derecha de
unos 10 cm. Lesiones eritematosas e induradas en extremidades inferiores.
Astenia, febrícula y sudoración. Hemograma: hematíes 3´19 x 106, Hb:
9 g/dl, Hcto: 28´7%, plaquetas 122.000, VSG 86 mm. Coombs negativo. LDH 794
U/I.
La TAC muestra
adenopatías en bifurcación iliaca derecha y cadena hipogástrica derecha e
izquierda. Resto de abdomen sin adenopatías. Escasa afectación intratorácica,
con pequeñas adenopatías paratraqueales izquierdas. Múltiples adenopatías en
huecos axilares de hasta 20 mm.
Evolución:
LDCG-B con afectación cutánea y ganglionar. En tratamiento quimioterápico, es
éxitus a las 5 semanas del diagnóstico, tras presentar pérdida brusca de
conciencia, coma profundo, posible ACV (el TAC de urgencias no mostró lesiones
hemorrágicas).
S5C5
Mujer de 70
años, fumadora pasiva durante cuarenta años, con antecedentes de otitis media
crónica que ha requerido varias intervenciones quirúrgicas y artritis en manos
y tobillos (primer episodio a los 14 años).
La historia
actual corresponde a tumoración supraclavicular izquierda que se nota la misma
paciente (8 cm de diámetro en la exploración), que aumenta de tamaño y se endurece progresivamente.
Resto de
exploración clínica y exámenes complementarios estrictamente normales (LDH
normal, B 2-MG 2´24).
La Radiografía
de tórax y TAC torácico identifican una extensa masa en partes blandas sobre
región apical del lóbulo pulmonar superior izquierdo con contorno irregular y
que realiza impronta sobre la tráquea.
Evolución:
LDCG-B estadio IIA, bulky, IPI 1. Quimioterapia según esquema CHOP. En el curso
del tratamiento síndrome febril en el contexto de neutropenia postquimioterapia
(día 9 post-CHOP). Buena respuesta a tratamiento con antibioterapia empírica,
con ceftazidima y amikacina junto con G-CSF, quedando afebril a las 48 horas,
buen estado general y recuperación hematológica. En remisión completa clínica a
los 4 meses del diagnóstico, se inicia radioterapia.
DISCUSIÓN DE CASOS
Los casos S5C4 y S5C5 representan variantes
morfológicas, inmunofenotípicas y probablemente clínicas de la misma
enfermedad, el linfoma difuso de células grandes B (LDCG-B), y por ello serán
discutidos aquí de forma conjunta y comparativa. El caso S5C3 plantea problemas
de diagnóstico diferencial entre la llamada forma plasmablástica del LDCG-B y
el plasmocitoma.
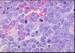
El primero de ellos, S5C3, es un tumor difuso
compuesto por una población de células de tamaño intermedio y sólo
ocasionalmente grandes, de núcleos excéntricos, vesiculosos, con nucléolo
eosinófilo central y prominente, y citoplasma amplio y basófilo, con fuerte
pironinofilia. Se observa incluso un halo claro perinuclear y una apariencia
general plasmocitoide de forma difusa de la celularidad tumoral. Algunas
imágenes mitóticas y ausencia de necrosis. El estudio inmunohistoquímico
muestra una neoplasia negativa para Antígeno Leucocitario Común (CD45) y
marcadores comunes de línea B y T (como CD20 y CD3). Ello, unido a la expresión
de Antígeno de Membrana Epitelial (EMA), podría sugerir una naturaleza
epitelial de la neoplasia, que queda rápidamente descartada con la demostración
de secreción monoclonal de IgG kappa, que muestra a la vez la naturaleza
linfoide del tumor y su carácter
neoplásico. De forma adicional el tumor es negativo para bcl-2 y bcl-6, pero
muestra positividad para syndecan/CD
138, lo que permite catalogar al tumor como procedente de la contrapartida
normal de la célula B postgerminal activada. El índice de proliferación solo
alcanza el 20% en las áreas de mayor actividad y el estudio para LMP-1 es
negativo.
Esta morfología e inmunofenotipo propias de
plasmocitoma, plantea el diagnóstico diferencial con la variante plasmablástica
de LDCG-B, que es posible observar tanto en pacientes HIV+, generalmente en la
cavidad oral, como en pacientes inmunocompetentes. Con un inmunofenotipo
prácticamente superponible en ambos casos, ayudan a realizar el diagnóstico
diferencial el tamaño celular; la morfología, más inmunoblástica en el LDCG y
con células plasmáticas en el plasmocitoma; el índice de proliferación; la
secreción de cadenas pesadas (IgG en LDCG y posibilidad de IgG, A, M, D, en
plasmocitoma); y asociación a VEB (60% en LDCG plasmablástico y 6% en
plasmacitoma). El estudio de CD20, CD79a, CD45, VS38, CD138 y EMA, ofrece
resultados equivalentes en ambos casos.
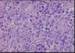
El caso S5C4 muestra otra proliferación linfoide de
patrón difuso pero esta vez constituida por elementos de núcleos grandes de
aspecto vesicular, con presencia generalizada de nucléolo eosinófilo central y
prominente, citoplasma amplio y eosinófilo y numerosas mitosis. En esta ocasión
el estudio inmunofenotípico pone de manifiesto la naturaleza B del tumor (CD45,
CD20 y CD79a) y un índice proliferativo evaluado mediante Ki67 muy elevado, del
80%. El tumor muestra positividad para bcl2 y bcl6, resultando el syndecan
negativo. En este caso la célula contrapartida normal de este fenotipo
correspondería a la célula B del centro germinal.
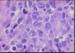
Por fin, el caso S5C5 corresponde a otro LDCG-B,
pero tal y como puede verse en esta ocasión los elementos nucleares muestran
núcleos grandes, de aspecto vesicular, con presencia de nucléolos múltiples de
pequeño tamaño y citoplasma amplio y eosinófilo; numerosas mitosis e imágenes
apoptóticas. El inmunofenotipo del tumor, CD20 y CD79 a positivo, muestra en
esta ocasión negatividad para bcl-2, bcl-6 y CD138. Otra vez el índice
proliferativo resulta llamativamente elevado, del 90% evaluado mediante Ki67.
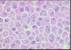
ICONOGRAFIA
|
|
S5C3
|
S5C4a
|
S5C5
|
|
Bcl-2 |
|||
|
Bcl-6 |
|||
|
CD138 |
|
|
H.E.
1 |
H.E.
2 |
H.E.
3 |
CD20 |
CD10 |
CD79a |
CD30 |
Ki67 |
|
S5C3 |
||||||||
|
S5C4 |
||||||||
|
S5C5 |
|
GENERALIDADES
Las históricas clasificaciones de linfomas ponen de
manifiesto la gran variedad terminológica para identificar una serie de
procesos linfoproliferativos morfológicamente caracterizados por una proliferación difusa de células grandes
con núcleo vesicular, prominencia nucleolar y citoplasma basofílico.
Términos del tipo histiocítico difuso / mixto
linfo-histiocítico difuso (Rappaport), linfoma centroblástico / inmunoblástico
/ anaplásico de célula grande (Kiel), centrofolicular de célula grande hendida
o no/ sarcoma inmunoblástico (L&C), etc, tienen como denominador común
notables problemas de diagnóstico diferencial y escasa reproductibilidad intra
e interobservador , incitando infructuosas discusiones a lo largo de los años
(Cancer 1982).
En 1994 el International Lymphoma Study Group
elabora una propuesta de clasificación de los linfomas (Harris 1994, Morente
1995) con la integración de todos estos procesos (de origen en células B) bajo
el epígrafe de linfoma difuso de células grandes B (DLBCL), propuesta asumida
por la WHO Classification of Neoplastic Diseases of The Hematopoietic and
Lymphoid Tissues (Jaffe 1997, Álvaro 1997), estableciendo las variantes
morfológicas y subtipos que integran el grupo. (Tabla 1). La subclasificación
morfológica se realizaría con carácter opcional, al no disponer de criterios
biológicos y patológicos suficientemente contrastados que permitan la
subclasificación, así como actuaciones terapéuticas específicas basadas en la
misma, siendo necesarios estudios adicionales para estandarizar criterios de
subclasificación (Harris 1999).
Tabla
1. DLBCL, Morphologic Variants and Subtypes
![]()
Morphologic variants
Centroblastic
Immunoblastic
T-cell/histiocyte-rich
Lymphomatoid
granulomatosis type
Anaplastic
large B-cell
Plasmablastic
Subtypes
Mediastinal (thymic)
large B-cell lymphoma
Primary
effusion lymphoma
Intravascular
large B-cell lymphoma
![]()
SIGNIFICACIÓN DE BCL-2/BCL-6/CD138
En líneas generales, podemos clasificar los DLBCL en
primarios o secundarios en función de su origen de novo o a partir de otras neoplasias hematológicas. Los linfomas
foliculares constituyen una fuente importante de DLBCL secundarios mediante el
acúmulo de múltiples alteraciones genéticas secundarias, entre las que se han
identificado cambios cromosómicos diversos, reordenamiento del gen c-myc,
mutaciones de p53, mutaciones somáticas
del gen bcl-2 translocado e inactivación de p15 y p16 bien sea por deleción,
mutación o hipermetilación. Entre estas alteraciones parece adquirir cierto
protagonismo la presencia de mutaciones somáticas en la región 5’ no
codificante del gen Bcl-6 (Capello 2000, Szereday 2000, Lossos 2000). El gen
BCL-6 es el gen implicado con mayor frecuencia en la patogenia del LDCG-B. Se
trata de un protooncogén, situado en 3q27 que se observa reordenado entre el
30-40% de todos los LDCG-B, pero únicamente entre el 6-10% de los linfomas
foliculares.
Otras aportaciones investigan la existencia de
subpoblaciones de DLBCL en función del origen centrofolicular / célula B
activada de la célula neoplásica. Mediante la combinación de técnicas
inmunohistoquímicas y genotípicas (King
2000) se ha procedido a la determinación de marcadores antigénicos y
oncogénicos asociados con diferenciación folicular y postfolicular (CD10,
Bcl-6, Bcl-2 ,CD138, IgH, Bcl-2R, Bcl-6R) sobre muestras tisulares de linfomas
foliculares (FL) y DLBCL nodales y extranodales excluyendo pacientes VIH +
conocidos. El análisis de sus resultados sobre DLBCL muestra múltiples
combinaciones de expresión de marcadores, siendo la triple positividad para
Bcl-6/Bcl-2/CD10 el inmunofenotipo expresado en mayor proporción (>40% de
los casos). A nivel individual, Bcl-6
es el marcador expresado en mayor proporción (> 90% de los casos), seguido
de la expresión proteica de Bcl-2 (81%), CD10 (62%), siendo mínima la expresión
de CD138. La expresión de Bcl-6, CD10 y ausencia de expresión de CD138
apoyarían el origen centrofolicular de la neoplasia. La interpretación de
resultados respecto a Bcl-2 tendría poco valor respecto a la categorización
pues, pese a su amplia expresión en linfomas foliculares, no es considerado un
marcador específico de origen centrofolicular
y se constata la ausencia de correlación entre t(14;18) y expresión
proteica de Bcl-2 lo que implicaría mecanismos tales como la amplificación
(Hough 2001) o mutaciones somáticas (Monni 1999, De brasi 2000).
Las conclusiones que pueden extraerse de estos
estudios es que la mayoría de LDCG-B exhiben un inmunofenotipo que apoya origen
sobre células del centro folicular. La ausencia de BCL-2 y CD10 podría estar
asociada justamente con los linfomas foliculares de alto grado y es posible que
la expresión de bcl-6 no sea enteramente específica de origen en el centro
folicular. Sólo una minoría de LDCG-B muestran un inmunofenotipo sugerente de
diferenciación postfolicular ( o célula B activada-like) y finalmente solo unos
pocos muestran reordenamiento de bcl-2, lo que sugiere una patogenia molecular
diferente de los linfomas foliculares (King 2000).
El estudio del reordenamiento de genes de las
inmunoglobulinas (King 2000, Lossos 2000, Ottensmeier 2000) también ha sido
recientemente aplicado a la identificación de subpoblaciones de DLBCL apoyando
la hipótesis de origen centrofolicular / célula activada.
ALTERACIONES
GENÉTICAS DEL LDCG-B
Hasta
la fecha no se ha encontrado ningún tipo de alteración genética específica
común a todos o la mayoría de LDCG-B. Sin embargo sí se han observado una serie
de anomalías que se repiten con cierta frecuencia, entre las que destacan
(Warnke RA, 1999):
t(14;18)(q32;q21) (BCL2) 20-30%
t(3q27;14q32, 2p12, 22q11, …)(BCL6) 10-12%
t c-MYC 10-20%
Inactivación RB 10-20%
Algunos de los pacientes con t(14;18) tienen un
linfoma de bajo grado ya conocido o bien se observa de entrada la coexistencia
de ambos linfomas; pero está claro que eso no sucede siempre.
Los esfuerzos realizados por encontrar algún tipo de
correlación entre las características morfológicas, inmunofenotípicas y
genéticas no han sido fructíferas hasta muy recientemente. En general la
citología de las células tumorales no suele tener significación pronóstica en
la mayoría de los estudios, aunque se ha apuntado un posible peor curso en el
caso de los inmunoblásticos. La fracción proliferativa si que se ha mostrado
como dato significativo. Con respecto a las alteraciones genéticas, el
reordenamiento de bcl-6 parece conferir mejor pronóstico a pesar de asociarse
con mayor frecuencia a afectación extranodal, mientras que la t(14;18) peor.
LINFOMA NODAL /EXTRANODAL
Bcl2 y bcl6 son expresados de forma inversa en el folículo
linfoide secundario normal. Esta relación no se mantiene en los LDCG-B
derivados del mismo, siendo el patrón más frecuente de expresión la positividad
para ambos, bcl2 y bcl6. Alrededor de un 70% de LDCG-B (y un 100% de linfomas
foliculares) expresan bcl-6 (Skinnider BF, et al, 1999), con una diferencia
significativa entre aquellos de morfología centroblástica (82%) e
inmunoblástica (27%). Merece la pena recordar que el grado de inmunotinción
para bcl6, variable en diferentes estudios, ha sido correlacionado
especialmente con el tiempo transcurrido desde que se cortan las secciones
tisulares hasta que se realiza la técnica de inmunotinción. Sin embargo no se
han objetivado diferencias de expresión de bcl6 entre LDCG-B nodales y
extranodales. Asimismo, la hipótesis de que la expresión de bcl6 es predictiva
de histogenesis en células del centro germinal ha sido cuestionada. Por
supuesto la expresión de bcl6 no se correlaciona con las alteraciones del mismo
gen.
Por su parte la expresión de bcl-2, que aparece en
el 51% de LDCG-B es mucho más frecuente en linfomas nodales (71%) que
extranodales (30%), pero no existen diferencias significativas cuando se
estudian linfomas de morfología centroblástica o inmunoblástica. Curiosamente
la expresión de bcl2 es significativamente más baja en LDCG-B gástricos que en
el resto de tumores equivalentes extranodales de otras localizaciones
(Cogliatti SB, et al. 2000).
CÉLULA CENTRO GERMINAL / CÉLULA B ACTIVADA
La maduración normal de las células B puede
subdividirse en cuatro estadios. El primero corresponde al estadio de
progenitor de célula B de forma previa a la recombinación de V (D)J. El segundo
es la generación de células B vírgenes tras la recombinación V (D)J, antes de encontrarse
con el Ag, cuando los genes VH todavía no están mutados. El tercero
ocurre en el centro germinal, e incluye mutación somática y selección
antigénica. Finalmente el cuarto, postgerminal, corresponde a las células B de
memoria y células plasmáticas, cuando el proceso mutacional ha sido completado
y se producen Ac de alta afinidad.
El estudio de ganglios linfáticos no tumorales
revela al menos tres patrones fenotípicos que se corresponden con diferentes
estadios del desarrollo fisiológico normal de los linfocitos B. Concretamente
la combinación de tres marcadores (bcl6, MUM1 y CD138) aparece como
especialmente útil en este sentido. bcl-6 es expresado por centroblastos y
centrocitos, MUM1/IRF4, múltiple myeloma 1/Interferon regulatory factor-4 es
expresado en los estadios más avanzados de desarrollo centrocitario en el
interior de los centros germinales y por células B postgerminales y
CD138/syndecan 1 por células B postgerminales. Con excepción de las células
plasmáticas, las células MUM1+ del centro germinal y las áreas perifoliculares
son negativas para CD138 y no existe coexpresión de bcl6 y MUM1. Concretamente
los centroblastos aparecen como bcl6+/MUM1-/CD138-; las células B de los
últimos estadios del centro germinal y los primeros postgerminales bcl6-/MUM1+/CD138-;
y las células postgerminales bcl6-/MUM1+/CD138+ (Carbone A, et al, 2001). Es
decir que bcl6 aparece inmediatamente después que la célula B entra en el
centro germinal y se mantiene hasta que sale de él, mientras que MUM1 comienza
a expresarse en el estadio de centrocito y se mantiene durante la maduración
postgerminal. Cuando la célula B sale del centro germinal retiene la expresión
de MUM1 y empieza a expresar CD138. Cabría añadir aquí que el fenotipo
postgerminal parece ser el único permisivo para la expresión de LMP-1-VEB, o
bien que LMP-1 fuerza la maduración postgerminal (Carbone A, et al, 2001).
Sin embargo, estos patrones teóricos no encuentran
una correspondencia exacta en tumores. Así, si bien un 75% de LDCG-B son MUM1+,
casi la mitad de estos coexpresan bcl-6 (Falini B, et al, 2000).
El reordenamiento de bcl-6 y bcl-2 se ha comunicado
en el 20-35% y 10-25% respectivamente de los LDCG-B (Pescarmona et al, 1997),
mientras que ambas anomalías no suelen coexistir en el mismo tumor. La
interpretación que se ha pretendido dar es que los casos con reordenamiento de
bcl-2 podrían representar linfomas foliculares transformados, mientras que las
alteraciones de bcl6 podrían corresponder a LDCG-B de novo. Aunque se ha
tratado de asociar estas lesiones genéticas a un diferente comportamiento
clínico (curso más favorable en aquellos casos con reordenamiento de bcl-6 y
peor en caso de reordenamiento de bcl-2), su utilidad pronóstica sigue estando
poco clara. Pero lo que sí está claro es que el reordenamiento de bcl6 puede
verse en linfomas con morfología centroblástica igual que en aquellos con
morfología inmunoblástica, y además en proporciones relativas similares.
Sobre los DLBCL de novo no hay reconocimiento
unánime sobre el origen celular. Asumiendo la heterogeneidad clínica de las
entidades que componen el grupo (Alizadeh 2000), se procede a la
identificación, mediante la construcción de “DNA microarrays”, de la expresión
de cientos de genes agrupados entorno a una serie de patrones predefinidos
(Eisen 1998), que justifique la diversidad de comportamientos biológicos y
siente las bases de una nueva clasificación. El "linfochip" utilizado
por Alizadeh et al. incluye 17856 genes, algunos conocidos y otros no, con un
subgrupo de 380 genes que han sido los utilizados para separar las dos
categorías de linfomas ya mencionadas, linfomas de células B del centro
germinal-like y linfomas de células B activadas-like.
Los DLBCL, como grupo, comparten la expresión de
genes agrupados bajo patrones de proliferación, de ganglio linfático y de
células T (los dos últimos en relación con la celularidad linfoide no tumoral
acompañante) (Tabla 2). A pesar de la expresión común de estos genes, se
identifica cierta variabilidad individual atribuible a los diferentes índices
de proliferación de cada tumor y a la heterogénea composición de la celularidad
acompañante en cada caso. Especial atención merece el reconocimiento de dos
subgrupos en función de la expresión o no de genes de células B de centro
germinal, sugiriendo implicaciones patogénicas, taxonómicas, pronósticas y
terapéuticas. Los DLBCL Centro Germinal-Like expresan genes que codifican
conocidos marcadores de centro germinal [CD10, CD38, Factor nuclear A-myb,
proteína de reparación nuclear 8-oxoguanina DNA glicosilasa, Bcl 6 ], así como
otros de reciente descripción [Bcl 7A, LMO3].
El segundo grupo, DLBCL célula B activada-like,
vendría representado por la expresión, entre otros, de IRF4, FLIP, Bcl-2.
Otro intento de dividir en dos grupos los LDCG-B se
basa en la presencia o ausencia de mutaciones somáticas del gen de las Ig, que
a su vez parecen corresponderse con la subdivisión en linfomas de células B del
centro germinal-like y linfomas de células B activadas-like (Lossos IS, et al,
2000), apoyando una vez más que las células malignas retienen en parte el
programa genético de las células normales de las que proceden.
Tabla 2. DLBCL. Patrones comunes de expresión
genómica.
![]()
Patrón
proliferación:
Genes de control del ciclo celular.
Genes implicados en la síntesis y replicación de DNA
Ki67
Patrón
ganglio linfático:
Marcadores monocito-macrófago: CD 14 , CD 105,
receptor CSF-1.
Marcadores Natural Killer: NK 4.
Patrón
célula T
Receptor célula T: TCR-b , CD3e
![]() Transmisor
señal receptor T: fyn , LAT, PKC-q
Transmisor
señal receptor T: fyn , LAT, PKC-q
HALLAZGOS INMUNOFENOTÍPICOS
INFRECUENTES
El estudio inmunofenotípico del LDCG-B muestra como
esta denominación recoge un grupo heterogéneo de linfomas carente de un perfil
fenotípico particular, ya sea mediante estudio sobre tejido o por Citometría de
flujo (Kaleem Z, et al, 2001).
En la evaluación de proliferaciones difusas
linfoides de células grandes, en secciones en parafina, los estudios
inmunohistoquímicos contribuyen a resolver diferentes situaciones de
diagnóstico diferencial. Por ejemplo, ante la situación de linfoma versus
hiperplasia (piénsese por ejemplo en mononucleosis infecciosa), el panel
CD20, CD79a y CD43 resolverá la mayoría de los problemas. Aproximadamente el
30% de LDCG-B coexpresan CD43. También puede detectarse restricción de cadenas
ligeras en un porcentaje variable de casos, observándose policlonalidad en las
proliferaciones asociadas a infección por VEB. CD68 y mieloperoxidasa ayudan a
reconocer los monocitos plasmocitoides de la enfermedad de Kikuchi.
Con respecto a la definición de línea celular
de la proliferación linfoide, la combinación de CD20, CD79a, CD3 policlonal y
CD43 son especialmente útiles. Sólo con el uso de CD20 y CD3 será posible
identificar la línea celular de más del 90% de LDCG. Además CD79a contribuirá a
identificar un subgrupo de tumores B de células precursoras y con
diferenciación plasmacítica. Los linfomas que no expresan marcadores de línea
celular o que se tiñen sólo para marcadores T, deben ser evaluados con CD30
(linfoma anaplásico) y CD56 (NK).
La ausencia de expresión de CD45 por algunos LDCG-B
y tumores de células plasmáticas, probablemente refleja los cambios
fisiológicos normales en la expresión de CD45 que ocurren durante el proceso de
diferenciación y activación de los linfocitos B. Con muy pocas excepciones los
tumores de células plasmáticas muestran restricción de cadenas ligeras, y
prácticamente el 100 % se teñirán ya sea con VS38 o CD138/syndecan. Por el
contrario apenas un 5% se teñirán con CD20, mientras que casi la mitad lo harán
con CD79a, y sólo un 15% son CD45 positivas. Con respecto al estudio de las Ig,
la identificación de IgG o IgA favorece el diagnóstico de tumor de células
plasmáticas, pero IgM apunta más hacia linfoma linfoplasmocitoide, sobre todo
si se acompaña de tinción para CD20 o CD45RB.
Existen numerosas observaciones de coexpresión de
marcadores de línea B y T por estos linfomas B, y no solo de CD5 y CD43, sino
también de marcadores considerados más específicos de línea T como CD3. Se sabe
que existe una pequeña fracción de linfocitos B periféricos normales CD2+. Tal
vez ello pueda justificar la expresión aberrante de este marcador en linfomas
B, tal y como Kaleem et al, 2001, han comunicado. Aparte de CD43, se han comunicado
casos de LNH-B con expresión aberrante de marcadores T como CD2, CD3, CD4, CD5,
CD7, CD8 y CD45RO. Pero a diferencia de lo que puede ocurrir con CD2 y CD5, no
se conocen en la actualidad subpoblaciones linfocitarias B normales que
coexpresen por ejemplo CD4 o CD7, por lo que se piensa que en LDCG-B con esos
marcadores, probablemente existe una desregulación del control de la expresión
génica en las células malignas, que conlleva la activación de genes reprimidos
o silentes de línea T.
En el diagnóstico diferencial de linfoma versus
tumor de otra línea celular, en principio es posible confiar en CD45, positivo
en más del 90% de los linfomas y no comunicado en tumores no hematopoyéticos.
Sin embargo, existen una serie de comunicaciones de marcadores inesperados en
linfomas, como pueden ser citokeratinas en el 35% de tumores de células
plasmáticas (Wotherspoon AC, et al, 1989), cerca del 30% de linfomas
anaplásicos (Gustmann C, 1991) y algunos LDCG-B (Lasota J, 1996).
EMA no es útil para establecer el diagnóstico
diferencial entre neoplasia epitelial o linfoide (muchos linfomas son
positivos), y su interpretación debe realizarse en el contexto adecuado
(Chittal et al, 1997).
Hasta
actina específica muscular se ha comunicado en LDCG-B sarcomatoide (Nozawa et
al, 2001; Chan et al. 1990).
Finalmente
conviene recordar que el 95% de los tumores mieloides extramedulares son CD45
positivos, por lo que la adición de algún marcador mieloide al panel (MPO,
CD68) evitará algunos diagnósticos erróneos de linfoma.
PRONÓSTICO
Los DLBCL constituyen el tipo más frecuente de
linfoma, representando el 40% de todos los linfomas no Hodgkin (Shipp 1997). Representan un grupo heterogéneo de
procesos linfoproliferativos desde el punto de vista morfológico, clínico y
terapéutico, con respuesta al tratamiento en aproximadamente el 40 % de los
casos (Vose 1998). Diferentes modelos pronósticos, basados fundamentalmente en
parámetros clínicos
pretratamiento, han sido desarrollados
permitiendo establecer el riesgo
individual de cada paciente, su inclusión en grupos de riesgo similar y
facilitar la toma de decisiones terapéuticas (Morente 1998, Contreras 1999,
Conconi 2000). El desarrollo de nuevas tecnologías ha proporcionado una
avalancha de trabajos dirigidos a la identificación de marcadores moleculares
que complementen los índices
pronósticos vigentes, aclaren rutas patogénicas y reorienten el desarrollo de
nuevas estrategias terapéuticas. Múltiples son los estudios encaminados a tal
fin, identificándose marcadores dotados de significado pronóstico “per se” o en
combinación. La presencia de respuesta inmune con linfos Tcd4+ (Ansell SM
2001), la pérdida de moléculas de adhesión celular (CD11a, CD18, CD54), de
reconocimiento [MHC I (MAS y MCA) y MHC II (HLA-DR, -DP, -DQ)] y
coestimuladoras [B7.1 (CD80) y B7.2 (CD86)] (Stopeck 2000), alteraciones
cromosómicas afectando a Bcl-2 (Monni 1999, De brasi 2000), Bcl-6 (Akasaka
2000), implicación de factores relacionados con apoptosis [survivina
(Adida 2000), soluble Fas (sFas) (Hara 2000)], baja expresión de proteína E2F-1
e inactivación de p16INK4A (Moller 2000), expresión de c-Myc (Akasaka 2000) y
p53 (Zhang 1999, Chang 2000), expresión de syndecan/CD138 (Gattei 1999,
Sutcliffe 2000, Kuwabara 2000), expresión de CD10 (Uherova
2001), expresión de CD5 o la identificación de nuevos genes [BAL (Aguiar
2000)], constituyen una mínima representación del alud de posibles marcadores moleculares
dotados de significado pronóstico.
Hasta el momento la información que es posible
extraer de la literatura es poco homogénea y con frecuencia contradictoria. Un
buen ejemplo de este hecho está representado por los estudios realizados con
CD10 en LDCG-B. A lo largo de la diferenciación linfocitaria, CD10 aparece
primero en células pro-B, luego se pierde durante la maduración hacia células B
vírgenes y reaparece nuevamente sobre la superficie celular durante la
maduración en el centro germinal antígeno-dependiente, por lo que su expresión
en LDCG-B se ha postulado como indicativa de origen en células B del centro
germinal. Alrededor del 20%-30% de LDCG-B expresan CD10 (Harada et al, 1999;
Fang et al, 1999). Un estudio reciente en casos seleccionados, excluyendo
aquellos con evidencia de linfoma folicular, muestra una apreciable diferencia
de supervivencia (8 meses en aquellos casos CD10+ vs 30 meses en los CD10-)
(Uherova et al., 2001). Por contra, los datos de Alizadeh et al., 2000, usando
microarrays de DNA de alta densidad, y separando los LDCG-B en dos grupos según
el origen celular del linfoma, células B del centro germinal y células B
activadas, no parecen apoyar los resultados de Uherova et al. Antes al
contrario, en el trabajo de Alizadeh et al, los LDCG-B de tipo células B
activadas-like muestran un acentuado peor pronóstico que el grupo de células B
del centro germinal- like (supervivencia a. los 5 años 76% vs. 15% en ambos
grupos). La cuestión que surge aquí, pues, es si la expresión de CD10 no
solamente refleja diferenciación de células del centro folicular, sino también
un subgrupo de LDCG-B más agresivo, independientemente de su origen celular.
Hsi, 2001, en su comentario al trabajo de Uherova et
al. y en la revisión de marcadores pronósticos en LDCG-B apunta que hasta la
fecha no existe un marcador universal aceptado como factor pronóstico
independiente, y selecciona como candidatos principales el índice
proliferativo, las alteraciones de p53 y la expresión proteica de bcl-2.
La no existencia de una correlación con los patrones
histológicos conocidos es la norma en los diferentes estudios citados (Alizadeh
2000, King 2000) con una mínima
representación de casos asignables al subtipo inmunoblástico de la
clasificación de Kiel.
CONCLUSIÓN
Se presentan tres casos con el mismo diagnóstico
según la REAL-OMS, de linfoma difuso de células grandes B. Los tres presentan
diferencias clínicas y de inmunofenotipo notables.
El S5C3 corresponde a un paciente varón de
60 años con ausencia de síntomas B que
consulta por presentar adenopatías laterocervicales unilaterales y una banda monoclonal IgG-K (0.6
g/dL). IPI:1. En la evolución, tras recibir CHOP, recidiva al cabo de un
año. Este LDCG-B aparece con morfología plasmablástica y un inmunofenotipo
bcl2-bcl6-cd138+, que sugiere un origen sobre célula B activada. La variante
inmunoblástica, por definición, incluye más del 90% de células con esta
morfología, con o sin diferenciación plasmocelular, y solo una pequeña
proporción de casos de LDCG-B pertenece a esta variante, que muestra un
inmunofenotipo similar a la forma centroblástica. Por el contrario, la variante
plasmablástica presenta una morfología que puede asemejarse mucho a la forma
inmunoblástica pero en la que el inmunofenotipo es más similar al de un
plasmocitoma. Habitualmente CD45 y CD20 son negativos y frecuentemente producen
IgG monoclonal, que como en nuestro caso puede dar una banda monoclonal en
suero. Esta variante plasmablástica está ahora de moda creciente, por
presentarse en la cavidad oral de pacientes HIV+, con muy mal pronóstico. Los
datos acumulados en pacientes inmunocompetentes son escasos, al tratarse de un
tumor muy raro.
El S5C4 corresponde a un LDCG-B con afectación cutánea y ganglionar. En tratamiento
quimioterápico, es éxitus a las 5 semanas del diagnóstico. En esta ocasión la
morfología centroblástica y el inmunofenotipo bcl2+bcl6+cd138- parecen sugerir
origen sobre células B del centro germinal. Además de CD45 y CD20, estos
tumores pueden mostrar positividad para CD5 hasta en 10% de los casos, y una
pequeña proporción celular puede mostrar expresión de CD30 débil. La fracción
proliferativa suele ser alta, habitualmente por encima del 40%.
El S5C5 corresponde a un LDCG-B estadio IIA, bulky,
IPI 1, con buena respuesta inicial al tratamiento. En éste la morfología
centroblástica y el inmunofenotipo bcl2-bcl6-cd138- no permiten sugerir con
exactitud un origen celular concreto.
DATOS ADICIONALES
Bcl-2
|
Bcl-6
|
Bcl-7A
|
BIBLIOGRAFÍA
- Adida
C, Haioun C, Gaulard P, Lepage E, Morel P, Briere J, Dombret H, Reyes F,
Diebold J, Gisselbrecht C, Salles G, Altieri DC, Molina TJ. Prognostic significance of
survivin expression in diffuse large B-cell lymphomas. Blood 2000
1;96(5):1921-5.
- Aguiar RC , Yakushijin Y, Kharbanda S , Salgia R , Fletcher JA ,
Shipp MA. Bal is a novel risk-related gene in diffuse large B-cell
lymphomas that enhances cellular migration. Blood 2000 ; 96(13) : 4328-34.
- Akasaka T , Akasaka H , Ueda C,
Yonetani N , Maesako Y , Shimizu A , Yamabe H , Fukuhara S , Uchiyama T ,
Ohno H. Molecular and clinical features of non-Burkitt’s, diffuse
large-cell lymphoma of B-cell type associated with the c-MYC /
immunoglobulin heavy-chain fusion gene. J Clin Oncol 2000; 18(3): 510-18.
- Akasaka T, Ueda C , Kurata M ,
Akasaka H , Yanabe H , Uchiyama T , Ohno H. Nonimmunoglobin (non-Ig) /
BCL6 gene fusion in diffuse large B-cell lymphoma results in worse
prognosis than Ig / BCL6. Blood 2000 ; 96(8) :
2907-9.
- Alizadeh
AA. et al. Distinct types
of diffuse large B-cell lymphoma identified by gene expression profiling. Nature 2000; 403: 503-511.
- Álvaro
T , García B. Clasificación de la
Organización Mundial de la Salud (OMS) de los tumores del tejido
hematopoyético y linfoide. En: ”4 Curso de Hematopatología”, Ed.: Tomás
Álvaro Naranjo, Llorenç Font Ferré, Ramón Bosch Príncep, M. Teresa Salvadó
Usach, Josep Gumá Padró.
- Ansell SM, Stenson M, Habermann
TM, Jelinek DF, Witzig TE. Cd4+ T-cell immune response to large B-cell
non-Hodgkin's lymphoma predicts patient outcome. J Clin Oncol 2001
1;19(3):720-6.
- Capello D, Vitolo U,
Pasqualucci L, Quattrone S, Migliaretti G, Fassone L, Ariatti C, Vivenza
D, Gloghini A, Pastore C, Lanza C, Nomdedeu J, Botto B, Freilone R,
Buonaiuto D, Zagonel V, Gallo E, Palestro G, Saglio G, Dalla-Favera R,
Carbone A, Gaidano G. Distribution and pattern of BCL-6 mutations
throughout the spectrum of B-cell neoplasia. Blood. 2000;95(2):651-9.
- Carbone A, Gloghini A, Larocca
LM, et al. Expresión profile of MUM1/IRF4,bcl6, and CD138/syndecan-1
defines novel histogenetic subsets of human immunodeficiency virus-related
lymphomas. Blood. 2001;97: 744-751.
- Chan Jk, Buchanan R, Fletcher
CD. Sarcomatoid variant of anaplastic large-cell Ki-1 lymphoma. Am J Surg
Pathol 1990; 14: 983-8.
- Chang CC , Liu YC , Cleveland
RP , Perkins SL. Expresion of c- Myc and P-53 correlates with clinical
outcome in diffuse large B-cell lymphomas. Am J Clin Pathol 2000 ; 113(4)
: 512-8.
- Chittal S, Al Saati T, Delsol
G. Epithelial membrane antigen in hematolymphoid neoplasms. A review. Appl
Immunohist 1997; 5: 203-215.
- Cogliatti SB, Griesser H, Peng
H, et al. Significantly different bcl-2 expression profiles in gastric and
non-gastric primary extranodal high-grade B-cell lymphomas. J Pathol 2000;
192: 470-478.
- Conconi A, Zucca E, Roggero E,
Bertoni F, Bernasconi A, Mingrone W, Pedrinis E, Cavalli F. Prognostic
models for diffuse large B-cell lymphoma. Hematol Oncol 2000;18(2):61-73.
- Contreras
E. Factores pronósticos en los linfomas no Hodgkinianos. En: ”6 Curso de
Hematopatología”, Ed.: Tomás Álvaro Naranjo, Ramón Bosch Príncep , Rafel
Balanzà Roure , Llorenç Font
Ferré, Salomé Martínez González , M. Teresa Salvadó Usach. ICS, 1999.
- De Brasi C , Narbaitz M ,
Rodriguez A , Larripa I , Slavutsky I. Bcl-2 molecular analysis in paraffin-embedded
biopsies from diffuse large B-cell lymphomas. Medicina 2000 ;
60(3):305-10.
- Donnelly GB, Glassman J, Long
C, Torres P, Straus DJ, O'Brien JP, Bertino J, Moskowitz CH, Zelenetz AD,
Portlock CS. Granulocyte-colony stimulating factor (G-CSF) may improve
disease outcome in elderly patients with diffuse large cell lymphoma
(DLCL) treated with CHOP chemotherapy. Leuk Lymphoma 2000;39(1-2):67-75.
- Eisen M B, Spellman P T, Brown
P O, & Botstein D. Cluster analysis and display of genome-wide expression
patterns. Proc. Natl. Acad. Sci. USA 1998; 95:14863-14868.
- Falini
B, Fizzotti M, Pucciarini A, et al. A monoclonal antibody (MUM1p) detects expresión of the MUM1/IRF4
protein in a subset of germinal center B cells, plasma cells, and
activated T cells. Blood 2000; 95: 2084-2092.
- Fang JM, Finn
WG, Hussong JW, Goolsby CL, Cubbon AR, Variakojis D. CD10 antigen
expression correlates with the t(14;18)(q32;q21) major breakpoint region
in diffuse large B-cell lymphoma. Mod Pathol. 1999 Mar;12(3):295-300.
- Gattei V, Godeas C, Degan M,
Rossi FM, Aldinucci D, Pinto A. Characterization of anti-CD138 monoclonal
antibodies as tools for investigating the molecular polimorphism of
syndecam-1 in human lymphoma cells. Br J Haematol 1999; 104(1): 152-62.
- Gustmann C, Altmannsberger M,
Osborn M, e al. Cytokeratin expresión and vimentin content in large cell
anaplastic lymphomas and other non-Hodgkin´s lymphomas. Am J Pathol 1991;
138: 1413-1422.
- Hara T, Tsurumi H, Takemura M,
Goto H, Yamada T, Sawada M, Takahashi T, Moriwaki H. Serum-soluble fas
level determines clinical symptoms and outcome of patients with aggressive
non-Hodgkin's lymphoma. Am J Hematol 2000;64(4):257-61.
- Harada S, Suzuki R, Uehira K,
Yatabe Y, Kagami Y, Ogura M, Suzuki H, Oyama A, Kodera Y, Ueda R, Morishima Y, Nakamura S, Seto M.
Molecular and immunological dissection of diffuse large B-cell lymphoma:
CD5+, and CD5- with CD10+ groups may constitute clinically relevant
subtypes. Leukemia 1999; 13: 1441-7.
- Harris NL, Jaffe ES, Stein H,
et al. A revised European-American classification of lymphoid neoplasms: a
proposal from the International Lymphoma Study Group. Blood 1994; 84:
1361-1392.
- Harris NL, Jaffe ES, Diebold D,
Flandrin G, Muller HK, Vardiman J, Lister TA, Bloomfield CD. World Health
Organization classification of neoplastic diseases of the hematopoietic
and lymphoid tissues: Report of the Clinical Advisory Committee
Meeting-Airlie House, Virginia, November 1997. J. Clin. Oncol. 1999; 17:
3835-3849.
- Hosokawa Y, Maeda Y, Ichinohasama
R, Miura I, Taniwaki M, Seto M. The Ikaros gene, a central regulator of
lymphoid differentiation, fuses to the BCL6 gene as a result of
t(3;7)(q27;p12) translocation in a patient with diffuse large B-cell
lymphoma. Blood 2000 15;95(8):2719-21.
- Hough RE, Goepel JR, Alcock HE,
Hancock BW, Lorigan PC, Hammond DW. Copy number gain at 12q12-14 may be
important in the transformation from follicular lymphoma to diffuse large
B cell lymphoma. Br J Cancer 2001;84(4):499-503.
- Hsi ED. The search for
meaningful prognostic markers in diffuse large B-cell lymphoma. Am J Clin
Pathol 2001; 115: 481-3.
- Jaffe ES. Introduction to the
WHO classification. Am J Surg Pathol 1997; 21: 114-121.
- Kaleem Z, White G,Vollmer RT.
Critical analysis and diagnostic usefulness of limited immunophenotyping
of B-cell non-Hodgkin lymphomas by flow cytometry. Am J Clin Pathol 2001; 115(1): 136-42.
- Kaleem Z, White G,Vollmer RT.
Aberrant expression of T-cell-associated antigens on B-cell non-Hodgkin
lymphomas. Am J
Clin Pathol 2001; 115: 396-403.
- King BE, Chen C, Locker J, Kant
J, Okuyama K, Falini B, Swerdlow SH. Immunophenotypic and genotypic
markers of follicular center cell neoplasia in diffuse large B-cell
lymphomas. Modern Pathol 2000; 13: 1219-1231.
- Kroft SH, Dawson DB, McKenna
RW. Large cell lymphoma transformation of chronic lymphocytic
leukemia/small lymphocytic lymphoma. A flow cytometric analysis of seven
cases. Am J Clin Pathol 2001;115(3):385-95.
- Kuwabara H, Nagai M, Shibanushi
T, Ohmori M, Kawakami K, Asakura H. CD138- positive and Kaposi’s sarcoma
associated herpesvirus (KSHV)-negative B-cell lymphoma with serosal
spreading of the body cavity and lymphadenopathy: an autopsy case. Hum
Pathol 2000; 31(9): 1171-5.
- Lasota J, Hyjek E, Koo CH, et al.
Cytokeratin-positive large cell lymphomas of B-cell lineage: a study of
five phenotypically unusual cases verified by PCR. Am J Surg Pathol 1996;
20: 346-354.
- Lossos IS, Alizadeh AA, Eisen
MB, et al. Ongoing immunoglobulin somatic mutation in germinal center B
cell-like but not in activated B-cell like diffuse large cell lymphomas.
Proc. Natl. Acad. Sci. USA 2000; 97:10209-10213.
- Lossos IS, Levy R. Higher-grade
transformation of follicle center lymphoma is associated with somatic
mutation of the 5' noncoding regulatory region of the BCL-6 gene. Blood
2000; 96(2): 635-9.
- Mohammad RM, Wall NR, Dutcher
JA, Al-Katib AM. The addition of bryostatin 1 to cyclophosphamide,
doxorubicin, vincristine, and prednisone (CHOP) chemotherapy improves
response in a CHOP-resistant human diffuse large cell lymphoma xenograft
model. Clin Cancer Res 2000; 6(12): 4950-6.
- Moller MB, Kania PW, Ino Y,
Gerdes AM, Nielsen O, Louis DN, Skjodt K, Pedersen NT. Frequent disruption
of the RB1 pathway in diffuse large B cell lymphoma: prognostic
significance of E2F-1 and p16INK4A. Leukemia 2000; 14(5): 898-904.
- Monni O, Franssila K, Joennsuu
H, Knuutila S. BCL2 over expression in diffuse large B-cell lymphoma. Leuk
lymphoma 1999; 34: 45-52.
- Morente MM, Piris MA. REAL Classification. Una propuesta del International Lymphoma Study Group para la clasificación de los linfomas. Patología 1995; 28: 319-358.
- Morente
M. Factores pronósticos en los linfomas no Hodgkinianos. En: ”5 Curso de
Hematopatología”, Ed.: Tomás Álvaro Naranjo, Ramón Bosch Príncep, Llorenç
Font Ferré, Salomé Martínez González, M. Teresa Salvadó Usach.
- Nagy M, Balazs M, Adam Z, Petko
Z, Timar B, Szereday Z, Laszlo T, Warnke RA, Matolcsy A. Genetic
instability is associated with histological transformation of follicle
center lymphoma. Leukemia 2000; 14(12): 2142-8.
- Nakamura N, Kuze T, Hashimoto
Y, Hara Y, Hoshi S, Sasaki Y, Shirakawa A, Sato M, Abe M. Analysis of the
immunoglobulin heavy chain gene variable region of CD5-positive and
-negative diffuse large B cell lymphoma. Leukemia 2001; 15(3): 452-7.
- Nakamura N, Kuze T, Hashimoto
Y, Hoshi S, Tominaga K, Sasaki Y, Shirakawa A, Sato M, Maeda K, Abe M.
Analysis of the immunoglobulin heavy chain gene of secondary diffuse large
B-cell lymphoma that subsequently developed in four cases with B-cell
chronic lymphocytic leukemia or lymphoplasmacytoid lymphoma (Richter
syndrome). Pathol Int 2000 Aug;50(8): 636-43.
- Non-Hodghin’s Lymphoma
Pathologic Classification Project: National Cancer Institute sponsored
study of classifications of non-Hodgkin’s lymphoma. Summary and
description of a working formulation for clinical usage. Cancer 1982; 49:
2112-2135.
- Nozawa Y, Wang J, Weiss LM,
Kikuchi S, Hakozaki H, Abe M.Diffuse large B-cell lymphoma with spindle
cell features. Histopathology 2001; 38: 177-8.
- Ottensmeier CH, Stevenson FK.
Isotype switch variants reveal clonally related subpopulations in diffuse
large B-cell lymphoma. Blood 2000; 96(7): 2550-2556.
- Pescarmona
E, de Sanctis V, Pistilli A, et al. Pathogenetic and clinical implications of bcl-6 and bcl-2
configuration in nodal diffuse large B-cell lymphomas. J Pathol 1997; 183:
281-286.
- Shipp M, Harris N, Mauch P. The
non-Hodgkin's lymphomas. In: DeVita VT,Hellman S,Rosenberg SA, eds. Cancer
Principles & Practices of Oncology. Philadelphia, PA: J.B. Lippincott;
1997: 2165-2220.
- Skinnider BF, Horsman DE,
Dupuis B, Gascoyne RD. Bcl-6 and Bcl-2 protein expression in diffuse large
B-cell lymphoma and follicular lymphoma: correlation with 3q27 and 18q21
chromosomal abnormalities. Hum Pathol 1999; 30: 803-808.
- Stopeck AT, Gessner A, Miller
TP, Hersh EM, Johnson CS, Cui H, Frutiger Y, Grogan TM. Loss of B7.2
(CD86) and intracellular adhesion molecule 1 (CD54) expression is
associated with decreased tumor-infiltrating T lymphocytes in diffuse
B-cell large-cell lymphoma. Clin Cancer Res 2000 Oct; 6(10): 3904-9.
- Sutcliffe M, Oscier D, Wright
DH. Syndecan-1(CD138) expression in human non-Hodgkin’s lymphomas. Br J
Haematol 2000; 110(1): 239-40.
- Szereday Z, Csernus B, Nagy M,
Laszlo T, Warnke RA, Matolcsy A. Somatic mutation of the 5' noncoding
region of the BCL-6 gene is associated with intraclonal diversity and
clonal selection in histological transformation of follicular lymphoma. Am
J Pathol. 2000; 156(3): 1017-24.
- Tamaru JI, Kawana H, Takahashi
Y, Takahashi N, Isobe K, Hirai A, Saito Y, Harigaya K, Itoyama S, Mikata
A. Expression of Cell Cycle Regulating Proteins in an Unusual
Transformation of Mantle Cell Lymphoma. Leuk Lymphoma 1999; 36(1-2):
128-137.
- Uherova P, Ross CW, Schnitzer
B, Singleton TP, Finn WG. The Clinical Significance of CD10 Antigen
Expression in Diffuse Large B-Cell Lymphoma. Am J Clin Pathol 2001; 115:
582-8.
- Vose JM. Current approaches to the
management of non-Hodgkin’s lymphoma. Semin. Oncol. 1998; 25: 483-491.
- Wotherspoon AC, Norton AJ,
Isaacson PG. Immunoreactive cytokeratins in plasmacytomas. Histopathology
1989; 14: 141-150.
- Zhang A, Ohshima K, Sato K,
Kanda M, Suzumiya J, Shimazaki K, Kawasaki C, Kikuchi M. Prognostic
clinicopathologic factors, including immunologic expression in diffuse
large B-cell lymphoma. Pathol Int 1999; 49(12): 1043-52.