INTRODUCCIÓN
VIRUS DE EPSTEIN-BARR
Generalidades
El VEB es un patógeno ubicuo que ha infectado a más del 90% de la población adulta. La infección por el VEB usualmente ocurre de forma subclínica en la infancia temprana. La primoinfección clinicamente aparente es la mononucleosis infecciosa, que generalmente afecta a individuos que no han sido expuestos al VEB hasta la juventud, siendo un cuadro autolimitado la mayoría de las veces. La puerta de entrada del virus es la orofaringe, siendo su transmisión a través de la saliva.
Estructura del VEB
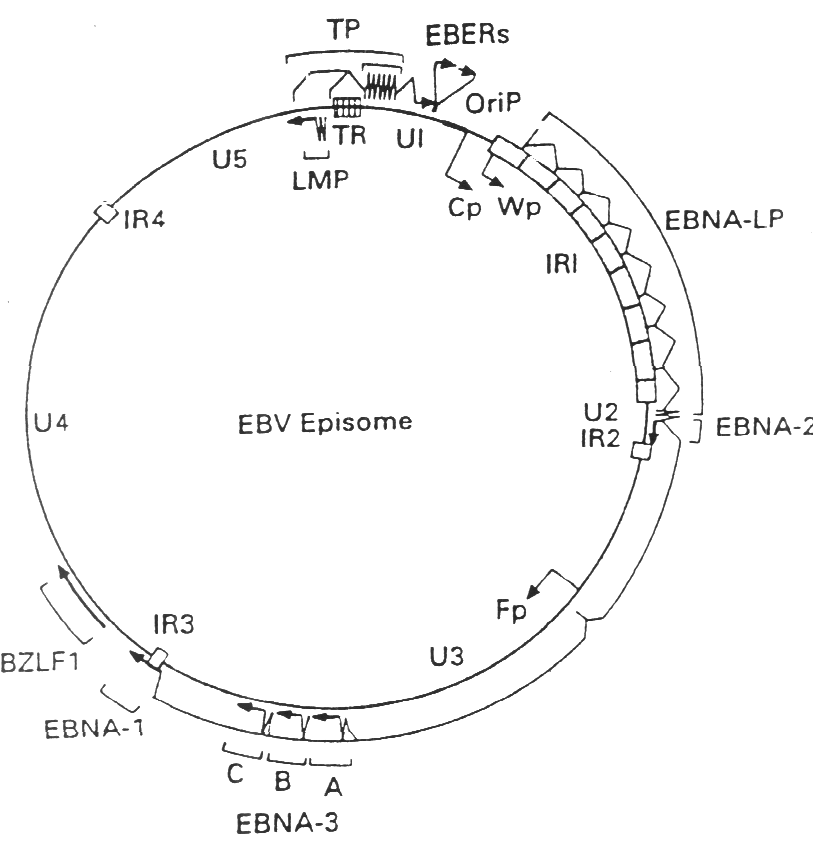
El genoma del VEB esta constituido por una molécula de ADN bicatenario de una longitud aproximada de 172 kb que codifica aproximadamente unas 100 proteínas. La molécula de ADN esta flanqueada en ambos extremos por un número variable de repeticiones terminales, cada una de ellas de una longitud aproximada de 500 pb. La recombinación entre estas repeticiones terminales origina la formación de una molécula extracromosómica cerrada de forma covalente o episoma, que es la estructura que el virus adopta en el núcleo de las células infectadas de forma latente.
Figura 1. Genoma del VEB: episoma
 |
Infección y respuesta inmune frente al VEB
El virus se trasmite por vía oral infectando a las células epiteliales de la orofaringe y posteriormente afecta a los linfocitos B del tejido linfoide adyacente. El receptor para el VEB de las células epiteliales y de los linfocitos B es el CD21.
En las células epiteliales se realiza un ciclo vital productivo en el que el virus se replica produciendo viriones e induciendo la lisis de la célula huésped. Este tipo de ciclo sólo se observa en la primoinfección y en los individuos inmunodeprimidos. Durante los estadios iniciales de la primoinfección, en los que se produce la replicación, se induce una marcada respuesta inmunitaria frente a los antígenos de la cápside que tienen capacidad neutralizante y previenen la viremia generalizada.
Como en el ciclo lítico se produce la muerte de célula infectada, los genes que se expresan exclusivamente en éste no deben tener demasiada importancia en la tumorogenesis, aunque hay dos de ellos que sí podrían tener un papel en el desarrollo de tumores: los genes BHRF1 y BCRF1.
Infección latente por VEB
Para comprender el papel patogénico que puede tener el VEB en el desarrollo de algunas neoplasias es importante conocer que después de la infección primaria, el VEB nunca es erradicado completamente del organismo, permaneciendo presente en una pequeña población de linfocitos B en una situación de relativa inactividad conocida como fase latente.
En el individuo normal existen clones de linfocitos T citotóxicos que reconocen de forma específica a las células B infectadas de forma latente por VEB siendo esta respuesta T fundamental para el mantenimiento de la vigilancia inmune frente al virus.
Los genes expresados en la infección latente son de especial interés en la patogénesis de las neoplasias asociadas al VEB (tabla 1).
Tabla 1. Genes del VEB cuyos productos podrían estar implicados en su oncogenicidad.
| EBNA 1 | Factor transcripcional, esencial para el mantenimiento del VEB. Induce la expresión de RAG1 y RAG2 in vitro |
| EBNA 2 | Factor transcripcional, esencial para la transactivación de LMP-1 |
| EBNA 3A (3B, EC) |
Factores transcripcionales, que favorecen una potente respuesta inmune |
| EBNA LP | Proteína que interfiere con la función normal de las proteínas p53 y pRb |
| LMP-1 | Única proteína del VEB con capacidad oncogénica demostrada, interacciona con receptores de la familia de los receptores del TNF (TRAF); causa sobrexpresión de la proteína Bcl-2 y de la IL-10 |
| LMP 2 A/B | Proteína relacionada con la familia src de proteínas tirosín kinasas, pudiendo controlar la actividad del ciclo lítico del VEB |
| EBER 1/2 | Fragmentos de ARN no transcritos, que se expresan muy abundantemente, cuya función es desconocida |
| BHRF 1 | Proteína homóloga de Bcl-2, capaz de inhibir la apoptosis |
| BCRF 1 | Proteína homóloga de la IL-10, capaz de estimular la proliferación celular B e inhibir la capacidad citotóxica de los linfocitos T |
Una de las características del VEB es su capacidad de transformar los linfocitos B in vitro estableciendo líneas celulares linfoblastoides, quedando el VEB en forma latente. De los muchos genes codificados por el virus sólo 11 se expresan en estas líneas celulares. Se trata de seis antígenos nucleares (EBNA-1, -2, -3A, -3B. -3C, -LP), tres antígenos de membrana (LMP-1, -2A, -2B) y dos ARNs de pequeño tamaño (EBERs 1 y EBERS 2).
Dependiendo de los genes expresados en la célula huésped, se han descrito tres formas diferentes de latencia del VEB, que se observan en las distintas líneas celulares y en las diversas patologías asociadas al VEB (tabla 2):
Tabla 2. Formas de latencia del VEB.
EBNA-1 |
EBNA-2, -3(A-C),-LP |
LMP-1 |
LMP-2A/B |
EBERS |
BHRF1 |
|
Latencia I LB |
+ |
- |
- |
? |
+ |
? |
Latencia II EH, CNF |
+ |
- |
+ |
+ |
+ |
? |
Latencia III TLP-PT TLP-VIH |
+ |
+ |
+ |
+ |
+ |
+ |
CNF: carcinoma nasofaríngeo; EH: enfermedad de Hodgkin; LB: linfoma Burkitt; TLP-PT: trastornos linfoproliferativos postransplante; TLP-VIH: trastornos linfoproliferativos asociados al SIDA.
ASPECTOS PATOGÉNICOS DEL VEB
Los mecanismos patogénicos por los que el VEB es capaz de inducir la aparición de tumores se relacionan con los productos derivados de algunos de sus genes que ejercen varias acciones sobre la célula huésped infectada, especialmente en la infección latente (tabla 3):
Tabla 3. Patogenia del VEB
| Inhibición de apoptosis | BHRF 1 y LMP-1 |
| Inducción de porliferación celular | LMP-1, EBNA-2, BCRF 1, EBNA-LP |
| Inducción de traslocaciones | EBNA-1 |
| Escape a la respuesta inmune | BCRF 1, mutantes delecionados de LMP-1 |
Mantenimiento de las poblaciones celulares infectadas ® inhibición de la muerte celular por apoptosis:
BHRF1, debido a su homología con bcl-2 podría interferir en el balance entre bcl-2 y bax y, mediante este mecanismo, inhibir la apoptosis.
LMP-1, que aumenta los niveles de bcl-2 y así inhibiría la apoptosis.
Inducción de proliferación celular:
LMP-1, única proteína del VEB que tiene demostrada capacidad oncogénica.
EBNA2, probablemente su actividad consiste en mediar la transactivación de LMP-1.
BCRF1, análoga a la IL-10 humana, actuaría como un factor de crecimiento autocrino de células B.
EBNA-LP ó EBNA-5, que parece puede formar complejos moleculares con p53 y pRb y secuestrando los productos de genes supresores, activaría la proliferación celular.
Inducción de recombinasas que posibilitan traslocaciones.
EBNA-1, que favorece la expresión de los genes RAG-1 y RAG-2, los cuales inducen recombinasas, cuya activación podría favorecer las recombinaciones aberrantes (traslocaciones).
Evasión de la respuesta inmune mediada por células T
Las proteínas virales más antigénicas para los linfocitos T son: EBNA3A, 3B y 3C, pero los linfocitos T responden también frente a EBNA-2, EBNA-LP, LMP-1 y LMP-2, aunque de forma mas débil.
Los métodos que utiliza el VEB para escapar a la respuesta inmune son :
Regulando a la baja las proteínas virales con mayor poder antigénico.
Inhibiendo a las células T mediante la secreción de algunas citocinas por la células infectadas como IL-10 y TGF.
Produciendo mutantes delecionadas de LMP-1 que la hacen resistente a la respuesta inmune T.
DETECCIÓN DEL VEB EN LOS TEJIDOS
Técnicas moleculares para la detección del ADN (genoma):
Southern Blot: es necesario disponer de tejido congelado y se realiza con marcaje radiactivo; permite la demostración de clonalidad (hibridando la región terminal repetida).
PCR: puede utilizarse ADN extraído de parafina, es más sensible que la técnica anterior; permite tipificar la cepa del VEB (Tipo 1 o 2) y detectar la presencia de deleción en el oncogen LMP-1.
Ninguna de estas dos técnicas permite identificar las células infectadas por el virus.
Técnicas moleculares de Hibridación in situ (HIS) para ADN o ARN:
Ambas se realizan sobre cortes de tejido fijado en formol e incluido en parafina; permiten utilizar un sistema de detección no-radiactivo combinando la hibridación in situ con la inmunohistoquimica; y posibilitan la identificación de la célula infectada.
En concreto, la HIS para la determinación de EBERS (ARN) es un método muy sensible ya que los EBERs están presentes en las células infectadas de forma latente en un gran número de copias. Es la técnica más recomendada para el diagnóstico histológico.
Técnicas inmunohistoquímicas para la detección de diferentes proteínas virales
Existe anticuerpos comerciales para la detección de LMP-1, EBNA-1, EBNA-2 y ZEBRA; permiten la utilización de tejidos procesados rutinariamente; y ayudan a valorar la expresión de los productos del VEB en la población tumoral.
Tabla 4. Técnicas moleculares empleadas para la detección del VEB
¿Cómo detectar el VEB en un tejido?
¿Qué detecta? |
Ventajas |
Inconvenientes |
|
| Southern blot | genoma viral (ADN) |
Clonalidad |
Sólo congelación |
| PCR | genoma viral (ADN) |
Sensibilidad Parafina y cong. |
No localizador |
| Hibridación in situ | ARN o ADN |
Sensibilidad Localizador |
Caro |
| Inmunohistoquímica | LMP-1, EBNA-1, ZEBRA, etc. |
Localizador Demostración de funcionalidad |
No siempre se detecta expresión |
|
Figura 1a. PCR Genoma viral TC60-61.