 Fig 9.
Fig 9.
Con el objeto de obtener unos resultados fiables y reproducibles consideramos fundamental una metodología rigurosa en consonancia con las recomendaciones de la Conferencia de Consenso en todos los aspectos que a continuación mencionaremos.
1. Toma y conservación de las muestras.
El material utilizado para Citometría de ADN debe reflejar la
composición de la muestra de la que procede. Es conocido el
hecho de que distintos tipos de tumores presentan heterogeneidad
locorregional, por tanto la muestra deberá ser seleccionada por
un patólogo, de tal forma que sea adecuada (componente tumoral
neto, cantidad suficiente, ausencia de necrosis, sangre o grasa)
y representativa (tomada de distintas regiones y a distinta
profundidad).
El estado de conservación de la muestra es un factor importante
a tener en consideración. Puede tratarse de material fresco o
congelado, así como de células procedentes de material incluido
en parafina las cuales ya han sido fijadas. En términos
generales, para la cuantificación de ADN, la fijación previa
del material es innecesaria.
2. Transporte y almacenaje
Este es otro aspecto determinante para garantizar unos resultados
de calidad. El tipo de transporte depende de la proximidad así
como de la disponibilidad del citómetro. Es crucial que el
tiempo entre la extracción de la muestra y el procesamiento o la
conservación del mismo sean mínimos. La muestra puede ser
congelada directamente sin disgregar o en forma de suspensión
celular en medio tamponado de citrato con un 0.1% de DMSO. El
almacenamiento que mejor y durante más tiempo conserva las
muestras es el nitrógeno líquido.
3. Obtención de suspensiones celulares
Disgregación
Un paso decisivo e imprescindible en la cuantificación de ADN
por Citometría de Flujo es la obtención de suspensiones
celulares. El tratamiento de la muestra depende fundamentalmente
de dos factores: por un lado la naturaleza de la muestra, y por
otro su estado de conservación.
La disociación celular continúa siendo el mayor obstáculo en
la preparación de las muestras para citometría de flujo en el
caso de tejidos sólidos.
Para disgregar un tejido sólido hemos de tener en cuenta que la
mayoría de las células de los organismos pluricelulares están
en relación con una intrincada trama de macromoléculas
extracelulares que constituyen la llamada matriz extracelular. En
el caso concreto de los tejidos epiteliales, las células se
encuentran frecuentemente unidas por desmosomas y con muy poco
material intercelular adyacente. Los enlaces extremadamente
rígidos existentes hacen que la disociación del epitelio sea un
proceso difícil.
Existen numerosas técnicas descritas para la separación
celular: enzimática (tripsina, pepsina, pronasa, etc), mecánica
(bisturí, tijeras, aguja), mediante reactivos químicos como
EDTA o EGTA, o detergentes (Nonidet P-40, Triton X-100, etc).
Para la preparación de una suspensión de células singulares
dichas técnicas pueden ser utilizadas, aunque no existe una
técnica adecuada para todas las circunstancias. A pesar de ser
un paso crucial en el estudio citométrico la literatura rara vez
especifica la técnica de disgregación utilizada en detalle,
siendo este un tema a discutir y consensuar. Nosotros utilizamos
una disgregación combinada mecánica (cortando el tejido con
bisturí en pedacitos de 1mm) y enzimática (tripsina).
Tras una disgregación habrán de tenerse en cuenta las
siguientes consideraciones:
1. Heterogeneidad y representatividad de la muestra
2. Rendimiento de la disgregación (pérdida selectiva de
células)
3. Estado de células o núcleos. (Revisar mediante examen
citológico)
4. Proporción detectable de eventos anómalos (por ej.
aneuploides).
5. Tipo o tipos celulares presentes (inflamación?)
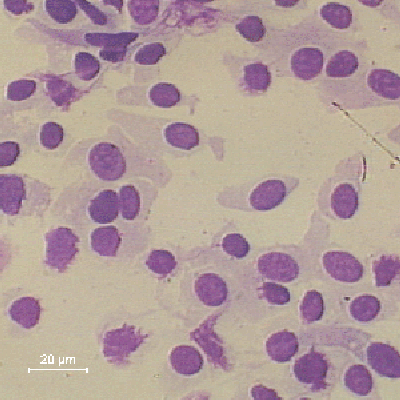
Control citológico
Con el fin de garantizar una buena muestra de partida para el
análisis citométrico, es fundamental realizar un control del
estado de las células tras la disgregación. Para ello
procedemos a teñir mediante un Giemsa rápido y archivamos las
laminillas con el mismo número de registro que el estudio
citométrico.(Fig 9).
 Fig 9.
Fig 9.
El procedimiento más utilizado para la tinción del ADN,
descrito por Vindelöv et col., comprende tres fases:
1. En primer lugar, se incuba la suspensión con una disolución
de tripsina para facilitar la digestión de membranas y otros
restos celulares en medio de reguladora citrato.
2. Un segundo paso comprende la inhibición de esta digestión y
adición de ARNasa para eliminar el ARN presente.
3. En un tercer paso se procede a la tinción con Ioduro de
propidio (concentración final de 50 mg/ml). Es un colorante de
intercalación del ADN y ARN, considerándose su unión
estequiométrica, siempre que se encuentre a una concentración
saturante. Tras la incubación de la suspensión en estas tres
disoluciones durante diez minutos en cada una de ellas, la
muestra está preparada para ser adquirida en el Citómetro de
Flujo. En la fig 10 se muestra el aspecto de la suspensión
celular preparada mediante esta técnica, imagen obtenida por
Microscopía Láser-Confocal.
 Fig 10.
Fig 10.
Aunque algunos autores proponen el uso de linfocitos o células rojas nucleadas de otras especies como estándar, se ha comprobado que la desviación de la fluorescencia del estándar respecto a la esperada del pico diploide puede ser consecuencia de variaciones en el enlace con el fluorocromo o porque las células estén muertas o en proceso de muerte celular, en apoptosis o con su DNA dañado. Por todo ello el mejor estándar es el componente sano del mismo tejido. En nuestra experiencia utilizamos siempre que es posible tejido sano del mismo órgano y del mismo individuo que procesamos en paralelo a la muestra tumoral.Para comprobar la linealidad del instrumento utilizamos una suspensión de eritrocitos de pollo.
Ajuste instrumental y adquisición.
Una vez que la suspensión de núcleos está preparada para ser
introducida en el Citómetro de Flujo, se adquieren los datos que
posteriormente nos darán información a cerca de esa muestra. En
la adquisición es necesario tener en cuenta una serie de
consideraciones de carácter instrumental así como de manejo,
estas son las siguientes: selección de los parámetros de
interés, comprobación de la linealidad del citómetro
(calibración), y establecimiento del número de células a
analizar (10-20.000).
Análisis de datos e interpretación del histograma de
ADN.
Los histogramas de ADN requieren un análisis matemático para
extraer información a cerca de las fases del ciclo celular y de
la ploidía.
El contenido real de ADN exhibe siempre distribuciones con cierta
varianza en torno al valor 2C debido al proceso de tinción,
errores instrumentales y/o diferencias de célula a célula en el
contenido en DNA. La colección de datos en un histograma se
encuentra distribuida en canales o intervalos de resolución
donde pueden recogerse uno o más picos modales. Por tanto, en un
histograma diploide veremos un primer pico correspondiente a las
células G0/G1, un segundo pico de menor número de células
correspondiente a G2/M y una banda entre ambos picos
correspondiente a la fase S. En un histograma aneuploide se
observará además la presencia de otra u otras poblaciones
además de la diploide en las cuales puede también distinguirse
las fases G0/G1, S y G2/M de las poblaciones aneuploides.
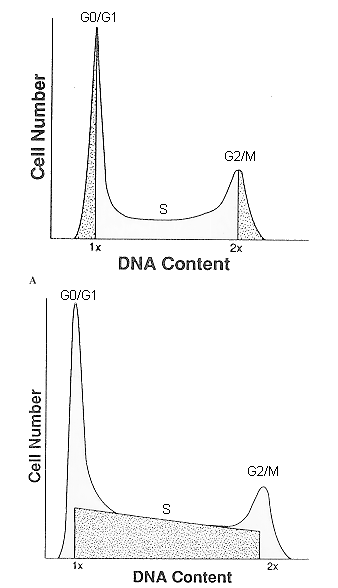
Existen distintos métodos desarrollados en las últimas dos décadas de mayor o menor complejidad para evaluar las fases de proliferación en el Ciclo Celular. Se pueden encontrar en el mercado varios programas informáticos específicos para el análisis de ciclo celular.
Calidad de los resultados
En el informe del contenido de ADN por CF de una muestra tumoral
deberán estar reflejada al menos la siguiente información:
El grupo de Oviedo hemos realizado un estudio de
control de calidad poniendo a disposición de las personas
interesadas los histogramas analizados de 10 casos de colon de
difícil interpretación junto con los ficheros que generaron
dichos histogramas para su discusión por red. La dirección de
INTERNET es la siguiente:
http://www10.uniovi.es/sic/casos.htm