
 Nº 845. Comunicación libre
Nº 845. Comunicación libre
|
Inmunoexpresión de la ubicutina y telomerasa en cáncer de cuello uterino. Morelva C. Toro de Méndez[1], Antonio Llombart Bosch[2] |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
lay:none">fiogf49gjkf0d Con el interés de conocer el patrón de expresión de la ubicuitina y la telomerasa en la neoplasia cervical invasora en nuestro medio nos propusimos los siguientes objetivos: establecer el patrón de expresión inmunohistoquímica en biopsias de cáncer de cuello uterino, comparar la expresión inmunohistoquímica de la ubicuitina y la telomerasa cáncer cervical con la expresión en tejido cervical benigno y correlacionar la inmunoexpresión de estos biomarcadores con los tipos histológicos de cáncer cervical. Se llevó a cabo un estudio inmunohistoquímico para evaluar la expresión de la ubicutina y la telomerasa en 81 biopsias de cáncer de cuello uterino (59 carcinomas epidermoides y 19 adenocarcinomas cervicales) y en tejido cervical benigno diagnosticados en el Servicio de Anatomía Patológica del Hospital Clínico Universitario de Valencia, España, mediante la técnica de avidina-biotina-inmunoperoxidasa, utilizando los anticuerpos primarios: para ubicuitina un anticuerpo policlonal y para telomerasa el clon 44F12; los resultados fueron interpretados mediante una escala semicuantitativa. El tipo histológico más frecuente fue el carcinoma epidermoide moderadamente diferenciado (43.5%) y el adenocarcinoma endocervical (42.1%). La edad promedio de las pacientes fue 50.67±13.62 años. Los hallazgos inmunohistoquímicos fueron los siguientes: los tumores cervicales mostraron inmunorespuesta para la ubicuitina en el 98.7% y para la telomerasa en el 52.6%. Se encontraron diferencias estadísticamente significativas en la inmunoreactividad de los tumores en comparación con los controles (p <0,0007, en los dos biomarcadores). Ambos tipos histológicos de tumor mostraron sobrexpresión de estos biomarcadores sin diferencias significativas. El cáncer de cuello uterino asociado a infección por virus papiloma humano (HPV) oncogénico se caracteriza porque muestra inmunoreactividad alterada, con sobrexpresión de la ubicuitina que indica la existencia de una intensa degradación de proteínas y activación de la enzima inmortalizadora de células neoplásicas, la telomerasa.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Los virus papiloma humanos (HPV) oncogénicos son capaces de desplegar diferentes mecanismos moleculares, interrelacionados entre ellos mismos, para inducir el desarrollo de un clon celular con fenotipo maligno (zur Hausen, 2000; von Knebel-Doeberitz, 2002). Dichas interacciones son mediadas por proteínas que podrían usarse como marcadores moleculares e indicadores de alteración en los mecanismos de control celular, permitiendo de esta forma, estudiar estas vías moleculares complejas mediante diferentes técnicas de investigación y diagnóstico como la inmunohistoquímica (Syrjänen, 2005). Considerando que el cáncer de cuello uterino y sus lesiones precursoras son inducidas por la infección persistente con ciertos tipos de HPV oncogénicos (Muñoz et al, 2003; Moscicki y cols, 2006) se establece la necesidad de investigar, identificar y validar nuevos biomarcadores en el diagnóstico precoz de la lesión pre-neoplásica cervical (von Knebel-Doeberitz y Syrjänen, 2006). El cáncer de cuello uterino es la segunda causa de mortalidad en la población femenina a nivel mundial; cada año se diagnostican cerca de 500.000 nuevos casos de cáncer cervical y cerca de la mitad de estas pacientes fallecen, encontrándose las mayores tasas de incidencia y mortalidad en los países pobres y en vías de desarrollo (Bosch y de Sanjosé, 2003). Además de la detección y genotificación del HPV, en la actualidad se están validando una serie de biomarcadores tumorales que permitan identificar aquellas pacientes con infección por HPV y cuya presencia provoque alteraciones celulares que evolucionen a un cáncer. Dichos biomarcadores son de interés no sólo para complementar el diagnóstico histopatológico y una mejor comprensión de los eventos que conllevan al desarrollo del cáncer sino que además podrían implementarse como complemento de diagnóstico utilizando las muestras celulares de la pesquisa de cáncer cervical de rutina (von Knebel-Doeberitz y Syrjänen, 2006). La expresión continua de los oncogenes E6 y E7 de los HPV de alto riesgo oncogénico (AR), tanto en las lesiones intraepiteliales escamosas de alto grado (LIEAG) como en el cáncer invasor, altera la funcionalidad de una gran variedad de proteínas celulares reguladoras (revisado en Scheffner 1998; Jarboe et al, 2002; Scheffner y Whitaker, 2003; Kim y Zhao, 2005). La estabilidad de la longitud del telómero, en las células humanas germinales y también en las células altamente proliferativas, se requiere para la supervivencia ilimitada y para el fenotipo inmortal de las células derivadas del cáncer. Esta característica se logra a través de la expresión de la enzima telomerasa transcriptasa reversa (telomerase reverse transcriptase, TERT), la cual sintetiza repetidamente secuencias de un patrón de ARN por transcripción reversa, que se van añadiendo al telómero y a su vez alargando la vida celular (Hanahan y Weinberg, 2000). Se han llevado a cabo múltiples estudios para evaluar a la telomerasa como un posible marcador de neoplasia intraepitelial cervical y cáncer como un adjunto al diagnóstico citológico para evaluar a aquellas pacientes con anormalidades en células epiteliales del cuello uterino, tanto en biopsias como en muestras celulares (Jarboe et al, 2002; Reesink-Peters et al, 2003; Bravaccini et al, 2005; Jarboe et al, 2004; Pinto-Tang et al, 2005). La oncoproteína E6HPVAR activa la enzima telomerasa predominantemente por medio del estímulo de la transcripción del gen hTERT (Gewin y Galloway, 2001; Oh et al, 2001), inmortalizando a las células cervicales transformadas (Jarboe et al, 2002; Branca et al, 2005) y se ha demostrado que en el cáncer cervical y en las LIEAG, la actividad de esta enzima está más aumentada que en el tejido cervical normal (Takakura et al, 1998; Wang et al, 2004; Branca et al, 2006). Existen casos de cáncer cervical con niveles elevados de actividad telomerasa en los cuales se ha detectado la presencia de ADN-HPV 16 y 18 (Anderson et al, 1997) así como en LIEAG con infección asociada por un HPVAR (Yashima et al, 1998). El mecanismo por medio del cual E6HPVAR induce la activación de la telomerasa en las células con inestabilidad genómica parece involucrar al gen myc. La formación del complejo E6-myc provoca la expresión del gen hTERT, mediante la activación del promotor de este gen (Veldman et al, 2001; Fehrmann y Laimins, 2003). La actividad de la oncoproteína E6-HPVAR es relevante en el proceso de inmortalización celular y sugiere que otros genes celulares (myc) podrían estar regulados por esta proteína viral, a favor del mantenimiento de la progresión celular e inmortalización (Veldman et al, 2003). La remoción rápida de enzimas y proteínas reguladoras de acción limitada es esencial para el control del crecimiento y el metabolismo celular. Una vía rápida de degradación de proteínas intracelulares se inicia con la adición de múltiples monómeros de ubicuitina, seguida del reconocimiento y degradación de la proteína-sustrato específica por parte de la organela proteosoma 26S (Pagano, 1997). La proteolisis no lisosómica mediada por la vía ubicuitina-proteosoma incluye a una variedad de proteínas celulares generalmente de vida media corta, dentro de las cuales se incluyen, entre otras, las ciclinas (D1y E), los inhibidores de kinasa dependientes de ciclinas (específicamente la p27KIP1), los productos de los genes supresores de tumor (p53 y pRb), los factores de transcripción (E2F) y receptores de membrana. También son degradadas por esta vía aquellas proteínas mutadas que podrían afectar la homeostasis celular (Rolfe et al, 1997; Scheffner, 1998). Aparte de la degradación de proteínas, la activación de la ubicuitina es considerada un mecanismo que interviene en los procesos de señalización celular tanto fisiológicos como patológicos, implicados en muchas funciones celulares no proteolíticas como la transcripción de genes, reparación del ADN y tráfico intracelular. Este mecanismo de señalización funciona de la misma manera que la fosforilación proteínica (Haglund y Dikic, 2005). Las proteínas que deben degradarse (sustrato) son ubicuitinizadas durante una reacción dependiente de ATP. A tales proteínas se van añadiendo varias moléculas de ubicuitina (enzima polipeptídica de 76 aminoácidos) en cadena, unidas covalentemente a la proteína-sustrato; el sustrato poliubicuitinizado o “marcado” de esta forma es reconocido por el complejo multiproteínico proteosoma 26S de forma cilíndrica, que cataliza la ruptura de las proteínas-sustrato hasta conseguir pequeños péptidos de El miembro del sistema ubicuitina E3 se considera el más importante en el paso del reconocimiento de la proteína específica destinada a la degradación, debido a que es el que se une directamente al sustrato. Esta selectividad se debe a que las células contienen una variedad de E2 y E3 que son específicas para diferentes tipos de proteínas (revisado en Mitch y Goldberg, 1996). De estas enzimas ligasas E3 celulares se ha logrado clonar Muchos tumores humanos mantienen activado el sistema proteolítico ubicuitina-proteosoma, con la consecuente degradación rápida de numerosas proteínas que conllevan al característico descontrol en la proliferación celular de las neoplasias (Pagano, 1997). En el proceso de carcinogénesis del cuello uterino, la integración del genoma de ciertos HPV oncogénicos, como los tipos HPV 16 y 18, al genoma de la célula que lo hospeda, permite la expresión continua pero sin control de los oncogenes virales E6 y E7 (zur Hausen, 2000). La unión covalente de oncoproteínas de HPV a la ubicuitina y a otras proteínas relacionadas a esta, modifican e inducen la degradación de las proteínas celulares que les convenga. Algunas oncoproteínas inclusive son blanco del sistema ubicuitina-protesoma y aprovechan esta situación para unirse directamente a las proteínas celulares específicas, atrayendo el efecto de este sistema hacia las propias proteínas celulares, y doblegando a la célula para su beneficio. El mejor ejemplo es el HPV (revisado en Scheffner y Whitaker, 2003). Los HPVAR 16 y 18 utilizan el sistema proteolítico celular ubicuitina-protesoma para dianizar a los productos supresores de tumor, p53 y pRb, provocando la degradación rápida de estas proteínas reguladoras a través de HPVAR-E6 y E7. Para la propagación del HPV y la continua expresión de sus principales oncoproteínas, es necesario que la célula infectada sea conducida irreversiblemente hacia la fase de síntesis del ciclo celular. Para ello, se forma el complejo E7-HPVAR-pRb que deja libre al factor de transcripción E2F activo y sin restricciones. Esta interacción conduce a la degradación de la pRb mediada por la ubicuitina-proteosoma (Boyer et al, 1996; González et al, 2001). La oncoproteína E7-HPVAR recluta a la enzima ligasa-ubicuitina E3 para dianizar la pRb que, de esta forma, queda ubicuitinizada para posterior degradación ejecutada por el protesoma 26S. Es posible también que E7 sirva como adaptador directo entre la pRb y el proteosoma 26S, de modo que la pRb es degradada más rápidamente sin previa ubicuitinización (Berezutskaya y Bagchi, 1997). Por tanto, la pRb puede verse inactivada y conducida a degradación rápida en aquellas células del epitelio cervical infectadas por HPVAR. La acción específica de la oncoproteína E6 sobre la proteína p53 es una interacción funcionalmente equivalente a la inactivación de p53 por mutación, lo cual indica que el complejo E6-HPVAR-p53 representa uno de los eventos más importantes de la carcinogénesis cervical, dada la interrupción de los puntos de control e inhibición de la apoptosis La oncoproteína E6 atrae a la enzima ligasa E6-AP para que le permita unirse a la p53, de forma que sea ubicuitinizada; así la p53 poliubicuitinizada es reconocida y degradada por el proteosoma 26S. Por tanto, la expresión inmunohistoquímica de p53 en células neoplásicas cervicales podría ser nula, si a esto se suma la acción reguladora de la proteína MDM-2. La degradación de la p53 inducida por E6-E6AP es un logro significativo de los HPVAR para alcanzar la transformación maligna de las células epiteliales del cuello uterino, en conjunto con la inactivación y degradación de la proteína Rb (Sheffner, 1998). Si consideramos la acción proteolítica de las oncoproteínas E6 y E7 de los papilomavirus humanos oncogénicos sobre las proteínas supresoras de tumor p53 y pRb utilizando la vía de degradación ubicuitina-proteosoma, podríamos deducir que la ubicuitina altamente conservada tanto en el núcleo como en el citosol, se encontrará sobrexpresada en aquellas lesiones neoplásicas del cuello uterino asociadas a infección por HPV oncogénico. Con el interés de conocer el patrón de expresión de la ubicuitina y la telomerasa en la neoplasia cervical invasora de nuestro medio nos propusimos los siguientes objetivos: establecer el patrón de expresión inmunohistoquímica en biopsias de cáncer de cuello uterino de la ubicuitina y la telomerasa, comparar la expresión inmunohistoquímica de la ubicuitina y telomerasa en cáncer cervical con la expresión de estos en tejido cervical benigno y correlacionar la inmunoexpresión de estos biomarcadores con los tipos histológicos de cáncer cervical.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
1. Muestra. El material para estudio consistió en la selección de casos de cáncer invasor de cuello uterino diagnosticados en el Servicio Anatomía Patología del Hospital Clínico Universitario de Valencia, utilizando los archivos muertos y computarizados de este servicio. Se incluyeron dos grupos, el primero con los casos diagnosticados durante los años 2. Ensayo inmunohistoquímico. Para el presente estudio se construyeron por separado dos micromatrices de los tumores cervicales con la finalidad de evitar la pérdida definitiva de los discos de tejido tumoral, garantizando así su presencia en una micromatriz o en otra. Para las micromatrices de tejido benigno, se tomo de cada bloque la parte de exo y endocérvix. Construimos 6 micromatrices tisulares en la que incluimos todos los casos de cáncer de cuello uterino seleccionados: dos micromatrices tisulares, marcadas como A y B, cada una de ellas con áreas distintas del tumor constituidas ambas por carcinomas epidermoides. Incluyen como testigos para orientarnos y como controles de reactividad conocida: 1 tumor vesical y 1 tejido de cuello uterino benigno y como controles positivos (de reactividad conocida): 1 tumor de mama, 1 linfoma y 1 tumor vesical. Dos micromatrices tisulares, marcadas como A y B, cada una de ellas con áreas distintas del tumor constituidas ambas por adenocarcinomas endocervicales. Incluyen como testigos para orientarnos y como controles de reactividad conocida: 1 tumor vesical y 1 tejido de cuello uterino benigno y como controles positivos (de reactividad conocida): 1 tumor de mama, 1 linfoma y 1 tumor vesical. Una micromatriz tisular de exocérvix benigno (n=22) y una micromatriz tisular de endocérvix benigno (n=22). La técnica inmunohistoquímica empleada en este estudio estuvo basada en la técnica avidina-biotina-inmunoperoxidasa con modificaciones: se realizó la desparafinización e hidratación de las micromatrices tisulares y controles negativos colocandolas por lo menos 12 horas en la estufa de En el caso concreto de la inmunodetección de la telomerasa, después de colocar el anticuerpo primario correspondiente usamos el kit de detección EnVisión™, HRP (DAKO Cytomation, Dinamark) de acuerdo a las especificaciones de la casa comercial, incubamos las micromatrices tisulares durante 30 minutos con el anticuerpo secundario (EnVision™). Finalmente, colocamos la solución sustrato-DAB cromógeno (EnVision™). Es importante detallar lo siguiente. Inicialmente el proceso de inmunotinción contra el antígeno telomerasa (1:50) se llevó a cabo siguiendo los pasos convencionales de la técnica contrastando con hematoxilina de Harris. Sin embargo, debido a que no obtuvimos resultados satisfactorios en los casos de neoplasia cervical invasora en estudio, a pesar de que el control positivo (linfoma) mostró intensa reactividad (+++) para telomerasa, se realizó una segunda inmunotinción con el anticuerpo diluido 1:20, utilizando nuevamente EnVisión y contratinción con hematoxilina de Harris. Finalmente, se efectuó una tercera vez pero contrastando con verde de metilo al 0.5%, debido a que encontramos núcleos con reactividad muy débil que se sospechó podría estar solapada por la contratinción nuclear ya que se apreciaban tonalidades semejantes, de esta forma podríamos confirmar los casos sin reactividad (verdaderos negativos) y reclasificar aquellos casos con reactividad dudosa (falsos negativos). Incluimos como control negativo un corte de tejido cervical neoplásico que fue procesado en las mismas condiciones que las micromatrices tisulares pero omitiendo el anticuerpo primario. Los controles positivos estaban constituidos por tejido neoplásico con reactividad conocida ante los biomarcadores en estudio, procedentes de un tumor vesical, un tumor mamario y un linfoma. Estos controles fueron incluidos en cada micromatriz tisular. Se realizó un contaje celular abarcando todo el diámetro del disco tumoral como un todo (100%). Se consideró una reacción positiva ante el anticuerpo cuando la célula, tumoral o normal, mostró tinción marrón a nivel del compartimiento específico o diana para cada anticuerpo: nuclear o citoplasmática. Todas las matrices tisulares fueron evaluadas, sin conocimiento de los datos clinicopatológicos, por un primer observador y posteriormente por un patólogo experimentado. Los casos con discordancia, fueron revisados nuevamente, utilizando un sistema de monitor adaptado al microscopio, para la observación simultánea por ambos observadores y así acordar por consenso la inmunoreactividad definitiva. El porcentaje de células neoplásicas o normales con reactividad fue estimado considerando un mínimo de 100 células por disco tisular. La distribución de las células inmunoreactivas se efectuó mediante una escala semicuantitativa como se especifica a continuación: negativo menos del 5% de las células reactivas; + de 5% a <25% de células reactivas. ++ de 25% a 50% de células reactivas. +++ más del 50% de células reactivas. Además, consideramos cualitativamente la intensidad de la tinción a nivel de cada segmento celular en determinados anticuerpos, mencionando la intensidad como: baja, moderada o alta, dependiendo de la palidez de la tinción o, por el contrario, de la observación de inmunoreactividad moderada o intensa. Análisis estadístico.
Los datos fueron almacenados en una base de datos de Access para Microsof Office. Para el estudio estadístico empleamos variables binarias, reflejando la presencia/ausencia de una determinada característica histopatológica o categórica en función de la naturaleza de las variables analizadas. Con la finalidad de simplificar el análisis, recodificamos los datos relacionados con la ubicutina, agrupando los intervalos con menor número de casos. La asociación entre las diferentes variables se determinó utilizando el test de En el caso de variables ordinales, aplicamos el coeficiente de correlación de Pearson, r, que es una medida de la asociación lineal entre dos variables, y el coeficiente de correlación de Spearman, que es una medida de la asociación entre los órdenes de los rangos. Los valores de ambos varían entre -1 (relación negativa perfecta) y +1 (relación positiva perfecta). Un valor de 0 indica que no existe relación lineal alguna. Todos los tests empleados están incluidos en el paquete estadístico SPSS (versión 12.0). Se estableció el nivel de significación estadística a partir del 5% (p=0.05). En todos los test se han tomado como límites de significación p=0.05, considerándose: no significativo p>0.05; significativo p=0.05; muy significativo p<0.01 y altamente significativo p<0.005
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
1. Clinico-patológicos. La serie de tumores de cuello uterino incluida en este estudio quedó conformada por 66 casos de carcinoma invasor de cuello uterino diagnosticados entre 2000-05 más 15 casos diagnosticados entre 1969 y 1998, lo que suma un total de 81 carcinomas cervicales. La edad de la paciente para cada caso de cáncer de cuello uterino se obtuvo a partir del informe histopatológico realizado originalmente en este servicio, dato que se recopiló en 58 casos. El rango de edad de las pacientes fue de De los 81 tumores de cuello uterino, 62 eran carcinoma epidermoide (76.5%) y 19 eran adenocarcinoma (23.5%). En la población de carcinoma epidermoide de cuello uterino de este estudio predominó el grupo de tumores moderadamente diferenciados (MD) (43.5%), seguido de los bien diferenciados (BD) (21%). El grupo de los carcinomas con menos diferenciación quedó conformado por 22.6% de los inmaduros (I) más el 12.9% de los inmaduros e indiferenciados (II). considerando los subtipos histológicos en los casos de adenocarcinoma cervical obtuvimos que la mayor proporción de adenocarcinomas pertenece al tipo endocervical (42.1%), seguido de los adenocarcinomas endometrioides (26.3%); los tipos villoglandular y papilar alcanzaron porcentajes el 15.8% y 10.5%, respectivamente; el 5.3% restante representa a un tipo mucinoso. El diagnóstico histopatológico correspondiente a los 22 controles de cuello uterino consistió en: 1 cuello uterino normal, 16 con diagnóstico de metaplasia escamosa, 2 con cervicitis crónica, 2 con cervicitis quística y 1 con hiperplasia cervical quística. 2. Inmunoexpresión de biomarcadores en tumores y controles. Durante la evaluación de la inmunoexpresión de la proteína ubicuitina, consideramos positivas las células con tinción tanto nuclear como citoplasmática. Para este antígeno evaluamos 80/81 casos de cáncer cervical, de los cuales 79(98.7)% mostraron sobrexpresión de ubicuitina y sólo 1 caso fue negativo. De los 44 controles evaluamos 43 y en 10(23.30%) no hubo respuesta para ubicuitina. Debido que en la literatura no encontramos referencias que describieran el posible patrón de tinción inmunohistoquímica de la telomerasa a obtener en cáncer de cuello uterino, utilizamos como control positivo interno la tinción nuclear en los linfocitos, además de un control positivo externo correspondiente a un linfoma. La contratinción con colorante citoplasmático verde de metilo al 0.5% nos permitió confirmar los casos negativos y reclasificar los casos con reactividad dudosa. Los controles positivos y negativos, internos y externos incluidos en esta oportunidad, mostraron la reactividad esperada. Evaluamos 78/81 casos de cáncer cervical, de los cuales 41(52.6%) fueron inmunoreactivos y 37(47.4%) no mostraron reactividad ante el anticuerpo frente a la telomerasa. Los controles fueron evaluados en su totalidad: 10(22.7%) positivos y 34(77.3%) negativos. Al comparar la expresión de la ubicuitina en los tumores y controles encontramos diferencias muy significativas (p<0.0007), demostrando que la degradación de proteínas es más intensa en los tumores que en los controles. La inmunoexpresión de la telomerasa entre los tumores y controles mostró también diferencias muy significativas (p<0.0007), pues la expresión de esta enzima fue mayor en los tumores. Todos estos resultados se presentan en la tabla Nº 1 y figura Nº 1. Tabla Nº 1. Inmunoexpresión de la ubicuitina y telomerasa en el tejido cervical benigno (controles) y en los casos de cáncer cervical incluidos en este estudio.
3. Inmunoreactividad de los biomarcadores en los tipos histológicos de tumor cervical. En la tabla Nº 2 presentamos la distribución de los carcinomas cervicales con o sin expresión de la ubicuitina y telomerasa de acuerdo al diagnóstico histopatológico. El 100% de los adenocarcinomas resultaron reactivos para la ubicuitina y los carcinomas epidermoides alcanzaron una positividad del 98.4%, sin diferencias significativas (p=0.620). En la distribución de los carcinomas cervicales con o sin expresión de la telomerasa apreciamos que ambos tipos de tumor muestran expresión positiva en porcentajes muy semejantes, también sin diferencias estadísticamente significativas (p=0.595). Tabla Nº 2. Expresión de la ubicuitina y telomerasa de acuerdo al diagnóstico histopatológico.
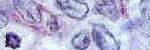
La distribución de los tipos histológicos de cáncer de cuello uterino de acuerdo al porcentaje de células malignas teñidas para ubicuitina reveló que la mayor proporción de casos de ambos tipos histológicos (56) mostraba tinción en más del 50%de las células (+++): 68.9%(42) para los carcinomas epidermoides y 73.7%(14) para los adenocarcinomas, mientras que la tinción entre 5 y 50%(+/++) de las células se apreció en el 29.5%(18) de los carcinomas epidermoides y el 26.3%(5) de los adenocarcinomas. No se encontraron diferencias estadísticamente significativas (p=0.620); estos datos no se muestran. Para la telomerasa consideramos inmunoreactividad positiva cuando encontramos reacción en más del 5% de las células tumorales distribuidas en el disco, sin aplicar la escala semicuantitativa. Los carcinomas cervicales mostraron inmunoreactividad para la ubicuitina tanto en el núcleo como en el citoplasma. En muchos de ellos era más evidente la tinción nuclear que la citoplasmática, indicando que la degradación de proteínas es constante y en ambos compartimientos celulares. La intensidad de la tinción fue moderada o marcada. En el estroma también se apreció reactividad frente a la ubicuitina celular (figura Nº 1g y 1h). La respuesta al anticuerpo contra la telomerasa fue netamente nuclear y nucleolar. El patrón de tinción se caracterizó por tener la apariencia de un puntillado muy fino, homogéneo y pálido (figura Nº 1c y 1d). Tanto los núcleos de las células tumorales como los núcleos de linfocitos del estroma mostraron reactividad, aunque estos últimos se observaron intensamente teñidos. El nucleolo se tornó de un color marrón-grisáceo, que le hacía destacar dentro del núcleo (figura Nº 1c, flechas). En general, la intensidad de la tinción fue pálida, sólo en unos pocos casos fue un poco más intensa. La sobrexpresión de la ubicuitina en los carcinomas epidermoides de diferentes grados de maduración no mostró diferencias significativas (p=0.879): el 100% de los BD, MD e II fueron positivos para esta proteína así como el 92.9% de los I. La inmunoexpresión de la telomerasa se observó en porcentajes semejantes entre los carcinomas epidermoides con diferente grado de diferenciación; fue mayor en los II(62.5%), seguido de los MD(55.6%) y en igual proporción para los BD e I (46.2%), sin diferencias significativas (p=0.667). Estos datos se presentan en la tabla Nº 3. La ubicuitina estaba sobrexpresada en el 100% de los subtipos histológicos de adenocarcinoma cervical sin diferencias importantes entre ellos (p=0.329). La mayor proporción de casos 14/19(73.7%) expresó esta proteína en más del 50% de las células malignas (reactividad +++). Los adenocarcinomas cervicales mostraron sobrexpresión de telomerasa con diferencias estadísticamente significativas entre ellos (p=0.028). Se presentó en el 100% de los villoglandulares y en el único caso del mucinoso, seguido de los subtipos histológicos endometrioide y papilar en igual proporción (50%). Los endocervicales mostraron la menor expresión (28.6%). Estos datos se presentan en la tabla Nº 4. Tabla Nº 3. Distribución de los carcinomas epidermoides de acuerdo al grado de maduración y al porcentaje de células tumorales con inmunoreactividad para los biomarcadores estudiados.
Tabla Nº 4. Distribución de los subtipos histológicos de adenocarcinoma cervical y el porcentaje de células tumorales con inmunoreactividad para los biomarcadores estudiados.
4. Inmunoreactividad de los biomarcadores en el tejido cervical benigno. Ubicuitina: en el epitelio poliestratificado plano benigno se tiñeron los núcleos celulares del estrato profundo fundamentalmente y en algunos del espinoso, con intensidad entre moderada y leve. También se observó tinción pálida en el citoplasma de las células escamosas. La tinción en el estroma fue más evidente en los endotelios vasculares (figura Nº 1e). En el epitelio glandular normal, la tinción fue nuclear e intensa y focalmente citoplasmática. Se tiñeron los núcleos y citoplasmas de las células del estroma (figura Nº Telomerasa: En algunos casos, se observó tinción ocasional en los núcleos celulares (menos del 10% de las células) del estrato proliferativo del epitelio escamoso cervical benigno. No hubo respuesta nuclear en los estratos maduros. La tinción en el estroma fue esporádica (figura Nº 1ª). Algunos núcleos dispersos glandulares y en estroma se encontraron teñidos (figura Nº 1b
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
En este estudio, hemos obtenido sobrexpresión de la ubicuitina en la serie de cáncer cervical en comparación con el tejido cervical de control altamente significativa. El HPVAR tiene como principal mecanismo activar la degradación de proteínas para eliminar los principales controles del ciclo celular que protegen a la célula de alteraciones en la homeostasis interna, entre ellos la proteína supresora p53 (Kao et al, 2000; Hengstermann et al, 2001) y la proteína Retinoblastoma (González et al, 2001). De igual forma, muchas otras proteínas celulares se convierten en dianas seguras de las ocoproteínas virales para su degradación. La sobrexpresión de la ubicuitina en el cáncer cervical asociado a HPVAR conlleva a la degradación rápida de las proteínas celulares que intervienen en el control del ciclo celular, de manera tal que no sólo las proteínas están inactivadas sino que además sus niveles de expresión tienden a ser muy reducidos (Scheffner y Whitaker, 2003). Nuestra serie de casos de cáncer cervical ha mostrado inmunoreactividad contra el antígeno telomerasa en el 52.6% comparado con el 22.7% de los casos control (p<0.001), a pesar de las dificultades que hemos encontramos para la correcta detección y valoración por medio de las técnicas de inmunohistoquímica. La actividad de la telomerasa se ha detectado en un amplio rango de neoplasias malignas, considerándose su expresión un paso esencial en la transformación maligna de los tejidos humanos (Shay y Bacchetti, 1997; Bryan y Cech, 1999; Jarboe et al, 2002). Esta capacidad permite que las células malignas se multipliquen de forma ilimitada. Actualmente, se han realizado múltiples estudios para evaluar la telomerasa como un posible marcador de neoplasia intraepitelial cervical, con gran utilidad como un adjunto al diagnóstico citológico durante la evaluación de las pacientes con anormalidades en células epiteliales del cuello uterino asociadas a la infección por HPVAR (Jarboe et al, 2002, 2004; Reesink-Peters et al, 2003; Bravaccini et al, 2005; Pinto-Tang et al, 2005). Para ello, se ha utilizado fundamentalmente el método telomeric repeat amplification protocol (TRAP) que permite determinar la actividad de la telomerasa en lesiones de cuello uterino. Este método se basa en una amplificación de la enzima telomerasa mediante la técnica de PCR y su visualización electroforética, arrojando elevados niveles de expresión enzimática. En este estudio, hemos encontrado un alto porcentaje de carcinomas cervicales con sobrexpresión inmunohistoquímica de la telomerasa en comparación con el tejido cervical benigno, aunque por debajo de lo reportado en la literatura, donde hemos hallado datos que alcanzan hasta el 95% de expresión de esta enzima (Yashima et al, 1998; Yokohama et al, 1998; Wang et al, 2004). Estas diferencias se presentan fundamentalmente debido a que el método utilizado en estos estudios es el TRAP, de mayor sensibilidad, para captar la reducida cantidad de telomerasa que se sintetiza en las células malignas, donde la detección cuantitativa está garantizada luego de una amplificación de secuencias enzimáticas. A pesar de las ventajas que pueda ofrecer la aplicación de las técnicas moleculares, es posible también estimar la expresión de la telomerasa mediante inmunohistoquímica. La eficacia de la inmunodetección de la telomerasa depende del cumplimiento de condiciones referentes a la dilución mínima del anticuerpo y al revelado de la reacción antígeno-anticuerpo utilizando un método altamente sensible (EnVisión). Inclusive en casos dudosos, debido a que el patrón de inmunoreactividad es un puntillado muy fino y homogéneo es necesario utilizar una contratinción más bien citoplasmática, que permita una mejor observación y diferenciación de la tinción nuclear provocada por la expresión de la telomerasa. Es posible que en nuestra serie de tumores, el porcentaje de expresión de esta enzima sea mayor, la cual quizás pudo detectarse si el anticuerpo anti-telomerasa se hubiese diluido menos; esto podríamos comprobarlo en investigaciones futuras, en las que además también podríamos considerar otras formas de recuperación antigénica, para establecer cual sería la más apropiada. En este estudio hemos encontrado también que el 53.8% de los carcinomas BD fueron negativos para la telomerasa mientras que los II mostraron positividad para este marcador en el 62.5%. Es posible que la heterogeneidad que pueda presentar un tumor influya sobre el análisis enzimático. Según explican Jorboe et al (2002), la actividad de la telomerasa podría estar relacionada con el grado de diferenciación tumoral. Así, los bien diferenciados tendrían menor expresión enzimática como lo pudimos observar en nuestros resultados.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Nuestros resultados nos permiten concluir: 1. El cáncer de cuello uterino asociado a infección por HPV oncogénico se caracteriza porque muestra inmunoreactividad alterada, con sobrexpresión de la ubicuitina que indica la existencia de una intensa degradación de proteínas y activación de la enzima inmortalizadora de las células neoplásicas, la telomerasa. 2. El tejido epitelial cervical benigno incluido como grupo control mostró menos inmunoreactividad frente a los biomarcadores estudiados permitiéndonos realizar la comparación de los hallazgos inmunohistoquímicos a nivel del tejido neoplásico que reveló sobrexpresión de los mismos con diferencias estadísticamente significativas. La inmunoexpresión de los biomarcadores en el tejido neoplásico comparada con el tejido cervical benigno confirmó que en la neoplasia cervical maligna ocurre una diversidad de interacciones y mecanismos moleculares alterados que conllevan a la desregulación del ciclo y a la proliferación celular. Estas alteraciones aparentemente son inducidas por las oncoproteínas E6 y E7 de los papilomavirus humanos de alto riesgo. 3. Las células malignas del cuello uterino muestran elevado porcentaje de inmunoexpresión de la telomerasa. Cuando esta enzima se estudia mediante métodos inmunohistoquímicos se hace necesario considerar algunas condiciones técnicas para lograr su correcta detección y valoración. Esta activación enzimática es relevante en el proceso de inmortalización celular característica de la neoplasia cervical invasora, pudiendo servir como un marcador de dicha enfermedad. 4. Los papilomavirus humanos oncogénicos tienen la habilidad de inducir la degradación rápida de los productos de los genes supresores de tumor, pRb y p53, así como de otras proteínas celulares a través de la activación de la vía ubicuitina-proteosoma, luego de bloquear su actividad. Las oncoproteínas de los HPVAR tienen la habilidad de activar la vía de degradación de la ubicuitina-proteosoma para eliminar los controles celulares y, así, inducir la transformación maligna del tejido cervical y mantener el fenotipo maligno.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
A Alejo Sempere y Laura Martínez del Departamento de Patología de
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Berezutskaya E, Bagchi S. The human papillomavirus E7 oncoprotein functionally interacts with the S4 subunit of the 26S proteosome. J Biol Chem., 1997, 272:30135-30140. Blaustein’s pathology of the female genital tract. Ed. Kurman R. 4º edition. 1994. Bosch FX, de Sanjose S. Chapter 1: human papillomavirus and cervical cancer-burden and assessment of causalita. J Natl Cancer Inst Monograf., 2003, 31:3-13. Branca M, Giorgi C, Ciotto M, Santini D, Di Bonito L, Costa S, Benedetto A, Bonifacio D, Di Bonito P, Paba P, Accardi L, Mariano l; Ruutu M, Syrjanen S, Favalli C, Syrjanen K. Upregulation of telomerase (hTERT) is related to the grade of cervical intraepithelial neoplasia, but is not an independent predictor of high-risk human papilomavirus, virus persistence, or disease outcome in cervical cancer. Diagn Cytopathol., 2006, 34:739-748. Braviccini S, Sanchini MA, Amadori A, Medri L, Saragoni L, Calistri D, Monti F, Volpi A, Amadori D. Potencial of telomerase expresión and activity in cervical specimens as a diagnostic tool. J Clin Pathol., 2005, 58:911-914. Bryan TM, Cech TR. Telomerase and the maintenance of chromosome ends. Curr Opin Cell Biol. 1999 Jun;11(3):318-24. Fehrmann F, Gewin L, Galloway DA. E box-dependent activation of telomerase by human papillomavirus type 16 E6 does not require induction of c-myc. J Virol., 2001, 75:7198-201. González SL, Stremlau M, He X, Basile JR, Münger K. Degradation og the retinoblastoma tumor suppressor by the human papillomavirus type 16 E7 oncoprotein is important for functional inactivation and is separable from proteosomal degradation of E7. J Virol., 2001, 75:7583-7591. Haglund K, Dikic I. Ubicuitylation and cell signaling. EMBO J., 2005, 24:3353-3359. Hanahan D, Weinberg R. The hallmark of cancer. Cell, 2000, 100:57-70. Hengstermann A, Linares LK, Ciechanover A, Huibregtse JM, Scheffner M, Beaudenon S, Howley PM. A family of proteins structurally and functionally related to the E6-AP ubiquitin-protein ligase. Proc Natl Acad Sci USA., 1995, 92:2563-2567. Jarboe EA, Liaw K-L, Thompson LC, Heinz DE, Baker PL, McGregor JA, Dunn T, Woods JE, Shroyer KR. Analysis of telomerase as a diagnostic biomarker of cervical dysplasia and carcinoma. Oncogene, 2002, 21:664-673. Jarboe EA, Thompson LC, Heinz D, McGregor BSJA, Shroyer KR. Telomerase and human papillomavirus as diagnosis adjuncts for cervical dysplasia and carcinoma. Hum Pathol., 2004, 35:396-402. Kao WH, Beaudenon SL, Talis AL, Huibregtse JM, Howley PM. Human papillomavirus type 16 E6 induces self-ubicuitination of the E6AP ubiquitin-protein ligase. J Virol., 2000, 74:6408-6417. Kim YT, Zhao M. Aberrant cell cycle regulation in cervical cancer. Yonsei Medical J., 2005, 46:597-613. Mitch WE, Goldberg AL. Mechanisms of muscle wasting- The role of the ubiquitin-proteosome pathway. New Engl J Med., 1996, 335:1897-1905. Moscicki A-B, Schiffman M, Kjaer S, Villa LL. Updating the natural history of HPV and anogenital cancer. Vaccine, 2006, 24S3:S3/42-S3/51. Muñoz, N; Bosch, FX; de Sanjosé, S; Herrero, R; Castellsagué, X; Shah, K; Snijders, P; Meijer,C. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med., 2003, 348:518-527. Oh ST, Kyo S, Pagano M. Cell cycle regulation by the ubicutin pathway. FASEB J., 1997, 11:1067-1075. Pinto-Tang, Castro T, Premoli G. Detection of telomerase activity in cervical lesions by non-radiactive telomeric repeat amplification protocol (TRAP). Invest Clin., 2005, 46:255-263. Reesink-Peters N, Helder MN, Wisman GBA, Knol AJ, Koopmans S, Boezen HM, Schuuring E, Hollema H, De Vries Ege, Jong S, van der Zee AGJ. Detection of telomerase, its components, and human papillomavirus in cervical scrapings as a tool for triage in women with cervical dysplasia. J Clin Pathol., 2003, 56:31-35. Rolfe M, Chiu I, Pagano M. The ubicutin-mediated proteolytic pathway as a therapeutic area. J Mol Med., 1997, 75:5-17. Scheffner M, Huibregtse JM, Scheffner M, Scheffner M. Ubicuitin, E6-AP, and their role in p53 inactivation. Pharmacol Ther., 1998, 78:129-139. Scheffner M. Ubicuitin, E6-AP, and their role in p53 inactivation. Pharmacol Ther., 1998, 78:129-139. Shay JW, Bacchetti S. A survey of telomerase activity in human cancer. Eur J Cancer. 1997 Apr;33(5):787-91. Syrjänen KJ. Immunohistochemestry in assessment of molecular pathogenesis of cervical carcinogenesis. Eur J Gynaecol Oncol., 2005, 26:5-19. Takakura M, Saturo K, Taro K, Tanaka M, Misaki I. Expression of human telomerase subunits and correlation with telomerase activity in cervical cancer. Cancer Res., 1998, 58:1558-1561. Veldman T, Horikawa I, Barrett JC, Schlegel R. Transcriptional activation of the telomerase hTERT gene by human papillomavirus type 16 E6 oncoprotein. J Virol., 2001, 75:4467-4472. Veldman T, Liu X, Yuan H, Schlegel R. Human papillomavirus E6 and Myc proteins associate in vivo and bind ti and cooperatively active the telomerase reverse transcriptase promoter. PNAS, 2003, 100:8211-8216. von Knebel-Doeberitz M, Syrjänen KJ. Molecular markers: How to apply in practice. Gynecol Oncol., 2006, 103:18-20. Wang S-Z, Sun J-H, Zhang W, Jin S-Q, Wang H-P, Jin Y-S, Qu P, Liu Y. Telomerase activity in cervical intraepithelial neoplasia. Chinese Med J., 2004, 117:202-206. Yashima K, Ashfaq R, Nowak J, von Gruenigen V, Milchgrub S, Rathi A, Albores-Saavedra J, Shay JW, Gazdar AF. Telomerase activity and expression of its RNA component in cervical lesions. Cancer, 1998, 82:1319-1327. Yokoyama Y, Takahashi Y, Shinohara A, Lian Z, Tamaya T. Telomerase activity in the female reproductive tract and neoplasms. Gynecol Oncol., 1998, 68:145-149. zur Hausen H. Papillomaviruses causing cancer: evasion from host-cell control in early events in carcinogenesis. J Natl Cancer Inst., 2000, 92:690-698.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
- ELSIE BEATRIZ PICOTT RANGEL (30/04/2007 19:20:22)
- Aleida Herrera Batista (10/05/2007 23:48:34)
- Morelva Coromoto Toro de Méndez (11/05/2007 19:29:56)
- Tatyana Omaña (14/05/2007 1:07:43)
- Carlos M. Villar Pastor (15/05/2007 20:00:47)
- Maria Carolina Moreno Barrios (17/05/2007 1:01:02)
- Zurama Eloisa Castro Castro (24/12/2007 17:39:54)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 17:19:20
.jpg) fiogf49gjkf0dInmunoexpresión de la telomerasa (a y b tejido cervical benigno; c y d cáncer cervical) en núcleos, a manera de puntillado muy fino y en nucléolos (en la microfotografía c se señalan (flechas) los nucléolos que destacan por su tinción marrón-grisácea pálida). El tejido cervical benigno presentó tinción para la telomerasa a nivel de algunos núcleos de las células más profundas y en el endocervix no se detectó. La ubicuitina (e y f tejido cervical benigno; g y h cáncer cervical) mostró marcada expresión tanto nuclear como citoplasmática. Observamos expresión en los núcleos del epitelio exocervical, principalmente en el tercio inferior y también en núcleos y citoplasmas celulares del epitelio endocervical.">
fiogf49gjkf0dInmunoexpresión de la telomerasa (a y b tejido cervical benigno; c y d cáncer cervical) en núcleos, a manera de puntillado muy fino y en nucléolos (en la microfotografía c se señalan (flechas) los nucléolos que destacan por su tinción marrón-grisácea pálida). El tejido cervical benigno presentó tinción para la telomerasa a nivel de algunos núcleos de las células más profundas y en el endocervix no se detectó. La ubicuitina (e y f tejido cervical benigno; g y h cáncer cervical) mostró marcada expresión tanto nuclear como citoplasmática. Observamos expresión en los núcleos del epitelio exocervical, principalmente en el tercio inferior y también en núcleos y citoplasmas celulares del epitelio endocervical.">