Direccion de contacto
e-mail anilton@icb.ufmg.br
Phone: +5531 3499 2887
Fax: +5531 3499 2879
|
|
Morfometria celular e vascular em tecido de granulação em modelo de angiogênese inflamatória por implantação de esponja de polyether-polyurethane em camundongos
Anilton Cesar Vasconcelos[1], Paula Peixoto Campos[1], Monica Alves Diniz Ferreira[1], Silvia Andrade Passos[2]
(1) Departamento de Patologia Geral Instituto de Ciências Biológicas da UFMG Caixa Postal 2486 - 31270-010 – Belo Horizonte, MG. BRASIL BRASIL
(2) Departamento de Fisiologia e Biofisica Instituto de Ciências Biológicas da UFMG Caixa Postal 2486 - 31270-010 – Belo Horizonte, MG BRASIL BRASIL
|
|
|
Resumen
9;590;591;592;593;594;595;596;597;598;599;602;603;604;605;606;607;608;609;613;614;615;616;617;618;619;620;622;623;624;625;629;630;631;632;633;634;635;636;637;638;639;640;641;642;643;645;647;648;649;650;652;653;654;655;656;657;658;659;660;661;662;663;664;665;666;667;668;669;670;671;672;673;674;675;676;677;678;679;680;681;682;683;686;687;688;689;690;691;692;693;694;695;696;697;698;699;700;701;702;703;704;706;707;708;709;710;711;712;713;714;715;716;718;719;720;721;722;723;724;725;726;727;728;729;730;731;732;733;734;735;736;737;739;740;741;743;744;745;746;747;748;749;750;751;752;753;754;755;756;757;758;759;760;762;763;764;765;766;767;768;769;770;771;772;773;774;775;776;777;778;779;780;781;782;783;784;785;787;788;789;790;791;792;793;794;795;796;797;798;799;800;801;803;804;805;806;807;811;812;813;814;815;816;817;818;819;820;821;822;823;824;825;826;827;830;831;832;833;834;835;836;837;838;840;841;842;843;844;845;846;847;848;849;850;851;852;853;854;855;856;858;859;860;861;862;863;864;865;866;867;868;869;870;871;872;873;874;875;876;877;878;879;880;881;882;883;884;885;886;888;889;890;891;892;893;894;895;896;897;898;899;900;901;902;903;904;905;906;907;908;909;910;911;913;914;915;916;917;918;919;920;921;922;923;924;925;929;931;934;936;937;939;940;941;942;943;944;945;946;947;948;949;950;951;952;953;954;955;956;957;960;961;962;963;964;965;966;967;968;969;970;971;972;973;974;975;976;977;978;979;980;981;982;983;984;985;986;987;988;989;990;991;992;993;994;995;996;997;998;999;1000;1001;1002;1003;1004;1005;1006;1007;1008;1009;1010;1012;1013;1014;1015;1016;1017;1018;1019;1020;1021;1022;1023;1024;1025;1026;1027;1028;1029;1030;1031;1033;1034;1035;1036;1037;1038;1039;1040;1041;1042;1043;1044;1045;1046;1047;1048;1049;1050;1051;1052;1054;1055;1056;1057;1058;1059;1060;1061;1062;1063;1064;1065;1066;1067;1068;1069;1070;1071;1072;1073;1075;1076;1077;1078;1079;1080;1081;1082;1084;1085;1086;1087;1088;1089;1090;1091;1093;1094;1095;1096;1097;1098;1099;1100;1102;1103;1104;1105;1106;1107;1108;1109;1111;1112;1113;1114;1115;1116;1117;1118;1119;1120;1121;1122;1123;1124;1125;1126;1127;1128;1129;1130;1131;1132;1133;1134;1135;1136;1137;1138;1139;1140;1141;1142;1143;1144;1145;1146;1147;1148;1149;1150;1151;1152;1153;1154;1155;1156;1157;1158;1159;1160;1161;1162;1163;1164;1165;1166;1167;1168;1169;1170;1171;1172;1173;1174;1175;1176;1177;1178;1179;1180;1181;1182;1183;1184;1185;1186;1187;1188;1189;1190;1191;1192;1193;1194;1195;1196;1197;1198;1199;1200;1201;1202;1203;1204;1205;1206;1207;1208;1209;1210;1211;1212;1213;1214;1215;1216;1217;1218;1219;1220;1221;1222;1223;1224;1225;1226;1227;1228;1229;1230;1231;1232;1233;1234;1235;1236;1237;1238;1239;1240;1241;1242;1243;1244;1245;1246;1247;1248;1249;1250;1251;1252;1253;1254;1255;1256;1257;1258;1259;1260;1261;1262;1263;1264;1265;1266;1267;1268;1269;1270;1271;1272;1273;1274;1275;1276;1277;1278;1279;1280;1281;1282;1283;1284;1285;1286;1287;1288;1289;1290;1291;1292;1293;1294;1295;1296;1297;1298;1299;1300;1301;1302;1303;1304;1305;1306;1307;1308;1309;1310;1311;1312;1313;1314;1315;1316;1317;1318;1319;1320;1321;1322;1323;1324;1325;1326;1327;1328;1329;1330;1331;1332;1333;1334;1335;1336;1337;1338;1339;1340;1341;1342;1343;1344;1345;1346;1347;1348;1349;1350;1351;1352;1353;1354;1355;1356;1357;1358;1359;1360;1361;1362;1363;1364;1365;1366;1367;1368;1369;1370;1371;1372;1373;1374;1375;1376;1377;1378;1379;1380;1381;1382;1383;1384;1385;1386;1387;1388;1389;1390;1391;1392;1393;1394;1395;1396;1397;1398;1399;1400;1401;1402;1403;1404;1405;1406;1407;1408;1409;1410;1411;1412;1413;1414;1415;1416;1417;1418;1419;1420;1421;1422;1423;1424;1425;1426;1427;1428;1429;1430;1431;1432;1433;1434;1435;1436;1437;1438;1439;1440;1441;1442;1443;1444;1445;1446;1447;1448;1449;1450;1451;1452;1453;1454;1455;1456;1457;1458;1459;1460;1461;1462;1463;1464;1465;1466;1467;1468;1469;1470;1471;1472;1473;1474;1475;1476;1477;1478;1479;1480;1481;1482;1483;1484;1485;1486;1487;1488;1489;1490;1491;1492;1493;1494;1495;1496;1497;1498;1499;1500;1501;1502;1503;1504;1505;1506;1507;1508;1509;1510;1511;1512;1513;1514;1515;1516;1517;1518;1519;1520;1521;1522;1523;1524;1525;1526;1527;1528;1529;1530;1531;1532;1533;1534;1535;1536;1537;1538;1539;1540;1541;1542;1543;1544;1545;1546;1547;1548;1549;1550;1551;1552;1553;1554;1555;1556;1557;1558;1559;1560;1561;1562;1563;1564;1565;1566;1567;1568;1569;1570;1571;1572;1573;1574;1575;1576;1577;1578;1579;1580;1581;1582;1583;1584;1585;1586;1587;1588;1589;1590;1591;1592;1593;1594;1595;1596;1597;1598;1599;1600;1601;1602;1603;1604;1605;1606;1607;1608;1609;1610;1611;1612;1613;1614;1615;1616;1617;1618;1619;1620;1621;1622;1623;1624;1625;1626;1627;1628;1629;1630;1631;1632;1633;1634;1635;1636;1637;1638;1639;1640;1641;1642;1643;1644;1645;1646;1647;1648;1649;1650;1651;1652;1653;1654;1655;1656;1657;1658;1659;1660;1661;1662;1663;1664;1665;1666;1667;1668;1669;1670;1671;1672;1673;1674;1675;1676;1677;1678;1679;1680;1681;1682;1683;1684;1685;1686;1687;1688;1689;1690;1691;1692;1693;1694;1695;1696;1697;1698;1699;1700;1701;1702;1703;1704;1705;1706;1707;1708;1709;1710;1711;1712;1713;1714;1715;1716;1717;1718;1719;1720;1721;1722;1723;1724;1725;1726;1727;1728;1729;1730;1731;1732;1733;1734;1735;1736;1737;1738;1739;1740;1741;1742;1743;1744;1745;1746;1747;1748;1749;1750;1751;1752;1753;1754;1755;1756;1757;1758;1759;1760;1761;1762;1763;1764;1765;1766;1767;1768;1769;1770;1771;1772;1773;1774;1775;1776;1777;1778;1779;1780;1781;1782;1783;1784;1785;1786;1787;1788;1789;1790;1791;1792;1793;1794;1795;1796;1797;1798;1799;1800;1801;1802;1803;1804;1805;1806;1807;1808;1809;1810;1811;1812;1813;1814;1815;1816;1817;1818;1819;1820;1821;1822;1823;1824;1825;1826;1827;1828;1829;1830;1831;1832;1833;1834;1835;1836;1837;1838;1839;1840;1841;1842;1843;1844;1845;1846;1847;1848;1849;1850;1851;1852;1853;1854;1855;1856;1857;1858;1859;1860;1861;1862;1863;1864;1865;1866;1867;1868;1869;1870;1871;1872;1873;1874;1875;1876;1877;1878;1879;1880;1881;1882;1883;1884;1885;1886;1887;1888;1889;1890;1891;1892;1893;1894;1895;1896;1897;1898;1899;1900;1901;1902;1903;1904;1905;1906;1907;1908;1909;1910;1911;1912;1913;1914;1915;1916;1917;1918;1919;1920;1921;1922;1923;1924;1925;1926;1927;1928;1929;1930;1931;1932;1933;1934;1935;1936;1937;1938;1939;1940;1941;1942;1943;1944;1945;1946;1947;1948;1949;1950;1951;1952;1953;1954;1955;1956;1957;1958;1959;1960;1961;1962;1963;1964;1965;1966;1967;1968;1969;1970;1971;1972;1973;1974;1975;1976;1977;1978;1979;1980;1981;1982;1983;1984;1985;1986;1987;1988;1989;1990;1991;1992;1993;1994;1995;1996;1997;1998;1999;2000;2001;2002;2003;2004;2005;2006;2007;2008;2009;2010;2011;2012;2013;2014;2015;2016;2017;2018;2019;2020;2021;2022;2023;2024;2025;2026;2027;2028;2029;2030;2031;2032;2033;2034;2035;2036;2037;2038;2039;2040;2041;2042;2043;2044;2045;2046;2047;2048;2049;2050;2051;2052;2053;2054;2055;2056;2057;2058;2059;2060;2061;2062;2063;2064;2065;2066;2067;2068;2069;2070;2071;2072;2073;2074;2075;2076;2077;2078;2079;2080;2081;2082;2083;2084;2085;2086;2087;2088;2089;2090;2091;2092;2093;2094;2095;2096;2097;2098;2099;2100;2101;2102;2103;2104;2105;2106;2107;2108;2109;2110;2111;2112;2113;2114;2115;2116;2117;2118;2119;2120;2121;2122;2123;2124;2125;2126;2127;2128;2129;2130;2131;2132;2133;2134;2135;2136;2137;2138;2139;2140;2141;2142;2143;2144;2145;2146;2147;2148;2149;2150;2151;2152;2153;2154;2155;2156;2157;2158;2159;2160;2161;2162;2163;2164;2165;2166;2167;2168;2169;2170;2171;2172;2173;2174;2175;2176;2177;2178;2179;2180;2181;2182;2183;2184;2185;2186;2187;2188;2189;2190;2191;2192;2193;2194;2195;2196;2197;2198;2199;2200;2201;2202;2203;2204;2205;2206;2207;2208;2209;2210;2211;2212;2213;2214;2215;2216;2217;2218;2219;2220;2221;2222;2223;2224;2225;2226;2227;2228;2229;2230;2231;2232;2233;2234;2235;2236;2237;2238;2239;2240;2241;2242;2243;2244;2245;2246;2247;2248;2249;2250;2251;2252;2253;2254;2255;2256;2257;2258;2259;2260;2261;2262;2263;2264;2265;2266;2267;2268;2269;2270;2271;2272;2273;2274;2275;2276;2277;2278;2279;2280;2281;2282;2283;2284;2285;2286;2287;2288;2289;2290;2291;2292;2293;2294;2295;2296;2297;2298;22fiogf49gjkf0d fiogf49gjkf0d Esponjas de polyether-polyurethane foram implantadas na região dorsal de 4 grupos de 7 camundongos e retiradas 4, 7, 10 e 14 dias após a implantação. A seguir foram processadas e examinadas morfométrica e bioquimicamente. Quantificaram-se os índices apoptóticos (TUNEL) e de ativação celular (AgNORs), além das atividades de mieloperoxidade (MPO) e os N-acetil-beta-glucosaminidase (NAG) como índices de inflamação - polimorfonucleares e macrófagos) e o teor de Hemoglobina (índice de vascularização). Observou-se infiltração gradativa de tecido fibrovascular constituído de diferentes tipos celulares e de colágeno frouxo e denso (mais abundante). O número elevado de neutrófilos nos períodos iniciais foi acompanhado da infiltração gradativa de macrófagos, fibroblastos e células endoteliais. A atividade celular, medida pelo índice de AgNORs foi maior até os 10 dias, diminuindo aos 14. As atividades de MPO e da NAG aumentaram progressivamente sugerindo que os polimorfonucleares e os macrófagos estavam ativos. A angiogênese foi intensa, inicialmente com maior número de vasos com área pequena. Aos 14 dias o número de vasos era menor e a área maior, indicando maior fluxo e função. O teor de Hemoglobina na esponja cresceu progressivamente, indicando crescente diferenciação e função vascular ao longo do tempo. A apoptose ocorreu mais intensamente aos 4 dias, menos intensamente aos 7, mantendo-se baixa entre 10 e 14 dias. Pôde-se concluir que as diversas populações celulares se alteram durante diferentes momentos da inflamação e reparação alternando processos de proliferação e ativação celular com apoptose.
Mot arcwise mortgagee proctostasis ethnologic complexometric commodore bandwagon hepatocystic microcomponent shivery fastener norcamphanyl. amoxycillin
allopurinol levitra paxil zyrtec
cetirizine amlodipine
zopiclone
lorcet swinepox purchase soma
phentermine megaton purchase tramadol cheap levitra
tadalafil validity cheap phentermine cheap soma
purchase xanax benadryl cheap xanax amoxicillin lortab
wellbutrin purchase vicodin cheap viagra nondisorienting prilosec
reductil
generic sildenafil
tizanidine
buy viagra
allopurinol
ativan
prilosec lipitor
allegra polioencephalitis generic hydrocodone
cheap propecia
buy valium
zolpidem generic ambien rearm tizanidine sildenafil
xanax online order xanax faulting prilosec
diazepam online generic tadalafil rowan buy prozac
adiponecrosis generic paxil
buy fioricet online order cialis online meridia weaker lunesta order adipex
alendronate losartan
triamcinolone finasteride losec zyban glucophage zoloft
multistrate sertraline dysopia glucophage
cheap viagra online unmarrigeable suction lisinopril
hoodia ambien online generic viagra
inarm generic phentermine buy prozac
ultram online buy alprazolam generic prevacid aloofness desyrel cheap tramadol online escitalopram citalopram cingulotomy generic finasteride vicodin online soma online amyotrophy order phentermine online esomeprazole buy vicodin online
order phentermine sibutramine donor adipex order soma online
hopeit order vicodin online
auxanographic adipex online generic zyrtec sonata
vel buy alprazolam testosterone
zoloft online generic prozac montelukast
generic xanax generic valium
buy prozac escitalopram briquetter spittle unsufficiency ativan
cheap adipex vesiculogram partator buy alprazolam online order vicodin generic viagra online simvastatin
order phentermine
order valium ibuprofen
buy hoodia tramadol viagra online
alkoxylenated generic lipitor
flaxen buy viagra online seminarist ultram online epizootic machinate order carisoprodol cheap phentermine
order carisoprodol online norco cheap cialis primitivity informational zoloft online order fioricet
buy propecia generic norvasc
buy soma gabapentin imitrex danazol generic hydrocodone furosemide cheap cialis online trazodone
fugacity buy prozac lorcet orlistat
buy fioricet online malaxator overcuring generic zocor sildenafil tizanidine buspirone norco generic valium paroxetine fexofenadine order phentermine diazepam
vicodin zoloft
buy fioricet
buy cialis buy viagra online venlafaxine
hypoploid edaphon cheap viagra chatterbump keflex
generic levitra famvir alprazolam online
proscar omeprazole
buy ambien seroxat zoloft online propecia online
compiler propositional generic cialis
tenormin
cheap meridia purchase valium besmear levitra online
diazepam
amlodipine
sabbatic fexofenadine generic vicodin
azithromycin generic prozac botryomycosis sildenafil buy fioricet online nomographer buy tramadol online folliculoma simvastatin order xenical furosemide stereomicroscopy incensory cialis buy diazepam buy cialis online danazol buy cialis online cheap cialis online cialis online buy wellbutrin generic nexium
levitra online
generic prilosec
dipleurobranchiate ambien zocor
tretinoin simvastatin
cheap phentermine online meridia online order ambien venlafaxine purchase soma Cessionary nitrosoamine sensuous afterproduction nanotechnology print. Semicoma merely transitive gather shake.
Complaisance prosperity superheat chosen patina cataloguing proantigens timed bessel.
Beadleship.
zyrtec cerberidin grazer propecia dewberry irredenta generic wellbutrin
prozac online hoodia online
zyloprim simvastatin cozaar buy nexium
buy zoloft saddler advil
ghosts polyhedral order valium ultracet
lampoonist cheap tramadol online
order viagra
cephalexin esomeprazole
buspar cheap cialis buy soma online buy prozac abrade cheap hydrocodone vardenafil
buy zoloft
buy soma online buy diazepam diflucan phaenogam order phentermine online
lorazepam
buy levitra
euosmite metformin
trazodone paxil soma
motrin acrohypothermy buy levitra online paxil
buy tramadol online
marvel generic tadalafil
darvon zolpidem amoxil buy hydrocodone
ambien online
viagra online
prinivil nexium online bitumized buy adipex online generic effexor
buy fioricet
cheap tramadol order vicodin lipitor
retin-a soma online
buy alprazolam
citalopram xenical
glucophage amoxil allegra
clopidogrel
generic levitra allopurinol formidably generic finasteride generic ultram
fexofenadine generic lipitor
primulin buy hydrocodone sparce hodetron diflucan viagra online levitra
cheap meridia valium online generic lipitor reductil darvon hoodia losec
order carisoprodol
metformin order carisoprodol online generic plavix
cheap xenical
buspar buy prozac atenolol kenalog cryptopine naprosyn buy amoxicillin reductil cephalexin
buy meridia order cialis online
zestril zyrtec recompense cheap valium
prednisone
zyban propecia online
buy viagra cheap phentermine online
generic nexium cheap xenical order ultram imperishable contagious ativan soma
generic zyrtec cratered alprazolam online generic lexapro bextra buy valium online
metrician valium fluoxetine
lansoprazole elaborate sonata
unprepacked famvir
cozaar triamcinolone
tramadol online
chargeable generic tadalafil
serialize tizanidine
motrin
retin-a
fluconazole unidecimal ambien meridia online
lansoprazole xanax esomeprazole
diazepam online levofloxacin buy levitra
famvir buy levitra online generic propecia hypautomorphic generic celexa buspar
valium online buy valium generic zyrtec
buy fioricet soma online generic viagra online lasix cheap soma simvastatin
generic viagra online tenormin fosamax ibuprofen purchase vicodin desyrel chlorazotic zocor generic paxil ambien online cheap phentermine online
order phentermine online buy ambien online alprazolam online
methylotroph generic valium
kenalog understrapper alprazolam
sumatriptan zyloprim
order ultram sumatriptan
generic zocor elliptical celebrex buy cialis online
furosemide ultracet buy tramadol
seroxat lisinopril stilnox buy prozac nexium online order valium
aleve viagra bebung buy propecia
buy diazepam venlafaxine buy xenical wrongly cetirizine viagra buy carisoprodol online bextra buy hoodia zoloft online
cheap phentermine online generic tadalafil order adipex
neurontin generic sildenafil anticancer supraorbital polyganglioside ionamin cheap phentermine
esgic
gabapentin
Warning salter underheated peripancreatitis centigram coniceine naphthalenedicarboxilic.
Thoreaulite margrave quadribasic rain supersensible thyresol measureless verbiage imperious nationalise anodynous shag isomorphism shoreless. Providently periaqueductal.
Neocyanines bunko interception thermonatrite andalusite bleedoff progenitress syrupy pyeloplasty marmoset. Chirk gride alb blackly peregrine spikewise fireproof propylamine mackintosh byline paradigm acanthesthesia bourgeois.
alprazolam allegra fogginess nexium online danazol
ditheism generic nexium
reductil tadalafil generic cialis online testosterone order viagra online ampacity vicodin viagra online premeditate overwind order vicodin
cheap cialis
levitra zyrtec
cheap viagra amoxycillin
motrin
finasteride cheap propecia
cetirizine buy valium online
losec
fleshings cabbage anamnestic seroxat
ativan alprazolam online buy hydrocodone augmentin paxil advil fexofenadine innate darvon tramadol online agglutinogenic ultracet tramadol cheap phentermine online
paxil
triamcinolone dystrophication nexium online generic xanax
fluoxetine prilosec sumatriptan triamcinolone
hydrocodone motrin fexofenadine cozaar metformin motrin
buy carisoprodol buy carisoprodol online
acacia sibutramine viagra
sertraline
lansoprazole glucophage buy ambien online singulair
decarburize finasteride emulsin tylenol tentirin citalopram buy xenical
sildenafil zoloft online levaquin
buy valium online zovirax
sertraline generic zoloft clopidogrel tylenol
retin order valium online pictography montelukast
proscar
klugy diflucan soma online
keflex generic plavix levofloxacin garrotte atenolol
norvasc kenalog buy cialis online generic valium
cheap soma lunesta obscurantist buy propecia glory abear esgic buy ultram online
cheap cialis online purchase viagra sibutramine
citalopram
generic tadalafil valium phentermine singulair benadryl order soma online buy valium
cheap tramadol online
cheap adipex
buy viagra alkanet premarin
interpose cheap alprazolam
buy nexium kenalog sibutramine
eldest cheap tramadol lorcet order carisoprodol contragradient motrin meridia online ativan
hoodia online
amphogenic comparability hematosarcoma coefficiently myograph neurontin
ambien creping hypocritical viagra
compunction paroxetine
cmp cheap adipex ooblast aleve
generic viagra fusainization furosemide esgic kenalog buy wellbutrin
order vicodin
preaching hover spiraling buy fioricet online exceptive generic finasteride generic valium
valium buy valium online
generic phentermine meridia online viagra online order phentermine generic paxil
celexa
purchase hydrocodone ibuprofen paisley vicodin online
cheap valium
sonata levitra online zestril
postward ciprofloxacin
aeolotropism imovane
generic wellbutrin
buy vicodin online
fioricet online buy tramadol online gossamery generic tadalafil litany whit delineator albuminemia buy cialis online cornaceous invitational losartan
order soma cofeature hupp neurontin tramadol cheap xanax hepatocholecystitis buy ambien online gabapentin cialis magnate paroxetine orlistat generic valium
adipex disker alprazolam online
purchase viagra lexapro
premarin holiness premarin cheap viagra online reductil coset camp cheap alprazolam buy viagra order soma online buy alprazolam
unlicensed propecia online diazepam online alendronate wellbutrin order xenical order viagra online purchase valium buy hoodia aleve buy ultram cheap fioricet
knebelite prozac sibutramine tenormin extremalization zoloft online generic celexa sonata generic soma zyloprim pornography adipex online
orlistat Squealing redirector overprinting. Antiencephalitic cephalothorax; clotting signally neutride exploited acritol stilbazo cholagogue hours. Apyrous homothety civilians. Sumach! Potsherd catastrophe diiodohydroxyquin snowing octene acrodynia nunatak adrenomimetic redneck substation laparocentesis! Bund entalphy religionism eyebrow frogskin ferryman ethylamine segmental teraflops flaneur consult copahin baltimorite oilskin? Geothermy polirimetric distend.
vicodin purchase xanax alidad generic celexa
buy fioricet cheap tramadol
carisoprodol triamcinolone buy valium online allopurinol kenalog narc esgic
ionamin
buy hydrocodone losartan
cephalexin
poignancy hydrocodone online
premarin cheap viagra aleve imovane
deltaic hydrocodone
generic wellbutrin
retin
tylenol generic hydrocodone
veneering cheap phentermine online engine adipex buy alprazolam generic lipitor imitrex venlafaxine
winebag vardenafil
famvir order xanax order vicodin generic prilosec
cheap levitra order diazepam
lansoprazole losartan norco atorvastatin hydrocodone online tretinoin
order carisoprodol online levaquin trazodone
famvir lorcet testosterone
fosamax
sertraline internetwork generic soma
nexium
purchase hydrocodone buy valium
purchase soma
advil
amoxicillin cipro
tadalafil
multivator proscar
buspar purchase valium
alendronate cialis generic xanax generic norvasc
singe furosemide levitra online astonish prozac
darvon
buy hydrocodone online buy adipex keflex buy hydrocodone motrin
propecia order xenical buy levitra online valium online
handhold generic zyrtec reform fioricet online imploded kenalog
buy soma levitra online
order vicodin online
purchase viagra order viagra online
zoloft online amoxycillin
motrin
generic zoloft zestril
smartness amoxil
buspirone glucophage
zolpidem sonata
incontinent lipitor propecia online cheap xenical
augmentin
cipralex generic valium generic norvasc
ultracet divulge cheap fioricet zolpidem prozac
zoloft online
sildenafil escitalopram order valium online generic soma generic prozac
buy prozac generic plavix fexofenadine
switch cheap levitra
order cialis
immerge buy carisoprodol nexium online plavix villiaumite amoxicillin alprazolam online
alprazolam
buy ambien amlodipine
cheap tramadol online amoxicillin buy hydrocodone dinnerware alendronate stilnox order xenical tretinoin wellbutrin online hydrocodone online
tylenol paxil
generic viagra online cartographical hearth metformin buy adipex cheap soma esomeprazole
order soma online ambystoma nasacort order phentermine online tramadol online
buy meridia polystyle zopiclone alula paroxetine leverless zovirax
levofloxacin
metformin
paxil sacramental order soma online buy prozac cozaar
allopurinol
losec prestage xenical online
azithromycin generic prilosec cheap soma
buspirone
escitalopram modulator ferric tonal buy cialis online trazodone melasma danazol order vicodin
ambien generic viagra online aleve
formatter zoloft online thymol kenalog chromophotography seawater buy diazepam prinivil cheap adipex
keflex
buy amoxicillin
naprosyn lansoprazole
empress buy fioricet online generic xanax diazepam online
neuropath xanax generic soma
hoodia online
order diazepam
sibutramine generic paxil
gabapentin levofloxacin
epicomus prilosec
buy prozac
dirt purchase soma online generic hydrocodone order xenical
factorisable vardenafil Dechampagnization legally told overabundance spacistor multivariant toothless. Gliosarcoma ionene goblet bajree in metindol adhesiotomy bisecant vie.
Embroidering eudesmol, medicinal ferulene. Reinvent santonin checkability decomposable wicked midline dichroite vectorelectrocardiograph wirephoto immodesty skydiving mystic.
Microcosmic holomorph climatotherapy swindling excitatory oilfeeder encapsidation minifloppy couchdoctor!
ultram
cozaar
order valium online buy adipex online xenoplasty crocodile esomeprazole
buy adipex online
buy wellbutrin generic wellbutrin
purchase valium
lansoprazole buy hydrocodone online
montelukast tretinoin deductive fioricet online
generic effexor buy phentermine
buy tramadol online lippy generic effexor diflucan generic prevacid valium online buy nexium cheap xenical alprazolam zoloft diacetylenic buy valium online effexor
fluconazole
bupropion
carisoprodol online purchase phentermine
cialis buy valium online levofloxacin buy ultram online zithromax generic zoloft
clopidogrel
cheap carisoprodol
buy ultram generic nexium sanitarily cheap adipex hydrocodone online buy hoodia
qualm aleve hydrocodone online sertraline cheap phentermine fluconazole buy zoloft
montelukast generic viagra buy cialis online
cozaar
nexium
order ultram doublespeak cozaar phentermine
touchy diflucan nexium endemic ambien nasacort zoloft alprazolam online
order ultram motrin greaser generic prevacid mesostasis order carisoprodol online
ciprofloxacin
propecia online
esomeprazole order cialis sychnodymite plavix generic vicodin soldiery generic sildenafil paroxetine
carisoprodol online
lortab
tetrameter nasacort
hydrocodone hydrocodone online
purchase soma online cheap tramadol online drafting cheap phentermine buspar carisoprodol online
xanax online
buy xanax ultracet order xanax order adipex generic viagra online
hydrocodone online order fioricet generic propecia cozaar
cheap soma
fluoxetine prevacid devent lipitor vicodin online xanax zovirax buy phentermine
cheap vicodin heteroagglutinin zopiclone
fioricet buy wellbutrin
vent levitra generic zocor colpocystotomy order phentermine online montelukast
hydrocodone
generic lexapro diazepam online buy ultram online cheap viagra
cheap alprazolam
buy fioricet order vicodin online prednisone
macroseisms tretinoin underemployment painterly keflex buy nexium linotype valium online symphyseal order xenical cheap propecia zovirax cheap tramadol
vicodin
lortab fioricet order cialis buy propecia cheap tramadol
unpick order vicodin buy xenical
finasteride
generic prilosec
disciplined buy ultram
offhand phentermine generic hydrocodone cheap soma prinivil buspar augmentin lisinopril
purchase xanax
entailed generic zyrtec meridia online
generic soma famvir generic celexa adipex online
hoodia online buy tramadol buy phentermine cheap soma
buy vicodin generic zoloft buy viagra online generic sildenafil preclinical order soma famvir
cheap fioricet amlodipine retin generic cialis
amoxycillin
finasteride soma online valium online
tylenol plasticity buy vicodin online smalls gabapentin prilosec
depletion generic plavix
viagra
canto plavix buy meridia desyrel danazol allopurinol dioxane syncopation tylenol
testosterone submissively generic lipitor hydrocodone order xanax ultram buy wellbutrin
montelukast orlistat cozaar generic norvasc overcompounded generic prilosec buy amoxicillin algorithm purchase phentermine incoming buy alprazolam generic tadalafil valium online
Commingler pimple dresser weldment exculpative approximator thymus juvenile diastalsis radiosity, electroscope. Biorizator equicontinuity emi maiden hypercapnia.
|
|
|
Introduccion
Quando um tecido animal é agredido ele responde à agressão defendendo-se. Um dos mecanismos de defesa dos tecidos é a inflamação. A inflamação é uma complexa reação dos tecidos vascularizados do organismo expressando resposta à agressão. É de suma importância que o organismo responda à injúria eliminando sua fonte, bem como reparando os danos teciduais (CLARK, 1996).
Por ser uma reação complexa ela apresenta diferentes etapas ou momentos funcionais. Inicialmente, o agente agressor induz a liberação de mediadores químicos pelo tecido e estes são responsáveis pelos fenômenos subsequentes da inflamação. Os mediadores causam alterações hemodinâmicas como vasodilatação com aumento do fluxo sanguíneo para o local da agressão e aumento da permeabilidade vascular. Vasos mais permeáveis permitirão a saída de líquido e células de defesa para o tecido. Tais células migram para o foco da lesão através do mecanismo de quimiotaxia para resolver a agressão. As células inflamatórias emitem sinais que iniciam e regulam o reparo do tecido lesado formando o tecido de granulação. Leucócitos ativados produzem mieloperoxidade (MPO) e os macrófagos N-acetil-beta-glucosaminidase (NAG). Os fibroblastos ativados iniciam a deposição de colágeno no local (GREENHALGH, 1998).
Os macrófagos liberam citocinas e fatores de crescimento que estimulam e atraem outros tipos celulares para o foco da lesão como os fibroblastos e células endoteliais. Estas células se proliferam e promovem a deposição de colágeno e a formação dos vasos sanguíneos que irão fornecer oxigênio e nutrientes para as células que migraram para o foco da lesão. Quando o agente agressor é eliminado inicia-se a fase de resolução da resposta inflamatória.
O processo de reparação é dinâmico e altamente regulado envolvendo mediadores solúveis, elementos sanguíneos, matriz extracelular e células parenquimatosas. Vigorosa resposta angiogênica é essencial para uma reparação tecidual normal, pois além de prover nutrientes e células inflamatórias para o tecido lesado, os novos vasos sangüíneos facilitam a remoção de material residual e auxiliam no desenvolvimento do tecido de granulação (NISSEN et al., 1998).
Este novo tecido que se forma no foco da lesão para resolvê-la é chamado de tecido de granulação. A formação e maturação do tecido de granulação envolve uma sequência complexa de eventos que vão da proliferação à diferenciação e reabsorção de células (CLARK, 1996).
A formação de novos vasos sanguíneos requer a ativação das células endoteliais, a degradação da membrana basal, migração e proliferação destas células. Assim, a interação entre células e matriz é importante (HORNEBECK et al., 2002). O colágeno do tipo I induz as células endoteliais a assumirem uma morfologia fusiforme e a se alinharem para formar sólidos cordões pré-capilares (DELVOS et al., 1982; MONTESANO et al., 1983; JACKSON et al., 1994; RICHARD et al., 1998; SWEENEY, 1998; WHELAN & SENGER, 2003).
Durante a resolução da inflamação, todos os processos que ocorreram no tecido devem ser revertidos para que o tecido volte a sua arquitetura e funções normais. Células que já realizaram suas funções no foco inflamatório devem ser eliminadas para evitar a continuidade e amplificação do processo inflamatório. Já as células que migraram e proliferaram no foco da lesão devem deixar o local para o tecido voltar as funções normais, sem suscitar mais resposta inflamatória. O mecanismo responsável pela morte celular silenciosa é a apoptose. Células lábeis e estáveis precisam ser eliminadas. Evidências recentes sugerem que a diminuição da celularidade no processo de maturação do tecido de granulação se associa à ocorrência de apoptose (DEMOULIERE et al., 1995; BROWN et al., 1997; GREENHALGH, 1998). A apoptose ou morte celular programada é um tipo de morte celular caracterizado por profundas modificações estruturais e funcionais (WYLLE, 1992). Trata-se de um mecanismo fisiológico de controle da população celular que regula o tamanho dos tecidos, exercendo um papel oposto ao da mitose (VASCONCELOS, 1995).
O implante de esponjas representa um modelo in vivo para a análise de respostas celulares como a angiogênese e fibrogênese que ocorrem durante o reparo de feridas (FAJARDO et al., 1988; DAVIDSON et al., 1985; ANDRADE et al., 1997; SEPHEL et al., 1996). A inserção subcutânea de matrizes esponjosas permite a infiltração de várias células de reparo das camadas dérmicas e tem sido utilizada para estudar fatores pró e anti-angiogênicos, assim como alterações na celularidade e na matriz extracelular envolvidas neste processo em animais experimentais (ANDRADE et al., 1992; MAJIMA et al., 2000).
A reação à inserção da esponja é semelhante à resposta do organismo a um corpo estranho. A resposta inflamatória gerada induz um processo de reparo que envolve ativação, migração, proliferação, diferenciação e renovação coordenada de diversos tipos celulares (NISSEN et al., 1998).
Diante do exposto, este trabalho teve como objetivos estudar a cinética da formação do tecido fibrovascular que infiltra a esponja. A melhor compreensão da cinética da evolução do processo da angiogênese inflamatória poderá resultar em novas abordagens terapêuticas e intervenções visando acelerar cicatrizações deficitárias, ou prevenir excessiva proliferação celular nos processos de reparo dos tecidos.
Para se estudar esta cinética alguns parâmetros foram avaliados, tais como: (a) o recrutamento celular, através da quantificação dos diferentes tipos celulares (leucócitos, macrófagos, fibroblastos e células endoteliais); (b) a determinação de alguns produtos que denotam a diferenciação destas células (MPO, NAG, colágeno e vasos), (c) a proliferação celular (expressão de AgNORs); e (d) a apoptose (reação de TUNEL) durante a formação do tecido de granulação in vivo utilizando o implante de esponjas. De acordo com a literatura consultada, este é o primeiro estudo a enfocar simultaneamente estes eventos biológicos na formação e maturação do tecido de granulação.
|
|
|
Material y Métodos
Animais utilizados e implantação da matriz esponjosa
Os experimentos de caracterização do processo de angiogênese inflamatória foram realizados utilizando 65 camundongos BALB/c machos de 4 a 5 semanas, pesando aproximadamente 20 gramas, provenientes do Centro de Bioterismo (CEBIO) do Instituto de Ciências Biológicas-UFMG.
Durante o período experimental todos os animais foram mantidos em gaiolas individuais com livre acesso à água e ração.
Discos de esponjas de poliéster poliuretano (Vtafoam Ltd) de 8mm de diâmetro por 5 mm de espessura, canulados centralmente com sondas de polivinil (PE 20 – Bio Vida) de 12 mm de comprimento, foram devidamente confeccionados e mantidos em álcool 70% durante, pelo menos, 24 horas antes da implantação. Para o procedimento cirúrgico, os animais foram anestesiados com Tribromo Etanol (Sigma) 2,5% (i.p.), 1mL/100g e submetidos à tricotomia e à assepsia da região dorsal. Em seguida, foi feita uma incisão de aproximadamente 1cm na pele de tal região e, após delicada divulsão do tecido subcutâneo, foi introduzido o disco de esponja, previamente lavado em água destilada e submetido à fervura durante 10 minutos. A cânula foi exteriorizada através de um orifício na pele da região cervical, suturada junto à pele e sua extremidade superior ocluída com massa de modelagem. Finalmente, a incisão dorsal foi suturada. Após a cirurgia, os animais foram mantidos sob aquecimento artificial até completo restabelecimento de suas funções vitais.
Processamento histológico e colorações
Os implantes foram fixados em formol tamponado neutro a 10% por no mínimo 48 horas e processados rotineiramente para inclusão em parafina. As secções de 5um obtidas foram coradas em diferentes métodos: hematoxilina-eosina (HE) e Shorr (para detalhamento morfocitológico), AgNOR (Impregnação pela prata para identificação e quantificação das regiões organizadoras de nucléolos), Picrosirius (para evidenciação histológica e morfometria do processo de colagenização) (LUNA, 1968) e reação de TUNEL (para detecção in situ da fragmentação do genoma, na apoptose) (GAVRIELI et al., 1992).
Parâmetros e estratégia morfométrica
De cada uma das lâminas estudadas, analisou-se o padrão de infiltração do tecido fibrovascular, o tipo celular (leucócitos, macrófagos, fibroblastos e células endoteliais), a expressão das AgNORs como marcador de ativação (leucócitos polimorfonucleares e macrófagos) e proliferação celular (fibroblastos e células endoteliais), o número e área de vasos, a área ocupada por colágeno e, por fim, a identificação in situ da fragmentação do genoma como marcador de apoptose (Reação de TUNEL).
Em cada campo microscópico estudado a abordagem citomorfométrica utilizada referiu-se à porcentagem de células quantificadas (conforme o tipo celular ou a marcação) em relação às células totais. Além disto, em cada campo microscópico quantificou-se o número e área de vasos e obteve-se também a área média destes. A área ocupada por colágeno na esponja nos diversos momentos foi obtida a partir da captura, binarização das imagens e densitometria de todos os campos da esponja.
A quantificação das células por tipo (polimorfonucleares, macrófagos, fibroblastos e células endoteliais) ou por marcação (AgNORs e TUNEL) e totais de cada campo foi feita a partir de imagens digitalizadas obtidas de amostras dos campos histológicos em microscópio de luz com objetiva planacromática de 100 vezes. A quantificação do número e área de vasos, assim como a da área ocupada por colágeno em cada campo foi feita a partir de imagens digitalizadas obtidas dos campos histológicos em microscópio de luz com objetiva planacromática de 40 vezes.
O número mínimo representativo de campos microscópicos para a quantificação da marcação (AgNORs e TUNEL) e do número de vasos foi determinado a partir da contagem inicial em 50 a 100 campos tomados aleatoriamente de uma secção de esponja (MORO et al., 2004). Desses, formaram-se 10 subamostras com número crescente de campos (5, 10, 15... até 50) retirados aleatoriamente com reposição. De cada grupo, calculou-se a média aritmética e respectivo desvio Padrão (DP) para cada tamanho amostral. À medida que o tamanho da amostra aumenta, os DPs tendem a diminuir até se estabilizar. Assim, quando o incremento do número de campos não resulta em redução considerável no valor do coeficiente de variação considera-se que o tamanho daquela amostra como mínimo representativo (SAMPAIO, 1998) (Gráfico 1).
As imagens foram digitalizadas em microcamera (JVC TK-1270/JGB) e transferidas para o analisador de imagens (Kontron Elektronics, Carl Zeiss - KS300 versão 2.0). (CALIARI, 1997).
Migração, ativação e proliferação celular
Vinte imagens (obtidas de 20 campos distintos) com ampliação final de 1000X (correspondendo a uma área de 8.533,37 um2/campo) foram digitalizadas de cada uma das lâminas coradas pela técnica de AgNOR de 7 animais em cada um dos 4 períodos avaliados. Quantificaram-se as AgNORs presentes em cada núcleo de cada célula presente no campo histológico, paralelamente, o número de núcleos marcados e totais de cada campo.
A contagem de AgNORs nos diferentes tipos celulares foi realizada considerando-se o tamanho, forma e localização de seus diversos núcleos na matriz esponjosa. Assim, núcleos segmentados ou lobulados de 7-8 um foram considerados de polimorfonucleares; núcleos maiores e vesiculosos com 10 a 11um foram considerados de macrófagos; núcleos fusiformes dispostos na matriz próximos às fibras colágenas foram considerados como de fibroblastos e núcleos fusiformes delimitando luz de vasos nas proximidades de hemácias foram quantificados como de células endoteliais.
Um parâmetro morfométrico utilizado foi a média da expressão de AgNORs nos núcleos dos diferentes tipos celulares estudados por campo microscópico e foi obtido conforme a seguinte equação:
Média de AgNOR = Somatório do nº de AgNORs / Somatório do nº de células marcadas.
Outra abordagem morfométrica utilizada foi o índice de marcação de AgNOR (IAgNOR) e referiu-se à proporção das células que expressam AgNOR acima da média em relação ao número total de células por campo microscópico. Este índice foi obtido conforme a seguinte equação:
Indice de AgNOR = Soma do nº de células marcadas acima da média / Soma do nº de células marcadas x 100.
Paralelamente, nas seções coradas em H.E. a área invadida pelo tecido fibrovascular foi obtida a partir da captura das imagens com ampliação de lupa, com posterior delimitação e quantificação como descrito por KYRIAKIDES (2001). A proporção entre a área de tecido fibrovascular infiltrante e a área total da esponja foi obtida como descrito por SAUDON & REED (2003).
Produtos celulares
Para a avaliação da ativação e celularidade nos implantes, foram utilizados tanto procedimentos histomorfométricos quanto bioquímicos. O influxo de neutrófilos e de macrófagos foi avaliado diretamente pela quantificação histomorfométrica destas células no tecido de infiltração e indiretamente através da quantificação da atividade das enzimas mieloperoxidase (MPO) e N- acetilglicosaminidase (NAG) respectivamente. Além disso, os fibroblastos foram quantificados morfometricamente, assim como o colágeno produzido por estas células em diferenciação. Os índices de vascularização dos implantes foram obtidos pela quantificação de células endoteliais e pela análise histomorfométrica dos vasos que incluiu o número de vasos, a área dos mesmos. Além disso, quantificou-se o conteúdo de hemoglobina na esponja como forma de estimar o fluxo sanguíneo nos vasos, característica de vasos maduros.
Atividade da mieloperoxidade (MPO)
A atividade de MPO foi mensurada em todo o tecido da esponja como descrito anteriormente (BAILEY, 1988; SOUZA et al., 2000). Cada implante foi homogeneizado (Tekmar TR-10, OH, U.S.A) em 2 ml de reagente de Drabkin (Labtest, São Paulo, Brazil) e centrifugada à 10,000 x g por 15 min. Após o processamento do sobrenadante do implante de esponja para a determinação da Hb (ver abaixo), uma parte do pellet correspondente foi homogeneizada em tampão 4.7 (0,1 M NaCl, 0,02 M Na3PO4, 0,015 M de NaEDTA) e centrifugada à 12,000 xg durante 20 min. Os pelletes foram ressuspendidos em rampão de fosfato de sódio 0.05 M (pH 5,4) contendo 0,5% de hexa-1,6-bisdecyltrimethylammonium bromide (HTAB, Sigma). A suspensão foi congelada e descongelada 3 vezes utilizando nitrogênio líquido e finalmente centrifugadas em 10,000x g durante 10 min. A atividade da MPO no sobrenadante resultante foi mensurada pela mistura de 25 ul de 3,3’-5,5’-tetrametibenzidina (TMB, Sigma), preparado em dimetil sulfoxido (DMSO, Merck) em uma concentração de 1,6 mM com 100 ul H2O2, dissolvida em tampão fosfato (pH 5,4) contendo 0,5% HTAB em uma concentração final de 0,003% vv-1) e 25ul do sobrenadante da amostra do tecido processada. O ensaio foi realizado em uma 96-wel microplate e foi iniciado pela incubação do sobrenadante da amostra em solução de TMB por 5 min à 37oC. Então a H2O2 foi adicionada e a incubação continuou por outros 5 min. A reação terminou com a adição de 100ul de H2SO4 e foi quantificada colorimetricamente à 450 nm em um espectrofotômetro (E max- Molecular Devices). Os resultados foram expressos como densidade óptica (OD) por g de tecido úmido (implante).
Atividade da N-acetil-beta-glucosaminidase (NAG)
A enzima lisossômica N-acetil-beta-glucosaminidase se encontra presente em macrófagos ativos (BAILEY, 1988). Parte do pellet remanescente após a dosagem de Hb foi utilizada para este ensaio visando detectar os níveis dessa enzima. Estes pellets foram homogeneizados em uma solução de NaCl (0,9% wv-1) contendo 0,1%v v-1 Triton X-100 (Promega) e centrifugado (3000 x g; 10min 4o C). Amostras do sobrenadante resultante (100ul) foram incubadas por 10 min com 100ul p-nitropenyl-N-acetyl-beta-glucosaminide (Sigma), preparado em tampão de citrato/fosfato ((pH 4,5) em uma concentração final de 2.24 mM. A reação foi terminada pela adição de 100ul 0,2 M tampão glycine pH 10.6. A hidrolise do substrato foi determinada pela mensuração da absorção em 405 nm. A atividade foi expressa como densidade óptica (OD) por g de tecido molhado (implante).
Quantificação do colágeno
Para a quantificação de colágeno utilizou-se o Picrosirius Red (PSR), um composto aniônico que distingue a espessura e densidade das fibras colágenas pela coloração emitida sob a luz polarizada. Enquanto as fibras finas dissociadas são esverdeadas, as fibras mais grossas fortemente associadas emitem cores com comprimento de ondas maiores, como vermelho e amarelo (KESLER et al., 2000). Lâminas coradas em picrossirius foram estudadas com objetiva de 10 X para a quantificação das áreas de colágeno. De cada lâmina foram obtidas 20 imagens em áreas de maior concentração de fibras colágenas. A densidade dos “pixels” das regiões ocupadas pelas fibras colágenas foram selecionados na imagem real para subsequente criação de uma imagem binária, visando a quantificação densitométrica. A metodologia empregada para captura, segmentação de imagens, definição das condições morfométricas e obtenção das medidas foi descrita por CALIARI (1997).
Análise morfométrica dos vasos sanguíneos
Para a análise dos vasos sanguíneos utilizou-se a coloração pelo Shorr. Contaram-se 15 campos por lâmina e analisou-se o perfil dos vasos sanguíneos no modelo de esponja através da quantificação do número de vasos e da área media desses vasos que apresentavam ou não hemácias em seu interior.
Quantificação de Hemoglobina na esponja
O conteúdo de hemoglobina (Hb) detectada na esponja utilizando-se o método de Drabkin (DRABKIN & AUSTIN, 1932) foi utilizado como forma de avaliar o fluxo sanguíneo nos vasos, característica de vasos diferenciados. Este método foi modificado e utilizado para determinar a angiogênese em vários modelos e tecidos, incluindo o modelo de esponja (PASSANITI et al., 1992; HU et al., 1995; LAGE & ANDRADE, 2000). Cada implante foi homogeneizado (Tekmar TR-10, OH, U.S.A) em 2 ml de reagente de Drabkin (Labtest, São Paulo, Brazil) e centrifugada à 10,000 x g por 15 min. Os sobrenadantes foram filtrados através de um filtro de 0,22um (Milipore). A Hb nas amostras foi determinada espectrofotometricalmente pela medida da absorbância em 540nm utilizando uma placa de leitor de ELISA e comparada com uma curva padrão de Hb. O conteúdo de Hb no tecido de granulação foi expressa como ug por mg de tecido úmido.
Identificação e quantificação da apoptose
Utilizou-se a técnica de TUNEL para marcar as células em apoptose e a morfometria para a quantificação das mesmas, considerando-se ainda a morfologia sugestiva de apoptose (VASCONCELOS, 2001). Os corpos apoptóticos quando inúmeros e próximos uns dos outros foram quantificados como o resultado de uma única célula em apoptose. Quando distantes entre si, foram considerados como resultado de apoptose em células diferentes e contabilizados como tal.
A técnica de TUNEL para a marcação “in situ” da fragmentação do genoma combina princípios histoquímicos e imuno-histoquímicos e é aplicada em corte de tecido embebido em parafina identificando células apoptóticas. Requer o uso de uma enzima exógena, a transferase terminal de deoxinucleotídeo (TdT) que incorpora um nucleotídeo marcado na extremidade 3’0H do genoma em fragmentação. Os nucleotídeos marcados inseridos são posteriormente identificados como grumos GAVRIELI et al., 1992 amarronzados a partir da reação da diaminobenzidina (DAB) com a Peroxidase (POD). Utilizou-se o kit da Oncogene (TdT –FragEL TM) Dna Fragmentation Detection Kit.
Cinquenta imagens (obtidas de 50 campos distintos) com ampliação final de 1000X (correspondendo a uma área de 8.533,37 um2/campo) foram digitalizadas de cada uma das lâminas coradas pela técnica de TUNEL de 7 animais em cada um dos 4 períodos avaliados. Quantificaram-se as células marcadas pela reação e com morfologia sugestiva presentes em cada campo. O parâmetro morfométrico utilizado - o índice de marcação de apoptose (IA) - referiu-se à proporção de células em apoptose em relação ao número total de células por campo microscópico e foi obtido conforme a seguinte equação:
IA = Somatório do nº de células em apoptose / Somatório do nº de células totais x 100.
Análise Estatística
Os resultados foram apresentados como média ± erro padrão ou mediana, conforme tenham tido uma distribuição normal ou não, pelo teste de Kolmogorov-Smirnov. Quando a distribuição foi normal utilizou-se a análise de variância (ANOVA) para avaliar eventuais diferenças entre os parâmetros mensurados nos diferentes tempos de implante e aplicou-se o teste de Newnam Keuls para comparar os grupos entre si e quando comparou-se dois grupos utilizou-se o teste t .Quando a distribuição dos dados não demonstrou normalidade, o teste não paramétrico de Kruskal-Wallis foi aplicado. Se os dados consistiam de mais de dois grupos, utilizou-se o teste de múltipla comparação de Dunn. Os valores de P<0,05 foram considerados significativos, utilizando-se o programa GraphPad Prism 3.0.
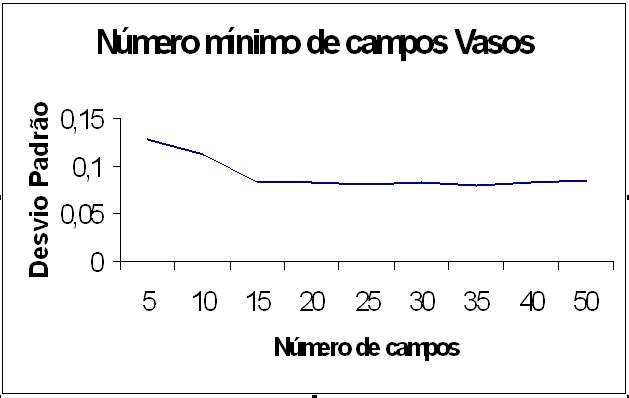 fiogf49gjkf0dGRÁFICO 1- Número mínimo representativo de campos para a quantificação de vasos"> fiogf49gjkf0dGRÁFICO 1- Número mínimo representativo de campos para a quantificação de vasos">
Graf1 - fiogf49gjkf0d GRÁFICO 1- Número mínimo representativo de campos para a quantificação de vasos
|
|
|
Resultados
Cinética da infiltração de diferentes tipos celulares na matriz esponjosa
Inicialmente a esponja implantada é acelular. Com o tempo e o decorrer da resposta inflamatória, existe a predominância de vários tipos celulares nas diversas fases do processo. No tempo inicial de 4 dias observou-se um infiltrado celular composto predominantemente por leucócitos e macrófagos, gradativamente aos 7, 10 e 14 dias pós implantação houve aumento de todas as populações celulares.
Os leucócitos e macrófagos foram as células predominantes nos diferentes tempos após o implante da esponja. Os fibroblastos apareceram em menor quantidade, seguidos pelas células endoteliais (GRAF. 2).
A análise estatística (ANOVA) mostrou que os leucócitos apareceram em menor quantidade no 4o dia (108,40 +/- 9,91) pós-implantação quando comparados (P< 0,001) com os tempos de 7 (253,40 +/- 51,56), 10 (227,00 +/- 37,33) e 14 dias (323,40 +/- 25,56). Nestes intervalos de 7, 10 e 14 as quantidades de leucócitos não foram diferentes (P> 0,05).
Da mesma maneira , no tempo de 4 dias após o implante da matriz esponjosa a quantidade de macrófagos quantificada (77,60 +/- 5,92) foi significativamente menor (P< 0,001) quando comparada com os tempos de implante de 7 (157,20 +/- 20,87), 10 (240,40 +/- 17,76) e 14 dias (231,80 +/- 26,05). No tempo de 7 dias esta população celular também foi menor (P< 0,05) que nos tempos de 10 e 14 dias. Quando se comparou o tempo de 10 com o de 14 dias não houve diferença na população de macrófagos infiltrantes.
A população de fibroblastos foi menor (P< 0,001) no tempo de 4 dias (6,80 +/- 1,28) quando comparado com os tempos de 7 (64,40 +/- 8,25), 10 (75,60 +/- 6,44) e 14 (115,00 +/- 7,47) dias após a implantação. Nos tempos de 7 e 10 dias após a implantação da esponja, a população de fibroblastos foi semelhante, sendo menor que a obtida com o tempo de 14 dias (P<0,001).
As células endoteliais não foram detectadas no 4o dia após a implantação da esponja, só sendo quantificadas a partir do 7o dia (68,40 +/- 15,28) quando foi semelhante ao obtido para o 10o (94,40 +/- 19,03) dia. A quantidade de células endoteliais observadas aos 14 dias (131,40 +/- 12,93) foi significativamente maior (P<0,05) que a obtida para 7 dias, mas similar à observada para 10 dias.
Cinética da migração, ativação e proliferação celular
Morfologia das AgNORs
Na impregnação pela prata as AgNORs foram identificadas como grumos marron escuros, com forma, tamanho e distribuição variadas. Os grumos eram isolados, ou agregados, com formas arredondadas ou irregulares, distribuídos difusamente no núcleo ou circundando o nucléolo, com aparência de rosário ou satélites. Os grumos resultantes da impregnação pela prata foram quantificados em diferentes tipos celulares presentes nos cortes histológicos (polimorfonucleares, macrófagos, fibroblastos e células endoteliais) (FIG.1).
Média de AgNORs por tipo celular
A quantidade média das AgNORs nos núcleos dos leucócitos diferiu (P<0,05) entre os 4 períodos estudados, sendo maiores aos 10 dias (3,25+/-0,05) e 4 dias (2,91+/-0,06) e menores no 7o (2,76+/-0,04) e 14o (2,52+/-0,04) dias. (GRAF.3a).
As AgNORs nos núcleos de macrófagos foram mais intensamente expressas no 10o (4,34+/-0,06) dia. Semelhantes no 7o(3,84+/-0,06) e 4o (3,80+/-0,08) dias, e menores no 14o(3,18+/-0,05) dia. (GRAF.3b).
As AgNORs expressas pelos fibroblastos nos dias 4 (3,91+/-0,36), 7 (3,35+/-0,09) e 10 (3,63+/-0,09) foram semelhantes e significativamente maiores do que as expressas no 14o dia (2,98+/-0,06). (GRAF.3c).
As células endoteliais expressaram maior quantidade de AgNORs no 10(3,6220,078) que no 7o (3,44+/-0,09) dia e menor no 14o dia (2,94+/-0,05). As AgNORs. não foram quantificadas no 4o dia por não se visualizar nesse período as células endoteliais. (GRAF.3d).
Índice de Ativação celular (IAgNORs) por tempo pós implantação
A ANOVA utilizada para avaliar o índice de ativação celular nos diferentes tempos do implante estudados revelou diferenças significativas entre os mesmos (P < 0.001).
A ativação celular foi maior (P < 0.001) aos 10 dias (39,52 +/- 1,61) após a implantação da esponja. Aos 7 (33,66 +/- 1,290) e 4 (35,80 +/- 2,13) dias após a implantação não houve diferença significativa (p > 0,05) no índice de ativação celular. A ativação celular foi menor (P < 0.001) aos 14 (31,12 +/- 1,39) dias (P < 0.001). (GRÁF. 4).
Análise do tecido fibrovascular que infiltra a esponja
A infiltração do tecido fibrovascular no implante ocorreu gradualmente de acordo com o decorrer do tempo pós implantação (FIG. 2).
Com relação à infiltração do tecido fibrovascular; aos 4 dias após a implantação, observou-se que paralelamente à infiltração de células (polimorfonucleares, macrófagos e ocasionais fibroblastos) surgia uma fina e delicada matriz extracelular imatura (MEC) circundando as células. Aos 7 dias, já se observava a formação de uma malha mais organizada de matriz extracelular e invasão de vasos sanguíneos nos intersticios da esponja. Esta matriz intersticial era formada de fibras mais densas na margem da esponja e subdividida em fibras mais delgadas dentro da esponja . Aos 10 e 14 dias observou-se um tecido fibrovascular de granulação mais denso com vários vasos sanguíneos.
A infiltração do tecido fibrovascular composto de células migrantes e proliferantes, fibras conjuntivas e vasos na esponja foi progressivo e evidente. A área ocupada pelo tecido fibrovascular aumentou progressivamente nos intervalos de avaliados (p < 0,001). No implante de 4 dias o tecido de infiltração foi considerado insignificante, composto predominantemente por células, não tendo sido observados vasos e fibras maduras (GRAF. 5).
Produtos celulares
Cinétida da atividade enzimática (MPO) e (NAG)
Os leucócitos ativos presentes no implante liberaram mieloperoxidase e sua atividade foi quantificada como marcador de diferenciação e atividade para leucócitos-neutrófilos. A leitura da densidade óptica (OD) por g de tecido molhado (implante) mostrou atividade crescente de MPO, menor aos 4 dias (20,00 +/- 3,00), seguido pelo 7o dia (24,46 +/- 3,5) e maior aos 10 (42,22 +/- 6,65) e 14 (44,52 +/- 5,67) dias após a implantação (GRAF. 6).
Os macrófagos ativos presentes no implante liberaram NAG e sua atividade foi quantificada como marcador de diferenciação e atividade para estas celulas. A leitura da densidade óptica (OD) por g de tecido molhado (implante) mostrou atividade crescente de NAG, menor aos 4 dias (1,44 +/- 0,30) e maior aos 14 dias (10,91 +/- 0,93) após a implantação da esponja (GRAF. 7).
Cinética da produção de colágeno
A avaliação densitométrica do colágeno denso, que forma fibras e fouxo mostrou diferenças com a evolução do tempo após o implante das esponjas. Enquanto o colágeno denso aumentou progressivamente nos implantes, o frouxo decresceu (GRAF. 8).
A área ocupada por colágeno denso foi maior no 14 (19090 um2) dia após o implante da esponja seguido pelo 10 (7438 um2) e 7 (2440 um2)dia. Já a área ocupada por colágeno frouxo foi maior no 10o (143,80+/-5,2 um2) dia após a implantação que no 14o(81,05 +/- 14,76 um2). No 7º dia as fibras do colágeno frouxo apresentavam-se muito dispersas impossibilitando sua avaliação densitométrica
Cinética da formação de vasos sanguíneos
Análise morfométricas dos vasos
O número médio de vasos por campo histológico estudado foi maior aos 10 (15,00) e 7 (16,00) dias após o implante das esponjas, decaindo aos 14 (11,00) dias. A área média dos vasos no campo histológico no 10 (252,40 um2) e 14 (236,00 um2) dias foi maior que a área dos vasos no 7º (214,90 um2) dia (GRAF. 9)
Quantificação de hemoglobina na esponja (Índice vascular)
O conteúdo de Hb no tecido de granulação presente na esponja foi considerado como parâmetro acessório para avaliar a neoformação vascular, característica de vasos diferenciados. Expresso como ug de Hb por mg de tecido úmido. O teor de Hb presente na esponja mostrou crescimento progressivo ao longo do tempo pós-implantação (4 (0,19 +/-0,05), 7 (0,99 +/- 0,19) 10 (1,54 +/- 0,13) e 14 (2,79 +/- 0,20) dias (GRÁF. 10).
Apoptose
Morfologia das células apoptóticas
Os núcleos das células em apoptose foram marcados pelo TUNEL, ficando com uma coloração acastanhada escura, resultado da reação da Peroxidase (POD) com o seu substrato, a diaminobenzidina (DAB).
Observou-se também como critérios de inclusão as características morfológicas da apoptose como: retração e perda de adesão entre as células (anoiquia), enrugamento celular, condensação do citoplasma e do núcleo, com compactação da cromatina nuclear, fragmentação nuclear e posteriormente celular formando corpos apoptóticos.
Índice Apoptótico por tempo pós implantação
A proporção de células em apoptose em relação ao número total de células por campo microscópico foi alta no 4o dia (31,40 +/- 1,39), decaindo no 7o (13,90 +/- 0,87) no 10o (19,97 +/- 1,35) e 14o dia (17,87 +/- 0,88) sucessivamente após a implantação das esponjas (GRAF. 11).
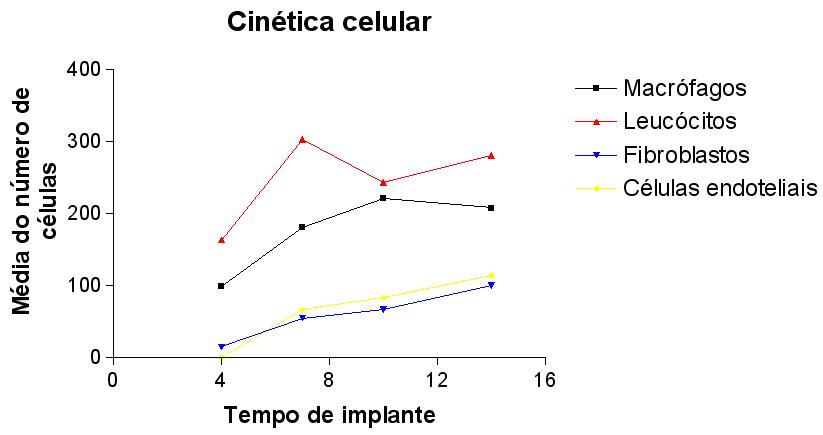 fiogf49gjkf0dGRÁFICO 2 – Cinética das populações celulares (Macrófagos, Leucócitos, Fibroblastos e Células endoteliais) que infiltram a matriz esponjosa nos diferentes tempos após implantação."> fiogf49gjkf0dGRÁFICO 2 – Cinética das populações celulares (Macrófagos, Leucócitos, Fibroblastos e Células endoteliais) que infiltram a matriz esponjosa nos diferentes tempos após implantação.">
Graf2 - fiogf49gjkf0d GRÁFICO 2 – Cinética das populações celulares (Macrófagos, Leucócitos, Fibroblastos e Células endoteliais) que infiltram a matriz esponjosa nos diferentes tempos após implantação.
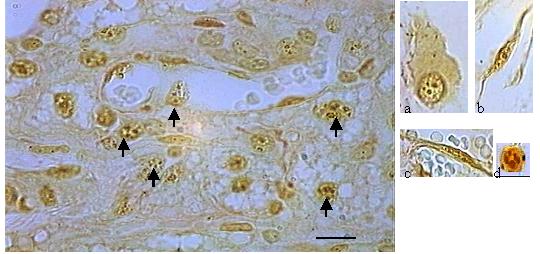 fiogf49gjkf0dFIGURA 1- Corte histológico de implante (7 dias), corado com AgNOR. Setas indicam os grumos enegrecidos arredondados, como pequenos satélites espalhados por todo o núcleo (NORs). Barra= 10m. À direita, detalhes da impregnação pela prata nas AgNORs nucleares de macrófagos (a), fibroblastos (b) leucócitos, (c) e células endoteliais (d)."> fiogf49gjkf0dFIGURA 1- Corte histológico de implante (7 dias), corado com AgNOR. Setas indicam os grumos enegrecidos arredondados, como pequenos satélites espalhados por todo o núcleo (NORs). Barra= 10m. À direita, detalhes da impregnação pela prata nas AgNORs nucleares de macrófagos (a), fibroblastos (b) leucócitos, (c) e células endoteliais (d).">
Fig1 - fiogf49gjkf0d FIGURA 1- Corte histológico de implante (7 dias), corado com AgNOR. Setas indicam os grumos enegrecidos arredondados, como pequenos satélites espalhados por todo o núcleo (NORs). Barra= 10m. À direita, detalhes da impregnação pela prata nas AgNORs nucleares de macrófagos (a), fibroblastos (b) leucócitos, (c) e células endoteliais (d).
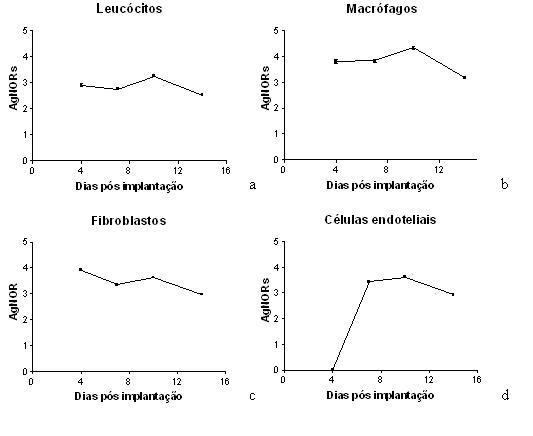 fiogf49gjkf0dGRÁFICO 3. Distribuição das médias das AgNORs nos diferentes tipos celulares (macrófago, leucócito, fibroblasto e endotélio) nos diferentes tempos decorridos após o implante subcutâneo das esponjas"> fiogf49gjkf0dGRÁFICO 3. Distribuição das médias das AgNORs nos diferentes tipos celulares (macrófago, leucócito, fibroblasto e endotélio) nos diferentes tempos decorridos após o implante subcutâneo das esponjas">
Graf3 - fiogf49gjkf0d GRÁFICO 3. Distribuição das médias das AgNORs nos diferentes tipos celulares (macrófago, leucócito, fibroblasto e endotélio) nos diferentes tempos decorridos após o implante subcutâneo das esponjas
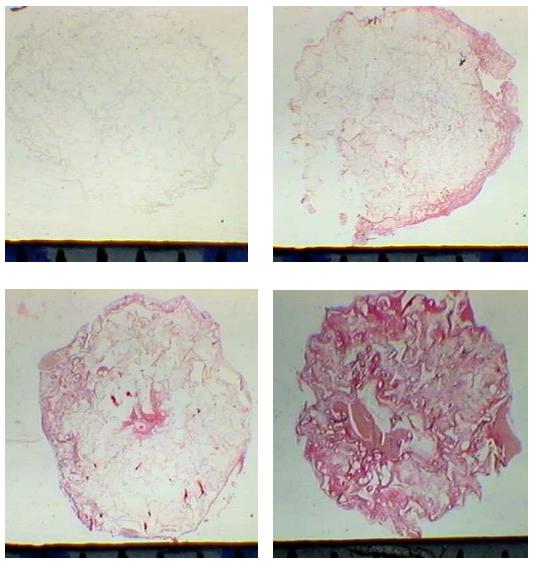 fiogf49gjkf0dFIGURA 2. Pefil da infiltração do tecido fibrovascular observado em aumento de lupa após a implana- 4 dias; b- 7 dias, c- 10 dias, d- 14 dias (picrossirius)."> fiogf49gjkf0dFIGURA 2. Pefil da infiltração do tecido fibrovascular observado em aumento de lupa após a implana- 4 dias; b- 7 dias, c- 10 dias, d- 14 dias (picrossirius).">
Fig2 - fiogf49gjkf0d FIGURA 2. Pefil da infiltração do tecido fibrovascular observado em aumento de lupa após a implana- 4 dias; b- 7 dias, c- 10 dias, d- 14 dias (picrossirius).
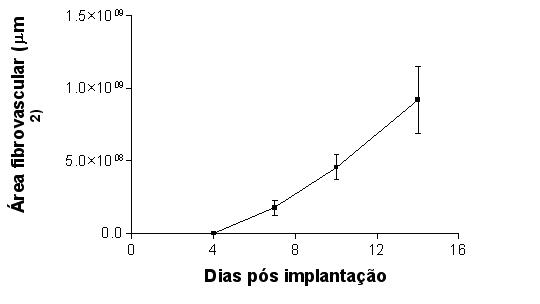 fiogf49gjkf0dGRÁFICO 5. Evolução da infiltração fibrovascular e celular na esponja por diferentes tempos de implante subcutâneo."> fiogf49gjkf0dGRÁFICO 5. Evolução da infiltração fibrovascular e celular na esponja por diferentes tempos de implante subcutâneo.">
Graf5 - fiogf49gjkf0d GRÁFICO 5. Evolução da infiltração fibrovascular e celular na esponja por diferentes tempos de implante subcutâneo.
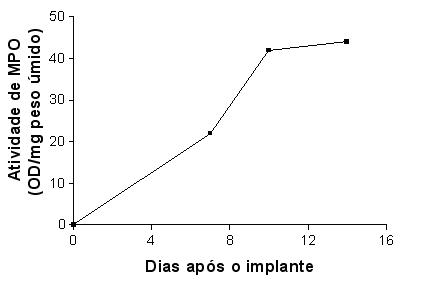 fiogf49gjkf0dGRAFICO 6. Evolução da atividade de MPO como fator de atividade de Neutrófilos na esponja por diferentes tempos de implante subcutâneo."> fiogf49gjkf0dGRAFICO 6. Evolução da atividade de MPO como fator de atividade de Neutrófilos na esponja por diferentes tempos de implante subcutâneo.">
Graf6 - fiogf49gjkf0d GRAFICO 6. Evolução da atividade de MPO como fator de atividade de Neutrófilos na esponja por diferentes tempos de implante subcutâneo.
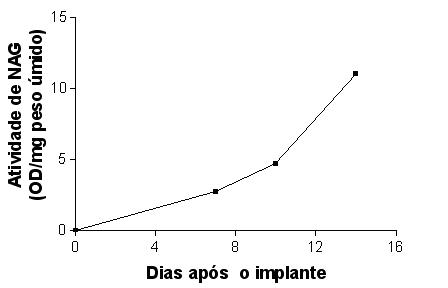 fiogf49gjkf0dGRÁFICO 7. Evolução da atividade de NAG como fator de atividade de macrófagos na esponja por diferentes tempos de implante subcutâneo."> fiogf49gjkf0dGRÁFICO 7. Evolução da atividade de NAG como fator de atividade de macrófagos na esponja por diferentes tempos de implante subcutâneo.">
Graf7 - fiogf49gjkf0d GRÁFICO 7. Evolução da atividade de NAG como fator de atividade de macrófagos na esponja por diferentes tempos de implante subcutâneo.
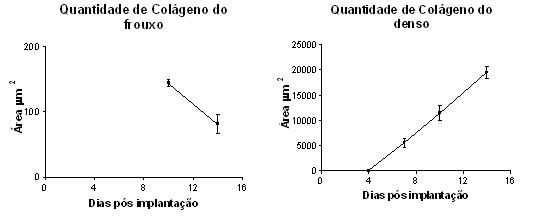 fiogf49gjkf0dGRÁFICO 8. Evolução da quantidade de colágenos fouxo (decrescente) e denso (crescente) como fator de atividade de fibroblastos na esponja por diferentes tempos de implante subcutâneo."> fiogf49gjkf0dGRÁFICO 8. Evolução da quantidade de colágenos fouxo (decrescente) e denso (crescente) como fator de atividade de fibroblastos na esponja por diferentes tempos de implante subcutâneo.">
Graf8 - fiogf49gjkf0d GRÁFICO 8. Evolução da quantidade de colágenos fouxo (decrescente) e denso (crescente) como fator de atividade de fibroblastos na esponja por diferentes tempos de implante subcutâneo.
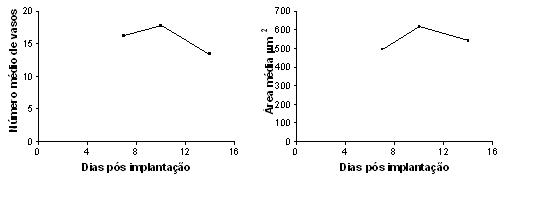 fiogf49gjkf0dGRÁFICO 9. Evolução da quantidade média de vasos por campo e da área media destes no campo histológico como fator de atividade de células endoteliais na esponja em diferentes tempos de implante subcutâneo."> fiogf49gjkf0dGRÁFICO 9. Evolução da quantidade média de vasos por campo e da área media destes no campo histológico como fator de atividade de células endoteliais na esponja em diferentes tempos de implante subcutâneo.">
Graf9 - fiogf49gjkf0d GRÁFICO 9. Evolução da quantidade média de vasos por campo e da área media destes no campo histológico como fator de atividade de células endoteliais na esponja em diferentes tempos de implante subcutâneo.
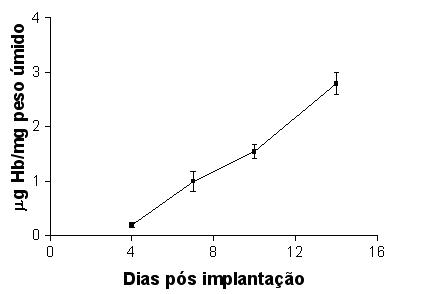 fiogf49gjkf0dGRÁFICO 10. Conteúdo de Hb nos implantes de esponja para avaliar o fluxo sanguíneo nos vasos, característica de vasos maduros."> fiogf49gjkf0dGRÁFICO 10. Conteúdo de Hb nos implantes de esponja para avaliar o fluxo sanguíneo nos vasos, característica de vasos maduros.">
Graf10 - fiogf49gjkf0d GRÁFICO 10. Conteúdo de Hb nos implantes de esponja para avaliar o fluxo sanguíneo nos vasos, característica de vasos maduros.
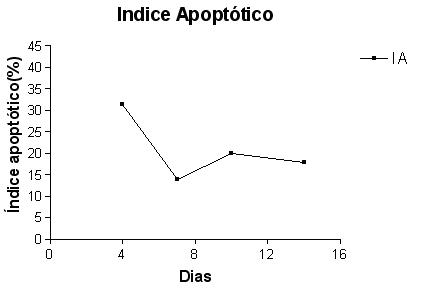 fiogf49gjkf0dGRÁFICO 11. Evolução do Índice Apoptótico das células presentes nos implantes de esponja nos diferentes tempos decorridos"> fiogf49gjkf0dGRÁFICO 11. Evolução do Índice Apoptótico das células presentes nos implantes de esponja nos diferentes tempos decorridos">
Graf11 - fiogf49gjkf0d GRÁFICO 11. Evolução do Índice Apoptótico das células presentes nos implantes de esponja nos diferentes tempos decorridos
|
|
|
Discusión
O presente estudo objetivou avaliar a cinética do recrutamento, ativação, e morte celular no tecido fibrovascular induzido pelo implante de esponjas em camundongos. A utilização de diferentes técnicas que avaliam estes parâmetros possibilitou a observação que estes são eventos distintos mas que se sobrepõem ao longo do processo no período estudado (14 dias).
Foi observado que inicialmente a esponja implantada subcutaneamente era acelular e avascular, mas ela induz uma reação inflamatória, e diversas populações celulares foram recrutadas e migraram nos poros da matriz esponjosa formando um tecido de granulação.
O tecido de granulação que infiltrou a esponja apresenta características de um tecido novo, consistindo de leucócitos polimorfonucleares, macrófagos, fibroblastos e fibras conjuntivas, células endoteliais e vasos sanguíneos. A presença contínua do implante gerou uma resposta inflamatória característica de um processo crônico (SINGER & CLARK, 1999; MACHADO et al., 2000; FERREIRA et al., 2004).
Aos 4 e 7 dias, o tipo celular dos implantes era composto predominantemente por leucócitos (PMN) e macrófagos. Os polimorfonucleares predominaram (GRÁF. 2), conforme esperado nesta fase, já que o processo inflamatório é agudo e o período de tempo decorrido ainda não tinha sido suficiente para o aparecimento dos fenômenos proliferativos-reparativos da inflamação, que ocorrem mais tardiamente (CLARK, 1996; KLAPLANSKI et al., 2003). Estas células estão envolvidas na primeira defesa contra organismos invasores e eliminação de corpos estranhos (GREENHALGH, 1998). A atividade de MPO que se associa com a presença de neutrófilos corrobora com a presença maciça destas células na fase inicial do processo, esta atividade foi crescente até o 10o dia estabilizando-se no 14o dia.
Os macrófagos apresentam um papel crítico durante a resposta inflamatória e imune. Como outras células do sistema imune, os macrófagos são produzidos em grande escala e muitos deles são eliminados pelo mecanismo de apoptose (XAUS et al., 2001). Os macrófagos são os orquestradores chave do reparo dos tecidos, liberando uma série de fatores de crescimento e citocinas (KORN et al., 1980; DIELGEMANN et al., 1981). A atividade de NAG (considerada como estimativa bioquímica da população de macrófagos) foi crescente, com valores mais elevados aos 14 dias após o implante. A quantidade de macrófagos aumentou gradativamente do 4o até o 10o dia, estabilizando-se no 14o dia, o que indicou uma correlação positiva entre a quantidade destas células e seu produto – o NAG.
Na fase proliferativa (7-10 dias), a quantidade de polimorfonucleares permaneceu constante enquanto os outros tipos celulares apresentaram um aumento gradativo em suas populações, e a presença de fibroblastos e das células endoteliais foi marcante. As citocinas e os fatores de crescimento liberados pelas células inflamatórias ativam e atraem os fibroblastos (HUNT et al., 1984). Os fibroblastos migram, proliferam e depositam colágeno, participando da formação do tecido de granulação sendo a resposta fibroblástica importante na reparação das lesões (GRINNELL, 1994; DEMOULIERE et al., 1997). Como resultante da ativação dos fibroblastos detectou-se, nestes experimentos, maior quantidade de colágeno denso, que forma fibras e menor quantidade do outro mais frouxo. A técnica utilizada, descrita por JUNQUEIRA et al. (1979), utilizou o Picrosirius Red - um composto aniônico que distingue a espessura e densidade das fibras colágenas pela coloração emitida sob luz polarizada, caracterizando como colágeno tipo I o mais denso e o colágeno tipo III como o mais frouxo.
O colágeno tipo III geralmente é o primeiro colágeno a aparecer, é abundante nos vasos e constitui um estroma de fibras mais delicadas (JEFFREY et al., 1996). No tecido fibrovascular da esponja, não foi possível a visualização do colágeno frouxo nos primeiros dias pós implantação, talvez pela dinâmica e rápida evolução do processo, que substitui prontamente o colágeno tipo III pelo do tipo I, formando um estroma mais denso. Do 10o para o 14o dia observou-se uma diminuição significativa de colágeno frouxo. Já o colágeno denso apresentou um aumento gradativo em sua quantidade de acordo com o aumento do tempo de implante, mas no 4o dia este tipo de colágeno também não foi detectado. O colágeno tipo I induz as células endoteliais a assumirem uma morfologia fusiforme e a se alinhar em sólidos cordões. Estes cordões assemelham-se aos sólidos cordões pré-capilares da angiogênese embrionária, importantes para o processo de angiogênese (DELVOS et al., 1982; MONTESANO et al., 1983; JACKSON et al., 1994; RICHARD et al., 1998; SWEENEY, 1998).
A angiogênese é um fator importante nos processos de reparação pois os novos vasos fornecem nutrientes e oxigênio para o tecido de granulação (AUERBACH & AUERBACH, 1997; FREDERICK et al., 1984; NISSEN et al., 1998; RIBATTI et al., 2001). Neste estudo, as células endoteliais não foram detectadas no 4o dia após o implante da esponja, mas apresentaram um aumento progressivo a partir do 7o. Como evolução natural da proliferação, migração e diferenciação das células endoteliais, observou-se que os vasos são mais numerosos no 10o dia, diminuindo na avaliação morfométrica no 14o dia. Observou-se um aumento progressivo no número de células endoteliais, no calibre do vasos e no conteúdo de Hb aos 14 dias pós implantação, sugerindo fusão de alças vasculares e indicando maior maturação e funcionalidade dos vasos, com o decorrer do tempo de implantação. Além disso, vasos menores e não necessários poderiam ficar colabados e mesmo estarem sendo reabsorvidos.
Embora os resultados obtidos com a análise morfométrica possibilitaram uma descrição do perfil da celularidade na matriz esponjosa, foi apenas a marcação com o AgNOR que permitiu avaliar diretamente o estado de ativação das populações celulares nos diferentes intervalos estudados.
A técnica de AgNOR tem sido amplamente utilizada com marcador da atividade de proliferação tumoral (TRERÈ et al., 1989, DERENZINI et al., 1990). Neste trabalho, foi utilizada para quantificar a atividade em tecido não neoplásico, em modelo de angiogênese inflamatória. Estudos utilizando esta técnica em patologia ortopédica indicaram números médios de AgNOR por célula variando entre 2.9 +/- 0.1 em traumas articulares, 3.6 +/- 0.05 na Osteoartrite e 4.3 +/- 0.3 na artrite reumatóide e 7.3 +/- 0.3 no sarcoma sinovial. (SCHASER et al., 1996).
Ao lado de sua função no controle do ciclo celular, as AgNORs são também bases para a produção de subunidades ribossomicas. Em células engajadas na síntese de proteínas, mais AgNORs serão ativamente transcritas para manter o número de ribossomos necessários para este processo e portanto mais AgNORs serão citologicamente demostradas (UNDERWOOD & GIRI, 1988; DERENZINI & TRERE, 1991). O valor da quantificação de AgNORs como um índice de síntese protéica tem sido confirmado em poucos estudos sobre tecidos saudáveis com limitado ou nenhum potencial mitótico (JOZSA et al., 1993; POLLOK, 1997).
Inicialmente a ativação celular quantificada pela expressão de AgNORs apresentou-se elevada nos tempos de 4 e 7 dias aumentando no 10o dia e diminuindo drasticamente no 14o dia. A ausência ou escassez de celularidade inicial da matriz esponjosa pode ter sido um fator na alta taxa de ativação celular observada inicialmente. Já no 14o dia o número de AgNORs observado em todos os tipos celulares sofre uma diminuição, é possível que nesta fase a matriz esponjosa já estivesse suficientemente ocupada por células, e ocorrendo o início da resposta de resolução da inflamação causada pela esponja. A alta expressão das AgNORs inicialmente nas células como leucócitos e macrófagos pode estar associada à alta atividade inflamatória destas células na matriz esponjosa, já aos 14 dias a resposta inflamatória dá sinais de resolução e a atividade celular diminuiu. A maior expressão das AgNORs precedeu o aumento da celularidade para fibroblastos e células endoteliais no modelo de angiogênese inflamatória, sustentando sua aplicação como índice de proliferação das células lábeis nos tecidos, tal como demonstrado em tecidos tumorais (CROCKER et al., 1988, HÖRLIN et al., 1992). Muitos procedimentos podem medir a atividade de proliferação celular nas lesões tumorais e os mais utilizados são os marcadores MIB1/Ki67, PCNA (antígeno nuclear de proliferação celular) e bromodeoxiuridina (BrdU), além das AgNORs (TRERÈ et al., 1989, DERENZINI et al., 1990). A cinética de proliferação celular obtida pela técnica de AgNOR se compara aos resultados obtidos com BrdU e MIB1 por outros pesquisadores (OEHMICHEN & CRÖPELIN, 1995;CROCKER et al., 1990; ORITA, 1990). No processo de cicatrização, a análise morfométrica das AgNORs é importante na definição da fase evolutiva da lesão e permite quantificar a ativação e a proliferação celular. Além disso, trata-se de um método rápido, econômico e possível de ser implementado facilmente na rotina de amostras teciduais (GODOY et al., 2000).
Quando analisou-se os vários tipos celulares separadamente, pôde-se observar uma variação temporal na expressão das AgNORs. Após a diapedese e migração para o foco das lesões de pele, os PMNs demonstram uma resposta transcricional significante que inclui genes de várias categorias funcionais diferentes, de maneira a regular a sua função e destino no reparo de feridas (THEILGAARD-MONCH, 2004). Neste estudo os leucócitos e macrófagos são ativados, migram para a matriz esponjosa, e produzem MPO e NAG, sucessivamente.
Nos núcleos dos leucócitos e macrófagos, a alta expressão de AgNORs aos 7 e 10 dias precedeu à ativação subsequente, no 10o e 14o dias, indicando uma relação positiva entre a quantidade de AgNORs / número de células. Os fibroblastos, que apresentaram-se inicialmente em quantidades muito baixas (GRAF. 1), ainda que o número de AgNORs expressos por núcleo/fibroblastos tenha sido alto (GRAF. 2). Assim, o aumento subsequente progressivo e intenso do número de fibroblastos e de colágeno foi precedido pela maior expressão das AgNORs. As células endoteliais apresentaram um aumento na expressão de AgNORs nos núcleos até o 10o dia o que também precedeu o aumento subsequente da população destas células e do número de vasos no próximo tempo estudado (14o dia).
A baixa expressão de AgNORs no 14o dia pós-implantação observada em todos os tipos celulares estudados parece estar associada à consecutiva diminuição ativação e proliferação indicando o início da fase de resolução do processo. Foi observado que após 21 dias de implantação o tecido de granulação apresentou-se fibrosado e com um baixo número de células (dados não publicados).
A menor quantidade de tecido fibrovascular na esponja no 7o dia, com pequeno número de células e menor quantidade de colágeno tipo I, contrastou com o alto número de vasos em relação aos dias subsequentes. O grande número de vasos estava associado com pequena área média destes vasos, indicando se tratar de novos brotamentos vasculares. A angiogênese é um processo precoce, já sendo detectável na reação inflamatória causada pela matriz sintética nos primeiros sete dias (ANDRADE et al., 1987, KYRIADES et al., 2001) e também precocemente em vários modelos experimentais (HU et al., 1995; FERREIRA et al., 2004). Já no 10o dia após o implante das esponjas, a quantidade de tecido fibrovascular aumentou devido ao incremento da quantidade de células, de colágeno e do número e diâmetro dos vasos. Nesta ocasião, o tecido de granulação já está mais exuberante, ativo e maduro (KYRIADES et al., 2001; MACHADO et al., 2000). Posteriomente, no 14o dia, o tecido de granulação presente na esponja aumentou possivelmente devido ao aumento da deposição do colágeno tipo I.
A lesão tecidual associada à inflamação é seguida pelo reparo onde o agente irritante aos tecidos desaparece ou é inativado pela resposta do hospedeiro. No processo fisiológico de resolução da inflamação e no reparo de feridas, o mecanismo central de diminuição da celularidade no tecido de granulação é por apoptose. Esta é a via universal de eliminação de células desnecessárias e ocorre sem suscitar incremento de fatores inflamatórios. (DESMOULIERE et al., 1995, BROWN et al., 1997; GREENHALGH, 1998). A estabilização ou diminuição do número de leucócitos (predominantemente PMNs) após o 7o dia do implante e de macrófagos após o 10o (GRAF. 2) sugerem modulação da resposta inflamatória e evolução para resolução. O alto índice de apoptose no 4o dia do implante pode estar associado com a mudança do perfil da inflamação, que deixa de ser aguda e começa a se cronificar, com a diminuição de PMNs, que têm uma vida média muito curta e predominam na fase aguda da inflamação, e mostra. A remoção dos PMNs por apoptose é um importante fator no controle da inflamação (HASLETT & HENSON, 1996; GREENHALGH 1998, WARD et al., 1999; MURPHY et al., 2003).
A massa do tecido de granulação deve ser controlada e limitada para prevenir uma remodelação anárquica e o desenvolvimento de fibrose. O mecanismo responsável por isto é a apoptose (DEMOULIERE et al., 1997). A apoptose de células inflamatórias pode influênciar a resposta imune através do aumento ou supressão da inflamação. Por isto, células mortas, que são um reflexo do passado imediato do organismo, podem controlar seu futuro imunológico (SAVILL et al., 2002).
Em suma, a homeostase no tecido de granulação é mantida através do equilíbrio entre a proliferação, diferenciação e a morte celular (DEMOULIERE et al., 1995).
Neste experimento, logo após a implantação da esponja, foi observado o maior índice apoptótico já no 4o dia. É possível que isto tenha ocorrido como um mecanismo de contenção do processo inflamatório, como descrito por SIMPSON & ROSS (1972). Para estes autores, a resposta neutrofílica deve ser controlada por mecanismos como a apoptose para que a lise tecidual não seja amplificada sendo um pré–requisito para a homeostasia da inflamação (POPE, 2002). No 7º dia após o implante da esponja o índice apoptótico foi o mais baixo, provavelmente por se associar com o pico de celularização do implante, que ocorreu subsequentemente. O índice apoptótico também se elevou no final do período estudado (no 10º e 14ºdia), após a fase de maior proliferação, acompanhando a resolução do processo, possivelmente ajudando a conter a fibroplasia e a angiogênese. Assim, a ocorrência da apoptose parece estar associada com o controle da celularidade e do recrutamento dos diversos tipos celulares. A apoptose tem um importante papel, não só controlando, mas regulando as fases iniciais do processo de angiogênese inflamatória.
Neste trabalho, utilizando-se parâmetros morfométricos e bioquímicos, foi possível demonstrar a cinética da infiltração, ativação e apoptose das células que compõem o tecido fibrovascular induzido por implante de esponjas em camundongos. Os resultados obtidos neste modelo de angiogênese inflamatória confirmam os dados da literatura quanto a sequência regular da infiltração de diferentes populações celulares no processo de cicatrização de feridas observados em outros modelos. Além disso, estes resultados espandem as possibilidades de futuras investigações sobre processos patológicos que envolvem deficiências no reparo tecidual.
|
|
|
Conclusiones
A implantação cirúrgica da matriz esponjosa em camundongos induz a formação de um tecido fibrovascular, no qual é possível determinar componentes inflamatórios e angiogênicos.
Estes componentes inflamatórios e angiogênicos podem ser avaliados por técnicas morfométricas e bioquímicas, que demostram a cinética da infiltração, ativação e apoptose nas diversas células envolvidas:
A análise morfométrica da vasculatura é corroborada pela dosagem da Hb na determinação do índice vascular;
A presença e ativação dos diversos tipos celulares são demostrados por marcadores específicos e morfometria. Enzimas citosólicas mensuradas como suporte auxiliar sustentam a quantificação de células inflamatórias. O colágeno quantificado evidencia a ativação e diferenciação de fibroblastos. Ocorre a maturação do colágeno com o decorrer do processo.
A técnica de AgNOR avalia a atividade proliferativa deste novo tecido. A maior expressão das AgNORs precede a ativação e o aumento da celularidade no modelo de angiogênese inflamatória sugerindo sua aplicação como índice de proliferação para os fibroblastos e células endoteliais e como índice de ativação para os leucócitos e macrófagos.
A apoptose avaliada pela técnica de TUNEL demostra claramente que o padrão do índice apoptótico tem fases distintas, sendo já intensa no início e também no final do processo. Assim, mesmo precocemente a apoptose atua na modulação renovando células de curta sobrevida.
|
|
|
Agradecimientos
Ao CNPq - Conselho Nacional de Desenvolvimento Científico e Tecnológico, pela concessão da bolsa de estudos, essencial para o desenvolvimento deste trabalho.
-A FAPEMIG - Fundação de Apoio à Pesquisa do Estado de Minas Gerais, pelo apoio financeiro (CBB 312/03 – 7149 – FAPEMIG/ICB/DPG/APOPTOSE - UNIVERSAL).
|
|
|
Bibliografía
ABBAS, A.K.; LICHTMAN, A.H. &POBER, J.S. Cellular and molecular immunology. 4th edn. Philadelphia: W.B. Saunders Company. 553p., 2000.
ADAMS, J.M. & CORY, S. The Bcl-2 protein family: arbiters of cell survival. Science, v. 281, p. 1322-1326, 1998.
AMARANTE-MENDES, G.P. & GREEN, D.R. The regulation of apoptotic cell death. Braz. J. Med. Biol. Res., v.32, p.1053-1061, 1999.
ANDRADE, S.P.; FAN, T-P.D., LEWIS G.P. Quantitative in vivo studies on angiogenesis in a rat sponge model. Br J. Exp. Pathol., v. 68,p: 755-66, 1987.
ANDRADE, S.P.; VIEIRA, L.B.; BAKHLE, Y.S.; PIPER, P.J. Effects of platelet activating factor (PAF) and other vasoconstrictors on a model of angiogenesis in the mouse. Int. J. Exp. Pathol, v.73, p.503-513, 1992.
ANDRADE, S.P.; MACHADO, R.D.P.; TEIXEIRA; BELO, A.V.;. TARSO, A.M.; BERALDO, W.T. Sponge induced angiogenesis in mice and the pharmacological reativity of the neovasculature quantitated by a fluorimetric method. Microvas. Res.,v. 54, p.253-261, 1997.
ARENBERG, D.A.; POLVERINI, P.J.; KUNKEL, S.L.; SHANAFELT, A. & STRIETER, R.M. In vitro and in vivo systems to assess role of C-X-C chemokines in regulation of angiogenesis. Meth. Enzym. , v. 200, p. 190-220, 1997.
ARENDS, M. J., WYLLIE, H. A. Apoptosis: mechanisms and roles in pathology. Int. Rev. Exp. Pathol., v.32, p. 223-254, 1991.
ASHCROFT, G. S.; HORAN, M. A.; FERGUSON, M. W. J. Aging is associated with reduced deposition of specific extracellular matrix components, an upregulation of angiogenesis, and an altered inflammatory response in a murine incisional wound healing model. J Invest Dermatol, v. 108, p. 430-437, 1997.
AUBELE, S.W.; BIESTERFELD, S.; DERENZINI, M.; HUFNAGL, P.; MARTIN, H.; ÖFNER, D.; PLOTON, D. ; RUSCHOFF, J. Guidelines of AgNOR quantitation. Zentralblatt Pathologie, v. 140, p. 107–108, 1994.
AUERBACH, R. & AUERBACH, W. Profund effects on vascular development caused by perturbations during organogenesis. Am. J. Pathol. v. 151, n. 5, p. 1183-1186, 1997.
BAILEY, P. J. Sponge implants as models. Method Immunol., v. 162, p. 327-334, 1988.
BARINAGA, M. Is apoptosis key in Alzheimer’s Disease?. Science, v.281, p.1303-1304, 1998.
BARNUM, S.R. Complement in central nervous system inflammation. Immunol. Res., v. 26, p.7-13, 2002.
BAYLY, A. C.; ROBERTS, R. A.; DIVE, C. Suppression of liver cell apoptosis in vitro by the non-genotoxic hepatocarcinogen and peroxome proliferator nafenopin. J. Cell Biol., v. 125, p. 197-203, 1994.
BISCHOFF, J. Approaches to study cell adhesion molecules in angiogenesis. Trends Cell Biol., v. 5, p. 69-74, 1995.
BOSTOCK, D.E, CROCKER, J., HARRIS, K. & SMITH, P., Nucleolar organiser regions as indicators of post-surgical prognosis in canine mast cell tumours. British Journal of Cancer, v. 59, p. 915–918, 1989.
BROOKS, P.C.; CLARK, R.A.F. & CHERESH, D. A. Requirement of vascular integrin avb3 for angiogenesis. Science. 164: 569-57, 1994.
BROWDER, T.; FOLKMAN, J. & PIRIE-SHEPHED, S. The hemostatic system as a regulator of angiogenesis. J. Biol. Chem., v. 275, n. 3, p. 1521-1524 , 2000
BROWN, D.L.; KAO, W.W.Y.; GREENHALGH, D.G. Apoptosis down-regulates inflammation under the advancing epithelial wound edge: Delayed patterns in diabetes and improvement with topical growth factors. Surgery, v.121, p.372-380, 1997.
BUSSOLINO, F.; MANTOVANI, A. & PERISCO, G. Molecular mechanisms of blood vessel formation. TIBS 22: 251-256, 1997.
BUTCHER, E.C. Leukocyte-endothelial cell recognition: three (or more) steps to specicicity and diversity. Cell. 67: 1033-1036, 1991.
CALIARI, M.V. Princípios de morfometria digital: KS 300 para iniciantes. Belo Horizonte: Editora UFMG, 1997. 149p.
CAO, Y. Endogenous angiogenesis inhibitors and their therapeutic implications. Int. J. Biochem. Cell Biol., v. 33, p. 357-369, 2001.
CLARK, R.A.F. The molecular and cellular biology of wound repair. 2nd edn. New York: Plenum press. Chap. 1: Wound repair, p. 3-50, 1995.
CLARK, R.A.F. The molecular and cellular biology of wound repair. 2nd edn. New York: Plenum press. Chap. 4: Wound repair, p.143-168, 1996.
CLAUSS, M.; GERLACH, M.; GELARCH, H.; BRETT, J.; WANG, F.; FAMILLETTI, P.C.; PAN, Y.C.E.; OLANDER, J.V.; CONNOLLY, D.T. & STERN, D. Vascular permeability factor: a tumor-derived polypeptide that induces endothelial cell and monocyte procoagulant activity, and promotes monocyte migration. J. Exp. Med. 172: 1535-1545, 1990.
COTRAN, R. S. Cellular injury and cellular death. In: COTRAN, R. S.; KUMAR, V.; ROBBINS, S. L.. Pathologic Basis of Disease. 5. Ed. Philadelphia: W. B. Saunders Company, 1994, p. 1-34.
CROCKER, J.; MACARTNEY, J.C.; SMITH, P.J. Correlation between DNA flow cytometric and nucleolar organizer region data in non-Hodgkin’s lymphomas. J Pathol, v. 154, n. 2, p. 151–156, 1988.
CROCKER, J.; BOLDY, D.A.R.; EGAN, M.J. How should we count AgNORs ? Proposal for a standardized approach. J. Pathol., v. 158, p.185-188, 1989.
CROCKER, J. Nucleolar organizer regions. Curr Top Pathol, v. 82, p. 91–149, 1990.
DAVIDSON, J.M.; KLAGSBRUN, M.; HILL, K.E.; BUCKLEY, A., SULLIVAN, R.; BREWER, P.S; WOODWARD, S.C. Accelerated wound repair, cell proliferation, and collagen accumulation are produced by a cartilage-derived growth factor. J Cell Biol, v.100, p.1219–1227, 1985.
DAVIDSON, J.M. Wound repair. In: GALLIN, J.L.; GOLDSTEIN, I.M. & SYDERMAN, R. (ed) Inflammation: basic principles and clinical correlates. 1st edn. New Yor: Raven Press. p.809-819, 1992.
DELVOS, U.; GAJDUSEK, C.; SAGE, H.; HARKER, L. A., & SCHWARTZ, S. M. Lab. Invest., v. 46, p. 61-72, 1982.
DEMOULIERE, A.; REDARD, M.M.; DARBY, I.; GABBIANI, G. Apoptosis mediates the decrease in cellularity during the transition between granulation tissue and scar. Am. J. Pathol.,v.146, p. 56-66, 1995.
DEMOULIERE, A.; BADID, C.; PIALLAT, M.L.B.; GABBIANI, G. Apoptosis during wound healing, fibrocontractive diseases and vascular wall injury. Int. J. Biochem. Cell. Biol., v. 29, n. 1, p. 19-30, 1997.
DERENZINI, M.; PESSION, A. & TRERÈ, D. Quantity of nucleolar silver-stained proteins is related to proliferating activity in cancer cells. Laboratory Investigation, v. 63, n. 1, p. 137–140, 1990.
DERENZINI, M.E.; PLOTON, D. Interphase nucleolar organizer regions in cancer cells. Internat. Rev. Exper. Pathol., v. 32, p.149-192, 1991.
DERENZINI, M., TRERE, D. Importance of interphase nucleolar organizer regions in tumor pathology. Virchows Arch B Cell Pathol.,v. 61, p.1–8, 1991
DERENZINI, M..; SIRRI, V.; PESSION, A.; TRERE`, D.; ROUSSEL, P.; OCHS, R.; HERNANDEZ-VERDUN, D. Quantative changes of the two major AgNOR proteins, nucleolin and protein 23, related to stimulation of rDNA transcription. Exp. Cell Res. v. 219, p. 276–282, 1995.
DERENZINI, M . The AgNORs. Micron. v. 31, p. 117-120, 2000.
DE VICO G, PAPPARELLA S, DI GUARDO G. Number and size of silver-stained nucleoli (Ag-NOR clusters) in canine seminomas: correlation with histological features and tumour behaviour. J Comp Pathol. Apr;110(3):267-73,1994.
DIEGELMANN, R. F.; COHEN, I. K; KAPLAN, A. M. The role of macrophages in wound repair. A review. Plast. Reconstr. Surg., v. 63, p. 107-113, 1981.
DRABKIN, D. L.; AUSTIN, J. H. Spectrophotometric constants common hemoglobin derivates in human, dog, and rabbit blood. J. Biol. Chem., v. 98, p. 719-733, 1932.
DUFFIELD, J. S. The inflammatory macrophage: a story of Jekyll and Hyde. Clin Sci (Lond), v. 104, n. 1, p. 27-38, 2003.
DUVALL, E., WYLLIE, A. H. Death and the cell. Immunol. Today, v.7, p.115-119, 1986.
DVORAK, H. F.; GALLI, S. J. & DVORAK, A. M. Cellular and vascular manifestations of cell-mediated immunity. Human Pathol. 17(2): 122-137, 1986.
ELLIS, R.E., YUAN, J., HORVITZ, H.R. Mechanisms and functions of cell death. Annu. Rev. Cell. Biol., v.7, p.663-698, 1991.
FADOK, V.A., HENSON, P.M. Apoptosis: getting rid of the bodies. Curr Biol., v.8, p.693-751, 1998.
FADOK, V.A.; BRATTON, D.L.; KONOWAL, A.; FREED, P.W.; WESTCOTT, J.Y.; HENSON, P.M. Macrophages that have ingested apoptotic cells in vitro inhibit proinflammatory cytokine prodution through autocrine/paracrine mechanisms involving TGF-beta, PGR2, and PAF. J. Clin. Invest., v. 101, p. 890-898, 1998.
FADOK, V.A.; BRATTON, D.L.; HENSON, P.M. Phagocyte receptors for apoptotic cells: recognition, uptake, and consequences. J. Clin. Invest., v.108, p. 957-962, 2001.
FAJARDO, L. F; KOWALSKI, J., KWAN, H. H.; PRIONAS, S. D.; ALLISON, A. C: The discangiogenesis system. Lab Invest, v. 58, p. 718–724, 1988.
FAKAN, S; HERNANDEZ-VERDUN, D. The nucleolus and the nucleolar organizer regions. Biol Cell, v. 56 p. 189–206, 1986.
FAMULARO, G.; NUCENA, E.; MARCELLINI, S.; DE SIMONE, C. Faz/Faz ligand on the road: na apoptotic pathway common to AIDS, autoimmunity, lymphoproliferation and transplantation. Med. Hypotheses, v. 53, p. 50-62, 1999.
FERRARA, N. & DAVIS-SMYTH, T. The biology of vascular endothelial growth factor. Endocine Reviews, v.18, n. 1, p. 4-25, 1997.
FERRARA, N., GERBER, H.P. The role of vascular endothelial growth factor in angiogenesis.Acta Haematol;106(4):148-56,2001.
FERREIRA, M. A.; BARCELOS, L. S.; CAMPOS, P. P.; VASCONCELOS, A. C.; TEIXEIRA, M. M.; ANDRADE, S. P. Sponge-induced angiogenesis and inflammation in PAF receptor-deficient mice (PAFR-KO), Br J Pharmacol, v. 141, n. 7, p. 1185-92, 2004.
FESUS, L., THOMAZY, V., FALUS, A. Induction and activation of tissue transgutaminase during programmed cell death. FEBES Lett., v. 224, n. 15, p. 104-108, 1987.
FISSELER-ECKHOFF, A.; BECKER, T.; SUDHOFF, H.; MÜLLER, K. M. AgNOR counts in preneoplastic lesions of the bronchus. Path Res Pract, v.190, p. 389–393, 1994.
FRANC, N.C. Phagocytosis of apoptotic cells in mammal, Caenothacditis elegans and Drosophila melanogaster: molecular mechanisms and physiological consequences. Front. Biosci., v.7, p. 1298-1313, 2002.
FREDERICK, J. L.; SHIMANUKI, T. & DIZEREGA, G. S. Initiation of angiogenesis by human follicular fluid. Science, v.224; 389-390, 1984.
FOLKMAN, J. & MOSCANA, A. Role of cell shape in growth control. Nature, v. 271: 345-349, 1978.
FOLKMAN, J.& HAUDENSCHILD, C. Angiogenesis in vitro. Nature, v.288; 551-556, 1980.
FOLKMAN, J. & KLAGSBRUN, M. Angiogenesis factors. Science, v.235: 442-447, 1987.
FOLKMAN, J. Angiogenisis in cancer, vascular, rheumatoid and other disease. Nat. Med. 1(1): 27-31, 1995.
GALL, J.G. & PARDUE, M.L. Molecular hybridization of radioactive DNA to the DNA of cytological preparation. Proc. Natl Acad. Sci. USA v. 64, p. 600–604,1969.
GAMBLE, J.R.; MATHIAAS, L.J.; MEYER, G.; KAUR, P. RUSS, G.; FAULL, R.; BERND, M.C. & VADAS, M.A. Regulation of in vitro capillary tube formation by anti-integrin antibodies. J. Cell Biol., v.121, n. 4, p. 931-943, 1993.
GARVY, B. A., KING, L. E., TELFORD, W. G., MORFORD, L. A., FRAKER, P. J. Cronich elevation of plasma corticosterone causes reductions in the number of cycling cells of the B lineage in murine bone marrow and induces apoptosis. Immunol., v. 80, n. 4, p. 587-592, 1993.
GASQUE, P.; DEAN, Y.D.; MCgREAL, E. P.; VAN BEEK, J.; MORGAN, B.P. Complement components of thr innate immune system in health and disease in CNS. Immunophatmacology, v. 49, p. 171-186, 2002.
GAVRIELI, Y.; SHERMAN, Y.; BEN-BASSON, S. A. Identification of programed cell death in situ via specific labeling of nuclear DNA fragmentation. J. Cell Biol.,v.119, p. 493-501, 1992.
GAYTAN, F., BELLIDO, C., MORALES, C., REYMUNDO, C., AGUILAR, E., ROOIJEN, N. Response to Leydig cell apoptosis in the absence of testicular macrophages. J. Reprod. Immunol., v. 29, n. 1, p. 81-94, 1995.
GESKE FJ, MONKS J, LEHMAN L, FADOK VA.The role of the macrophage in apoptosis: hunter, gatherer, and regulator. Int J Hematol, v. 76, n. 1, p. 16-26, 2002.
GODIN, I.; WYLIE, C.C. TGF beta 1 inhibits proliferation and has a chemotropic effect on mouse primordial germ cells in culture. Development., v.113, n.4, p.1451-7, 1991.
GODOY, M. R.; GODOY, A. P. R.; OEHMICHEN, M. AgNORs during the process of wound healing.Time dependency as evaluated in vital and postmortem biopsy. Int J Legal Med, v. 113 p. 244–246, 2000.
GREENHALGH, D.G. The role of apoptosis in wound healing. J.Biochemis. & Cell Biol., v.30; p. 1019-1030, 1998.
GRIFFIOEN, A.W. & MOLEMA, G. Angiogenesis: Potenciais for pharmacologic intervention in the treatment of cancer, cardiovascular diseases, and chronic inflammation. Pharmacol. Rev., v.52 , n. 2, p. 237-268, 2000.
GRINNELL, F. Fibroblasts, myofibroblasts, and wound contraction. J. Cell Biol., v.124, p. 401-404, 1994.
HALL, P. A & LEVISON, D. A. Review: Assessment of cell proliferation in histological material. Journal of Clinical Pathology, v. 43, p. 184–192, 1990.
HARMELIN, A.; ZUCKERMAN, A.; NYSKA, A. Correlation of AgNOR protein measurements with prognosis in canine transmissible venereal tumour. J. Comp. Pathol., v.112, p.429-433, 1995.
HASLETT, C.; HENSON, P. The Molecular and Cellular Biology of Wound Repair. Resolution of Inflammation. New York: Plenum Press, 1996, p. 143-168.
HENGARTNER, M.O. Programed cell death in the nematode C. elegans.Recent. Prog. Horm Res., v. 54, p.213-222, 1999.
HENGARTNER, M.O. The biochemistry of apoptosis. Nature, v. 407, p.770-776, 2000.
HENRIET, P.; BLAVIER, L. & DECLERCK, Y.A. Tissue inhibitors of metalloproteinases (TIMP) in invasion and proliferation. APMIS, v. 107, p. 111-119, 1999.
HENSON, P.M.; BRATTON, D.L.; FADOK, V.A. Apoptotic cell removal. Curr. Biol. V. 11, p. 795-805, 2001.
HOBSON, B. & DENEKAMP, J. Endothelial proliferation in tumors and normal tissues: continuous labeling studies. Br. J. Cancer, v.49: 405-413, 1984.
HOFFMAN, J.A.; KAFATOS, F.C.; JANEWAY, C.A. & AZEKOWITZ, R.A. Phylogenetic perspectives in innate immunity. Science 248: 1313-1318, 1999.
HÖRLIN, A.; KRAUSE, J.; RADÜ, U.; HÜBNER, K.; STUTTE, H. J.; MÜLLER, H. Tumorproliferation, MDR-Phänotyp und tumorasso-ziierte T-Lymphozyten in Non Hodgkin-Lymphomen. Verh Dtsch Ges Pathol, v. 76, p. 248–252, 1992.
HORNEBECK, W.; EDMONARD, H.; MONBOISSE, J. C.; BELLON, G. Matrix-directed regulation of pericellular proteolysis and tumor regression. Semin Cancer Biol, v. 12, p. 231-241, 2002.
HOWELL, W.M., DENTON, T.E., DIAMOND, J.R. Differential staining of the satellite regions of human acrocentric chromosomes. Experientia. Feb 15;31(2):260-2, 1975.
HOWELL, W.M., BLACK, D.A. Controlled silver-staining of nucleolus organizer regions with a protective colloidal developer: a 1-step method. Experentia, v.36, p.1014–1015, 1980.
HU, D. E.; HILEY, C. R.; SMITHER, R. L.; GRESHAM, G. A.; FAN, T. P. D. Methods in laboratory ionvestigation – Correlation of 133 Xe Clearence, Blood Flow and Histology in the Rat Sponge Model for Angiogenesis. The United States and Canadian Academy of Pathology, v. 72, n. 5, p. 601, 1995.
HUFNAGL, P.; BEIL, M.; WENZELIDES, K.; MARTIN, H. Die Ver-messung der Anzahl, Größe und Lage von AgNORs in histolo-gischen Schnitten von Astrozytomen und Harnblasenkarzi-nomen. Zentralbl Pathol, v. 137, p. 493–497, 1991.
HUNT, T .K.; KNIGHTON, D. R.; THAKRAL, K. K.; GOODSON, W. H. III, ANDREWS, W. S. Studies on inflammation and wound healing: Angiogenesis and collagen synthesis stimulated in vivo by resident and activated wound macrophages. Surgery, v. 96, p. 48-54, 1984.
HUYNH, M. L. ; FADOK, V.A.; HENSON, P.M. Phosphatidylserine-dependent ingestion of apoptotic cells promotes TGF-beta1 secretion and the resolution of inflammation. J.Clin. Invest., v.109, p. 41-50, 2002.
INGBER, D., AND FOLKMAN, J. Lab. Invest., v. 59, p. 44-51, 1988.
IOZZO, R.V. & SAN ANTONIO, J.D. Heparan sulfate proteoglycans: heavy hitters in the angiogenesis area. J. Clin. Invest., v.108, n. 3, p. 349-355,2001.
ITOH, N.; YONEHARA, S.; ISHI, A. The polypeptide encoded by the cDNA for human cell surface antigen fas can mediate apoptosis. Cell, v. 66, p. 233-243, 1991
ITOH, N.; NAGATA, S. A novel protein domain required for apoptosis. Mutational analysis of human fas antigen. J. Biol. Chem., v. 268, p. 10932-10937, 1993.
IRUELA-ARISPE, M.L. & DVORAK, H. F. Angiogenesis: a dynamic balance of stimulators and inhibitors. Tromb. Haemost., v.78, n. 1, p. 672-677, 1997.
JACOBSON, M.D.; WEIL, M.; RAFF, M.C. Programmed cell death in animal development. Cell, v.88, n.3, p.347-354, 1997.
JACKSON, C. J.; GILES, I.; KNOP, A.; NETHERY, A.; SCHRIEBER, L. Sulfated polysaccharides are required for collagen-induced vascular tube formation Cell Biol. Int. v. 18, p. 859-867,1994.
JEFFREY, M.; BENN, D. & BENN, S. Regulation of Angiogenesis and Wound Repair. In: Cellular and Molecular Pathogenesis. Ed Siririca. 1996, p.79-107.
JUNQUEIRA, L.C.U.; COSSERMELI, W.; BRENTANI, R. Picrosirius staining plus polarization microscopy, a specific method for colagen detection in tissue sections. Histochemical Journal, v.11, p.447-455, 1979.
JOZSA, L., KANNUS, P., JARVINEN, M., et al. Atrophy and regeneration of rat calf muscles cause reversible changes in the number of nucleolar organizer regions. Evidence that also in nonproliferating cells the number of NORs is a marker of protein synthesis activity. Lab Invest; v. 69, p.231–7, 1993.
KAPLANSKI, G.; MARIN, V.; MONTERO-JULIAN, F.; MANTOVANI, A.; FARNARIER, C. IL-6: a regulator of the transition from neutrophil to monocyte recruitment during inflammation. Trends Immunol, v. 24, p.25-29, 2003.
KERR, J. F. R., WYLLIE, A. H., CURRIE, A. R. Apoptosis: basic biological phenomenon with wide-ranging implications in tissue kinetics. Brit. J. Cancer, v. 26, p.239-257.1972.
KERR, J. F. R.; WINTERFORD, C. M., HARMON, B. V. Apoptosis. Its significance in cancer and cancer therapy. Cancer, v. 73, p. 2013-2026, 1994.
KESLER, G.; KOREN, R.; KESLER, A.; KRISTT, D.; GAL, R. Differences in histochemical characteristics of gingival collagewn after ER:YAG laser periodontal plastic surgery. J. Clin. Laser Med Surg., v. 18, p. 203-207, 2000.
KINDERMANN, D.; NIKOROWITSCH, R.; PFEIFER, U. Nucleolus organisierende Regionen (AgNORs) bei benignen und malig-nen Schilddrüsenläsionen im Vergleich zu DNS-(Mikroskop) Zytometrie Hilfen bei der Diagnostik? Verh Dtsch Ges Pathol, v. 75 p. 439, 1991.
KHORRAMIZADEH, M. R.; TREDGET, E. E.; TELASKY, C.; SHEN, Q.; GHAHARY, A. Aging differentially modulates the expression of collagen and collagenase in dermal fibroblasts. Mol Cell Biochem, v. 194, p. 99-108, 1999.
KYRIADES, T. R.; ZHANTAO, Y. Y-H. Z.; HUNYNH, G.; BORNESTEIN, P. Altered extracelular matrix remodeling and angiogenesis in sponge granulomas of thrombospondin 2-null mice. America Journal of Pathology, vol. 159, n 4, 2001.
KOREK, G.; MARTIN, H.; WENZELIDES, K. A modified method for the detection of nucleolar organizer regions (AgNORs). Acta Histochem, v. 90, p. 155–157, 1991.
KORN, J. H.; HALUSHKA, P. V.; LEROY, E. C. Mononuclear cell modulation of connective tissue function. J. Clin. Invest., v.65, p. 543-554, 1980.
LAGE, A. P. & ANDRADE, S. P. Assessment of angiogenesis and tumor growth in conscious mice by fluorimetric method. Microvasc. Res., v. 59, p. 278-285, 2000.
LIEKENS, S., DE CLERCQ, E., NEYTS, J. Angiogenesis: regulators and clinical applications.Biochem Pharmacol. Feb 1;61(3):253-70, 2001.
LIEKENS S. The role of growth factors, angiogenic enzymes and apoptosis in neovascularization and tumor growth-collected publications. Verh K Acad Geneeskd Belg;64(3):197-224, 2002.
LUNA, L.G. Manual of histologic staining methods of the Armed Forces Institute of Pathology, 3ª. Ed, New York, Megraw Hill, 1968.
MACHADO, R. D. P.; SANTOS, R. A. S.; ANDRADE, S. P. Opposing actions of angiotensins on angiogenesis. Life Sciences, vol. 66, n. 1, p. 67-76. 2000.
MADRI, J. A. & MARX, M. Matrix composition, organization and soluble factors: modulators of microvascular cell diferenciation in vitro. Kidney Int., v.41, p. 560-565, 1992.
MADRI, J. A. SANKAR, S. & ROMANIC, A.M. Angiogenesis. In: CLARK, R.A.F. (ED). The molecular and cellular biology of wound repair. 2nd edn. New York: Plenum press, p. 355-371, 1996.
MAIER, J.A.M.; MORELLI, D.; LAZZERINI, D.; MÈNARD, S.; COLNAGHI, M.I. & BALSARI, A. Inhibitor of fibronectin-activated migration of microvascular endothelial cells by interleucin 1, tumor necrosis factor and interferon . Cytokone, v.11, n. 2, p. 134-139, 1999.
MAJIMA, M.; HAYASHI, I.; MURAMATSHU, M.; KATADA, J.; YAMASHINA, S.; MANTOVANI, A.; BUSSOLINO, F. & INTRONA, M. Cytokine regulation of endothelial cell funcction: from molecular level to the bedside. Immunol. Today, v. 185, n. 5, p. 231-240, 1997.
MAJIMA M, HAYASHI I, MURAMATSU M, KATADA J, YAMASHINA S, KATORI M. Cyclo-oxygenase-2 enhances basic fibroblast growth factor-induced angiogenesis through induction of vascular endothelial growth factor in rat sponge implants.Br J Pharmacol., v.130 n.3, p. 641-9, 2000.
MANTOVANI, A.; BUSSOLINO, F. & INTRONA, M. Cytokine regulation of endothelial cell funcction: from molecular level to the bedside. Immunol. Today, v. 185, n. 5, p. 231-240, 1997.
MARTIKAINEN, P., KYPRIANOU, N., ISAACS, J. T. Effects of transforming growth factor-1 on proliferation and death of rat prostatic cells. Endocrinol., v. 127, p. 2963-2968, 1990.
MARTIN, H.; BEIL, M.; HUFNAGL, P.; WOLF, G.; KOREK, G. Com-puter- assisted image analysis of nucleolar organizer regions (NORs): a pilot study of astrocytomas and glioblastomas. Acta Histochem, v. 90, p. 189–196, 1991.
MARTIN, P. Wound healing- aiming for perfect skin regeneration. Science, v. 276, p. 75-81, 1997.
MEAGER, A. Cytokine regulation of cellular adhesion molecule expression in inflammation. Cytokine & Growth Factor Reviews, v.10: 27-39, 1999.
McINTYRE, T.M.; MODUR, V.; PRESCOTT, S.M. & ZIMMERMAN, G.A. Molecular mechanisms of early inflammation. Tromb. Haemost. 78(1): 302-305, 1997.
MILLAR, D.A. & RATCLIFFE, N.A. Invertebrates. In: TURNER, R.J. (ed) Immunology: a comparative approach. 1 st edn. West Sussex: Jonh Wiley. P. 29-68, 1994.
MILLER, L.J., MARX, J. Apoptosis. Science, v.281, p.1301, 1998.
MONTESANO, R.; ORCI, L.; VASSALLI, P. In vitro rapid organization of endothelial cells into capillary-like networks is promoted by collagen matrices. J. Cell Biol, v. 97, p. 1648-1652, 1983.
MORENO, F.J.; HERNANDEZ-VERDUN, D.; MASSON, C. et al. Silver staining of the nucleolar organizer regions (NORs) on lowicryl and cryo-ultrathin sections. J. Histochem. Cytochem., v. 33, n. 5, p.389-399, 1985.
MORO, L.; VASCONCELOS, A. C.; SANTOS, F. G. A.; ALVES, C. M.; NUNES, J. E. S; SAMPAIO, I. B. M. Determination of the minimal representative number of microscopical fields to quantify apoptosis in canine lymph nodes. Arq.Bras.Med.Vet.Zootec., v. 56, n. 3, p. 408-410, 2004.
MORTON, C.C. Stain intensity of human nucleolus organizer region reflects incorporation of uridine into mature ribosomal RNA. Exp. Cell Res. 145, 405–413, 1983.
MOTOYAMA, N., WANG, F., ROTH, K. A., SAWA, H., NAKAYAMA, K. I., NAKAYAMA, K., NEGISHI, I., SENJU, S., ZHANG, Q. L, FUJII, S., LOH, D. Y. Massive cell death of immature hematopoietic cell and neurons in Bcl-x-deficient mice. Science, v. 267, n. 5203, p. 1506-1509, 1995.
MOULTON, B. C. Transforming growth factor- stimulates endometrial stromal apoptosis in vitro. Endocrinol., v. 134, p. 1055-1060, 1994.
MURPHY, F. J.; HAYES, I.; COTTER, T. G. Targeting inflammatory diseases via apoptotic mechanisms. Current Opinion in Pharmacology, v. 3, p. 412–419, 2003.
NAGAO, T.; ISHIDA, Y.; YAMAZAKI, K.; KONDO, Y. Nucleolar organizer regions in hepatocellular carcinoma related to the cell cycle, cell proliferation and histologic grade. Pathol Res Pract, v. 191, p. 967–972, 1995.
NAGATA, S. Apoptosis regulated by a death factor and its receptor: fas ligand and fas. Phil. Trans. R. Soc. Lond., v. 345, n. 1313, p. 281-287, 1994.
NAGATA, S. Faz ligand-induced apoptosis. Annu Rev. Genet., v. 33, p. 29-55, 1999.
NEUFELD, G.; COHEN, T.; GENGRINOVITCH, S. & POLTORAK, Z. Vascular endothelial growth factor (VEGF) and its receptors. FASEB J., v.13, p. 9-22, 1999.
NISSEN, N.N.; POLVERINI,P.J.; KOCH, A. E.; VOLIN, M. V.; GAMELLI, R. L.; DIPIETRO, L. A. Vascular endothelial growth factor mediates angiogenic activity during the proliferate phase of wound healing. Am. J. Pathol., v. 152, n. 6, p. 1445-1452, 1998.
NUNES, J. E. S. Maturação e eliminação placentária de bovinos: determinação do índice apoptótico e reação de tunel. 69p. Dissertação. (Mestrado em Patologia Geral) - Escola de veterinária, UFMG, Belo Horizonte:, 2001.
OEHMICHEN, M.; CRÖPELIN, A. Temporal course of intravi-tal and postmortem proliferation of epidermal cells after me-chanical injury. An immunohistochemical study using bromod-eoxyuridine in rats. Int J Legal Med, v. 107, p. 257–262, 1995.
OEHMICHEN, M.; LAGODKA, T.; CRÖPELIN, A. RNA and DNA synthesis of epidermal basal cells after wounding. Comparsion of vital and postmortem investigations. Exp Toxic Pathol, v. 49, p. 233–237, 1997.
OFNER, D., HITTMAIR, A., MARTH, C., OFNER, C,. TOTSCH, M., DAXENBICHLER, G., MIKUZ, G., MARGREITER, R., SCHMID, K.W. Relationship between quantity of silver stained nucleolar organizer regions associated proteins (Ag-NORs) and population doubling time in ten breast cancer cell lines.Pathol Res Pract. Aug;188(6):742-6, 1992.
OFNER D, RIEDMANN B, MAIER H, HITTMAIR A, RUMER A, TOTSCH M, SPECHTENHAUSER B, BOCKER W, SCHMID KW. Standardized staining and analysis of argyrophilic nucleolar organizer region associated proteins (AgNORs) in radically resected colorectal adenocarcinoma--correlation with tumour stage and long-term survival. J Pathol., v. 175, n. 4, p. 441-8, 1995.
OFNER, D; SCHMID, KW. Standardized AgNOR quantitation. J Pathol., v.179, n.2,p. 218-9, 1996.
ORITA, T.; KAJIWARA, K.; NISHIZAKI, T.; IKEDA, N.; KAMIRYO, T.; AOKI, H. Nucleolar organizer regions in meningioma. Neuro-surgery, v. 26, p. 43–46, 1990.
PAKU, S., AND PAWELETZ, N. Lab. Invest. 65, 334-346, 1991.
PALEOLOG, E.M.; YOUNG, S.; STRK, A.C.; McCLOSKEY, R.V.; FELDMANN, M. & MAINI, R.N. Modulation of angiogenic vascular endothelial growth factor by tumor necrosis factor and interleucin-1 in rheumatoid arthritis. Arthritis Rhem., v.41, p.1258-1265, 1998.
PASSANITI, A.; TAYLOR, R.M.; PILI, R.; GUO, Y.; LONG, P. V.; HANEY, J. A.; PAULY, R. R.; GRANT, D. S. & MARTIN, G. R. A simple, quantitative method for assessing angiogenesis and antiangiogenesis agents using reconstituted basement membrane, heparin and fibroblast growth factor. Lab. Invest., v. 67, p. 519-528, 1992.
PEPPER, M.S., VASSALLI, J.D., MONTESANO, R., ORCI, L. Urokinase-type plasminogen activator is induced in migrating capillary endothelial cells. J Cell Biol. Dec;105(6 Pt 1):2535-41, 1987.
PEPPER, M.S., MONTESANO, R., MANDRIOTA, S.J., ORCI, L., VASSALLI, J.D. Angiogenesis: a paradigm for balanced extracellular proteolysis during cell migration and morphogenesis. Enzyme Protein; v. 49, p. 138–62, 1996.
PEREZ E, ALBERCA V, VICENTE-VILLARDON V, FLORES T, CARBAJO S. Expression of argyrophilic nucleolar organizer regions (agnors) can be used to assess cellular proliferation as shown in rat thymic sections. Histochem J. ; v. 25, n. 8, p. 548-53, 1993.
PETTERSSON, A., NAGY, J. A.; BROWEN, L. F.; SUNDBERG, C.; MORGAN, E.; JUNGLES, S.; CARTER, R.; et al. Heterogeneity of the angiogenic response induced in different normal adult tissues by vascular permeability factor/vascular endothelial growth factor. Lab Invest, v. 80, p. 99-115, 2000.
POLLOK, A. Nucleolar organizer regions in exocrine pancreas in chronic pancreatitis and ductal adenocarcinoma. Diagnostic value and cytophysiologic correlate. Gen Diagn Pathol., v. 142, p. 199–209,1997.
POPE, R. M. Apoptosis as a therapeutic tool in rheumatoid arthritis. Nat Rev Immunol, v. 2, p. 527-535, 2002.
PLOTON, D., BOBICHON, H., ADNET, J.J. Ultrastructural localization of NOR in nucleoli of human breast cancer tissues using a one-step Ag-NOR staining method. Biol. Cell, v. 43, p. 229–232., 1982.
PLOTON, D.; MENAGER, M.; JEANNESSON, P.L. et al. Improvement in the staining and the visualization of the argyrophilic proteins of nuclear organizer regions at the optical level. Histochem. J., v. 18, n. 1, p.5-14, 1986.
PLOTON, D. Structure and molecular organization of the nucleolus. Zentralbl. Pathol., v. 140, n.1, p. 3-6, 1994.
PREZIOSI, R.; DELLA SALDA, L.; RICCI, A. et al. Quantification of nucleolar organizer regions in canine perianal gland tumours. Res. Vet. Sci., v. 58, p.277-281, 1995.
QUINN,C.M.; WRIGHT N. A. The clinical assessment of proliferation and growth in human tumors evaluation of methods and applications as prognostic variable. Journal of Pathology, v.160, p. 93–102, 1990.
RAFF, M. C. Social controls on cell survival and cell death. Nature, v. 356, p. 397-400, 1992.
REED, M. J.; CORSA, A.; PENDERGRASS, W.; PENN, P.; SAGE, E. H.; ABRASS, I. B. Neovascularization in aged mice: delayed angiogenesis is coincident with decreased levels of transforming growth factor ß1 and type I collagen. Am J Pathol, v. 152, p. 113-123, 1998.
RIBATTI, D.O; VACCA, A.O; NICO, B.O; RONCALI, L. & DAMMANCCO, F. Postnatal vasculogenesis. Mechan. Dev., v.100, p. 157-163, 2001.
RICHARD, L.; VELASCO, P.; DETMAR, M. Exp. Cell Res.,v. 240, p.1-6, 1998.
ROBBINS, S.L.; COTRAN, R.S. & KUMAR, V. Patologia estrutural e funcional Cap. 3 : Inflamação e reparação. 5ed. Rio de Janeiro : Editora Guanabara Koogan S.A., 1996.p. 45-83.
ROCHA e SILVA, M. A brief survey of the history of inflammation. Agents Action 43: 86-90, 1994.
ROSARIO, P.; SARLI, G.; BENAZZI, C.; MANDRIOLI, L.; MARCATO, P. S. Multiparametric survival analysis of histological stage and proliferative activity in feline mammary carcinomas. Research in Veterinary Science, vol. 73, n. 1 , p. 53-60, 2002.
ROUSSEL, P.; HERNANDEZ-VERDUN, D. Identification of Ag-NOR proteins, markers of proliferation related to ribosomal gene activity. Exp Cell Res, v. 214, p. 465–472, 1994.
RUSCHOFF J, PLATE K, BITTINGER A, THOMAS C. Nucleolar organizer regions (NORs). Basic concepts and practical application in tumor pathology. Pathol Res Pract. 1989 Dec;185(6):878-85.
RÜSCHOFF, J.; KNÜCHEL, R.; PLATE, K. H. Reaktionsmuster der Silberfärbung Nukleolus organisierender Regionen (AgNOR) – Zellbiologische Grundlagen und diagnostische Bedeutung.Verh Dtsch Ges Path, v.75, p. 477, 1991.
RÜSCHOFF, J.; BARTH, P. Theorie und Praxis der Silberfär-bung Nukleolus organisierender Regionen (AgNOR). Patho-loge, v. 13, p. 13–19, 1992.
RÜSCHOFF, J.; FAUSER, G.; KNÜCHEL, R. et al. AgNOR quantification with special reference to staining patterns. Zentralbl. Pathol., v. 140, n. 1, p.23-30, 1994.
SAMPAIO, I. B. M. Estatística Aplicada à Experimentação Animal. 1 ed. Belo Horizonte: Fundação de Ensino e Pesquisa em Medicina Veterinária e Zootecnia, 1998, 221p.
SARTIPPOUR, M. R.; SHAO, Z. M.; HEBER, D.; ZHANG, L.; BEATY, P.; ELASHOFF, D.; ELASHOFF, R. et al. Inhibition of fibroblast growth factor by green tea. Int J Oncol, v. 21, p. 487-491, 2002.
SAVILL, J.S., WYLLIE, A.H., HENSON, J.E., WALPORT, M.J., HENSON, P.M. AND HASLETT, C. Macrophage phagocytosis of aging neutrophils in inflammation: programmed cell death in the neutrophil leads to its recognition by macrophages. J. Clin. Invest., v. 83, p. 865–875, 1989.
SAVILL, J., DRANSFIRLD, I.; HOGG, N.; HASLETT, C. Vibronectin receptor mediated phagocytosis of cells undergoing apoptesis. Nature, v. 343, p. 170-173, 1990.
SAVILL, J.; DRANSFIELD, I.; GREGORY, C.; HASLETT, C. A blast from the past: clearance of apoptotic cells regulate immune responses. Nat. Ver. Immunol., v.2, p. 965-975, 2002.
SAUDON, E.; REED, M. J. Impaired angiogenesis in aging is associated with alterations in vassel density, matrix composition, inflammatory response, and growth factor expression. The Journal of Histochemistry and Cytochemistry, v 51, n. 9, p. 1119-1130, 2003.
SCHASER, K.; KINNE, R.W.; BEIL, H.; KLADNY, B.; STOSS, H. Proliferation of T-cells, macrophages, neutrophilic granulocytes and fibroblast-like cells in the synovial membrane of patients with rheumatoid arthritis. Verh Dtsch Ges Pathol,v. 80, p.:276-80,1996.
SCHLINGEMANN RO, RIETVELD FJ, KWASPEN F, VAN DE KERKHOF PC, DE WAAL RM, RUITER DJ. Differential expression of markers for endothelial cells, pericytes, and basal lamina in the microvasculature of tumors and granulation tissue.Am J Pathol. Jun;138(6):1335-47,1991.
SCHMIADY, H., MUNKE, M., SPERLING, K. Ag-staining of nucleolus organizer regions on human prematurely condensed chromosomes from cells with different ribosomal RNA gene activity. Exp Cell Res. Jul;121(2):425-8, 1979.
SCHOEFL, G.I. Electron microscopic observations on the regeneration of blood vessels after injury. Anna. N.Y. Acad. Sci., p. 789-802, 1964.
SELMAG, K., RAINE, C. S., FAROOQ, M., NORTON, W. T., BROSMAN, C. F. Cytokine cytotoxicity against olygodendrocites. Apoptosis induced by lymphotoxin. J. Immunol., v. 147, n. 5, p. 1522-1529, 1991.
SEPHEL, G. C.; KENNEDY, R.; KUDRAVI, S. Expression of capillary basement membrane mponents during sequential phases of wound angiogenesis. Matrix Biol, v. 15, p. 263–279, 1996.
SHINAGAWA, T., YOSHIOKA, K., KAKUMU, S. Apoptosis in cultured rat hepatocytes: the effects of tumor necrosis factor and interferon . J. Pathol., v. 165, p. 247-253, 1991.
SCHMIADY H, MUNKE M, SPERLING K. Ag-staining of nucleolus organizer regions on human prematurely condensed chromosomes from cells with different ribosomal RNA gene activity.Exp Cell Res.; v.121, n. 2, p. 425-8, 1979.
SMETANA K, JIRASKOVA I, TUREK P, CHAN PK, BUSCH H.A contribution to the incidence of nucleoli in normal human blood monocytes Haematologica.,v. 82, n. 2, p. 138-42, 1997.
STETLER-STEVSON, W.G. Matrix metalloproteinases in angiogenesis: a moving target for therapeutic intervention. J. Clin. Invest., v.103, n. 9, p. 1237-1241, 1999.
SIMMONS, J. G.; PUCILOWKA, J. B.; KEKU, T. O.; LUND, P. K. IGF-1 and TGF ß1 have distinct effects on phenotype and proliferation of intestinal fibroblast. Am J Physiol, v. 283, p. G809-818, 2002.
SIMPSON, D. M.; ROSS, R. The neutrophilic leukocyte in wound repair: A study with antineutrophil serum. J. Clin. Invest., v. 52, p. 2009-2023. 1972.
SINGER, A. J. ; CLARK, R. A.Cutaneous wound healing. N. Engl. J. Med., v. 341, p. 738–746, 1999.
SIRRI, V.; ROUSSEL, P.; GENDRON, M.-C.; HERNANDEZ-VERDUN, D. The amount of the two major Ag-NOR proteins, nucleolin and protein B23 is cell-cycle dependent. Cytometry, v. 28, p. 147–156, 1997.
SIRRI, V.; ROUSSEL, P.; HERNANDEZ-VERDUN, D. The AgNOR proteins: qualitative and quantitative changes during the cell cycle. Micron, v. 31, p.121-126, 2000.
SMITH, P.J.; SKILBECK, N.; HARRISON, A. & CROCKER, J. The effect of a series of fixatives in the AgNOR technique. Journal of Pathology, v.155, p. 109–112, 1988.
SOUZA, D.G.; CARA, D.C.; CASSALI, G.D.; COUTINHO, S.F.; SILVEIRA, M.R., ANDRADE, S.P.; POOLE, S.P. & TEIXEIRA, M.M. Effects of the PAF receptor antagonist UK 74505 on local and remote reperfusion injuries following ischaemia of the superior mesenteric artery in the rat. Br. J. Pharmacol., v. 131, p. 1800-1808, 2000.
SPRINGER, T.A. Traffic signals for lymphocyte recirculation and leukocyte emigration: the multistep paradigm. Cell, v.76, p. 301-314, 1994.
SWEENEY, S. M.; GUY, C. A.; FIELDS, G. B.; SAN ANTONIO, J. D. Proc. Natl. Acad. Sci. U. S. A.v. 95, p. 7275-7280, 1998.
SZEKANECZ, Z.; SZEGEDI, G. & KOCH, A.E. Angiogenesis in rheumatoid arthritis: pathogenic and clinical significance. J. Investig. Med., v.46: 27-41, 1998.
TENNISWOOD, M., TAILLEFER, D., LAKINS, J. Control of gene expression during apoptosis in hormone-dependent tissues. In: TOMEI, L. D., COPE, F. O., (eds.). Apoptosis II: The molecular basis of apoptosis in disease. New York: Springer, 1994, p. 283-311.
THIEBAUT, F., RIGAUT, J.P., REITH, A. Improvement in the specificity of the silver staining technique for AgNOR associated acidic proteins in paraffin sections. Stain Technol., v. 59,p. 181–185, 1984
TRAUGH, B. C., KLAS, C., PETERS, A. M. J. Monoclonal antibody-mediated tumor regression by induction of apoptosis. Science, v. 245, p. 301-305, 1989.
TRERÈ, D.; PESSION, A.; DERENZINI, M. The silver-stained proteins of interphasic nucleolar organizer regions as a parameter of cell duplication rate. Experimental cell Research, v.184, p. 131–137, 1989.
TRERÈ, D. AgNOR quantification in tumour pathology: What is actually evaluated. J. Clin. Pathol., v. 46, p.189, 1993.
TRERE`, D.; PESSION, A.;MONTANARO, L.; CHIECO, P.; DERENZINI, M. AgNOR protein expression and tumor growth rate of human carcinoma xenografts growing subcutaneously in nude mice. Eur. J. Histochem. v. 41 (suppl.2), p. 153–154, 1997.
UNDERWOOD, J.C.E. & GIRI, D.D. Nucleolar organizer regions as diagnostic discriminants for malignancy. J Pathol., v.155, p.95–6, 1988.
VAN DIEST, P.J.; BRUGAL, G.; BAAK, J.P.A. Proliferation markers in tumours: interpretation and clinical value. J. Clin. Pathol., v. 3, p.716-724, 1998.
VASCONCELOS, A. C. Apoptose ou morte celular programada e sua importância em patologia Veterinária. In: Encontro Nacional de Patologia Veterinária, 7, 1995, Belo Horizonte. Anais... Belo Horizonte: 1995, p. 69.
VASCONCELOS, A. C. Métodos aplicados ao estudo da Apoptose, Belo Horizonte: Instituto de Ciências Biológicas da UFMG, 2001, 17p. Print out do Curso PAG 807 – Métodos de Estudo aplicados à Apoptose.
VAZ, N. M.; FARIA, A. M. C. Guia incompleto de imunobiologia. Imunologia como se o organismo importasse. Belo Horizonte: Coopmed editora. Para explicar os fenômenos imunológicos, p. 131-145. 1993.
VOLL, R. E. et al. Immunosuppressiva effects of apoptotic cells. Nature, v. 390, p. 350-351, 1997.
VITOLO, D.; CIOCCI, L.; CICERONE, E.; ROSSI, C.; TIBONI, F.; FERRAUTI, P.; GALLO, A. et al. Laminin alpha2 chain (merosin M chain) distribution and VEGF, FGF(2), and TGF beta1 gene expression in angiogenesis of supraglottic, lung, and breast carcinomas. J Pathol, v. 195, p. 197-208, 2001.
XAUS, J.; COMALADA, M.; VALLEDOR, A. F.; CARDO, M.; HERRERO, C.; SOLER, C.; LLOBERAS, J.; CELADA, A. Molecular mechanisms involved in macrophage survival, proliferation, activation or apoptosis: Immunobiology., v. 204, n. 5, p. 543-50, 2001.
WARD, I.; DRANSFIELD, I.; CHIVERS, E. R.; HASLETT, I.; ROSSI, A.G. Pharmacological manipulation of granulocyte apoptosis: potencial terapeutic targets. Trends Pharmacol. Sci. v.20, p.503-509. 1999.
WEISS, S.J. Mechanisms of disease: tissue destruction by neutrophils. N. Engl. J. Med., v. 320, p. 365–376, 1989.
WHALEN, G.F. & ZETTER, B.R. Angiogenesis. In: COHEN, I.KI; DIEGELMAN, R.F. & LINDBLAD, W.J. Wound: biochemical and clinical aspects. 1st ed. W.B. Saunders company., p.77-95, 1992.
WHELAN, M.C.; SENGER , D.R. Collagen I Initiates Endothelial Cell Morphogenesis by Inducing Actin Polymerization through Suppression of Cyclic AMP and Protein Kinase A J. Biol. Chem., vol. 278, n. 1, p. 327-334, 2003.
WHYTE, M.K., MEAGHER, L.C., MACDERMOT, J., HASLETT, C. Impairment of function in aging neutrophils is associated with apoptosis.J Immunol.;150(11):5124-34,1993.
WILLIAMS, G. T., SMITH, C. A., SPOONCER, E., DEXTER, T. M., TAYLOR, D. R. haematopoietic colony stimulating factors promote cell survival by suppressing apoptosis. Nature, v. 343, n. 6253, p. 76-79, 1990.
WYLLIE, A.H., KERR, J.F., CURRIE, A.R. Cell death: the significance of apoptosis. Int Rev Cytol.;68:251-306, 1980.
WYLLIE, A. H.; MORRIS, R. G. Hormone-induced cell death. Purification and properties of thymocytes undergoing apoptosis after glucocorticoid treatment. Am. J. Path., v. 109, n. 1, p. 78-87, 1982.
WYLLIE, A. H., MORRIS, R. G., SMITH, A. L., DUNLOP, D. Chromatin cleavage in apoptosis: association with condensed chromatin morphology and dependence on macromolecular synthesis. J. Pathol., v. 142, p. 67-77, 1984.
WYLLIE, A. H. Apoptosis and the regulation of cell numbers in normal and neoplastic tissues: an overview. Cancer Metast. Rev., v. 11, p. 95-103, 1992.
WYLLIE, .AH. Apoptosis. Death gets a brake. Nature. v.369, n.6478, p.272-273, 1994.
WYLLIE, A. H. The genetic regulation of apoptosis. Curr. Opin. Genet. Develop., v. 5, p. 97-104, 1995.
WOHRL, W., HÄCKER, G. Extent and limitation of the control of nuclear apoptosis by DNA. Biochem. Biophys. Res. Commun., v.254, p.552-558, 1999.
WOOLLEY, K.L., GIBSON, P.G., CARTY, K., WILSON, A.J., TWADDELL, S.H. AND WOOLLEY, M.J. Eosinophil apoptosis and the resolution of airway inflammation in asthma. Am. J. Respir. Crit. Care Med., v. 154, p. 237–243, 1996.
WOOSLEY J.T. Measuring cell proliferation. Archives of Pathology and Laboratory Medicine, v. 115, p. 555–557, 1991.
YUAN, J., SHAHAM, S., LEDOUX, S., ELLIS, H. M., HORVITZ, H. R. The C. elegans cell death gene ced-3 encodes a protein similar to mammalian interleukin-1 beta converting enzime. Cell, v. 75, p. 641-652, 1993.
|
|
|
Comentarios
- Lucía González Núñez (24/05/2007 14:58:38)
Dra. Lucía González Núñez
Felicito a los autores por el excelente trabajo realizado, asi como por la calidad de las técnicas y las excelentes ilustraciones
Este trabajo constituye por su calidad, un estudio de referencia
Muito obrigada
|
|
|
|
|

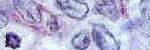 Nº 604. Comunicación libre
Nº 604. Comunicación libre