|
Diagnóstico diferencial de las lesiones de células gigantes de hueso
Francisco J. Martínez-Tello*, Palmira Manjón Luengo**, Santiago Montes Moreno*
* Departamento de Anatomía Patológica. Hospital Universitario “12 de Octubre”. Madrid ESPAÑA
** Servicio de Radiodiagnóstico. Hospital Universitario “12 de Octubre”. Madrid ESPAÑA
|
|
INTRODUCCIÓN
fiogf49gjkf0d El diagnóstico diferencial de las lesiones de células gigantes de hueso, definidas arbitrariamente como lesiones que contienen células gigantes multinucleadas benignas que ocurren en el hueso, requiere que el patólogo tenga en cuenta un considerable número de posibilidades. Cada lesión ósea debería ser contemplada como una entidad clinicopatológica y por tanto el patólogo al enfrentarse al diagnóstico diferencial de una lesión ósea que contenga células gigantes multinucleadas, y en general de toda lesión ósea, deberá disponer de los datos clínicos pertinentes, la evaluación del radiólogo de imágenes radiólogicas apropiadas y la descripción de los hallazgos operatorios por el cirujano antes de que haga la evaluación macro y microscópica del especimen patológico.
Desde un punto de vista práctico las lesiones a considerar se pueden dividir en dos grandes grupos. En el primer grupo se incluyen aquellas lesiones que en su diagnóstico diferencial pueden ser confundidas con un tumor benigno de células gigantes (TBCG). Dicha confusión puede producirse o bien por la gran similitud histológica con un TBCG o porque una lesión que presente una moderada semejanza histopatológica se localice en un extremo de los huesos tubulares largos, al igual que el TBCG.
El otro grupo de tumores incluye aquellos que contienen células gigantes multinucleadas benignas pero cuya histopatología usualmente es significativamente diferente de la del TBCG pudiendose diferenciar de éste por esta razón. Además, cuando ocurren en los huesos largos tienden a localizarse en la diáfisis o metáfisis y no en la epífisis. Requieren más bien diferenciarlos entre ellos y no del TBCG.
En el primer grupo deben incluirse los siguientes tumores y lesiones no neoplásicas seudotumorales: TBCG; 2-Tumor maligno de células gigantes; 3-Tumor de células gigantes originado en enfermedad de Paget ósea, 4-Condroblastoma benigno; 5- Condroblastoma maligno; 6-Granuloma reparativo de células gigantes; 7- Variante sólida de quiste óseo aneurismático; 8- Querubismo; 9-Tumor de células gigantes de la encía (épulis); 10- Sinovitis y tenosinovitis villonodular pigmentada intraósea (Invasiva, agresiva); 11- Tumor pardo del hiperparatiroidismo.
En el segundo grupo deben de considerarse las siguientes entidades: 1- Osteosarcoma rico en osteoclastos; 2- Osteosarcoma telangiectásico; 3- Osteoblastoma; 4- Osteoma osteoide; 5- Fibroma condromixoide; 6- Fibroma no osificante; 7- Fibrohistiocitoma benigno; 8- Displasia fibrosa; 9-Fibroma cementificante; 10-Fibroma osificante de los huesos maxilares; 11- Displasia osteofibrosa; 12- Quiste óseo aneurismático; 13- Quiste óseo solitario; 14- Granuloma eosinófilo óseo ; 15 Enfermedad de Paget florida.
|
|
Tumor de células gigantes
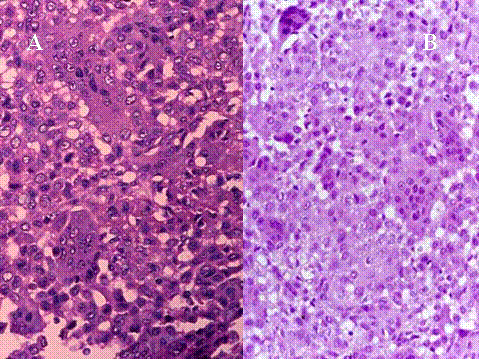
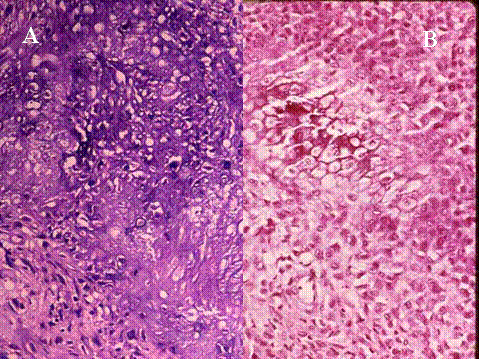
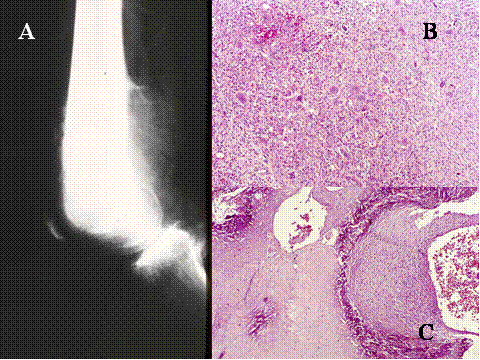
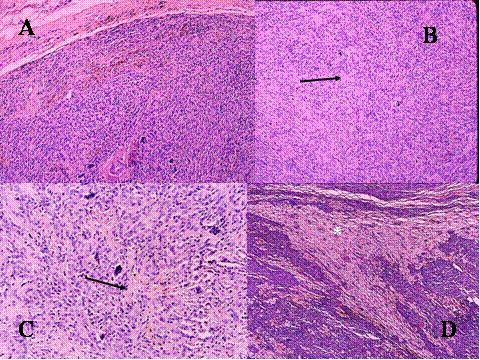
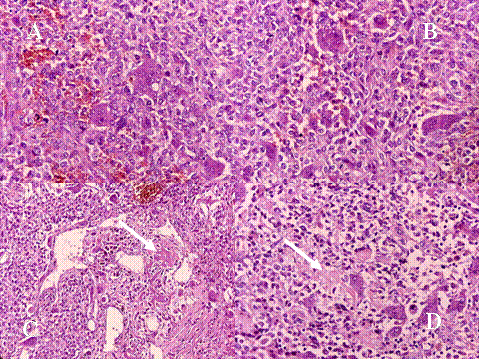
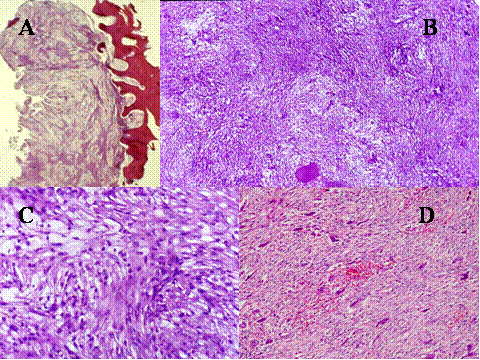
fiogf49gjkf0d El Tumor de células gigantes es una neoplasia benigna pero localmente agresiva que está constituido por sábanas de células neoplásicas mononucleadas, redondeadas, ovoideas o alargadas, entre las que se encuentran abundantes células gigantes mononucleadas, distribuidas uniformemente ( Fig-1). Las células gigantes suelen ser muy grandes y contienen de 50 a 100 núcleos. Loa núcleos de ambos tipos de células muestran las mismas características mostrando una cromatina abierta. En todos los casos se encuentran mitosis, variando su número entr 2 y 20 por campo de gran aumento. Por definición no se encuentra atipia nuclear ni mitosis atípicas. El tumor puede expander el hueso por reabsorción endóstica y aposición perióstica de neoformación ósea, destruir la cortical y permear vasos sanguineos ( Fig-2). En el 2% de los casos aparecen metástasis pulmonares después de 3 a 4 años del primer diagnóstico. Las características histológicas de las metástasis pulmonares son similares si no idénticas a las del tumor primario, habiéndose usado por ello el término de “metástasis benignas” ya que excepcionalmente tienen consecuencias fatales, curándose el enfermo con la ablación de dichas metástasis ( Fig-3) ( 1).
El TBCG puede mostrar aspectos histológicos variados que en ciertos casos pueden inducir a error diagnóstico. Consisten en la presencia de amplios campos de 1- Proliferación fibroblástica; 2-Patrón estoriforme; 3- Cambios telangiectasicos. 4 depósito de osteoide ( 2). En tales casos se podría considerar diagnósticos como fibroma no osificante, quiste óseo aneurismático u osteoblastoma. Por todo ello es esencial conocer las carácteristicas clínicas y radiológicas en cada caso antes de hacer el patólogo un diagnóstico de TBCG.
Es mandatorio conocer la edad del paciente y la localización del tumor. Los TBCG ocurren mayoritariamente en individuos de 20 a 45 años de edad, siendo raros en individuos con esqueleto inmaduro y excepcional en niños de menos de 10 años. Se localizan típicamente en los extremos de los huesos largos, especialmente en el distal del fémur, proximal de la tibia, distal del radio y proximal del húmero, afectando usualmente la epífisis y metáfisis, extendiendose frecuentemente a la placa subcondral y afectándo a veces a la articulación. En adolescentes en que el tumor está situado en relación con una fisis abierta éste aparece confinado a la metáfisis. Tumores diafisarios son excepcionales. Alrededor del 5% se localizan en huesos planos, especialmente de la pelvis. El sacro es la localización más común del esqueleto axial. Los huesos de manos y pies se ven raramente afectados. Se han descrito aislados casos de tumores multicéntricos.
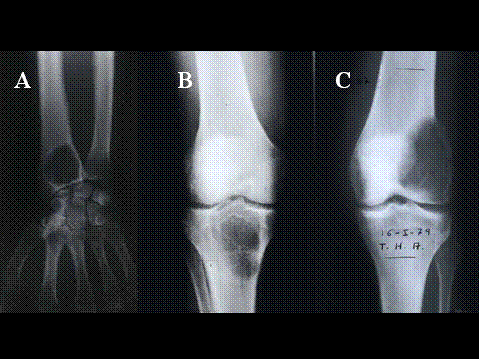
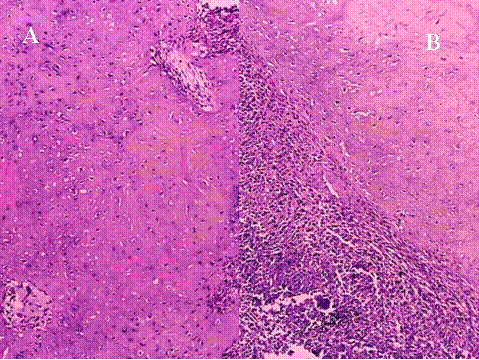
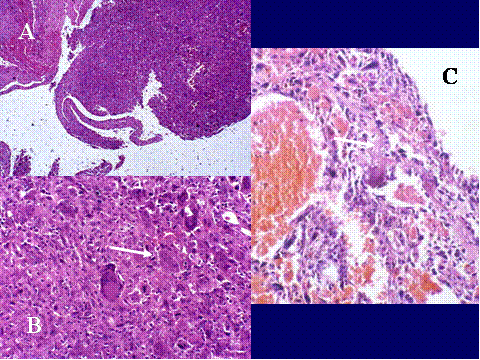
Las radiografías simples muestran usualmente una lesión osteolítica, expansiva y excéntrica. Los bordes de la lesión varían y son la base para la clasificqción de grados/estadíos: Lesiones quiescentes, lesiones y tumores agresivos. ( Fig-4 y Fig-5). Un tumor de células gigantes maligno es un sarcoma de alto grado originado “de novo” en un tumor de células gigantes (Tumor de células gigantes maligno primario (TCGMP) o en el sitio de un TBCG previamente documentado y tratado, más fercuentemente con radioterapia (Tumor de células gigantes maligno secundario (TCGMS). En total se malignizan menos del 1%. Los TCGMS son histológicamente sarcomas fusocelulares de alto grado que pueden producir osteoide, no encontrándose usualmente TBCG residual. En los TCGMP se tienen que hallar áreas típicas de TBCG, como requisito para hacer el diagnóstico ( Fig-6). La transición entre ambos componentes es abrupta ( Fig-7). Los pacientes generalmente son una década mayores que los de TBCG, son algo más frecuentes en mujeres y presentan las mismas localizaciones. Se debe sospechar una transformación maligna si recurre el dolor y la hichazón en el sitio de un TBCG, muchos años después del tratamiento y en tales casos se observará en la radiología un proceso destructivo de bordes poco nítidos ( 3). Las características histológicas del TBCG originado en la enfermedad de Paget son indistinguibles de las del TBCG común, aunque usualmente las células mononucleadas son más fusiformes y presentan más colágena. El desarrollo de un TBCG en la enfermedad de Paget es mucho menos frecuente que el de un sarcoma. Existen marcadas diferencias clínicas con el TBCG común, relativos a la propia enfermedad de Paget: Mayor edad, una tasa de fosfatasa alcalina en suero elevada, localización de la mayoria en los huesos craneofaciales y los raros casos que ocurren en los huesos tubulares no afectan a los extremos epifisarios. Además los enfermos tienen un excelente pronóstico en contraposición al pésimo pronóstico en los que desarrollan un sarcoma sobre enfermedad de Paget ( 4).
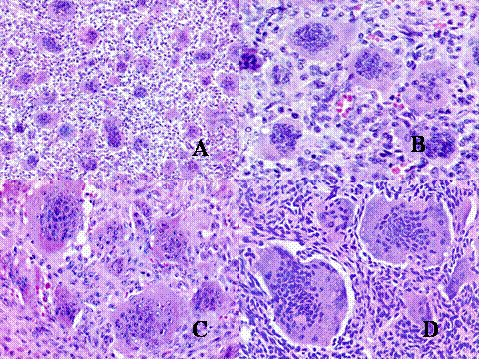 fiogf49gjkf0dFig.1-ABCyD. Tumor de células gigantes benigno a diversos aumentos. Las células gigantes aparecen distribuidas uniformemente, rodeadas por células mononucleadas. Las células gigantes son de gran tamaño y poseen numerosos núcleos que muestran las mismas características que las células mononucleadas."> fiogf49gjkf0dFig.1-ABCyD. Tumor de células gigantes benigno a diversos aumentos. Las células gigantes aparecen distribuidas uniformemente, rodeadas por células mononucleadas. Las células gigantes son de gran tamaño y poseen numerosos núcleos que muestran las mismas características que las células mononucleadas.">
Fig-1 - fiogf49gjkf0d Fig.1-ABCyD. Tumor de células gigantes benigno a diversos aumentos. Las células gigantes aparecen distribuidas uniformemente, rodeadas por células mononucleadas. Las células gigantes son de gran tamaño y poseen numerosos núcleos que muestran las mismas características que las células mononucleadas.
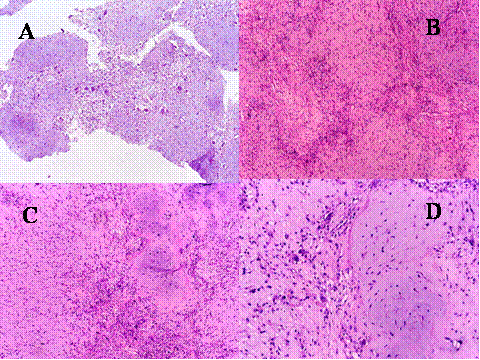
 fiogf49gjkf0dFig.2- Aspectos de los tumores de células gigantes. A) crecimiento expansivo con erosión endóstica de la cortical que aparece casi desaparecida. B) Crecimiento infiltrante a través de la cortical que indica una mayor agresividad y capacidad de infiltración del tumor ( C y D) Permeación de vasos sanguíneos por células tumorales (flechas)."> fiogf49gjkf0dFig.2- Aspectos de los tumores de células gigantes. A) crecimiento expansivo con erosión endóstica de la cortical que aparece casi desaparecida. B) Crecimiento infiltrante a través de la cortical que indica una mayor agresividad y capacidad de infiltración del tumor ( C y D) Permeación de vasos sanguíneos por células tumorales (flechas).">
Fig-2 - fiogf49gjkf0d Fig.2- Aspectos de los tumores de células gigantes. A) crecimiento expansivo con erosión endóstica de la cortical que aparece casi desaparecida. B) Crecimiento infiltrante a través de la cortical que indica una mayor agresividad y capacidad de infiltración del tumor ( C y D) Permeación de vasos sanguíneos por células tumorales (flechas).
 fiogf49gjkf0dFig.3-Tumor de células gigantes benigno que ha producido metástasis pulmonares. A) Radiografia de los pulmones que muestra nódulos metastásicos.B) Tumor primario óseo. C) Metástasis en parenquima pulmonar y D) en pared broquial. En ambas localizaciones presenta características histológicas benignas."> fiogf49gjkf0dFig.3-Tumor de células gigantes benigno que ha producido metástasis pulmonares. A) Radiografia de los pulmones que muestra nódulos metastásicos.B) Tumor primario óseo. C) Metástasis en parenquima pulmonar y D) en pared broquial. En ambas localizaciones presenta características histológicas benignas.">
Fig-3 - fiogf49gjkf0d Fig.3-Tumor de células gigantes benigno que ha producido metástasis pulmonares. A) Radiografia de los pulmones que muestra nódulos metastásicos.B) Tumor primario óseo. C) Metástasis en parenquima pulmonar y D) en pared broquial. En ambas localizaciones presenta características histológicas benignas.
 fiogf49gjkf0dFig.4- Tumor de células gigantes. A) TCGB del radio, con bordes bien delimitados, parcialmente esclerosos. B) TGCB tibial de bordes mal delimitados, con septos finos en su interior. C) TGCB femoral, levemente insuflante, con bordes mal delimitados parcialmente."> fiogf49gjkf0dFig.4- Tumor de células gigantes. A) TCGB del radio, con bordes bien delimitados, parcialmente esclerosos. B) TGCB tibial de bordes mal delimitados, con septos finos en su interior. C) TGCB femoral, levemente insuflante, con bordes mal delimitados parcialmente.">
Fig-4 - fiogf49gjkf0d Fig.4- Tumor de células gigantes. A) TCGB del radio, con bordes bien delimitados, parcialmente esclerosos. B) TGCB tibial de bordes mal delimitados, con septos finos en su interior. C) TGCB femoral, levemente insuflante, con bordes mal delimitados parcialmente.
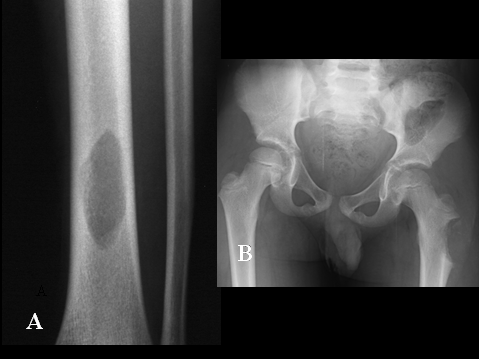
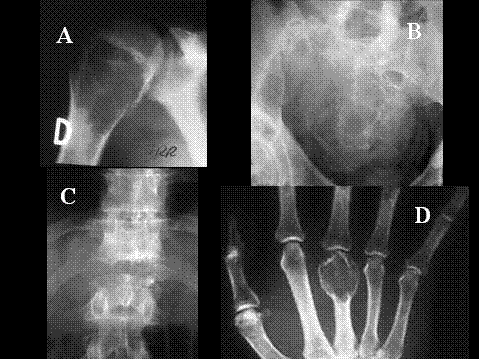 fiogf49gjkf0dFig.5- Tumor de células gigantes. A) AP de hombro derecho, se observa lesión lítica, geográfica con fractura patológica, de localización exclusivamente metafisaria en el húmero derecho.B)AP de pelvis. Lesión lítica, geográfica, de bordes muy mal definidos, con rotura de la cortical y afectación secundaria del sacro.C) AP de columna dorsolumbar. Se aprecia lesión lítica con marcado aplastamiento del cuerpo de D-II junto con masa de partes blandas. D) AP de mano: TGC muy insuflante, localizado en la región epífiso metafisaria del 3º metacarpiano."> fiogf49gjkf0dFig.5- Tumor de células gigantes. A) AP de hombro derecho, se observa lesión lítica, geográfica con fractura patológica, de localización exclusivamente metafisaria en el húmero derecho.B)AP de pelvis. Lesión lítica, geográfica, de bordes muy mal definidos, con rotura de la cortical y afectación secundaria del sacro.C) AP de columna dorsolumbar. Se aprecia lesión lítica con marcado aplastamiento del cuerpo de D-II junto con masa de partes blandas. D) AP de mano: TGC muy insuflante, localizado en la región epífiso metafisaria del 3º metacarpiano.">
Fig-5 - fiogf49gjkf0d Fig.5- Tumor de células gigantes. A) AP de hombro derecho, se observa lesión lítica, geográfica con fractura patológica, de localización exclusivamente metafisaria en el húmero derecho.B)AP de pelvis. Lesión lítica, geográfica, de bordes muy mal definidos, con rotura de la cortical y afectación secundaria del sacro.C) AP de columna dorsolumbar. Se aprecia lesión lítica con marcado aplastamiento del cuerpo de D-II junto con masa de partes blandas. D) AP de mano: TGC muy insuflante, localizado en la región epífiso metafisaria del 3º metacarpiano.
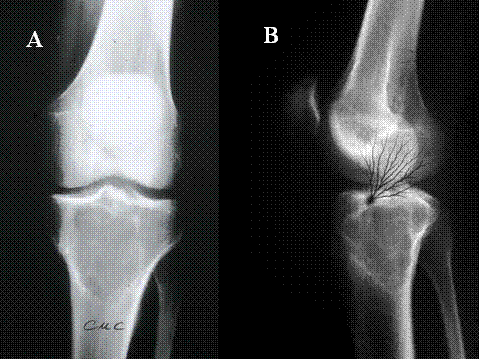 fiogf49gjkf0dFig.6- Tumor de células gigantes maligno. Radiografías simples A) AP y B lateral) Lesión lítica geográfica, relativamente bien delimitada, salvo en su borde inferior, algo impreciso, de localización epífiso-metafisaria tibial."> fiogf49gjkf0dFig.6- Tumor de células gigantes maligno. Radiografías simples A) AP y B lateral) Lesión lítica geográfica, relativamente bien delimitada, salvo en su borde inferior, algo impreciso, de localización epífiso-metafisaria tibial.">
Fig-6 - fiogf49gjkf0d Fig.6- Tumor de células gigantes maligno. Radiografías simples A) AP y B lateral) Lesión lítica geográfica, relativamente bien delimitada, salvo en su borde inferior, algo impreciso, de localización epífiso-metafisaria tibial.
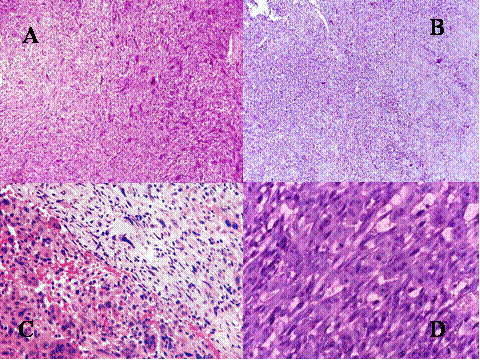 fiogf49gjkf0dFig.7- A,B,C y D. Tumor de células gigantes maligno primario a distintos aumentos. En C) se muestra una buena delimitación entre ambos componentes."> fiogf49gjkf0dFig.7- A,B,C y D. Tumor de células gigantes maligno primario a distintos aumentos. En C) se muestra una buena delimitación entre ambos componentes.">
Fig-7 - fiogf49gjkf0d Fig.7- A,B,C y D. Tumor de células gigantes maligno primario a distintos aumentos. En C) se muestra una buena delimitación entre ambos componentes.
|
|
Condroblastoma
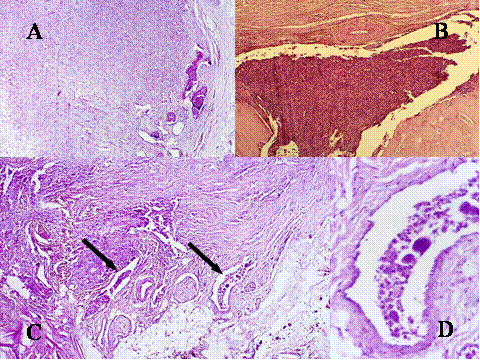
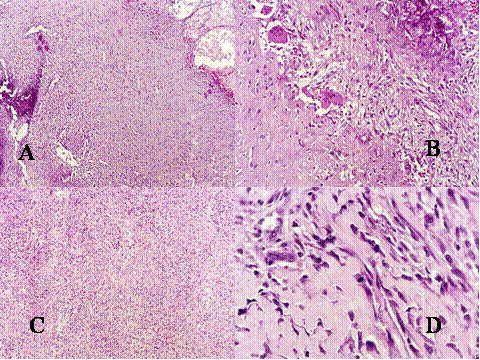
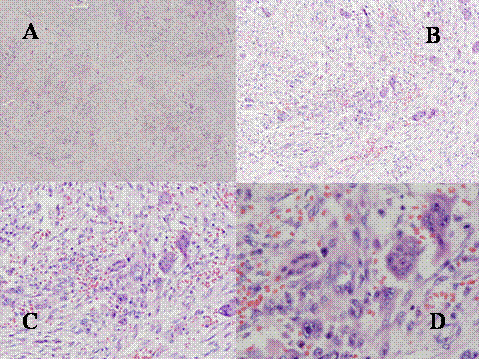
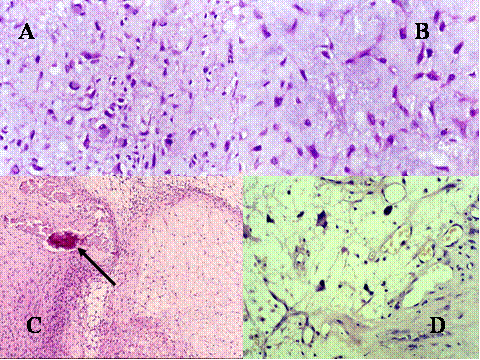
fiogf49gjkf0d El Condroblastoma (CB) es un tumor que como el TBCG afecta el extremo de los huesos tubulares largos por lo que se debe de considerar en el diagnóstico diferencial. Además presenta ciertas similitudes histológicas con el TBCG. Microscópicamente presenta un patrón lobular con áres condroides rodeadas por zonas de células proliferantes, redondeadas u ovoides, dispuestas apretádamente ( Fig-8, Fig-9 y Fig-10). Dichas células tienen un núcleo ovoide hipercromático, un citoplasma claro o moderadamente eosinófilo y una nítida membrana plasmática. Entre estas células se encuentran abundantes células gigantes de tipo osteoclástico, generalmente de pequeño a mediano tamaño, que contienen menos de 20 núcleos ( Fig-11). Característicamente suelen presentar finos depósitos de calcio granulares que forman como un enrejado rodeando las células ( Fig-12). En los condroblastomas se producen secundariamente quistes óseos aneurismáticos ( Fig-13).
El CB es un tumor benigno (de aquí la denominación de condroblastoma benigno) infrequente (1% de los tumores óseos) que en el 90% de los casos ocurren en individuos menores de 25 años y son ligeramente más frecuentes en varones que en mujeres. Su localización mas fecuente es la epífisis de los huesos tubulares largos, especialmente superior del húmero y fémur, aunque también se ha referido en otros huesos e incluso en el cartílago bronquial.
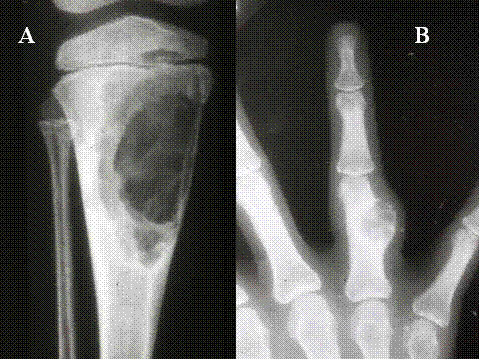
En la mayoría de los casos la radiología es característica, consistente en un área osteolítica, oval o redondeada de límites nítidos, de tamaño moderado, localizada excentricamente en una epífisis ( Fig-14). Suele descubrirse en su interior un fino moteado debido a las referidas calcificaciones; en algunos casos la lesión se extiende secundariamente a la metáfisis y en otros puede expander el córtex, causando excepcionalmente, en los casos más avanzados, una reacción perióstica. La presencia de un borde escleroso en las radiografías simples junto con la menor edad en la mayoría de los casos sugiere el diagnóstico.
Otra similitud del CB con el TBCG es que excepcionalmente puede dar lugar a metástasis pulmonares sin que se haya producido una transformación maligna del tumor, presentando las metástasis las mismas caracteríticas histológicas que el tumor primitivo. Solamente se san descrito casos aislados de condroblastoma con un comportamiento más agresivo. La existencia del Condroblastoma maligno verdadero es controvertida y la mayoría de los investigadores opinan que la mayor parte de los tumores publicados con ese diagnóstico representan sarcomas postradiación o se trata de errores diagnósticos ( 5). A este respecto hay que recordar que se ha descrito la variante condroblastoma-like de osteosarcoma ( 6).
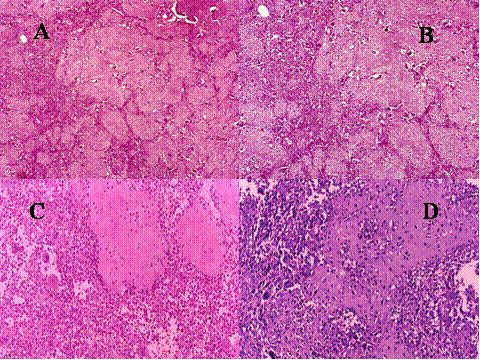 fiogf49gjkf0dFig.8- Condroblastoma. A y B) Visión panorámica en que se muestra el patrón lobulado del tumor. Los lóbulos condrales se encuentran separados por septos de distinto grosor, muy celulares, constituidos por células mononucleadas y células gigantes multinucleadas, como se aprecia en las imágenes a mayor aumento C y D.
"> fiogf49gjkf0dFig.8- Condroblastoma. A y B) Visión panorámica en que se muestra el patrón lobulado del tumor. Los lóbulos condrales se encuentran separados por septos de distinto grosor, muy celulares, constituidos por células mononucleadas y células gigantes multinucleadas, como se aprecia en las imágenes a mayor aumento C y D.
">
Fig-8 - fiogf49gjkf0d Fig.8- Condroblastoma. A y B) Visión panorámica en que se muestra el patrón lobulado del tumor. Los lóbulos condrales se encuentran separados por septos de distinto grosor, muy celulares, constituidos por células mononucleadas y células gigantes multinucleadas, como se aprecia en las imágenes a mayor aumento C y D.
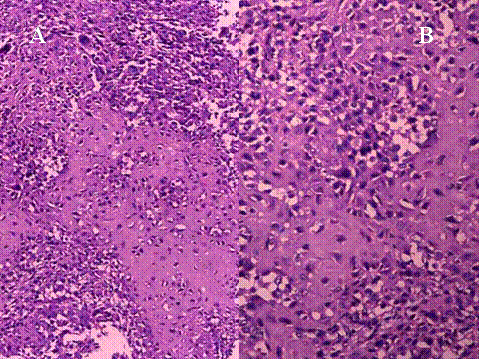 fiogf49gjkf0dFig.9- Condroblastoma. A y B) Zonas de interfase entre áreas condrales y septos celulares."> fiogf49gjkf0dFig.9- Condroblastoma. A y B) Zonas de interfase entre áreas condrales y septos celulares.">
Fig-9 - fiogf49gjkf0d Fig.9- Condroblastoma. A y B) Zonas de interfase entre áreas condrales y septos celulares.
 fiogf49gjkf0dFig.10- Condroblastoma. A y B) Amplias áreas fibrocondrales."> fiogf49gjkf0dFig.10- Condroblastoma. A y B) Amplias áreas fibrocondrales.">
Fig-10 - fiogf49gjkf0d Fig.10- Condroblastoma. A y B) Amplias áreas fibrocondrales.
 fiogf49gjkf0dFig.11- Condroblastoma. A y B) Imágenes a gran aumento que muestran las características de las células mononucleadas, poligonales u ovoideas, de amplio citoplasma eosinófilo y núcleos blandos con un nucleolo poco prominente."> fiogf49gjkf0dFig.11- Condroblastoma. A y B) Imágenes a gran aumento que muestran las características de las células mononucleadas, poligonales u ovoideas, de amplio citoplasma eosinófilo y núcleos blandos con un nucleolo poco prominente.">
Fig-11 - fiogf49gjkf0d Fig.11- Condroblastoma. A y B) Imágenes a gran aumento que muestran las características de las células mononucleadas, poligonales u ovoideas, de amplio citoplasma eosinófilo y núcleos blandos con un nucleolo poco prominente.
 fiogf49gjkf0dFig.12- Condroblastoma. A y B) Calcificación en enrejado, rodeando célula a célula, típica de las calcificaciones del condroblastoma."> fiogf49gjkf0dFig.12- Condroblastoma. A y B) Calcificación en enrejado, rodeando célula a célula, típica de las calcificaciones del condroblastoma.">
Fig-12 - fiogf49gjkf0d Fig.12- Condroblastoma. A y B) Calcificación en enrejado, rodeando célula a célula, típica de las calcificaciones del condroblastoma.
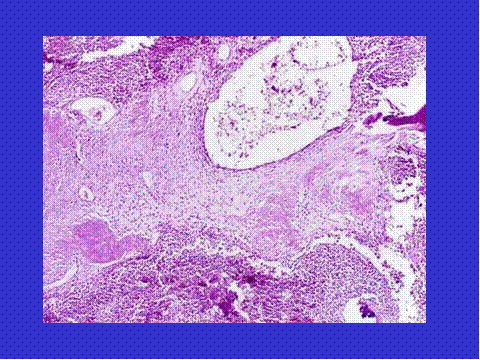 fiogf49gjkf0dFig.13- Transformación quística que da lugar a la formación de quistes aneurismáticos en estos tumores."> fiogf49gjkf0dFig.13- Transformación quística que da lugar a la formación de quistes aneurismáticos en estos tumores.">
Fig-13 - fiogf49gjkf0d Fig.13- Transformación quística que da lugar a la formación de quistes aneurismáticos en estos tumores.
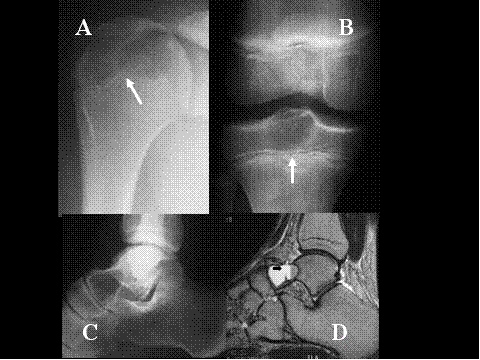 fiogf49gjkf0dFig.14- Radiología del condroblastoma. Lesión lítica, bien delimitada con reborde parcialmente escleroso situada en las epífisis (flechas). A) AP de hombro con condroblastoma humeral. B) AP de rodilla con condroblastoma tibial. C, Radiografía simple de proyección lateral de tobillo y D) Resonancia magnética (RM) sagital en secuencia potenciada T2 con condroblastoma del astrágalo con cambios quísticos con nivel líquido (flecha)."> fiogf49gjkf0dFig.14- Radiología del condroblastoma. Lesión lítica, bien delimitada con reborde parcialmente escleroso situada en las epífisis (flechas). A) AP de hombro con condroblastoma humeral. B) AP de rodilla con condroblastoma tibial. C, Radiografía simple de proyección lateral de tobillo y D) Resonancia magnética (RM) sagital en secuencia potenciada T2 con condroblastoma del astrágalo con cambios quísticos con nivel líquido (flecha).">
Fig-14 - fiogf49gjkf0d Fig.14- Radiología del condroblastoma. Lesión lítica, bien delimitada con reborde parcialmente escleroso situada en las epífisis (flechas). A) AP de hombro con condroblastoma humeral. B) AP de rodilla con condroblastoma tibial. C, Radiografía simple de proyección lateral de tobillo y D) Resonancia magnética (RM) sagital en secuencia potenciada T2 con condroblastoma del astrágalo con cambios quísticos con nivel líquido (flecha).
|
|
Granuloma reparativo, Tumor pardo, Sinovitis villonodular
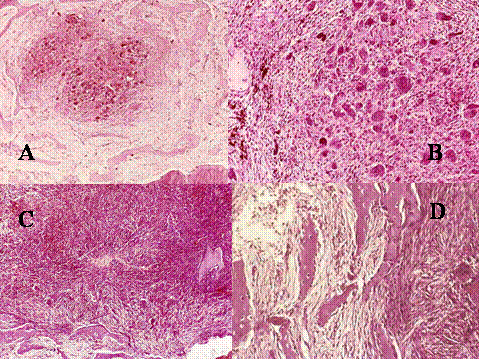
fiogf49gjkf0d El Granuloma reparativo de células gigantes de hueso (GRCG) fue primero descrito por Jaffe en 1953 ( 7) en los huesos maxilares. Una década después, una lesión similar, localizada en las falanges de las manos, fue referida por Ackerman y Spjut ( 8) como reacción de células gigantes y en 1980 Lorenzo y Dorfman ( 9) propusieron el término GRCG para lesiones benignas con células gigantes localizadas en los huesos tubulares cortos de manos y pies, un término que ha sido ampliamente aceptado para este tipo de lesiones con localización extragnática. Sanerkin y col. describieron una lesión similar como “variante sólida de Quiste óseo aneurismático”(QOA) ( 10), habiéndose también aceptado ampliamente dicho término. Dorfman y Czerniak opinan que estas peculiares lesiones con células gigantes no localizadas en los maxilares son similares al GCGR de los huesos maxilares y que en consecuencia prefieren llamarlas GCGR en vez de utilizar el controvertido término de variante sólida de QOA ( 11) . No obstante el término variante sólida de QOA refiere muy adecuadamente las características clinicopatológicas de esta lesión por lo que el término ha sido ampliamente aceptado y es usado comunmente. En mi opinión, todas estas entidades corresponden a un mismo proceso de respuesta, secundaria a distintas causas, tumores (como el CB u osteoblasoma) u otras que en un cierto número de casos no son demostrables histológicamente, variando las características clínicas y radiológicas dependiendo del sitio en que se produce la lesión ( 12). Las localizaciones extragnáticas más frecuentes son los pequeños huesos de manos y pies, seguidas por los huesos craneofaciales y cuerpos vertebrales.
El GRCG consiste histológicamente ( Fig-15) en un estroma fibroso no neoplásico constituido por fibroblastos, células gigantes pequeñas, distribuidas formando pequeños acúmulos dispersos, focos de pequeñas hemorragias de distinta antigüedad y áreas de metaplasia ósea. Frecuentemente se encuentran también quistes hemorrágicos que se asemajan al QOA.
Radiológicamente, el GRCG produce en los huesos craniofaciales áreas osteolíticas redondeadas o elípticas que muestran a veces una fina trabeculación de bordes nítidos con mínima reacción esclerosa. El hueso puede aparecer expandido, el córtex notablemente adelgazado pero no roto, pero no hay reacción perióstica. En los huesos tubulares de manos y pies la lesión puede ser metafisaria, diafisaria o metadiafisaria y no sobrepasa la placa de crecimiento. En los individuos con esqueleto maduro puede afectar la epífisis o incluso todo el hueso. La lesión se encuentra localizada centralmente y muestra un contorno marcadamente expandido. El hueso cortical aparece adelgazado pero intácto. En los huesos tubulares largos de los miembros el GRCG produce una lesión osteolítica excentrica, meta- o diafisaria que puede expander un córtex adelgazado. En los huesos del carpo y tarso pueden mostrar un patrón radiológico mixto ( Fig-16). En las vértebras la lesión es también osteolítica y expansiva. Aquellas lesiones que han causado una expansión del hueso son las que se han denominado variante sólida de QOA, las cuales muestran ciertas características histológicas peculiares, consistentes en focos de mineralización con un aúrea condral y abundante neoformación ósea reactiva con actividad osteoblástica prominente ( Fig-17 y Fig-18).
Otra lesión con células gigantes que hay que considerar es el Querubismo. Se trata de una rara enfermedad hereditaria autosómica dominante y autolimitada, caracterizada clínicamente por una hichazón simétrica de las mejillas, debido al agrandamiento mandibular y aumento del crecimiento del maxilar superior, que le imparte al paciente un aspecto de querubin ( 13) ( Fig-19 y Fig-20). Las lesiones óseas fueron interpretadas en un principio como displasia fibrosa ( 14) pero potseriormente como GRCG ( 15). Sin embargo en opinion de ciertos autores los hallazgos microscópicos del querubismo pueden ser tan distintivos como para permitir el diagnóstico sin el concurso de la historia clínica ni de los hallazgos radiológicos ( 16). Sgún estos autores en estas lesiones las células gigantes multinucleadas son usualmente escasa, dispuestas alrededor de capilare sanguíneos y tienden a formar pequeños focos adoptando un patrón parcheado, y alrededor de los más bien numerosos pequeños vasos sanguíneos del laxo estroma existe un estrecho anillo de colágena ( Fig-21 y Fig-22).
El Granuloma de células gigantes periférico de encía presenta las mismas características histológicas que el GRCG y puede manifestarse clínicamente cómo un épulis.
El Tumor pardo del hiperparatiroidismo puede simular radiológicamente una neoplasia primaria o secundaria de hueso. Debido al parecido histológico pueden producirse problemas de diagnóstico diferencial con el verdadero TCG en los huesos largos y con el GRCG en los maxilares cuando el patólogo no posee la necesaria información clínica y radiológica. En pacientes que no tengan enfermedad de Paget ósea no ocurren nunca verdaderos TCG en los huesos maxilares y de la cara. En los huesos de manos y pies y en toda localización que sería atípica para un TCG se sugiere que sea realizado un concienzudo estudio analítico para excluir hiperparatiroidismo. Los tumores pardos del hiperparatiroidismo afectan más frecuentemente a la diáfisis de los huesos largos de las extremidades y menos comunmente a los extremos de los huesos largos y a los los huesos tubulares de manos y pies.
Histológicamente ( Fig-23), el hueso esponjoso y médula ósea ha sido reemplazado por una lesión nodular constituida por una prolifeación de células mononucleadas del estroma imersas en una matriz fibrosa, rica en fibras de colágena, entremezcladas con abundante células gigantes de tipo osteoclastico, que usualmente no presentan gran tamaño y se encuentran irregularmente distribuidas formando agregados de tamaño variable, frecuentemente alrededor de focos hemorrágicos Las células mononucleadas suelen ser má diferenciadas y menos abundantes que las células proliferantes mononucleadas de los TCG. El hueso que circunda a la lesión presenta cambios histológicos muy característicos, consistentes de un lado en trabéculas oseas neoformadas ribeteadas por osteoblastos activos (que explica el incremento de la fosfatasa alcalina sérica), y por otro lado signos de reabsorción ósea con trabéculas de hueso laminar con un número aumentado de osteoclastos en su superficie. En lesiones menos evolucionadas las trabéculas óseas pueden mostrar las características de la “fibro-osteoclasia disecante” .
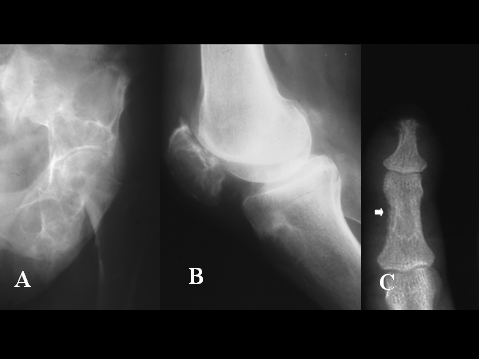
Radiológicamente, los tumores pardos, característicamente muestran una lesión osteolítica, de márgenes usualmente poco nítidos, que frecuentemente expande el córtex y se halla rodeada por una fina cáscara de hueso perióstico neoformado. Otras características radiológicas del hiperparatiroidismo, cómo reabsorción perióstica, especialmente de las falanges distales y del extremo distal de la clavícula, pueden indicar el diagnóstico correcto de tumor pardo ( Fig-24).
La sinovitis villonodular y tenosinovitis pigmentada (tumor de células gigantes de las vainas tendinosa ) intraósea ( invasiva, agresiva) es una variante de sinovitis villonodular pigmentada que también ha de ser considerada en el diagnóstico diferencial de las lesiones óseas de células gigantes, dado que pueden erosionar el hueso o huesos de la zona en el curso de su expansión, espacialmente aquellos que se desarrollan en los dedos de los pies, en otras partes del pie, o en el tobillo, debido a los densos ligamentos de la región que le impide extenderse hacia el exterior (Fig.25). Se observan erosiones óseas en aproximadamente el 10% de los casos pudiendo producirse destrucción del hueso. El diagnóstico diferencial histológico se simplifica en gran medida si el cirujano informa al patólogo que la lesión se origina en la sinovial articular o en la vaina tendinosa y aparece erosionando o invadiendo el hueso, más bien que originándose en éste, debiendo levantar la sospecha el estudio macroscópico de la pieza quirúrgica, haciendo inverosimil el diagnóstico de TCG o condroblastoma.
Histológicamente, la lesión consiste en una proliferación de células mononucleadas, células gigantes multinucleadas, células xantomatosas e histiocitos cargados de hemosiderina, dependiendo su aspecto de la proporción de los distintos tipos de células y el grado de colagenización ( Fig-26). Espacios en forma de hendiduras se encuentran a veces, particularmente en lesiones originadas en las grandes articulaciones. Raramente se encuentran focos de metaplasia cartilaginosa u ósea. Las células mononucleadas son células neoplásicas y en algunos casos se encuentran más de 3 mitosis por 10 campos de gran aumento lo cual ha conducido en algunas ocasiones a diagnosticar un tumor maligno. Se trata por tanto de un tumor benigno, localmente agresivo que no metastatiza.
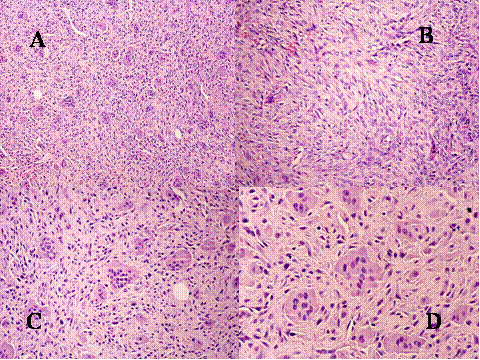 fiogf49gjkf0dFig.15- Granuloma reparativo de células gigantes. (A, B, C y D) La lesión consiste en una proliferación fibrohistiocitaria con células gigantes, no grandes y con pocos núcleos relativamente."> fiogf49gjkf0dFig.15- Granuloma reparativo de células gigantes. (A, B, C y D) La lesión consiste en una proliferación fibrohistiocitaria con células gigantes, no grandes y con pocos núcleos relativamente.">
Fig-15 - fiogf49gjkf0d Fig.15- Granuloma reparativo de células gigantes. (A, B, C y D) La lesión consiste en una proliferación fibrohistiocitaria con células gigantes, no grandes y con pocos núcleos relativamente.
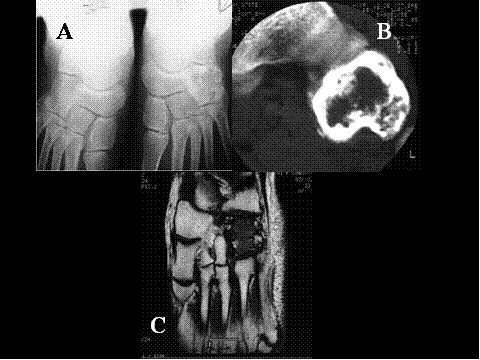 fiogf49gjkf0dFig.16- Granuloma reparativo de células gigantes del hueso cuboides. A) Radiografía simple, B) Tomografía computerizada ( TAC) y C) RM -T1: Lesión de tipo mixto, lítica y esclerosa, con engrosamiento de la cortical y leve expansión ósea, con señal hipointensa en secuencias T1 en RM"> fiogf49gjkf0dFig.16- Granuloma reparativo de células gigantes del hueso cuboides. A) Radiografía simple, B) Tomografía computerizada ( TAC) y C) RM -T1: Lesión de tipo mixto, lítica y esclerosa, con engrosamiento de la cortical y leve expansión ósea, con señal hipointensa en secuencias T1 en RM">
Fig-16 - fiogf49gjkf0d Fig.16- Granuloma reparativo de células gigantes del hueso cuboides. A) Radiografía simple, B) Tomografía computerizada ( TAC) y C) RM -T1: Lesión de tipo mixto, lítica y esclerosa, con engrosamiento de la cortical y leve expansión ósea, con señal hipointensa en secuencias T1 en RM
 fiogf49gjkf0dFig.17- Quiste óseo aneurismático, variante sólida. A) Radiografía simple lateral de rodilla. Lesión metafisaria femoral, con gran expansión de la cortical posterior, con septos finos y espiculaciones en la cortical anterior. B) proliferación fibrohistiocitaria con células gigantes multinucleadas de características similares o idénticas a las del granuloma reparativo de células gigantes. C) Área que muestra cambios fibromixoides con calcificaciones y formaciones quísticas de quiste óseo aneurismático."> fiogf49gjkf0dFig.17- Quiste óseo aneurismático, variante sólida. A) Radiografía simple lateral de rodilla. Lesión metafisaria femoral, con gran expansión de la cortical posterior, con septos finos y espiculaciones en la cortical anterior. B) proliferación fibrohistiocitaria con células gigantes multinucleadas de características similares o idénticas a las del granuloma reparativo de células gigantes. C) Área que muestra cambios fibromixoides con calcificaciones y formaciones quísticas de quiste óseo aneurismático.">
Fig-17 - fiogf49gjkf0d Fig.17- Quiste óseo aneurismático, variante sólida. A) Radiografía simple lateral de rodilla. Lesión metafisaria femoral, con gran expansión de la cortical posterior, con septos finos y espiculaciones en la cortical anterior. B) proliferación fibrohistiocitaria con células gigantes multinucleadas de características similares o idénticas a las del granuloma reparativo de células gigantes. C) Área que muestra cambios fibromixoides con calcificaciones y formaciones quísticas de quiste óseo aneurismático.
 fiogf49gjkf0dFig.18- Quiste óseo aneurismático, variante sólida. A) A la izquierda de la imagen restos de trabéculas óseas y áreas más sólidas, fibrosas, en la zona central. B) zonas fibrocodroides (ángulo inferior izquierdo) bordeada por una franja celular con células gigantes y calcificaciones ( ángulo superior derecho). C) zona sólida más celular. D) Área con células grandes, irregulares e hipercromáticas que pueden inducir a diagnosticar un tumor maligno."> fiogf49gjkf0dFig.18- Quiste óseo aneurismático, variante sólida. A) A la izquierda de la imagen restos de trabéculas óseas y áreas más sólidas, fibrosas, en la zona central. B) zonas fibrocodroides (ángulo inferior izquierdo) bordeada por una franja celular con células gigantes y calcificaciones ( ángulo superior derecho). C) zona sólida más celular. D) Área con células grandes, irregulares e hipercromáticas que pueden inducir a diagnosticar un tumor maligno.">
Fig-18 - fiogf49gjkf0d Fig.18- Quiste óseo aneurismático, variante sólida. A) A la izquierda de la imagen restos de trabéculas óseas y áreas más sólidas, fibrosas, en la zona central. B) zonas fibrocodroides (ángulo inferior izquierdo) bordeada por una franja celular con células gigantes y calcificaciones ( ángulo superior derecho). C) zona sólida más celular. D) Área con células grandes, irregulares e hipercromáticas que pueden inducir a diagnosticar un tumor maligno.
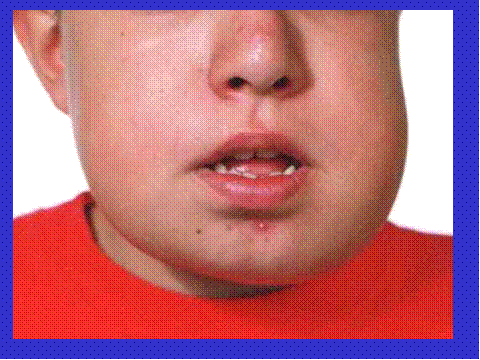 fiogf49gjkf0dFig.19- Fotografia de niño de 11 años con la hinchazón bilateral de los maxilares característica del querubismo."> fiogf49gjkf0dFig.19- Fotografia de niño de 11 años con la hinchazón bilateral de los maxilares característica del querubismo.">
Fig-19 - fiogf49gjkf0d Fig.19- Fotografia de niño de 11 años con la hinchazón bilateral de los maxilares característica del querubismo.
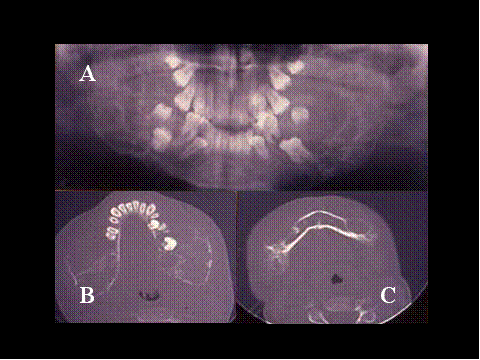 fiogf49gjkf0dFig.20- Querubismo. A) Radiografía simple, panorámica en la que se observan múltiples lesiones líticas expansivas, bilaterales, afectando a toda la mandíbula, con desplazamiento de los dientes.El TAC (B y C) muestra la gran expansión mandibular"> fiogf49gjkf0dFig.20- Querubismo. A) Radiografía simple, panorámica en la que se observan múltiples lesiones líticas expansivas, bilaterales, afectando a toda la mandíbula, con desplazamiento de los dientes.El TAC (B y C) muestra la gran expansión mandibular">
Fig-20 - fiogf49gjkf0d Fig.20- Querubismo. A) Radiografía simple, panorámica en la que se observan múltiples lesiones líticas expansivas, bilaterales, afectando a toda la mandíbula, con desplazamiento de los dientes.El TAC (B y C) muestra la gran expansión mandibular
 fiogf49gjkf0dFig.21- Querubismo. A) lesión parcheada constituida por focos con células gigantes multinucleadas separadas por áreas de tejido fibroso. B,C y D) a distintos aumentos. Los focos de células gigantes, las cuales no son de gran tamaño, poseen pocos núcleos y no son numerosas. Estos focos presentan con frecuencia pequeñas hemorragias (D)."> fiogf49gjkf0dFig.21- Querubismo. A) lesión parcheada constituida por focos con células gigantes multinucleadas separadas por áreas de tejido fibroso. B,C y D) a distintos aumentos. Los focos de células gigantes, las cuales no son de gran tamaño, poseen pocos núcleos y no son numerosas. Estos focos presentan con frecuencia pequeñas hemorragias (D).">
Fig-21 - fiogf49gjkf0d Fig.21- Querubismo. A) lesión parcheada constituida por focos con células gigantes multinucleadas separadas por áreas de tejido fibroso. B,C y D) a distintos aumentos. Los focos de células gigantes, las cuales no son de gran tamaño, poseen pocos núcleos y no son numerosas. Estos focos presentan con frecuencia pequeñas hemorragias (D).
 fiogf49gjkf0dFig.22- Querubismo. A) límite entre un foco de células gigantes y área fibrosa. B) En el área fibrosa los fibroblástos no muestran atipia. C y D) Collarete fibroso alrededor de pequeños vasos."> fiogf49gjkf0dFig.22- Querubismo. A) límite entre un foco de células gigantes y área fibrosa. B) En el área fibrosa los fibroblástos no muestran atipia. C y D) Collarete fibroso alrededor de pequeños vasos.">
Fig-22 - fiogf49gjkf0d Fig.22- Querubismo. A) límite entre un foco de células gigantes y área fibrosa. B) En el área fibrosa los fibroblástos no muestran atipia. C y D) Collarete fibroso alrededor de pequeños vasos.
 fiogf49gjkf0dFig.23- Tumor pardo del hiperparatiroidismo. A) Visión panorámica en que el hueso esponjoso ha sido sustituido por una lesión en la que a mayor aumento B) se ve que está constituida por una proliferación de células mononucleadas, fibroblástos e histiocitos, y células gigantes multinucleadas, de poco tamaño y pocos núcleos. En dichos focos hay signos de hemorragia antigua (histiocitos con hemosiderina) y reciente ( C).En las márgenes de la lesión, en C y D) se encuentra típicamente trabéculas óseas neoformadas, ribeteadas por osteoblastos."> fiogf49gjkf0dFig.23- Tumor pardo del hiperparatiroidismo. A) Visión panorámica en que el hueso esponjoso ha sido sustituido por una lesión en la que a mayor aumento B) se ve que está constituida por una proliferación de células mononucleadas, fibroblástos e histiocitos, y células gigantes multinucleadas, de poco tamaño y pocos núcleos. En dichos focos hay signos de hemorragia antigua (histiocitos con hemosiderina) y reciente ( C).En las márgenes de la lesión, en C y D) se encuentra típicamente trabéculas óseas neoformadas, ribeteadas por osteoblastos.">
Fig-23 - fiogf49gjkf0d Fig.23- Tumor pardo del hiperparatiroidismo. A) Visión panorámica en que el hueso esponjoso ha sido sustituido por una lesión en la que a mayor aumento B) se ve que está constituida por una proliferación de células mononucleadas, fibroblástos e histiocitos, y células gigantes multinucleadas, de poco tamaño y pocos núcleos. En dichos focos hay signos de hemorragia antigua (histiocitos con hemosiderina) y reciente ( C).En las márgenes de la lesión, en C y D) se encuentra típicamente trabéculas óseas neoformadas, ribeteadas por osteoblastos.
 fiogf49gjkf0dFig.24- Hiperparatiroidismo. Radiografías simples: A) AP de cadera y B) lateral, de rodilla, que muestran lesiones líticas, de contorno escleroso bien delimitado, situadas en el hueso iliaco, rótula y parte anterior de la metáfisis tibial. C) Radiografía de lesión localizada en el 2º dedo, que muestra reabsorción subperióstica de la cortical medial de la falange media ( flecha) y del penacho de la falange distal; nótese el desdibujamiento de la superficie cortical medial y del penacho, a diferencia de la buena delimitación de la superficie cortical contralateral."> fiogf49gjkf0dFig.24- Hiperparatiroidismo. Radiografías simples: A) AP de cadera y B) lateral, de rodilla, que muestran lesiones líticas, de contorno escleroso bien delimitado, situadas en el hueso iliaco, rótula y parte anterior de la metáfisis tibial. C) Radiografía de lesión localizada en el 2º dedo, que muestra reabsorción subperióstica de la cortical medial de la falange media ( flecha) y del penacho de la falange distal; nótese el desdibujamiento de la superficie cortical medial y del penacho, a diferencia de la buena delimitación de la superficie cortical contralateral.">
Fig-24 - fiogf49gjkf0d Fig.24- Hiperparatiroidismo. Radiografías simples: A) AP de cadera y B) lateral, de rodilla, que muestran lesiones líticas, de contorno escleroso bien delimitado, situadas en el hueso iliaco, rótula y parte anterior de la metáfisis tibial. C) Radiografía de lesión localizada en el 2º dedo, que muestra reabsorción subperióstica de la cortical medial de la falange media ( flecha) y del penacho de la falange distal; nótese el desdibujamiento de la superficie cortical medial y del penacho, a diferencia de la buena delimitación de la superficie cortical contralateral.
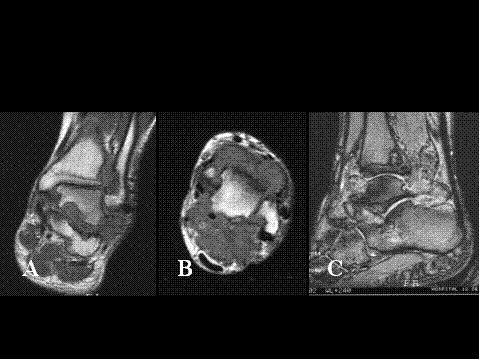 fiogf49gjkf0dFig.25-Radiología de la sinovitis villonodular invasiva con erosión ósea. RM de tobillo.A) cortecoronal y B) corte axial en secuencias potenciadas en T1; C) corte sagital Eco de gradiente potenciado en T2. Se observa ocupación de los recesos articulares de la articulación tibio-peronea-astragalina y del seno del tarso por masas de aspecto polilobulado, que producen erosión de los huesos contiguos. Estas masas son hipointensas en secuencias potenciadas T1 y heterogéneas en T2, en donde se aprecian focos hipointensos relacionados con la presencia de hemosiderina.
"> fiogf49gjkf0dFig.25-Radiología de la sinovitis villonodular invasiva con erosión ósea. RM de tobillo.A) cortecoronal y B) corte axial en secuencias potenciadas en T1; C) corte sagital Eco de gradiente potenciado en T2. Se observa ocupación de los recesos articulares de la articulación tibio-peronea-astragalina y del seno del tarso por masas de aspecto polilobulado, que producen erosión de los huesos contiguos. Estas masas son hipointensas en secuencias potenciadas T1 y heterogéneas en T2, en donde se aprecian focos hipointensos relacionados con la presencia de hemosiderina.
">
Fig-25 - fiogf49gjkf0d Fig.25-Radiología de la sinovitis villonodular invasiva con erosión ósea. RM de tobillo.A) cortecoronal y B) corte axial en secuencias potenciadas en T1; C) corte sagital Eco de gradiente potenciado en T2. Se observa ocupación de los recesos articulares de la articulación tibio-peronea-astragalina y del seno del tarso por masas de aspecto polilobulado, que producen erosión de los huesos contiguos. Estas masas son hipointensas en secuencias potenciadas T1 y heterogéneas en T2, en donde se aprecian focos hipointensos relacionados con la presencia de hemosiderina.
 fiogf49gjkf0dFig.26- Sinovitis villonodular pigmentada extraarticular ( proliferativa, florida). La lesión está constituida por células mononucleadas redondeadas o poligonales y contiene escasa células gigantes multinucleadas. Presentan un cecimiento expansivo y células que contienen pigmento de hemosiderina (A), fibrosis y hialinización en la matriz intercelular (C y D, flechas) y células xantomatosas (D, arterisco)."> fiogf49gjkf0dFig.26- Sinovitis villonodular pigmentada extraarticular ( proliferativa, florida). La lesión está constituida por células mononucleadas redondeadas o poligonales y contiene escasa células gigantes multinucleadas. Presentan un cecimiento expansivo y células que contienen pigmento de hemosiderina (A), fibrosis y hialinización en la matriz intercelular (C y D, flechas) y células xantomatosas (D, arterisco).">
Fig-26 - fiogf49gjkf0d Fig.26- Sinovitis villonodular pigmentada extraarticular ( proliferativa, florida). La lesión está constituida por células mononucleadas redondeadas o poligonales y contiene escasa células gigantes multinucleadas. Presentan un cecimiento expansivo y células que contienen pigmento de hemosiderina (A), fibrosis y hialinización en la matriz intercelular (C y D, flechas) y células xantomatosas (D, arterisco).
|
|
Osteosarcoma, O.osteoide, Fibroma
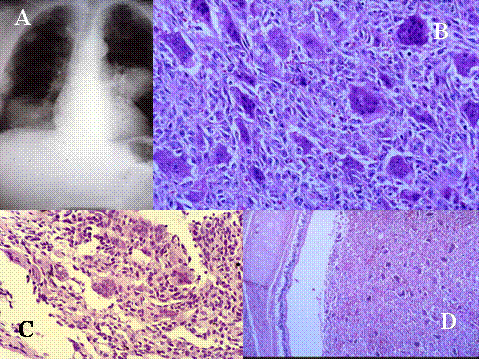
fiogf49gjkf0d Ciertos osteosarcomas contienen abundamtes células gigantes de tipo osteoclástico, ampliamente distribuidas entre las células neoplásicas sarcomatosas. Bathurst y colaboradores llamaron descriptivamente a estos tumores osteosarcomas ricos en células osteoclásticas ( Fig-27) . Las células de estos tumores pueden tener una apariencia decepcionantemente benigna y pueden ser confundidos con TCG en los poco frecuentes casos de localización epifisaria. El osteosarcoma telangiectásico ( Fig-28, Fig-29, Fig-30)consiste típicamente en espacios seudoquísticos no revestidos por endotelio, que se hallan divididos por septos, similares a los que se observan en el QOA, yque contienen frecuentemente abundantes células gigantes de tipo osteoclástico que sin embargo aparecen entremezcladas con células neoplásicas muy atípicas. El osteoide es usualmente muy escaso y fecuentemente muy dificil de detectar . Algunos casos pueden sugerir un TCG maligno. La distinción entre ambas variantes de osteosrcoma y el TCG usualmente se puede hacer teniendo en cuenta la edad del paciente y la localización del tumor junto a una estricta interpretación de las características histológicas y radiológicas. La identificación de la naturaleza osteoblástica de estos tumores puede requerir un extenso muestreo , la correlación con las características radiológicas o ambas.
El Osteoma osteoide (OO) y el Osteoblastoma (OB son neoplasias benignas productoras de osteoide que contienen numerosas células gigantes de tipo osteoclástico. Ambos tumores muetran características hitológicas idénticas. La diferenciación entre ambas entidades se basa casi exclusivamente en diferencias clinico-radiológicas, tales como el dolor característico y el hueso escleroso reactivo que rodea al tumor en el caso del OO y el mayor tamaño del OB.
Histológicamente, estos tumores aparecen constituidos por finas espículas de osteoide o de hueso inmaduro ribeteadas por una sola capa de osteoblastos en el seno de un estroma ricamente vascularizado, en el que frecuentemente se observan hematíes extravasados. En el OB se pueden hallar mitosis pero no atipia. En ambos tumores se encuentran abundantes células gigantes multinucleadas de tipo osteoclástico que pueden simular un TCG ( Fig-31 y Fig-32).
El OO afecta generalmente a niños y adolescentes, es más frecuente en varones y ha sido referido prácticamente en todos los huesos excepto el esternón, si bien su localización más frecuente es en los huesos tubulares, particularmente en el fémur proximal. El OB afecta a individuos entre 10 y 30 años y es tanbien más comun en varones. Las localizaciones más frecuentes son columna, particularmente los elementos posteriores, y el sacro, la metáfisis proximal y distal del fémur, proximal de la tibia y menos frecuentemente en los huesos del tarso.
La radiología del OO en las placas simples es muy característica consistiendo en una esclerosis densa de la cortical que rodea a un “nidus” radiolúcido ( Fig-33). En los casos poco frecuentes en que el centro de la lesión se ha osificado, ésta puede mostrar una imagen en diana, presentando esclerosis central que aparece rodeada por un anillo radiolúcido. Los OB generalmente muetran una lesión redondeada u oval radiolúcida, casi siempre circunscrita por una cáscara de hueso reactivo perióstico ( Fig-34). Los tumores de gran tamaño y los localizados en vértebras producen cambios similares al QOA y pueden invadir los tejidos blandos.
El Fibroma condromixoide (FCM) (Figs.35 y 36) es una neoplasia benigna caracterizada histológicmente por lóbulos de células estrelladas o fusiformes en el seno de una matriz condroide o mixoide, separados por septos fibrosos en donde se encuentran células gigantes multinucleadas, no de gran tamaño ni abundantes, que a veces pueden faltar. Los lóbulos son hipocelulares en el centro e hipercelulares en la periferia. En un número importante de casos las células neoplásicas presentan grandes núcleos bizarros, hipercromáticos, que pueden sugerir malignidad, pero tales cambios son generalmente focales y asociados a citoplasmas voluminosos que sugieren cambios degenerativos y no malignos. En el 50% de los casos se encuentra cartílago hialino y algunas veces gruesas calcificaciones más frecuentes en individuos mayores o en tumores de localización yuxtacortical ( 18). Cambios de QOA se encuentran el el 10% de tumores localizados en huesos planos y tubulares largos.
El FCM es un tumor raro que ocurre preponderantemente en la 2ª y 3ª décadas, aunque aparece también en pacientes más jóvenes y mayores y afecta igualmente a ambos sexos. Se produce en todos los sitios del esqueleto, más frecuentemente en la metáfisis de los huesos tubulares largos, especialmente en la tibia. Los huesos planos se ven afectados en el 25% de los casos, especialmente el ilion, también los huesos de manos y pies y ocurre, aunque infrecuentemente, en localización juxtacortical ( 18).
Radiológicamente ( Fig-37) se observa una lesión osteolítica, geográfica y excéntrica, con septos y bordes festoneados, que expande el hueso. En algunos casos se produce rotura de la cortical e infiltración de tejidod blandos pero el periostio adyacente típicamente permanece intacto. El diagnóstico diferencial importante que surge en algunos casos es con el condrosarcoma, porque el FCM frecuentemente tiene células grandes de núcleos bizarros.
El Fibroma no osificante ( FNO) (defecto fibroso cortical, defecto fibroso metafisario) es una lesión ósea no neoplásica, de etiología desconocida, caracterizada por ua proliferación de fibroblastos e histiocitos dispuestos formando un patron arremolinado o estoriforme, que contien células gigantes multinucleadas de tipo osteoclástico, no grandes. Los histiocitos pueden contener en sus citoplasmas cantidades variables de pigmento de hemosiderina o lípidos (Fig.38). Dichas lesiones se localizan en la metáfisis de los huesos tubulares largos, preferentemente en la inferior del fémur y superior de la tibia. Se descubren en la 1ª y 2ª decadas de la vida, raramente después de los 15 años y afectan igualmente a ambos sexos. Las lesiones pueden regresar espontáneamente y en el 30% de los casos son hallazgos radiológicos casuales. La mitad de los pacientes debutan con dolor y en el 15% se produce una fractura patológica. La lesión puede ser multifocal y aparecer asociada a ciertos síndromes como la neurofibromatosis tipo-1 o el síndrome de Jaffe-Campanacci ( 13). Las radiografías simples muestran una lesión excéntrica, radioluciente, de márgenes polilobulados, frecuentemente escleróticos ( Fig-39).
El Fibrohistiocitoma benigno de hueso (FHB) es una lesión benigna con características histológicas similares al FNO pero que ocurre en sitios diferentes como la epífisis y diáfisis de huesos tubulares largos, particularmente fémur y tibia, y huesos de la pélvis , pero puede afectar a cualquier hueso. Como el FNO es una proliferación de fibroblastos e histiocitos con presencia de células gigantes multinucleadas de tipo osteoclástico. Células espumosas (xantomatosas), células de la inflamación crónica focos de hemorragia y pigmento de hemosiderina son también hallazgos comunes ( Fig-40). Radiológicamente es una lesión medular, radioluciente, sin formación de matriz. Puede haber trabeculación interna o seudoseptación. En un cierto número de casos los bordes son esclerosos, mientras que en otros aparecen adelgazados con expansión del cortex pero sin reacción perióstica en tanto no se haya producido una fractura ( Fig-41).
 fiogf49gjkf0dFig.27- Osteosarcoma rico en osteoclastos. El diagnóstico de osteosarcoma hay que basarlo en la atipia celular (A y B) y en descubrir osteoide que puede ser escaso (C y D. flechas)."> fiogf49gjkf0dFig.27- Osteosarcoma rico en osteoclastos. El diagnóstico de osteosarcoma hay que basarlo en la atipia celular (A y B) y en descubrir osteoide que puede ser escaso (C y D. flechas).">
Fig-27 - fiogf49gjkf0d Fig.27- Osteosarcoma rico en osteoclastos. El diagnóstico de osteosarcoma hay que basarlo en la atipia celular (A y B) y en descubrir osteoide que puede ser escaso (C y D. flechas).
 fiogf49gjkf0dFig.28- Osteosarcoma telangiectásico. A, B y C) Las paredes y septos de los quistes están constituidos por una proliferación de células mesenquimales neoplásicas atípicas, salpicadas por la presencia de células gigantes multinucleadas de tipo osteoclástico (flechas) entre las que se encuentran células gigantes multinucleadas neoplásicas atípicas ( B, flecha corta). El osteoide suele ser escaso (C, flechas), y a veces no es posible hallarlo."> fiogf49gjkf0dFig.28- Osteosarcoma telangiectásico. A, B y C) Las paredes y septos de los quistes están constituidos por una proliferación de células mesenquimales neoplásicas atípicas, salpicadas por la presencia de células gigantes multinucleadas de tipo osteoclástico (flechas) entre las que se encuentran células gigantes multinucleadas neoplásicas atípicas ( B, flecha corta). El osteoide suele ser escaso (C, flechas), y a veces no es posible hallarlo.">
Fig-28 - fiogf49gjkf0d Fig.28- Osteosarcoma telangiectásico. A, B y C) Las paredes y septos de los quistes están constituidos por una proliferación de células mesenquimales neoplásicas atípicas, salpicadas por la presencia de células gigantes multinucleadas de tipo osteoclástico (flechas) entre las que se encuentran células gigantes multinucleadas neoplásicas atípicas ( B, flecha corta). El osteoide suele ser escaso (C, flechas), y a veces no es posible hallarlo.
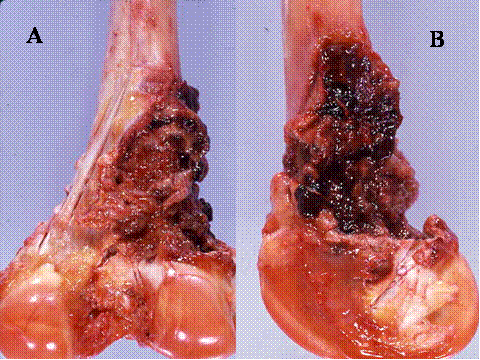
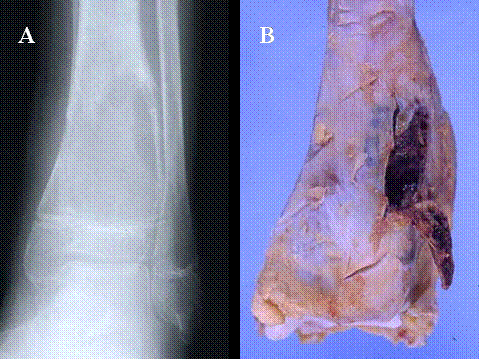 fiogf49gjkf0dFig.29- Radiología y pieza quirúrgica de amputación de osteosarcoma telangiectásico de metáfisis inferior de la tibia. A) Lesión lítica de límites imprecisos con patrón permeativo. B) Tras la apertura de una ventana cortical se observa que la lesión está coformada por un tejido ocupado por coágulos sanguíneos."> fiogf49gjkf0dFig.29- Radiología y pieza quirúrgica de amputación de osteosarcoma telangiectásico de metáfisis inferior de la tibia. A) Lesión lítica de límites imprecisos con patrón permeativo. B) Tras la apertura de una ventana cortical se observa que la lesión está coformada por un tejido ocupado por coágulos sanguíneos.">
Fig-29 - fiogf49gjkf0d Fig.29- Radiología y pieza quirúrgica de amputación de osteosarcoma telangiectásico de metáfisis inferior de la tibia. A) Lesión lítica de límites imprecisos con patrón permeativo. B) Tras la apertura de una ventana cortical se observa que la lesión está coformada por un tejido ocupado por coágulos sanguíneos.
 fiogf49gjkf0dFig.30- Osteosarcoma telangiectásisco de metáfisis inferior de fémur. A) vista posterior y B) lateral mostrando una lesión básicamente hemorrágica ocupada por coagulos sanguíneos."> fiogf49gjkf0dFig.30- Osteosarcoma telangiectásisco de metáfisis inferior de fémur. A) vista posterior y B) lateral mostrando una lesión básicamente hemorrágica ocupada por coagulos sanguíneos.">
Fig-30 - fiogf49gjkf0d Fig.30- Osteosarcoma telangiectásisco de metáfisis inferior de fémur. A) vista posterior y B) lateral mostrando una lesión básicamente hemorrágica ocupada por coagulos sanguíneos.
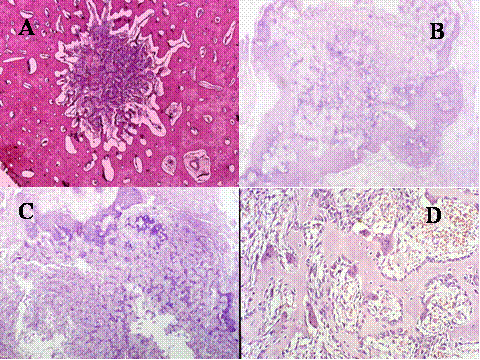 fiogf49gjkf0dFig.31- Osteoma osteoide. En A, B y C) se muestra el nidus que constituye el tumor. En A) el tumor aparece rodeado por un hueso cortical escleroso. En B y C) se muestra el centro con trabéculas óseas calcificadas rodeado de una zona anular fibrosa lo que da lugar a la imagen radiológica en ojo de perdiz. La textura del tumor se muestra en D): Trabéculas de osteoide bordeadas por osteoblastos y presencia de células gigantes multinucleadas de tipo osteoclástico en el seno de un estroma laxo, ricamente vascularizado."> fiogf49gjkf0dFig.31- Osteoma osteoide. En A, B y C) se muestra el nidus que constituye el tumor. En A) el tumor aparece rodeado por un hueso cortical escleroso. En B y C) se muestra el centro con trabéculas óseas calcificadas rodeado de una zona anular fibrosa lo que da lugar a la imagen radiológica en ojo de perdiz. La textura del tumor se muestra en D): Trabéculas de osteoide bordeadas por osteoblastos y presencia de células gigantes multinucleadas de tipo osteoclástico en el seno de un estroma laxo, ricamente vascularizado.">
Fig-31 - fiogf49gjkf0d Fig.31- Osteoma osteoide. En A, B y C) se muestra el nidus que constituye el tumor. En A) el tumor aparece rodeado por un hueso cortical escleroso. En B y C) se muestra el centro con trabéculas óseas calcificadas rodeado de una zona anular fibrosa lo que da lugar a la imagen radiológica en ojo de perdiz. La textura del tumor se muestra en D): Trabéculas de osteoide bordeadas por osteoblastos y presencia de células gigantes multinucleadas de tipo osteoclástico en el seno de un estroma laxo, ricamente vascularizado.
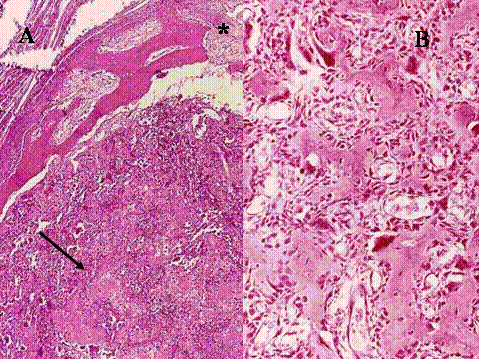 fiogf49gjkf0dFig.32- Osteoblastoma. A y B) El Osteoblastoma presenta características histológicas similares a las del osteoma osteoide, si bien los depósitos de osteoide pueden ser mas extensos (A, flechas) y el patrón trabecular más irregular. Además no presenta el hueso escleroso rodeándolo, como en el osteoma osteoide, y la cortical puede estar erosionada (A, arterísco)."> fiogf49gjkf0dFig.32- Osteoblastoma. A y B) El Osteoblastoma presenta características histológicas similares a las del osteoma osteoide, si bien los depósitos de osteoide pueden ser mas extensos (A, flechas) y el patrón trabecular más irregular. Además no presenta el hueso escleroso rodeándolo, como en el osteoma osteoide, y la cortical puede estar erosionada (A, arterísco).">
Fig-32 - fiogf49gjkf0d Fig.32- Osteoblastoma. A y B) El Osteoblastoma presenta características histológicas similares a las del osteoma osteoide, si bien los depósitos de osteoide pueden ser mas extensos (A, flechas) y el patrón trabecular más irregular. Además no presenta el hueso escleroso rodeándolo, como en el osteoma osteoide, y la cortical puede estar erosionada (A, arterísco).
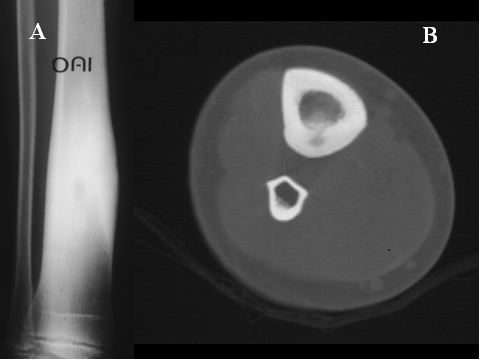 fiogf49gjkf0dFig.33- Osteoma osteoide tibial. A) Radiografía simple y B) TAC de la pierna. Pequeña imagen lítica intracortical, redondeada, (nidus) rodeada de marcado engrosamiento de la cortical femoral."> fiogf49gjkf0dFig.33- Osteoma osteoide tibial. A) Radiografía simple y B) TAC de la pierna. Pequeña imagen lítica intracortical, redondeada, (nidus) rodeada de marcado engrosamiento de la cortical femoral.">
Fig-33 - fiogf49gjkf0d Fig.33- Osteoma osteoide tibial. A) Radiografía simple y B) TAC de la pierna. Pequeña imagen lítica intracortical, redondeada, (nidus) rodeada de marcado engrosamiento de la cortical femoral.
 fiogf49gjkf0dFig.34- Osteoblastoma. Radiografías de A) Lesión lítica, geográfica, de bordes bien definidos, no esclerosos, situada en la diáfisis femoral. B) Lesión lítica , geográfica, con rotura de la cortical externa, e imágenes espiculadas, situada en el borde externo de la región proximal de la diáfisis del fémur."> fiogf49gjkf0dFig.34- Osteoblastoma. Radiografías de A) Lesión lítica, geográfica, de bordes bien definidos, no esclerosos, situada en la diáfisis femoral. B) Lesión lítica , geográfica, con rotura de la cortical externa, e imágenes espiculadas, situada en el borde externo de la región proximal de la diáfisis del fémur.">
Fig-34 - fiogf49gjkf0d Fig.34- Osteoblastoma. Radiografías de A) Lesión lítica, geográfica, de bordes bien definidos, no esclerosos, situada en la diáfisis femoral. B) Lesión lítica , geográfica, con rotura de la cortical externa, e imágenes espiculadas, situada en el borde externo de la región proximal de la diáfisis del fémur.
 fiogf49gjkf0dFig.35- Fibroma condromixoide. Neoplasia de patrón lobular como se aprecia en A y B. Los lóbulos condromixoides están separados por septos de estroma celular que contiene células mononucleadas de estirpe fibroblástica y células gigantes multinucleadas, no grandes y de pocos núcleos (C y D)."> fiogf49gjkf0dFig.35- Fibroma condromixoide. Neoplasia de patrón lobular como se aprecia en A y B. Los lóbulos condromixoides están separados por septos de estroma celular que contiene células mononucleadas de estirpe fibroblástica y células gigantes multinucleadas, no grandes y de pocos núcleos (C y D).">
Fig-35 - fiogf49gjkf0d Fig.35- Fibroma condromixoide. Neoplasia de patrón lobular como se aprecia en A y B. Los lóbulos condromixoides están separados por septos de estroma celular que contiene células mononucleadas de estirpe fibroblástica y células gigantes multinucleadas, no grandes y de pocos núcleos (C y D).
 fiogf49gjkf0dFig.36- Fibroma condromixoide. Las áreas mixoides presentan células de forma estrellada con finas prolongaciones citoplásmicas (A y B). En pocos casos se encuentran calcificaciones de tipo distrófico (C, flecha). Algunos tumores contienen células de gran pleomorfismo e hipercromatismo nuclear (D), que pueden inducir al diagnóstico erróneo de condrosarcoma."> fiogf49gjkf0dFig.36- Fibroma condromixoide. Las áreas mixoides presentan células de forma estrellada con finas prolongaciones citoplásmicas (A y B). En pocos casos se encuentran calcificaciones de tipo distrófico (C, flecha). Algunos tumores contienen células de gran pleomorfismo e hipercromatismo nuclear (D), que pueden inducir al diagnóstico erróneo de condrosarcoma.">
Fig-36 - fiogf49gjkf0d Fig.36- Fibroma condromixoide. Las áreas mixoides presentan células de forma estrellada con finas prolongaciones citoplásmicas (A y B). En pocos casos se encuentran calcificaciones de tipo distrófico (C, flecha). Algunos tumores contienen células de gran pleomorfismo e hipercromatismo nuclear (D), que pueden inducir al diagnóstico erróneo de condrosarcoma.
 fiogf49gjkf0dFig.37- Fibroma condromixoide.A) Radiografía AP de rodilla que muestra lesiòn lítica geográfica de contornos polilobulados, bien delimitados, con septos en su interior, que invade la epífisis, localizada excéntricamente en la metáfisis tibial. Fibroma condromixoide muy insuflante, con septos en su interior, localizado en el 4º metacarpiano."> fiogf49gjkf0dFig.37- Fibroma condromixoide.A) Radiografía AP de rodilla que muestra lesiòn lítica geográfica de contornos polilobulados, bien delimitados, con septos en su interior, que invade la epífisis, localizada excéntricamente en la metáfisis tibial. Fibroma condromixoide muy insuflante, con septos en su interior, localizado en el 4º metacarpiano.">
Fig-37 - fiogf49gjkf0d Fig.37- Fibroma condromixoide.A) Radiografía AP de rodilla que muestra lesiòn lítica geográfica de contornos polilobulados, bien delimitados, con septos en su interior, que invade la epífisis, localizada excéntricamente en la metáfisis tibial. Fibroma condromixoide muy insuflante, con septos en su interior, localizado en el 4º metacarpiano.
 fiogf49gjkf0dFig.38- Fibroma no osificante. A) imagen panorámica en que se ve la lesión en localización subcortical. B) visión panorámica en la que se reconocen células gigantes multinucleadas en el seno de una lesión mesenquimal de patrón arremolinado y que presenta áreas claras, en las que se encuentran histiocitos espumosos, lo cual se aprecia en detalle en (C). D) Foco de células gigantes con pequeñas hemorragias."> fiogf49gjkf0dFig.38- Fibroma no osificante. A) imagen panorámica en que se ve la lesión en localización subcortical. B) visión panorámica en la que se reconocen células gigantes multinucleadas en el seno de una lesión mesenquimal de patrón arremolinado y que presenta áreas claras, en las que se encuentran histiocitos espumosos, lo cual se aprecia en detalle en (C). D) Foco de células gigantes con pequeñas hemorragias.">
Fig-38 - fiogf49gjkf0d Fig.38- Fibroma no osificante. A) imagen panorámica en que se ve la lesión en localización subcortical. B) visión panorámica en la que se reconocen células gigantes multinucleadas en el seno de una lesión mesenquimal de patrón arremolinado y que presenta áreas claras, en las que se encuentran histiocitos espumosos, lo cual se aprecia en detalle en (C). D) Foco de células gigantes con pequeñas hemorragias.
 fiogf49gjkf0dFig.39- Radiología de fibroma no osificante con fractura oblícua en la diáfisis distal de la tibia. Lesión lítica, geográfica, metafiso-diafisaria, excéntrica, levemente insuflante, de contornos bien delimitados, polilobulados, esclerosos, que contiene septaciones finas en su interior."> fiogf49gjkf0dFig.39- Radiología de fibroma no osificante con fractura oblícua en la diáfisis distal de la tibia. Lesión lítica, geográfica, metafiso-diafisaria, excéntrica, levemente insuflante, de contornos bien delimitados, polilobulados, esclerosos, que contiene septaciones finas en su interior.">
Fig-39 - fiogf49gjkf0d Fig.39- Radiología de fibroma no osificante con fractura oblícua en la diáfisis distal de la tibia. Lesión lítica, geográfica, metafiso-diafisaria, excéntrica, levemente insuflante, de contornos bien delimitados, polilobulados, esclerosos, que contiene septaciones finas en su interior.
 fiogf49gjkf0dFig 40- Fibrohistiocitoma benigno. A, lesión fibrohistiocitaria salpicada por células gigantes multinucleadas que pueden presentar focos de inflamación (B) y abundantes histiocitos espumosos ( C y D)."> fiogf49gjkf0dFig 40- Fibrohistiocitoma benigno. A, lesión fibrohistiocitaria salpicada por células gigantes multinucleadas que pueden presentar focos de inflamación (B) y abundantes histiocitos espumosos ( C y D).">
Fig-40 - fiogf49gjkf0d Fig 40- Fibrohistiocitoma benigno. A, lesión fibrohistiocitaria salpicada por células gigantes multinucleadas que pueden presentar focos de inflamación (B) y abundantes histiocitos espumosos ( C y D).
 fiogf49gjkf0dFig.41- Fibrohistiocitoma benigno. A) Radiografía que muestra una lesión lítica de contornos polilobulados bien definidos, situada en la región supraacetabular del iliaco. B) Pieza quirúrgica consistente en múltiples fragmentos de tejido de color amarillento y pardo por el contenido de lípidos de numerosas células y en otras de hemosiderina."> fiogf49gjkf0dFig.41- Fibrohistiocitoma benigno. A) Radiografía que muestra una lesión lítica de contornos polilobulados bien definidos, situada en la región supraacetabular del iliaco. B) Pieza quirúrgica consistente en múltiples fragmentos de tejido de color amarillento y pardo por el contenido de lípidos de numerosas células y en otras de hemosiderina.">
Fig-41 - fiogf49gjkf0d Fig.41- Fibrohistiocitoma benigno. A) Radiografía que muestra una lesión lítica de contornos polilobulados bien definidos, situada en la región supraacetabular del iliaco. B) Pieza quirúrgica consistente en múltiples fragmentos de tejido de color amarillento y pardo por el contenido de lípidos de numerosas células y en otras de hemosiderina.
|
|
Displasia ósea y osteofibrosa, Quiste óseo aneurismático, Granuloma eosonófilo, E. Paget
fiogf49gjkf0d La Displasia Fibrosa es una lesión medular benigna fibroósea que afecta uno o más huesos. El tejido de la lesión prolifera durante el crecimiento del esqueleto y en algunos casos continua creciendo durante la edad adulta. La gravedad de la afectación del esqueleto es muy variable. En el 80% de los casos sólo se presenta un pequeño foco (DF monostótica). En la DF poliostótica se pueden afectar extensos segmentos que pueden producir una expansión cortical significativa. La DF puede presentarse en cualquier hueso pero los sitios más frecuentes son el esqueleto axial, huesos craneofaciales, costillas, femur y tibia. La forma poliostótica de la DF puede estar asociada a anormalidades endocrinas y pigmentación cutánea (Síndrome de McCune-Albrigth) y mixomas intramusculares ( Síndrome de Mazabraud).
Histológicamente ( Fig-42), la DF muestra trabéculas de hueso inmaduro en el seno de un estroma fibrocelular en el cual se pueden encontrar osteoclastos dispersos. Las trabéculas son delgadas y gráciles, no estando conectadas unas con otras y muetran una morfología curvilínea. Típicamente no se hallan bordeadas por un ribete de osteoblastos, aunque si se pueden hallar algunos en número escaso. La proporción de tejido fibroso o hueso puede variar, siendo a veces difícil encontrar mínimos rastros de osteoide. En algunos casos los depósitos de osteoide aparecen cómo glóblos redondeados semejantes al cemento ( Fig-43), por lo que tales lesiones han sido denominadas cementomas fibrosos o fibromas cemento-osificantes. En algunas lesionesse encuentran nódulos de cartílago hialino ( 19).
Radiológicamente, las lesione de DF son frecuentemente diagnósticas. En el esqueleto apendicular las lesiones son alargadas con expansión del hueso y adelgazamiento de la cortical. Rara vez la DF crece cómo una expansión en burbujas en el córtex. (FD protuberans). Típicamente la lesión presenta una textura de vidrio esmerilado pero en ocasiones es radiolítica o radiodensa, dependiendo de la cantidad de trabéculas mineralizadas de la lesión. En huesos grávemente afectados que soportan el peso corporal es común que se produzcan deformidades debido a múltiples fracturas ( Fig-44). Hay que considerar tres importantes diagnósticos diferenciales : 1- Osteosarcoma intraóseo bien diferenciado; 2- Fibroma osificante en los hueso maxilares y 3- en la tibia displasia osteofibrosa.
Actualmente está bien aceptado que el Fibroma osificante (FO ) de los huesos maxilares es una entidad distinta, separada de la DF, aunque sigue existiendo cierto excepticismo ( 20). La diferenciación entre ambas entidades es importante, puesto que existen diferencias en cuanto a tratamiento y pronóstico.El FO es uns verdadera neoplasia consistente en una proliferación de un tejido fibroso celular, que aparece bien delimitada o raramente encapsulada, que incluye hueso neoformado o calcificaciones esféricas. El tumor sólo se presenta en los maxilares y huesos craneofaciales. Casos similares histológicamente se han descrito en los huesos tubulares largos pero se consideran DF. En el análisis de 120 FOs de los maxilares la mayoría de los pacientes comprendían edades entre la 2ª y 4ª décadas con una edad promedio de 32 años. Más del 70% eran mujeres. Su localización más frecuente fue la mandíbula ( 77%) , específicamente en la región molar, seguida de la premolar ( 20).
Histológicamente, la lesión generalmente está bien circunscrita, conteniendo componentes fibrosos y óseos, que varían en su proporción de una lesión a otra y también dentro de la misma lesión. El componente fibroso muestra fibroblastos que no presentan atipia y un bajo índice mitótico. Usualmente se encuentran escasas células multinucleadas gigantes, ocasionales macrófagos espumosos y también pueden producirse cambios de QOA o mixoides. Las trabéculas óseas son finas, curvilineas y aparecen inconexas, no hallándose bordeadas por un ribete de osteoblastos, como es característico del hueso reactivo o neoplásico, aunque se pueden encontrar ocasionales osteoblastos adyacentes a los ribetes de osteoide ( Fig-45). En algunos tumores, particularmente aquellos que afectan a los huesos craneofaciales, el osteoide se deposita en forma de glóbulos redondeados, semejantes al cemento. Tumores con dichas características histológicas también han sido denominados Cementomas fibrosos o Fibromas cementoosificantes. En algunos casos también hay nódulos de cartílago hialino Las características histológicas descritas son similares a las antes referidas de la DF por lo que la distinción entre ambas entidades hay que hacerla en base a los criterios clínicos y radiológicos así como con los hallazgos quirúrgicos y características macroscópicas que deben ser correlacionadas con la histopatología. En la cirugía el FO tiende a poder enuclearse facilmente separándolo de hueso intacto en una o en grandes piezas. Estas características junto con la evidencia histológica de una buena demarcación de la lesión sirven para distinguir una entidad de la otra. Por tanto es de suma importancia que en la biopsia esté preservada la relación entre el córtex y la lesión para poder realizar el diagnóstico diferencial ( 19).
Radiológicamente las lesiones están bien circunscritas presentando unos bordes lisos y frecuentemente esclerosos ( Fig-46). Generalmente son lesiones uniloculares aunque tambin se han descrito multiloculares. Su aspecto depende de la madurez de la lesión, esto es, radiolúcidas si son meramente fibrosas o con trabéculas de osteoide sin calcificar, mixtas o radioopacas cuando el tumor contiene básicamente trabéculas calcificadas. El crecimiento centrífugo del tumor causa un arqueamiento del borde inferior de la mandíbula. Puede producirse la reabsorción o separación de las raices dentarias con el crecimiento continuado del tumor ( 20). El tratamiento recomendado es la excisión quirúrgica completa.
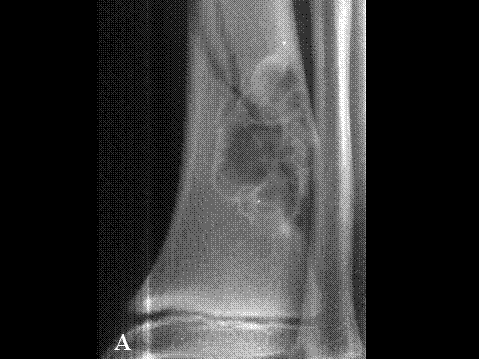
La Displasia osteofibrosa ( OFD) ( 21) es una lesión fibroósea de crecimiento autolimitado caracterizada por afectar la cortical ósea de la cara anterior de la porción media de la diáfisis de la tibia durante la primera infancia y niñez pero también se ha referido en neonatos. Dicha lesión es rara después de los 15 años. Aunque su localización más frecuente es la tibia también ocurre en peroné, cúbito y radio. Las lesiones de la tibia pueden ser bilaterales o con afectación ipsilateral o contralateral del peroné.
Histológicamente, la DOF presenta característicamente trabéculas de hueso neoformado que a diferencia de las de la DF se encuentran rodeadas por un ribete de osteoblastos (Fig.47), un hecho que indujo a ser denominada fibroma osificante de los huesos largos ( 22). Otra característica distintiva es que la lesión presenta un patrón zonal: El centro es predominantemente fibroso en tanto que en la perifería hay más hueso neoformado, patrón que no tiene la DF. La característica más distintiva de la DOF es que se encuentran en el estroma, en el 93 % de los casos, células, aisladas y dispersas, que no muestran características citológicas epiteliales, que son queratina positivas ( Fig-48). A las lesiones en que dichas células son más abundantes se las ha denominado “ DOF adamantinoma-like”. La DOF se la ha relacionado con el adamantinoma de los huesos largos, que es un tumor epitelial que contiene tejido fibroóseo idéntico al de la DOF y que ocurre casi exclusivamente en la tibia.
Radiológicamente la DOF presenta radiolucencias intracorticales, multiloculares, rodeadas generalmente de hueso escleroso, que se encuentran casi siempre centradas en el córtex anterior de la diáfisis ( Fig-49). Las lesiones pueden ser pequeñas ( 1cm) , pudiendo permanecer estacionarias o evolucionar agrandándose hasta poder llegar a afectar la mayor parte de la diáfisis tibial.
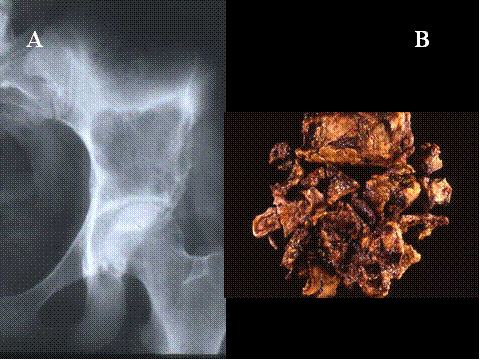
El Quiste óseo aneurismático (QOA) y el Quiste óseo simple (QOS) también contienen característicamente células gigantes multinucleadas de tipo osteoclástico. El QOA es una lesión ósea quística benigna que presenta macroscópicamente cavidades ocupadas por sangre que se corresponde histológicamente con lagos sanguineos separados por septos conectivos que contienen fibroblastos, células gigantes de tipo osteoclástico y hueso reactivo inmaduro ( Fig-50). El QOA puede producirse “de novo” o secundariamente a una lesión preexistente, más comunmente a un TCG, OB, CB o DF y tambien sarcomas óseos, especialmente el osteosarcoma. El QOA puede aparecer a cualquier edad pero es más frecuente en las dos primeras décadas de la vida. Se localiza preferentemente en la metáfisis de los huesos tubulares largos, principalmente femur, tibia y humero, en los elementos posteriores de los cuerpos vertebrales, pero pueden desarrollarse en cualquier hueso. Radiológicamente, presentan una lesión osteolitica, excentrica y expansiva, de márgenes bien definidos, y la mayoría de ellos tienen una delgada cáscara de hueso reactivo subperióstico ( Fig-51 y Fig-52). Las imágenes de TAC y RM muestran septos internos y niveles típicos de líquido-líquido.
El QOA es una lesión benigna pero que puede recidivar tras el curetaje en más del 20% de los casos. Se han referido casos de regresión espóntánea tras una excisión incompleta y de aparente transformación maligna.
El Quiste óseo solitario (Quiste óseo esencial o simple) es un quiste intramedular, unilocular relleno con un líquido seroso o serosanguinolento. La superficie interna de la cavidad quística presenta crestas que separan zonas deprimidas revestidas por una fina membrana y septos incompletos. Histológicamente el revestimiento de la superficie interna y septos consiste en tejido conectivo con escasas y dispersas células gigantes de tipo osteoclástico, macrófagos con pigmento de hemosiderina y depósistos de fibrina o de líquido plasmático coagulado y mineralizado que se asemejan al cemento. Generalmente existe hueso neoformado en la porción externa de la membrana del quíste ( Fig-53).
El QOS se descubre en el 85% de los casos en las 2 primeras décadas de la vida, es má frecuente en varones ( 3:1), y se localiza preferentemente en la región diafiso-metafisaria de los huesos tubulares largos, especialmente en las proximales del húmero, femur y tibia. En pacientes de más edad ocurren también comunmente en la pelvis y el calcáneo.
Radiológicamente, la lesión es radiolúcida, eventualmente septada, esta localizada centralmente y con nula o escasa expansión del hueso. La cortical generalmente está adelgazada y erosionada pero intacta, en tanto no se hay producido una fractura patológica (Fig.54). En los huesos tubulares largos la lesión progresa hacia la diáfisis con la edad. En 20-30% de los pacientes se producen recidivas, especialmente en niños.
El Granuloma eosinófilo (EO) sabemos hoy que es una proliferación neoplásica de células de Langerhans ( 23) por lo que el nombre apropiaddo es Histiocitosis de células de Langerhans. Sinónimos: Histiocitosis X; Granulomatosis de células de Langerhans. Histológicamente la lesión tiene un carácter granulomatoso consistiendo los granulomas en una mezla de células de Langerhans proliferantes y células inflamatorias en proporción variable, incluyendo gran número de eosinófilos, histiocitos comunes, macrófagos, linfocitos y células plasmáticas.Pueden también encontrarse células gigantes de tipo osteoclástico y macrófagos cargados de lípidos. El diagnóstico se realiza reconociendo la presencia de células de Langerhans en la lesión, que son de mediano tamaño y presentan una membrana indistinta, citoplasma claro o eosinófilo, y poseen un núcleo oval, frecuentemente indentado, de contorno irregular que típicamente posee hendiduras nucleares ( Fig-55). El inmunofenotipo de la célula de Langerhans es característico: Expresión de CD1a membranosa y proteina S-100, en ambos patrones nuclear y membranoso y ultraestructuralmente se encuentra el el citoplasma celular característicamente granulos de Birbeck ( 23) ( Fig-56). Las células de Langerhans se encuentran en las lesiones óseas formando acúmulos o nidos, Es común encontrar necrosis lo cual no presupone una peor evolución ( 22).
El GE aparece en individuos de todas las edades, con una incidencia máxima en niños por debajo de 10 años, infrecuente en adultos y rara en ancianos. Puede ser solitario o múltiple, afectando varios sitios del esqueleto o de otros órganos, siendo mucho más común la enfermedad monostótica. La experiencia nos ha enseñado que cuando después de tratar un GE único, transcurren 8 meses sin que aparezca una segunda lesión, es extremadamente improbable que eso ocurra. Se han descrito variantes clínicas referidas como las enfermedades de Hand-Schüller-Christian y de Letterer-Siwe. Las lesiones esqueléticas se producen más frecuentemente en el cráneo, seguidas por el fémur, huesos pélvicos y mandíbula. En adultos la costilla es la localización más frecuente.
Radiológicamente ( Fig-57), las lesiones son líticas, bien delimitadas y generalmente asociadas a neoformación ósea, reactiva periostal. En el cráneo las lesiones se han descrito como representando “ un agujero en un agujero”, debido a la afectación de ambas tablas óseas, y en columna pueden provocar el colapso de una vértebra dando lugar a una “vértebra plana”. El pronóstico es muy bueno tanto en las formas monostóticas como poliostóticas.
La Enfermedad ósea de Paget es una enfermedad crónica caracterizada por un remoldeamiento óseo exagerado, no fisiológico, que afecta uno o varios lugares del esqueleto. Ocurre en individuos de edad avanzada, siendo excepcional en menores de 40 años, siendo las localizaciones más comunes el esqueleto axial (pelvis 80% de los casos; columna y cráneo) fémur y tibia e infrecuentes en costillas, peroné y huesos de manos y pies.
Histológicamente, cada foco de enfermedad de Paget evoluciona en una secuencia de cambios que se han dividido en tres fases: 1- Inicial, de reabsorcion ósea ( la fase caliente o florida) ; 2- fase en la que una rápida e intensa actividad osteoblástica equilibra la reabsorción ósea ( fase intermedia), y 3- estadio final, en la que la reabsorción ha cesado casi completamente, continuando la formación de hueso, dándo como resultado un hueso denso (fase fria). Las características histológicas de cada fase se correlacionan con los cambios radiológicos, y el diagnóstico en muchos casos se puede hacer con sólo las radiografías simples. La fase caliente se caracteriza histológicamente por el gran incremento del número de osteoclastos. Los osteoclastos del Paget son típicamente de mayor tamaño que los normales, contienen también un mayor número de núcleos, hasta 100 o más. Las características histológicas de esta fase se asemejan a los cambios óseos de hiperparatiroidismo secundario ( Fig-58)
. Radiológicamente el patrón es radiolúcido en la fase florida ( Fig-59). En los huesos largos, el primer cambio es un área de radiolucencia en forma de llamarada, en la metáfisis apuntando hacia la diáfisis. Al ritmo de aproximadamente 1cm por año la radiolucencia se extiende cómo una ola a la diáfisis llegando a veces a ocuparla enteramente.
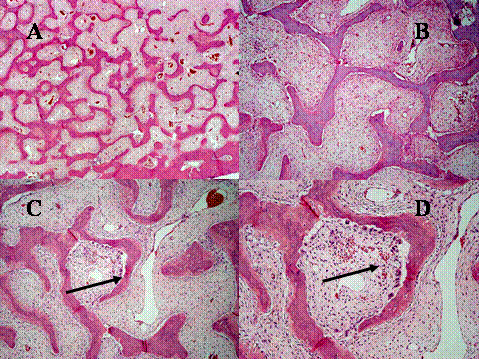 fiogf49gjkf0dFig.42- Displasia fibrosa. Lesión constituida por tejido fibroso en la que se produce hueso inmaduro metaplásico (woven bone) que conforma trabéculas gráciles de trayectos curvilíneos que producen un patrón de “letras chinas” (A y B). Las trabéculas óseas no aparecen bordeadas por osteoblastos ( aunque algunas si lo pueden estar) y el número de células gigantes multinucleadas es escaso ( C y D, flechas)."> fiogf49gjkf0dFig.42- Displasia fibrosa. Lesión constituida por tejido fibroso en la que se produce hueso inmaduro metaplásico (woven bone) que conforma trabéculas gráciles de trayectos curvilíneos que producen un patrón de “letras chinas” (A y B). Las trabéculas óseas no aparecen bordeadas por osteoblastos ( aunque algunas si lo pueden estar) y el número de células gigantes multinucleadas es escaso ( C y D, flechas).">
Fig-42 - fiogf49gjkf0d Fig.42- Displasia fibrosa. Lesión constituida por tejido fibroso en la que se produce hueso inmaduro metaplásico (woven bone) que conforma trabéculas gráciles de trayectos curvilíneos que producen un patrón de “letras chinas” (A y B). Las trabéculas óseas no aparecen bordeadas por osteoblastos ( aunque algunas si lo pueden estar) y el número de células gigantes multinucleadas es escaso ( C y D, flechas).
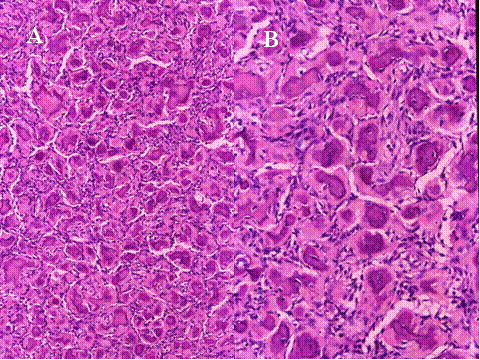 fiogf49gjkf0dFig.43- Displasia fibrosa. En algunas de estas lesiones el osteoide constituye formaciones redondeadas, que pueden calcificarse, presentando un aspecto semejante al cemento, constituyendo los llamados cementículos. Son frecuentes en los maxilares y raros en los huesos tubulares."> fiogf49gjkf0dFig.43- Displasia fibrosa. En algunas de estas lesiones el osteoide constituye formaciones redondeadas, que pueden calcificarse, presentando un aspecto semejante al cemento, constituyendo los llamados cementículos. Son frecuentes en los maxilares y raros en los huesos tubulares.">
Fig-43 - fiogf49gjkf0d Fig.43- Displasia fibrosa. En algunas de estas lesiones el osteoide constituye formaciones redondeadas, que pueden calcificarse, presentando un aspecto semejante al cemento, constituyendo los llamados cementículos. Son frecuentes en los maxilares y raros en los huesos tubulares.
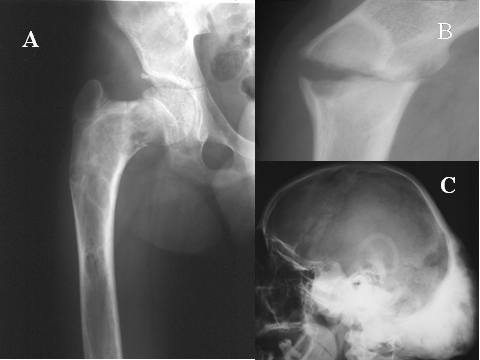 fiogf49gjkf0dFig.44- Displasia fibrosa Imágenes radiológicas. A) Displasia fibrosa poliostótica. Se observan lesiones líticas, situadas en el iliaco y en el fémur. El fémur presenta adelgazamiento de la cortical y fractura patológica del cuello, así como típica deformidad en varo o cayado de pastor. B) Lesión bien delimitada, rodeada de un anillo escleroso y con aumento de la densidad ósea en vidrio deslustrado. Fractura patológica. C) Lesión esclerosa en la base del cráneo y en el hueso occipital con expansión de la tabla externa."> fiogf49gjkf0dFig.44- Displasia fibrosa Imágenes radiológicas. A) Displasia fibrosa poliostótica. Se observan lesiones líticas, situadas en el iliaco y en el fémur. El fémur presenta adelgazamiento de la cortical y fractura patológica del cuello, así como típica deformidad en varo o cayado de pastor. B) Lesión bien delimitada, rodeada de un anillo escleroso y con aumento de la densidad ósea en vidrio deslustrado. Fractura patológica. C) Lesión esclerosa en la base del cráneo y en el hueso occipital con expansión de la tabla externa.">
Fig-44 - fiogf49gjkf0d Fig.44- Displasia fibrosa Imágenes radiológicas. A) Displasia fibrosa poliostótica. Se observan lesiones líticas, situadas en el iliaco y en el fémur. El fémur presenta adelgazamiento de la cortical y fractura patológica del cuello, así como típica deformidad en varo o cayado de pastor. B) Lesión bien delimitada, rodeada de un anillo escleroso y con aumento de la densidad ósea en vidrio deslustrado. Fractura patológica. C) Lesión esclerosa en la base del cráneo y en el hueso occipital con expansión de la tabla externa.
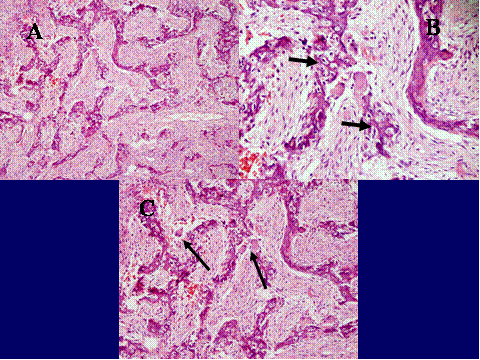 fiogf49gjkf0dFig.45- Fibroma osificante de los maxilares. A,B, y C). Tumor constituido por un tejido fibroso, poco celular y trabéculas óseas producidas por osteoblastos (flechas) y escasa células gigantes multinucleadas de poco tamaño (flechas)."> fiogf49gjkf0dFig.45- Fibroma osificante de los maxilares. A,B, y C). Tumor constituido por un tejido fibroso, poco celular y trabéculas óseas producidas por osteoblastos (flechas) y escasa células gigantes multinucleadas de poco tamaño (flechas).">
Fig-45 - fiogf49gjkf0d Fig.45- Fibroma osificante de los maxilares. A,B, y C). Tumor constituido por un tejido fibroso, poco celular y trabéculas óseas producidas por osteoblastos (flechas) y escasa células gigantes multinucleadas de poco tamaño (flechas).
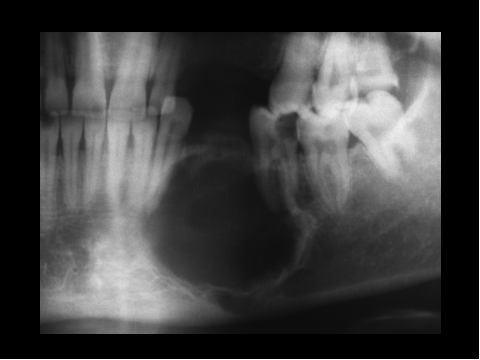 fiogf49gjkf0dFig.46- Fibroma osificante de los maxilares. Radiología de fibroma osificante mandibular que muestra una lesión lítica, geográfica, de contornos bien delimitados esclerosos, con ausencia de piezas dentarias y compresión de las raíces vecinas."> fiogf49gjkf0dFig.46- Fibroma osificante de los maxilares. Radiología de fibroma osificante mandibular que muestra una lesión lítica, geográfica, de contornos bien delimitados esclerosos, con ausencia de piezas dentarias y compresión de las raíces vecinas.">
Fig-46 - fiogf49gjkf0d Fig.46- Fibroma osificante de los maxilares. Radiología de fibroma osificante mandibular que muestra una lesión lítica, geográfica, de contornos bien delimitados esclerosos, con ausencia de piezas dentarias y compresión de las raíces vecinas.
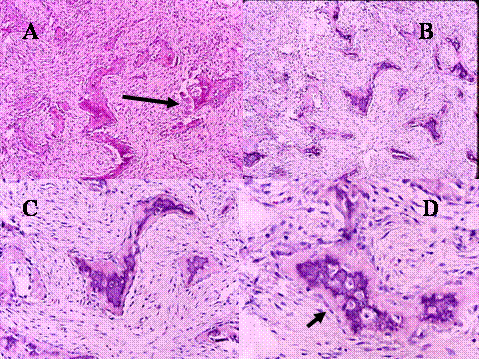 fiogf49gjkf0dFig.47- Displasia osteofibrosa. A,B,C y D. Lesión consistente en una proliferación fibrosa, que sustituye al hueso normal, en la que se producen trabéculas óseas, gráciles e irregulares, bordeadas por osteoblastos (flechas cortas) y con escasa células gigantes multinucleadas (flechas largas)."> fiogf49gjkf0dFig.47- Displasia osteofibrosa. A,B,C y D. Lesión consistente en una proliferación fibrosa, que sustituye al hueso normal, en la que se producen trabéculas óseas, gráciles e irregulares, bordeadas por osteoblastos (flechas cortas) y con escasa células gigantes multinucleadas (flechas largas).">
Fig-47 - fiogf49gjkf0d Fig.47- Displasia osteofibrosa. A,B,C y D. Lesión consistente en una proliferación fibrosa, que sustituye al hueso normal, en la que se producen trabéculas óseas, gráciles e irregulares, bordeadas por osteoblastos (flechas cortas) y con escasa células gigantes multinucleadas (flechas largas).
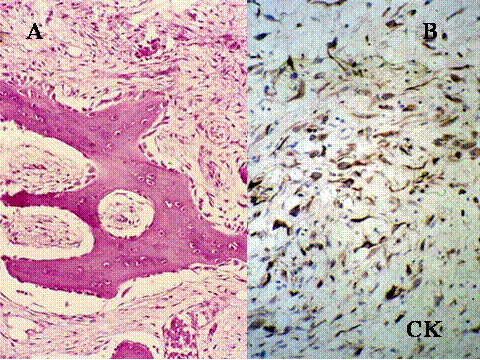 fiogf49gjkf0dFig.48- Displasia osteofibrosa. En el tejido fibroso se encuentran células de aspecto mesenquimal que son positivas con la inmunotinción para citoqueratina."> fiogf49gjkf0dFig.48- Displasia osteofibrosa. En el tejido fibroso se encuentran células de aspecto mesenquimal que son positivas con la inmunotinción para citoqueratina.">
Fig-48 - fiogf49gjkf0d Fig.48- Displasia osteofibrosa. En el tejido fibroso se encuentran células de aspecto mesenquimal que son positivas con la inmunotinción para citoqueratina.
 fiogf49gjkf0dFig.49- Radiografía de displasia osteofibrosa tibial. Extensa lesión de tipo mixto, lítica y en mayor medida esclerosa, que afecta a la región anterior del tercio medio de la diáfisis tibial."> fiogf49gjkf0dFig.49- Radiografía de displasia osteofibrosa tibial. Extensa lesión de tipo mixto, lítica y en mayor medida esclerosa, que afecta a la región anterior del tercio medio de la diáfisis tibial.">
Fig-.49 - fiogf49gjkf0d Fig.49- Radiografía de displasia osteofibrosa tibial. Extensa lesión de tipo mixto, lítica y en mayor medida esclerosa, que afecta a la región anterior del tercio medio de la diáfisis tibial.
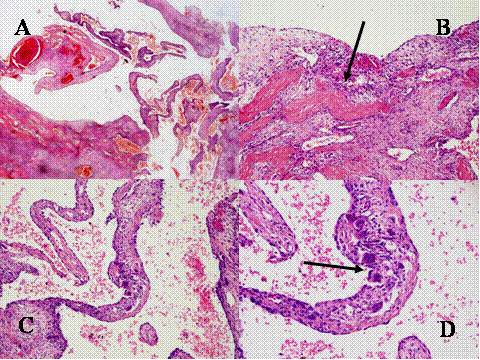 fiogf49gjkf0dFig.50- Quiste óseo aneurismático. A) Amplias cavidades separadas por septos de variable grosor y frecuentemente incompletos. B) En las paredes y septos se produce deposito de osteoide (flecha) y neoformación ósea en proporciones muy variables y se encuentran abundantes células gigantes multinucleadas de tipo osteoclástico (flechas)."> fiogf49gjkf0dFig.50- Quiste óseo aneurismático. A) Amplias cavidades separadas por septos de variable grosor y frecuentemente incompletos. B) En las paredes y septos se produce deposito de osteoide (flecha) y neoformación ósea en proporciones muy variables y se encuentran abundantes células gigantes multinucleadas de tipo osteoclástico (flechas).">
Fig-50 - fiogf49gjkf0d Fig.50- Quiste óseo aneurismático. A) Amplias cavidades separadas por septos de variable grosor y frecuentemente incompletos. B) En las paredes y septos se produce deposito de osteoide (flecha) y neoformación ósea en proporciones muy variables y se encuentran abundantes células gigantes multinucleadas de tipo osteoclástico (flechas).
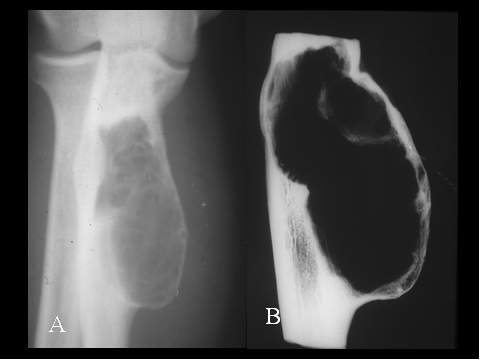 fiogf49gjkf0dFig.51- Quiste óseo aneurismático. Radiografías A) del paciente y B) de la pieza quirúrgica. Se observa lesión lítica, geográfica, excéntrica, situada en el extremo proximal del cúbito,con septos finos en su interior, de contornos bien delimitados, que adelgaza e insufla marcadamente la cortical medial del cúbito."> fiogf49gjkf0dFig.51- Quiste óseo aneurismático. Radiografías A) del paciente y B) de la pieza quirúrgica. Se observa lesión lítica, geográfica, excéntrica, situada en el extremo proximal del cúbito,con septos finos en su interior, de contornos bien delimitados, que adelgaza e insufla marcadamente la cortical medial del cúbito.">
Fig-51 - fiogf49gjkf0d Fig.51- Quiste óseo aneurismático. Radiografías A) del paciente y B) de la pieza quirúrgica. Se observa lesión lítica, geográfica, excéntrica, situada en el extremo proximal del cúbito,con septos finos en su interior, de contornos bien delimitados, que adelgaza e insufla marcadamente la cortical medial del cúbito.
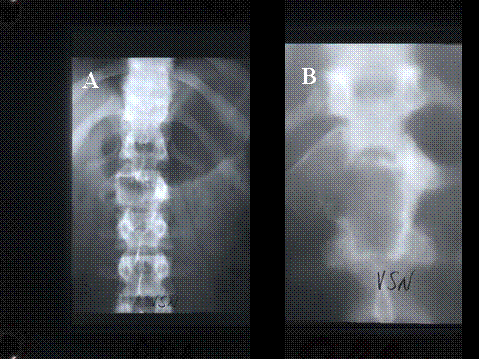 fiogf49gjkf0dFig.52- Quiste óseo aneurismático de columna. A) Radiografía simple AP y B) tomografía convencional de columna lumbar. Se observa lesión lítica, geográfica, que afecta a la mitad derecha del cuerpo vertebral, al pedículo y a la apófisis transversa derechos y a la apófisis espinosa, produciendo gran insuflación de las apófisis."> fiogf49gjkf0dFig.52- Quiste óseo aneurismático de columna. A) Radiografía simple AP y B) tomografía convencional de columna lumbar. Se observa lesión lítica, geográfica, que afecta a la mitad derecha del cuerpo vertebral, al pedículo y a la apófisis transversa derechos y a la apófisis espinosa, produciendo gran insuflación de las apófisis.">
Fig-52 - fiogf49gjkf0d Fig.52- Quiste óseo aneurismático de columna. A) Radiografía simple AP y B) tomografía convencional de columna lumbar. Se observa lesión lítica, geográfica, que afecta a la mitad derecha del cuerpo vertebral, al pedículo y a la apófisis transversa derechos y a la apófisis espinosa, produciendo gran insuflación de las apófisis.
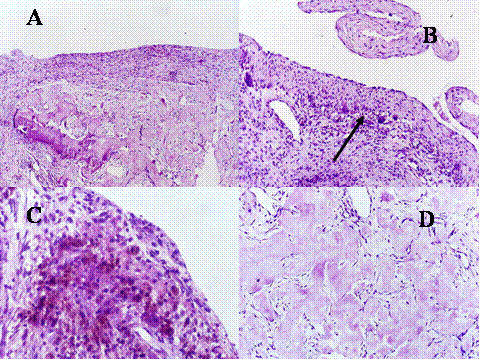 fiogf49gjkf0dFig.53- Quiste óseo simple. La pared del quiste consiste en una estrecha membrana A), formada por tejido fibroso que contiene histiocitos y células gigantes multinucleadas (B, flechas). Los histiocitos frecuentemente contienen hemosiderina (C). D) Depósitos de una substancia amorfa que recuerda al cemento, producida por la coagulación de plasma extravasado, constituye un hallazgo característico."> fiogf49gjkf0dFig.53- Quiste óseo simple. La pared del quiste consiste en una estrecha membrana A), formada por tejido fibroso que contiene histiocitos y células gigantes multinucleadas (B, flechas). Los histiocitos frecuentemente contienen hemosiderina (C). D) Depósitos de una substancia amorfa que recuerda al cemento, producida por la coagulación de plasma extravasado, constituye un hallazgo característico.">
Fig-53 - fiogf49gjkf0d Fig.53- Quiste óseo simple. La pared del quiste consiste en una estrecha membrana A), formada por tejido fibroso que contiene histiocitos y células gigantes multinucleadas (B, flechas). Los histiocitos frecuentemente contienen hemosiderina (C). D) Depósitos de una substancia amorfa que recuerda al cemento, producida por la coagulación de plasma extravasado, constituye un hallazgo característico.
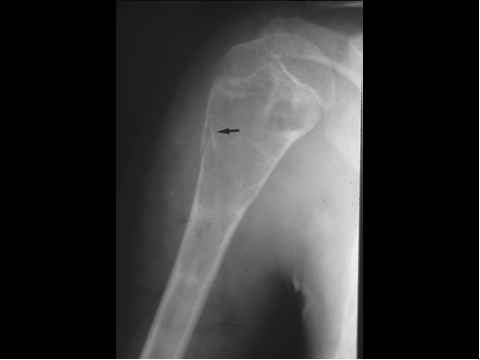 fiogf49gjkf0dFig.54 -Quiste óseo simple. Radiografía simple de quiste óseo simple humeral Lesión lítica, geográfica, que insufla y adelgaza la cortical, situada en la región metafisaria proximal, en contacto con el cartílago de crecimiento. Presenta pequeña fractura cortical, con un fragmento óseo libre (flecha) y finos septos en su interior."> fiogf49gjkf0dFig.54 -Quiste óseo simple. Radiografía simple de quiste óseo simple humeral Lesión lítica, geográfica, que insufla y adelgaza la cortical, situada en la región metafisaria proximal, en contacto con el cartílago de crecimiento. Presenta pequeña fractura cortical, con un fragmento óseo libre (flecha) y finos septos en su interior.">
Fig-54 - fiogf49gjkf0d Fig.54 -Quiste óseo simple. Radiografía simple de quiste óseo simple humeral Lesión lítica, geográfica, que insufla y adelgaza la cortical, situada en la región metafisaria proximal, en contacto con el cartílago de crecimiento. Presenta pequeña fractura cortical, con un fragmento óseo libre (flecha) y finos septos en su interior.
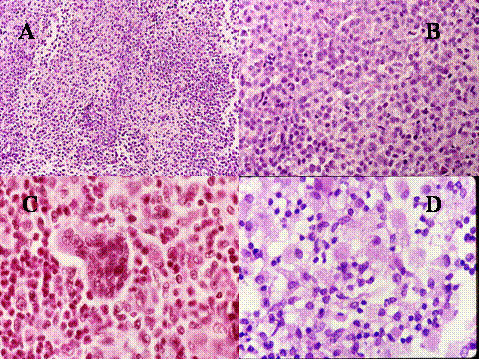 fiogf49gjkf0dFig. 55- Granuloma eosinófilo. Consiste en una proliferación de carácter granulomatoso de células de Langerhans entremezcladas con células de la inflamación (A y B), en la que se encuentran abundantes eosinófilos y células gigantes multinucleadas en proporción variable (C) e histiocitos (D) que en ocasiones pueden aparecer cargados de lípidos."> fiogf49gjkf0dFig. 55- Granuloma eosinófilo. Consiste en una proliferación de carácter granulomatoso de células de Langerhans entremezcladas con células de la inflamación (A y B), en la que se encuentran abundantes eosinófilos y células gigantes multinucleadas en proporción variable (C) e histiocitos (D) que en ocasiones pueden aparecer cargados de lípidos.">
Fig-55 - fiogf49gjkf0d Fig. 55- Granuloma eosinófilo. Consiste en una proliferación de carácter granulomatoso de células de Langerhans entremezcladas con células de la inflamación (A y B), en la que se encuentran abundantes eosinófilos y células gigantes multinucleadas en proporción variable (C) e histiocitos (D) que en ocasiones pueden aparecer cargados de lípidos.
 fiogf49gjkf0dFig.56- Granuloma eosinófilo. A) Inmunotinción de células de Langerhans. Con inmunosuero CD1a. B) Microscopía electrónica en la que se observan los gránulos de Birbeck."> fiogf49gjkf0dFig.56- Granuloma eosinófilo. A) Inmunotinción de células de Langerhans. Con inmunosuero CD1a. B) Microscopía electrónica en la que se observan los gránulos de Birbeck.">
Fig-56 - fiogf49gjkf0d Fig.56- Granuloma eosinófilo. A) Inmunotinción de células de Langerhans. Con inmunosuero CD1a. B) Microscopía electrónica en la que se observan los gránulos de Birbeck.
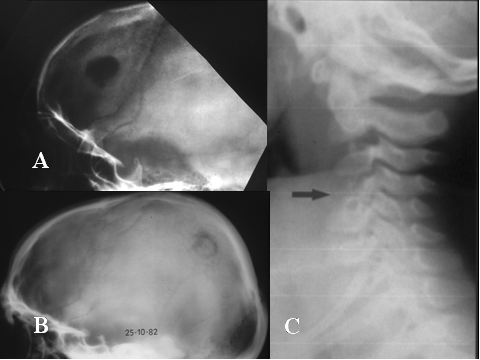 fiogf49gjkf0dFig.57- Radiología de granuloma eosinófilo. A) lesión lítica, geográfica, de bordes bien delimitados, situada en la región frontal. B) Granuloma eosiófilo con foco escleroso intralesional, correspondiente a secuestro óseo.C) Radigrafía lateral lateral de columna cervical que muestra aplastamiento del cuerpo vertebral de C4, que en niños es muy sugestiva de granuloma eosinófilo."> fiogf49gjkf0dFig.57- Radiología de granuloma eosinófilo. A) lesión lítica, geográfica, de bordes bien delimitados, situada en la región frontal. B) Granuloma eosiófilo con foco escleroso intralesional, correspondiente a secuestro óseo.C) Radigrafía lateral lateral de columna cervical que muestra aplastamiento del cuerpo vertebral de C4, que en niños es muy sugestiva de granuloma eosinófilo.">
Fig-57 - fiogf49gjkf0d Fig.57- Radiología de granuloma eosinófilo. A) lesión lítica, geográfica, de bordes bien delimitados, situada en la región frontal. B) Granuloma eosiófilo con foco escleroso intralesional, correspondiente a secuestro óseo.C) Radigrafía lateral lateral de columna cervical que muestra aplastamiento del cuerpo vertebral de C4, que en niños es muy sugestiva de granuloma eosinófilo.
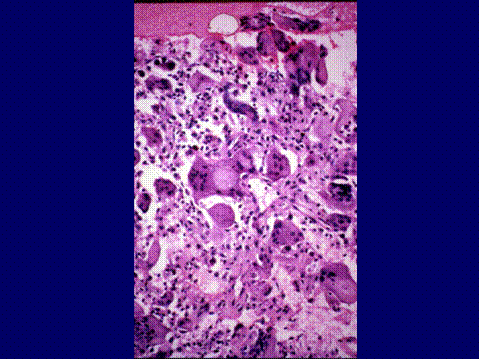 fiogf49gjkf0dFig.58- Enfermedad de Paget en fase florida con abundantes células gigantes multinucleadas de tipo osteoclástico."> fiogf49gjkf0dFig.58- Enfermedad de Paget en fase florida con abundantes células gigantes multinucleadas de tipo osteoclástico.">
Fig-58 - fiogf49gjkf0d Fig.58- Enfermedad de Paget en fase florida con abundantes células gigantes multinucleadas de tipo osteoclástico.
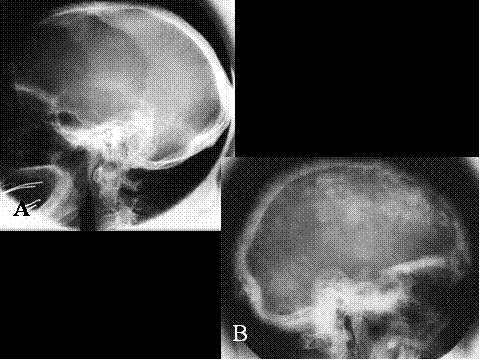 fiogf49gjkf0dFig.59-.Radiología de enfermedad de Paget de bóveda craneal. A) Lesión lítica geográfica de bordes bien definidos, en la región fronto parietal, típica de la fase púramente osteolítica, llamada osteoporosis circunscrita. B) Cráneo algodonoso. Se observan múltiples focos esclerosos y áreas líticas, típicos de la fase mixta."> fiogf49gjkf0dFig.59-.Radiología de enfermedad de Paget de bóveda craneal. A) Lesión lítica geográfica de bordes bien definidos, en la región fronto parietal, típica de la fase púramente osteolítica, llamada osteoporosis circunscrita. B) Cráneo algodonoso. Se observan múltiples focos esclerosos y áreas líticas, típicos de la fase mixta.">
Fig-59 - fiogf49gjkf0d Fig.59-.Radiología de enfermedad de Paget de bóveda craneal. A) Lesión lítica geográfica de bordes bien definidos, en la región fronto parietal, típica de la fase púramente osteolítica, llamada osteoporosis circunscrita. B) Cráneo algodonoso. Se observan múltiples focos esclerosos y áreas líticas, típicos de la fase mixta.
|
|
Bibliografía
1.-Bertoni F, Present D, Enneking WF (1985). Giant dell tumor of bone with pulmonary metastase.J Bone Joint Surg (Am), 67:890-900.
2.-Martinez-Tello FJ, Calvo-Asensio N, Loizaga-Iriondo JM, López-Barea F, Pérez-Villanueva F (1998). Tumor de células gigantes del hueso: estudio clinico-patológicode 140 casos con evaluación de los factores pronósticos. Rev Esp Patol 31:353-364.
3.-Nascimento AG, Huvos AG, Marcove RC (1979). Primary malignant giant cell tunor of bone: a study of eight cases and review of the literature. Cancer 44: 1393-1402.
4.-Hutter RVP, Foote FW, Frazell EL, Francis KC. (1963). Giant´s cell tumors complicating Paget´s disease of bone. Cancer 16:1044-1056.
5.-Kyriakos M, Land VJ, Peuning HC, Parker SG (1985), Metastatic chondroblastoma. Report of a fatal case with a review of the literature on atypical, aggressive, and malignant chondroblastoma. Cancer, 55: 1770-1789.
6.-Schajowicz F, Donato de Próspero J, Constantino E (1990). Case report 641. Chondroblastoma-like osteosarcoma. Skeletal Radiol, 19: 603-606.
7.-Jaffe HL (1953). Giant cell reparative granuloma, traunatic bone cyst, and fibrous (fibro-osseous) dysplasia of the jaw bone. Oral Surg Oral Med Oral Pathol, 6: 159-175.
8.-Ackerman LV, Spjut HJ eds. (1971) Tumors of bone and cartilage. Atlas of tumor pathology, 2 nd series, fasc 5.
9.-Lorenzo JC, Dorfman HD (1980). Giant cell reparative granuloma of the short tubular bones of the hands and feet. Am J Surg Pathol, 4: 551-563.
10.-Sanerkin NG, Mott MG, Roylance J (1983). An unusual intraoseous lesion with fibroblastic, osteoclastic, osteoblastic, aneurysmal and fibromyxoid elements: solid variant of aneurysmal bone cyst, Cancer, 51: 2278-2286.
1 1.-Dorfman HD, Czerniak B, eds (1998). Bone and soft tissue tumors. St Louis. Mosby. Pag. 598.
1 2.-Santos-Briz A, Lobato RD, Ramos A, Mºillán JM, Ricoy JR, Martínez-Tello FJ (2003). Giant cell reparative granuloma of the occipital bone, 32: 151-155.
1 3.-Martínez-Tello FJ, Manjón-Luengo P, Martin-Pérez M, Montes-Moreno S (2005). Cherubism associated with neurofibromatosis type 1, and multiple osteolytic lesions of both femurs: A previously undescribed association of findings. Skeletal Radiol en prensa.
1 4.-Gorlin RJ, Cohen MM Jr. Levin S (1990). Syndromes of the head and neck. 3 rd ed. Oxford: Oxford university Press, pags.. 392-399.15-
1 5.-Yamaguchi T, Dorfman HD, Eisig S (1999). Cherubism: clinicopathologic features. Skeletal Radiol. 28: 350-352.
1 6.-Standish S, Horlin RJ (1979). Bone disorders affecting th jaws. In Thoma´s oral pathology. Gorlin RJ, Goldman HL, eds. 6ª ed. St Louis Mosby, pp 542-546.
1 7.-Bathurst N, SanerkinN, Watt Y (1986) Osteoclast-rich osteosarcoma. Br J Radiol, 59: 667-6
1 8.-Marin C, Gallego C, Manjón P, Martínez-Tello FJ: (1997).Juxtacortical chondromyxoid fibroma : imaging findings in three cases and a review of the literature. Skeletal Radiol 26: 636-641, 1997.
1 9.-Su L. Weathers DR, Waldron CA (1997). Distinguishing features of focal cemento-osseous dysplasias and cemento-ossifyin fibronas I. A pathologic spectrum of 316 cases. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 84: 301-309.
20.-Brannon RB, Fowler CB ( 2001). Benign fibro-osseous lesios: A review of current concepts. Advances in Anat Pathol. 8: 126-143.
2 1.-Campanacci M, Laus M (1981). Osteofibrous dysplasia of the tibia and fibula. J Bone Joint Surg Am. 63: 367-375
2 2.-Kempson RL (1966). Ossifying fibroma of the long bones; a light and electron microscopic study. Arch Pathol. 82: 218-233.
2 3.-De Young BR, Unni KK (2002). Langerhans cell histiocytosis. En Tumours of soft tissue and bones. Fletcher CDM, Unni KK, Mertens F. Eds. IARCPress, Lyon, pags. 345-346.
|
|



