|
Resumen
fiogf49gjkf0d INTRODUCCIÓN
La interpretación, diagnóstico e informe de las biopsias de médula ósea sigue planteando numerosos problemas a los patólogos en nuestro medio, sobre todo en aquéllos centros de tipo general en los que estas muestras no se reciben con la suficiente frecuencia como para permitir al patólogo familiarizarse con su estudio. A esto hay que sumar el hecho de que en muchos países, como es el caso de España, el diagnóstico hematológico está dividido entre varios laboratorios y descansa sobre todo en el estudio de extensiones de aspirados de médula ósea, a los que se aplican criterios de tipo cuantitativo y morfológico que en general no pueden aplicarse a las biopsias. Esto provoca a veces situaciones de confusión entre los responsables del diagnóstico de unas y otras muestras que buscan aplicar los mismos criterios e ideas a ambas, sin darse cuenta de que las dos ofrecen informaciones complementarias, que deben ser interpretadas con diferentes metodologías, y que el diagnóstico debe descansar conjuntamente en los datos que ofrecen tanto los aspirados como los cortes histológicos.
En otros países es habitual que el diagnóstico de ambas muestras se lleva a cabo en un único laboratorio que las evalúa conjuntamente y, de hecho, muchos textos sobre esta materia abarcan tanto el diagnóstico de extensiones como de biopsias. Es una opinión generalizada entre los hematopatólogos, que un patólogo con dedicación a este campo debe conocer bien los aspectos citológicos de la médula ósea. Sin embargo, en esta conferencia mi propósito es ofrecer una visión global de la metodología de estudio y análisis morfológico de las biopsia de médula ósea dedicado a patólogos generales no expertos en el tema y con la idea de que les sirva de orientación para saber el sentido y alcance del diagnóstico histológico en esta patología y, así, cuando se reúnan con el clínico para examinar sus casos puedan llegar a elaborar sus dictámenes de la forma más beneficiosa para sus pacientes.
En este breve escrito abordaré aspectos referentes a la sistemática de estudio de las biopsias de médula ósea y expondré mis puntos de vista acerca de esta metodología y del alcance y limitaciones que el estudio de cortes histológicos tiene para el diagnóstico de los procesos hematológicos. Un detalle de gran importancia que no debe olvidarse a lo largo de esta exposición, que los patólogos debemos recordar siempre, es que el peso del diagnóstico de muchos procesos hematológicos, incluyendo muchas hemopatías malignas, no pivota necesariamente, como sucede en general en oncología, en el estudio histológico de una biopsia. Esto es así a veces (aspirados secos, ciertas hemopatías, etc.) pero en la mayor parte de los casos la biopsia de médula ofrece otro tipo de información de gran valor. Por estos motivos es necesaria siempre una estrecha colaboración entre patólogo y clínico y, por supuesto, que el patólogo conozca bien la clínica hematológica y, por supuesto, la de sus pacientes. Esta necesidad general de correlación clínica del diagnóstico histológico es mucho más patente en este campo de la patología que en otros.
|
|
Requisitos y tecnicas
fiogf49gjkf0d
En patología de la médula ósea es preciso conjugar rapidez y precisión técnica. Los pacientes presentan muchas veces cuadros clínicos agudos y graves, que precisan una evaluación diagnóstica rápida, la cual en ocasiones descansa solo en la opinión del patólogo por no obtenerse aspirado o por otros motivos. Por ello es preciso poner a punto sistemas de procesamiento que permitan obtener cortes de calidad suficiente en el menor tiempo posible.
El procesamiento técnico óptimo de las biopsias óseas es un requisito imprescindible. La mayor parte de los errores o dificultades de interpretación de las biopsias se deben a problemas de este tipo. En realidad no es necesario recurrir a procedimientos sofisticados para obtener buenos resultados y las técnicas necesarias están al alcance de cualquier laboratorio de patología quirúrgica general.
Uno de los principales objetivos es obtener cortes válidos para diagnóstico rápidamente, a ser posible en las 24 horas siguientes a la recepción de la muestra. Para ello es necesario llevar a cabo la fijación y descalcificación de manera óptima y rápida. Pueden utilizarse múltiples fijadores. El formol tamponado es válido y permite aplicar sobre las biopsias todo tipo de técnicas auxiliares pero sus resultados morfológicos sobre este tipo de material son inferiores a los que da en otras piezas, y la evaluación morfológica es capital en esta patología. Un fijador ampliamente utilizado es el B5 pero en mi opinión endurece en exceso los cilindros y dificulta la inmunohistoquímica. En nuestro laboratorio utilizamos Bouin con ácido acético al 3-4% son excelentes resultados para todas las técnicas, incluida la inmunohistoquí mica. Con ambos se obtiene una fijación correcta en 2-4 horas según el tamaño de la biopsia. Es muy importante tener en cuenta que tanto el B5 como el Bouin imposibilitan la realización de técnicas moleculares al interferir directamente con el ADN.
La correcta descalcificación es un aspecto fundamental. Es preciso evitar los ácidos inorgánicos, en especial el formol nítrico, que altera profundamente la morfología y dificulta sobremanera la inmunohistoquímica. En nuestro laboratorio utilizamos un preparado de formol y ácido fórmico (Decalcifier II® de la marca Surgipath®) tras la fijación en Bouin que nos da excelentes resultados. En otros laboratorios se utilizan otros ácidos orgánicos e incluso EDTA aunque este último es de acción más lenta. La descalcificación suave puede estar completada en 2-3 horas tras la fijación con lo que a las 4-6 horas de la recepción de la muestra (en el caso de que se reciba en fresco) ésta puede pasar al procesador de forma que se obtienen cortes para evaluación al día siguiente. Nosotros realizamos siempre a todas las biopsias técnicas de H&E, PAS, Giemsa, Hierro y Reticulina. El Giemsa es para nosotros la más útil e importante de todas ellas.
Siempre se recomienda incluir junto con el cilindro los grumos medulares que suelen remitirse junto con él. En mi opinión esto es más por seguridad (y también por tradición) que por razones prácticas ya que este tipo de material tiene escasa o nula utilidad en histología. Por una parte si se obtienen grumos lo lógico es realizar extensiones con ellos por lo que los responsables de la evaluación citológica obtendrán siempre mejor información que en un corte histológico. Por otra parte este tipo de material refleja solo aspectos parciales de la médula ósea y no puede ser considerado de ningún modo como algo equivalente a ella. Por ejemplo no contienen estroma, no reflejan la arquitectura medular, no siempre contienen todos los elementos presentes en la médula y así una larga relación de diferencias. Por tanto los patólogos no debemos basar nuestros diagnósticos en la evaluación de grumos medulares y en mi opinión sólo debemos utilizarlos como complemento de la información de los cilindros de biopsia y nunca para reemplazarlos, empleando en su examen el mínimo tiempo imprescindible. En casos de cilindros insatisfactorios debe darse el diagnóstico de “biopsia insuficiente” y pedir una nueva biopsia antes que basar su diagnóstico en los grumos acompañantes.
La técnica auxiliar más importante y útil es la inmunohistoquímica y aquí nos referiremos exclusivamente a ella. Con el esquema anterior de procesamiento se pueden utilizar prácticamente todos los anticuerpos que se utilizan en patología quirúrgica por lo que los mismos paneles que se utilizan para linfomas, tumores metastáticos y otras patologías son utilizables en médula ósea sin necesidad de rutinas especiales. Únicamente hay que tener en cuenta el poco tiempo de fijación para ajustar los tiempos de desenmascaramiento por calor que, lógicamente, es por lo habitual menor. Las trabéculas óseas suelen desprenderse al calentar lo que no debe constituir un impedimento para la técnica.
En ocasiones es posible obtener cortes en congelación de cilindros sin descalcificar pero esto depende sobre todo de las condiciones particulares de cada caso y no puede por tanto utilizarse como técnica de rutina. En mi experiencia es posible solo cuando la médula está muy infiltrada y con la condición de mantener la temperatura del cilindro y de la cámara del criostato muy bajas para que la dureza del OCT sea considerable (comparable a la del hueso) de forma que puedan obtenerse cortes. Por supuesto siempre es posible obtener cortes en congelación de grumos de médula ósea pero hay que tener en cuenta las limitaciones propias de este tipo de material.
Además de los anticuerpos habituales para linfomas y patología general son muy útiles otros específicos para el estudio de las series hematopoyéticas y otros componentes medulares. En mi opinión los más útiles son la Glicoforina A para la serie eritroide, la mieloperoxidasa para la mielopoyesis y CD61 para la serie megacariocítica. Como en el resto de la patología no existe una receta mágica y existen otras moléculas que pueden utilizarse para los mismos fines. En algunos laboratorios se utiliza la hemoglobina en vez de la glicoforina; en este caso la tinción es citoplasmática en vez de membranosa como con la glicoforina y al igual que con esta es muy importante limitar la evaluación a los elementos nucleados. También puede utilizarse el antígeno asociado al FVIII para la serie megacariocítica pero en ese caso hay que tener en cuenta su menor sensibilidad. En nuestro laboratorio usamos la Glicoforina A para la serie roja junto a CD61 y Ag. asociado al FVIII para la megacariopoyesis y mieloperoxidasa para la mielopoyesis. Introducimos además de forma rutinaria CD34 para valorar los elementos inmaduros teniendo en cuenta que no todos los blastos son siempre CD34+. Para las leucemias agudas mieloides utilizamos además en panel mieloperoxidasa junto a KP-1 (CD68) ó PG-M1 (otro epítopo de CD68) y HAM56, que junto a CD34 permiten evaluar el grado de diferenciación mieloide en biopsias incluidas en parafina lo que es muy útil cuando el aspirado es seco y no se dispone de material para citología o citometría de flujo.
Los cilindros de biopsia ósea permiten aplicar técnicas moleculares, en especial PCR y FISH, siempre que se hayan empleado sistemas de fijación y descalcificación adecuados para ellas. En la práctica esto se limita a casos en los que no haya sido posible obtener aspirado por fibrosis o empaquetamiento del tejido medular ya que, en caso de obtenerse, tanto para la PCR como para el FISH los resultados son mejores y más reproducibles si se realizan sobre aspirados y extensiones respectivamente. En caso de aspirado seco es recomendable obtener extensiones por rodamiento del cilindro para FISH además de realizar la técnica sobre cortes histológicos y si es necesario extraer ADN para PCR es mejor siempre partir del cilindro en fresco sin fijar.
|
|
Valoración
fiogf49gjkf0d
La evaluación sistemática y rigurosa de los parámetros morfológicos presentes en las biopsias de médula ósea es esencial para no pasar por alto hallazgos de interés y alcanzar un diagnóstico adecuado. No debe olvidarse que en este terreno de la patología tan importante es alcanzar un diagnóstico como aportar datos de interés obtenidos del examen histológico que permitan una mejor correlación clínica o aporten información relevante de carácter pronóstico o de otro tipo.
En esta parte de la conferencia trataré de exponer cual es el esquema que utilizamos en nuestro Servicio y cual es el alcance del examen morfológico de cada uno de los aspectos que incluimos en él así como los puntos más importantes del diagnóstico diferencial histológico de cada una de sus lesiones elementales.
No es posible realizar diagnóstico alguno si la biopsia no tiene un mínimo tamaño y no alcanza la profundidad debida. Existen diferentes sistemas pero el más habitual es la aguja de Jamshidi de los calibres 9 u 11 (Figura 1). Con ambas, pero mejor con la más gruesa, se puede obtener material válido. No obstante, el tamaño no es el único parámetro de calidad. El cilindro debe estar bien conservado y no debe mostrar artefactos por aplastamiento, que son habituales en pacientes adultos con cambios osteoporóticos. Estos artefactos provocan irregularidades en las trabéculas óseas con extrusión del tejido hematopoyético y deben estar ausentes o al menos respetar una cantidad suficiente de tejido para permitir su valoración. 
Otro artefacto muy habitual es el producido por la obtención de un aspirado previo a la biopsia en el mismo lugar de la toma del cilindro. Provoca una sustitución parcheada del tejido hematopoyético y de la grasa en el centro de espacios medulares por hematíes bien conservados y a veces es tan extensa que imposibilita el examen histológico. La existencia de este artefacto debe hacerse constar siempre en los informes y es muy fácil de evitar: basta con hacer el aspirado después de la biopsia y a unos pocos milímetros de aquélla o si se prefiere hacer antes el aspirado tener la precaución de desplazar un poco la toma de la biopsia.
Dado que en adultos la médula subcortical puede estar despoblada de células hematopoyéticas debe exigirse una profundidad mínima que se cifra en 3-4 espacios intertrabeculares para considerar que la muestra es representativa.
Celularidad
En la cresta ilíaca posterior, de donde se toman habitualmente las biopsias, y en adultos sanos, el volumen de tejido hematopoyético ocupa una fracción que oscila entre un 45% y un 50% del volumen total siendo el resto tejido adiposo maduro (Figura 2). En pacientes más jóvenes la celularidad es mayor y en edades más avanzadas tiende a disminuir. 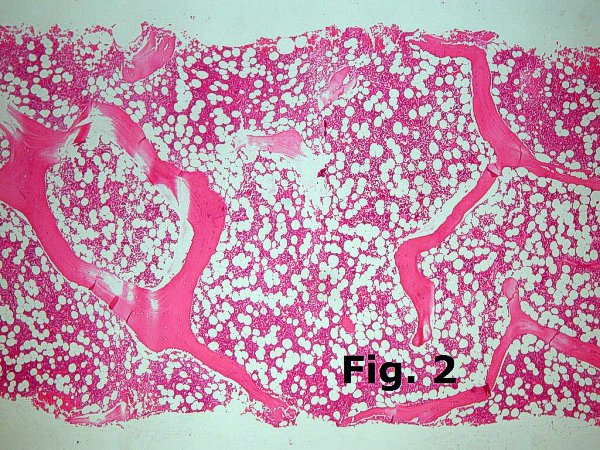
No obstante, la evaluación de la celularidad, que es uno de los parámetros que más interesa a los clínicos y en los que la biopsia ofrece una información más fiable que el aspirado, debe hacerse siempre en estrecha correlación con la situación clínica del paciente, especialmente con los recuentos de sangre periférica, ya que profundas variaciones en la celularidad y distribución del tejido medular son lo habitual en la mayoría de los cuadros clínicos susceptibles de biopsia medular. En especial es muy importante conocer los tratamientos previos del paciente y el tiempo transcurrido desde ellos. Las cifras expuestas en el párrafo anterior hacen referencia a personas sanas y sin tratamientos mielosupresores. Una situación frecuente e importante la constituyen los cuadros regenerativos tras quimioterapia o post-trasplante de médula ósea, ya que la distribución de la hematopoyesis puede llegar a ser muy irregular (“médula ósea en damero”) de forma que un único cilindro de hueso puede no reflejar la situación global de la hematopoyesis.
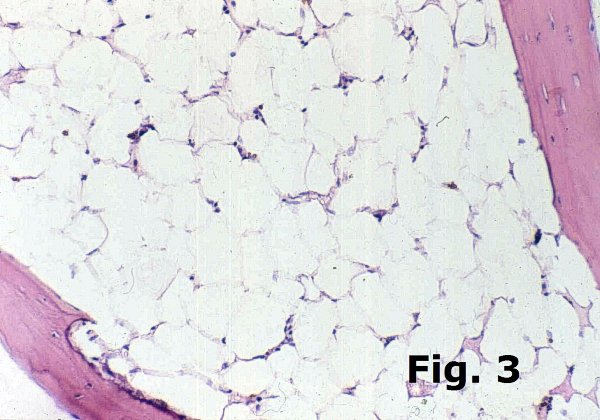
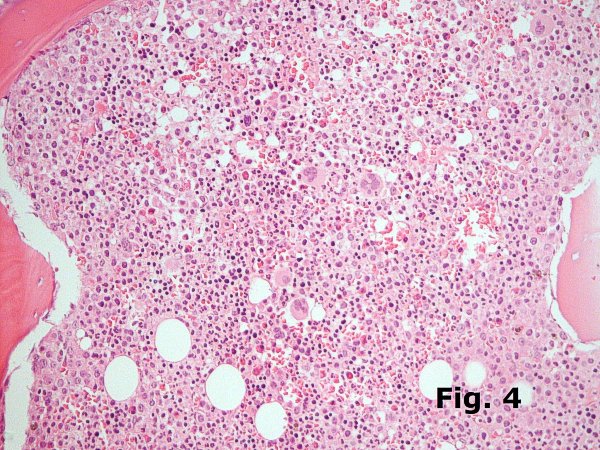
La disminución o la pérdida del tejido hematopoyético es el sustrato morfológico de la hipoplasia medular y de la anemia aplásica, tanto primaria como secundaria (Figura 3). El tiempo mínimo tras un tratamiento de quimioterapia para que la médula comience su regeneración es variable pero se establece en unas 3-4 semanas tras finalizar la toma de medicación mielotóxica, antes de plantear el diagnóstico de anemia arregenerativa. El aumento de la celularidad (Figura 4) se puede observar en numerosos procesos hematológicos que van desde cuadros reactivos a síndromes mieloproliferativos o mielodisplásicos y su análisis escapa al alcance de este breve escrito. Ciñéndonos aquí a los cuadros de carácter reactivo la hipercelularidad secundaria a hiperplasia global de toda la hematopoyesis es característica de la regeneración medular tras quimioterapia en una segunda fase, a partir de los 7-14 días. En el trasplante de médula aparece más tarde, a partir por lo general de las 4 semanas de la infusión y en ambos casos puede ir acompañada de alteraciones displásicas de la eritro y mielopoyesis muy profundas. La introducción de los tratamientos con factores de crecimiento (GM-CSF y otros), frecuente en estos dos casos, puede provocar grados de hipercelularidad muy elevada a base de un marcado incremento de la serie blanca y, en menor medida, de la eritropoyesis.
Arquitectura
La médula ósea es un órgano con una disposición arquitectural determinada y su valoración en un parámetro importante para el diagnóstico de las biopsias medulares, aunque a veces resulta complicada su apreciación o ésta aparece enmascarada por procesos reactivos o neoplásicos.
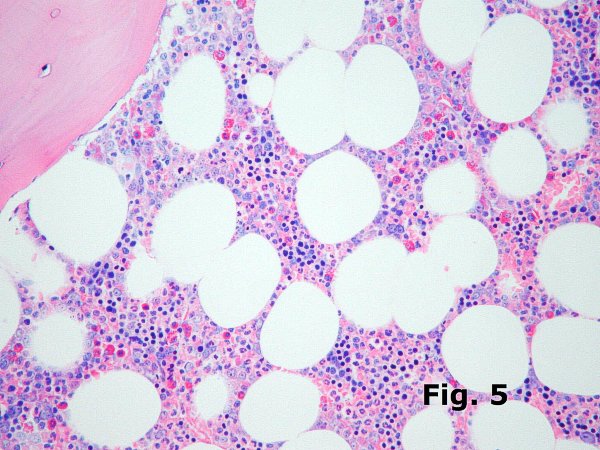
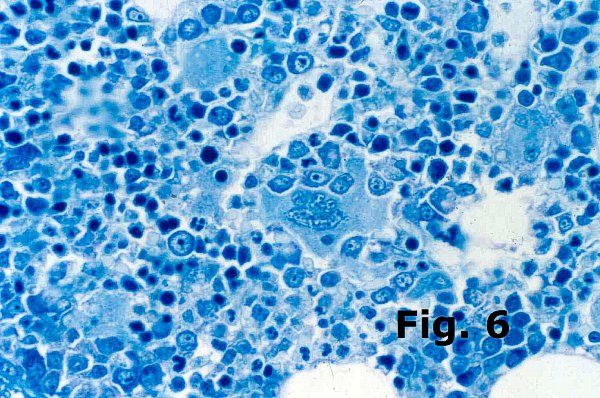
En la médula normal la eritropoyesis (Figura 5) se dispone en agregados discretos en el interior del espacio intramedular, fácilmente reconocibles por el tamaño y forma redondeada de sus núcleos y por la densidad elevada de la cromatina de los eritroblastos (“núcleos en tinta china”). Dependiendo de la orientación y calidad del corte en raras ocasiones es posible identificar un macrófago en el centro de estos agregados. Suelen observarse además elementos de diferentes tamaños dentro de una variabilidad muy discreta y en ocasiones se identifican eritroblastos basófilos de citoplasmas amplios que son muy llamativos y suelen observarse en escaso número. La presencia de elementos de tamaño mayor y de cromatina visible es un indicio de macrocitosis y maduración anómala de la serie roja que puede verse en múltiples procesos. En los síndromes mielodisplásicos (Figura 6) la eritropoyesis sufre profundas alteraciones; los islotes eritroides son grandes y muestran elementos macrocíticos frecuentemente en el mismo estadio madurativo (bloqueo madurativo), habitualmente los eritroblastos basófilos son abundantes y de tamaño incrementado con tendencia a formar agregados (eritropoyesis megaloblastoide) aunque los más importante es la pérdida de la disposición agrupada de la eritropoyesis que aparece en forma de elementos aislados dispersos entre el resto de la celularidad incluso en las áreas paratrabeculares normalmente ocupadas por la serie blanca. Todos estos cambios reflejan las alteraciones arquitecturales y de la maduración propias de estos cuadros.
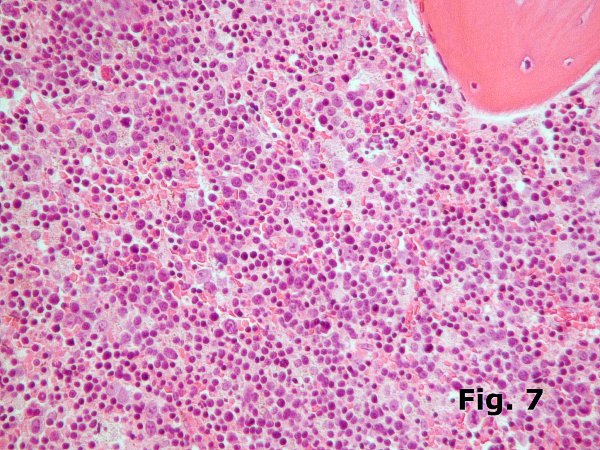
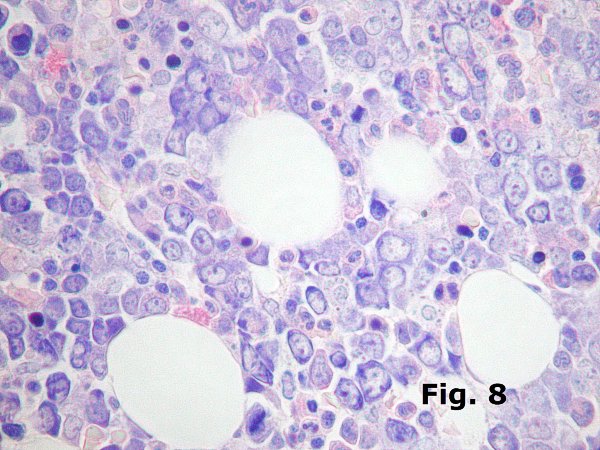
La eritropoyesis puede presentar una hiperplasia extrema en otras dos situaciones que siempre deben recordarse: las anemias hemolíticas y las anemias megaloblásticas. En las primeras (Figura 7) la hiperplasia es muy variable pero puede llegar a ser masiva sobre todo en cuadros graves de talasemia beta homozigota que en nuestro medio es más común que otras anemias hemolíticas intracorpusculares como la drepanocitosis. En estos casos el aspecto de la serie roja es próximo al normal salvo que por consumo excesivo de factores de crecimiento (Fe, ác. fólico, vit. B12, etc.) se produzcan alteraciones del tipo de macrocitosis o cambios megaloblastoides. En las anemias megaloblásticas (Figura 8) se producen profundas alteraciones en todas las series debido a déficit en la síntesis de ADN pero que suelen manifestarse con más intensidad en la serie roja que muestra aumento notable de tamaño y basofilia y en ocasiones graves una hiperplasia que puede llegar a enmascarar el resto de la hematopoyesis y confundirse con la infiltración de un linfoma o una leucemia aguda.
 La serie blanca no se dispone de una forma tan estructurada como la serie roja; en adultos sanos las formas inmaduras se disponen en las zonas paratrabeculares y también alrededor de los vasos (arteriolas y sinusoides) y desde allí las células mieloides van madurando hacia el espacio intramedular donde se pueden encontrar entremezcladas con los agregados eritroides y los megacariocitos, de manera que se pueden delimitar dos zonas, una paratrabecular ocupada por mieloblastos, promielocitos y mielocitos y otra en el interior del espacio intramedular donde predominan los metamielocitos, cayados y segmentados (Figura 9). Esta distribución en muchas ocasiones resulta difícil de apreciar debido al propio dinamismo del tejido medular, capaz de movilizar con rapidez las células mieloides maduras en caso necesario y por otra parte a la sensibilidad de la población mieloide a los fármacos mielotóxicos. Por estos motivos a veces resulta difícil comprobar la normal distribución de la mielopoyesis. La serie blanca no se dispone de una forma tan estructurada como la serie roja; en adultos sanos las formas inmaduras se disponen en las zonas paratrabeculares y también alrededor de los vasos (arteriolas y sinusoides) y desde allí las células mieloides van madurando hacia el espacio intramedular donde se pueden encontrar entremezcladas con los agregados eritroides y los megacariocitos, de manera que se pueden delimitar dos zonas, una paratrabecular ocupada por mieloblastos, promielocitos y mielocitos y otra en el interior del espacio intramedular donde predominan los metamielocitos, cayados y segmentados (Figura 9). Esta distribución en muchas ocasiones resulta difícil de apreciar debido al propio dinamismo del tejido medular, capaz de movilizar con rapidez las células mieloides maduras en caso necesario y por otra parte a la sensibilidad de la población mieloide a los fármacos mielotóxicos. Por estos motivos a veces resulta difícil comprobar la normal distribución de la mielopoyesis.
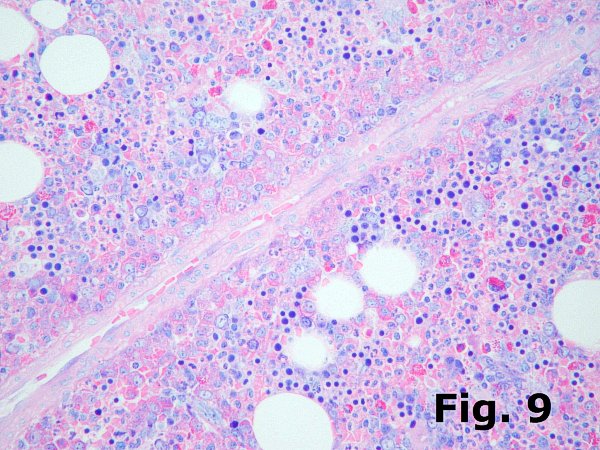 Las alteraciones arquitecturales de la mielopoyesis se aprecian sobre todo en los síndromes mielodisplásicos en los que es posible observar elementos maduros e inmaduros entremezclados en toda la extensión del tejido medular. Además en estos casos la celularidad es predominantemente inmadura y, de forma parecida a lo descrito al hablar de la eritropoyesis, se pueden apreciar agregados de elementos inmaduros en el mismo estadio sin relación con las zonas paratrabeculares, fenómeno denominado como ALIP. En mi opinión los ALIP se reconocen a veces aunque se ven con más facilidad en cortes semifinos incluidos en metacrilato que es donde se describieron originalmente. Las alteraciones arquitecturales de la mielopoyesis se aprecian sobre todo en los síndromes mielodisplásicos en los que es posible observar elementos maduros e inmaduros entremezclados en toda la extensión del tejido medular. Además en estos casos la celularidad es predominantemente inmadura y, de forma parecida a lo descrito al hablar de la eritropoyesis, se pueden apreciar agregados de elementos inmaduros en el mismo estadio sin relación con las zonas paratrabeculares, fenómeno denominado como ALIP. En mi opinión los ALIP se reconocen a veces aunque se ven con más facilidad en cortes semifinos incluidos en metacrilato que es donde se describieron originalmente.
Los megacariocitos se encuentran distribuidos de forma regular en el tejido medular, dispuestos por lo general aislados y en relación o próximos a sinusoides medulares. Su número es muy variable de manera que el rango de normalidad en cuanto a número y ploidía se sitúa en un rango muy amplio. Como norma general meramente orientativa puede decirse que se deben ver megacariocitos con facilidad en diferentes zonas del cilindro, en el rango de uno al menos en un campo de gran aumento y no deben mostrar tendencia a disponerse agrupados. Por estos motivos es muy difícil evaluar hiperplasias en esta serie y la distinción entre una trombocitemia esencial y una hiperplasia reactiva a nivel histológico puede ser en ocasiones imposible. Sin embargo las alteraciones de hiperploidía y aspecto hiperplásico que se observan en los síndromes mieloproliferativos, sobre todo en la mielofibrosis y en la policitemia vera, pero también en la trombocitemia, suelen ser muy características y permiten orientar el diagnóstico en casos de aspirado seco. En la leucemia mieloide crónica y en los síndromes mielodisplásicos los megacariocitos presentan, al contrario, aspecto hiposegmentado y tamaño menor del habitual.
Proporción de las series
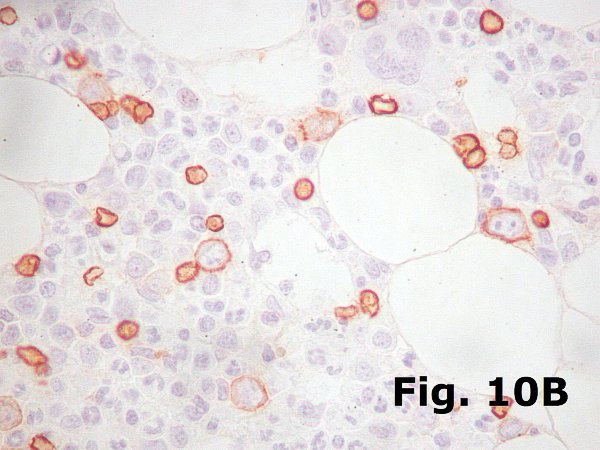
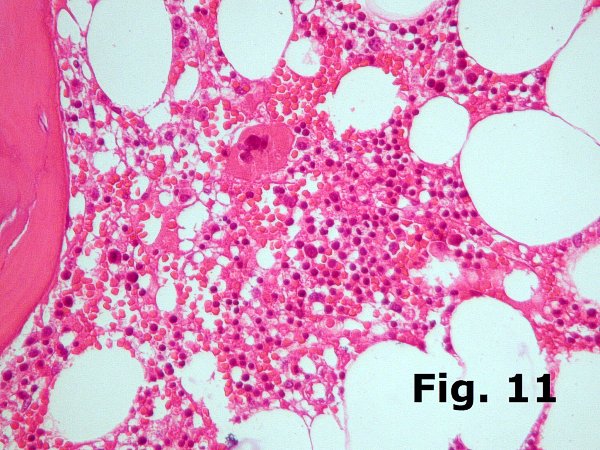
En condiciones normales la mielopoyesis supera a la eritropoyesis en una razón de 3 a 1. Lógicamente existen marcadas variaciones dentro de la normalidad y siempre debe tenerse en cuenta el estado clínico del paciente ya que ligeras variaciones son muy habituales y carecen de trascendencia clínica, e incuso cuando son más profundas, como en el caso de médulas que regeneran tras quimioterapia o trasplante, pueden carecer de significación clínica. Sin embargo una marcada disminución de una de las series puede ser indicativa de pérdida de injerto en un caso de trasplante o de anemia arregenerativa en un paciente tratado con poliquimioterapia. De nuevo hay que insistir en la importancia de evaluar la histología medular en función de los datos clínicos. 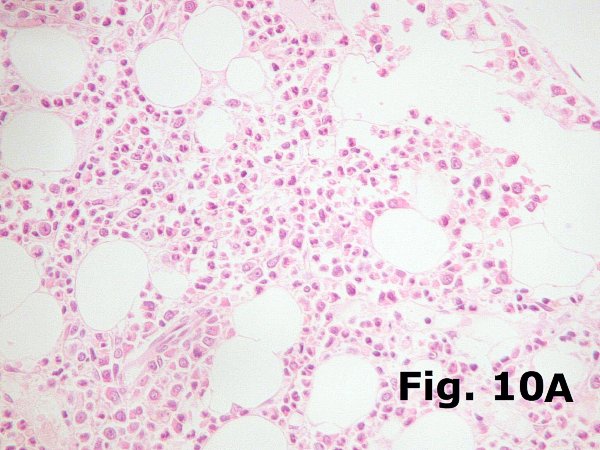 En relación con esto y pesar de parecer un comentario simple, merece la pena comentar la importancia de comprobar siempre y de forma explícita en todas las biopsias la existencia de todas las series hematopoyéticas. De esta manera no pasarán desapercibidos casos de eritroblastopenia (Figura 10ª y 10B) ni de agranulocitosis (Figura 11), especialmente de la primera que es más difícil de apreciar ya que es más fácil confundir los elementos mieloides inmaduros con eritroblastos. En relación con esto y pesar de parecer un comentario simple, merece la pena comentar la importancia de comprobar siempre y de forma explícita en todas las biopsias la existencia de todas las series hematopoyéticas. De esta manera no pasarán desapercibidos casos de eritroblastopenia (Figura 10ª y 10B) ni de agranulocitosis (Figura 11), especialmente de la primera que es más difícil de apreciar ya que es más fácil confundir los elementos mieloides inmaduros con eritroblastos.
Morfología y gradiente madurativo
No es el propósito de esta breve revisión describir aquí estos tópicos que son de sobra conocidos y acerca de los que existen magníficos textos. Por otra parte a lo largo de las anteriores líneas se han comentados datos acerca de la valoración del gradiente madurativo y diferentes circunstancias en las que se pueden observar fenómenos de bloqueo madurativo, etc. Sin embargo, me gustaría comentar en este punto algunos aspectos de la morfología y de las diferentes aproximaciones que ofrecen biopsias y aspirados a su análisis y que los patólogos debemos tener siempre en cuenta.
La biopsia es superior al aspirado en la evaluación de los aspectos comentados hasta aquí y en algunos otros, celularidad, arquitectura, etc. Sin embargo en la evaluación de aspectos citomorfológicos la citología ofrece un detalle mayor y se ha utilizado además desde hace más tiempo por lo que la experiencia en este campo es más sólida y puede decirse que en el estudio de alteraciones morfológicas a nivel celular es una herramienta mejor que la histología. Tradicionalmente las descripciones morfológicas y los criterios diagnósticos de muchas entidades se han basado en los hallazgos citológicos y así es como suele encontrarse la mayor parte de esta información en la literatura aunque los patólogos no debemos olvidar que gran parte de estos datos no son aplicables al material que manejamos y sobre el que debemos elaborar nuestros diagnósticos.
Muchos aspectos clásicos que definen los estadios de la hematopoyesis como la diferente hemoglobinización de la serie roja durante su maduración, los diferentes tipos de granulación de las células mieloides y numerosos detalles patológicos como granulaciones de las células eritroides, disgranulopoyesis, dishemoglobinización, sideroblastos en anillo, etc. escapan al alcance de la resolución de los cortes histológicos del material incluido en parafina que solemos utilizar en nuestra rutina aunque bajo ciertas circunstancias algunos de ellos pueden ser visibles como es el caso de los cortes semifinos tras inclusión en material plástico. En mi opinión, sin embargo, la puesta a punto de medios sofisticados para la evaluación de rutina de algunos detalles morfológicos de escasa utilidad práctica puede no estar justificada al suponer un excesivo esfuerzo técnico con un mínimo beneficio práctico.
Un comentario aparte merece la evaluación de los blastos en las biopsias de médula ósea. La detección y cuantificación de estas células en los aspirados es uno de los criterios diagnósticos más importante en el estudio de los síndromes mielodisplásicos y mieloproliferativos y su identificación en este contexto supone a muchos patólogos un auténtico quebradero de cabeza. En condiciones normales la médula ósea contiene una pequeña proporción de elementos inmaduros e indiferenciados que no suponen más de un 2-4% del total del recuento celular y que probablemente representan células stem que se encuentran dispersas entre las células hematopoyéticas normales. La identificación individual de estas células en esta proporción escapa al alcance de las técnicas histológicas habituales y carece además de sentido práctico si bien con buena técnica histológica es posible observar elementos aislados que cumplen los anteriores requisitos y también si se emplean técnicas inmunohistoquímicas con anti CD34. Sin embargo no se trata de blastos en el sentido oncológico sino de células inmaduras normales. La identificación de blastos neoplásicos en síndromes mieloproliferativos / mielodisplásicos y en las leucemias agudas pauciblásticas (en las convencionales no suele haber problemas) puede ser muy difícil en cortes histológicos y cuando se identifican con facilidad el paciente suele encontrarse ya en un rango de leucemia aguda por lo que, en cierto modo, no tiene mucho sentido esforzarse de forma rutinaria en la búsqueda de estas células. Téngase en cuenta además que la clasificación de estos casos depende del recuento celular, que no puede llevarse a cabo sobre cortes histológicos. Los casos problemáticos son los pacientes con aspirado seco por fibrosis o empaquetamiento en los que el sustrato lo constituye una mielodisplasia con fibrosis, circunstancia relativamente frecuente en la práctica. En estos casos, aunque es imposible evaluar con exactitud el número de blastos salvo que sean muy numerosos, puede realizarse una buena estimación por un lado examinando cuidadosamente la mielopoyesis, ya que una marcada inmadurez suele ser indicativa de una población elevada de blastos y debe consignarse en el informe y, por otro lado evaluando la reactividad para CD34 aunque debe tenerse muy en cuenta que no todos los blastos leucémicos son CD34 positivos.
La médula ósea es uno de los principales órganos de la linfopoyesis y el principal productor de anticuerpos del organismo. Aunque los linfocitos pueden suponer una fracción importante en el recuento de los aspirados, no suelen observarse agregados en las biopsias salvo en contadas ocasiones (siempre en función de la calidad y tamaño de las biopsias) y sólo muy raramente se observan folículos linfoides. Los linfocitos normales se observan dispersos por el intersticio medular de forma homogénea, con una abundancia algo mayor alrededor de capilares y arteriolas y son predominantemente células T. Sin embargo y a pesar de su rareza los agregados linfoides pueden plantear serios problemas de diagnóstico diferencial ya que su distinción de procesos linfoproliferativos puede ser muy problemática (especialmente del linfoma marginal esplénico y otros linfomas de células B maduras). El contexto clínico es muy importante así como el cuidadoso estudio morfológico (nódulos únicos u ocasionales, tamaño pequeño, situación intramedular, composición citológica polimorfa, etc.) pero a veces es preciso recurrir al examen inmunohistoquímico o molecular si las condiciones de fijación de la biopsia lo permiten. Los agregados reactivos son predominantemente T aunque con presencia de células B en número a veces llamativo, mientras que en los linfomas son predominantemente B. El problema es que muchas veces el nódulo linfoide desaparece en la seriación del bloque para la realización de la inmunohistoquímica y entonces el peso del diagnóstico recae sobre la evaluación morfológica. En nuestro Servicio y en casos de incertidumbre diagnóstica lo manifestamos en el informe junto con la recomendación de recurrir a otras técnicas sobre material de aspirado, especialmente PCR y citometría de flujo.
Las células plasmáticas también suponen una parte apreciable en los recuentos medulares y en determinadas circunstancias pueden ser muy abundantes, hasta el 50% del total celular sin que esto suponga un mieloma, si bien suelen mantenerse por debajo del 15% de la celularidad global. En condiciones normales se disponen alrededor o próximas a estructuras vasculares y, al contrario que los linfocitos, muchas veces son un componente llamativo en las biopsias. Es muy importante recordar que su número va en aumento con la edad de los pacientes de manera que a partir de los 60 años y en especial en ancianos pueden ser muy numerosas. En la evaluación de la población de plasmáticas tiene tanta o más importancia su número como su disposición (tendencia a agruparse en procesos neoplásicos, dispersas en procesos reactivos), su morfología, que puede evaluarse perfectamente en cortes histológicos, y sobre todo el perfil inmunohistoquímico de expresión de cadenas ligeras y pesadas de las inmunoglobulinas, en especial las primeras y que siempre debe formar parte de las técnicas empleadas en la evaluación de casos de gammapatía monoclonal de significado incierto.
El examen detenido de las posibles alteraciones estromales debe formar parte del estudio de toda biopsia ya que, además, únicamente su estudio se puede abordar por este medio. La alteración más conocida por ser además una de las indicaciones más clásicas de la biopsia, es la fibrosis asociada a cuadros mieloproliferativos y mielodisplásicos, algunas leucemias, linfomas, metástasis, etc. Sin embargo existen otras de interés clínico y entre ellas merece la pena destacar la degeneración mucinosa o serosa del estroma (en inglés marrow starvation) asociada a cuadros consuntivos crónicos de diferente naturaleza, caracterizada por un depósito de ácido hialurónico y que se observa con relativa frecuencia.
El estroma medular sufre alteraciones en múltiples circunstancias tales como tratamientos quimioterápicos, síndrome de inmunodeficiencia adquirida y en el trasplante de médula ósea, en este último tanto en relación con el acondicionamiento como durante su evolución. Sin embargo muchas de estas alteraciones carecen de entidad morfológica específica como las anteriores y, aunque indudablemente tienen un importante papel en la fisiopatología de los cuadros en los que aparecen, es muy difícil establecer una correlación clínica que permita conocer su valor pronóstico en estas situaciones. Probablemente esto se deba al escaso conocimiento en el vivo de las interacciones estroma-celularidad medular y sus vías moleculares.
Trama ósea
El examen de la trama ósea constituye uno de los aspectos de la evaluación de las biopsias más clásicos y a los que más habituados están los patólogos generales por lo que no nos extenderemos más en este punto. Únicamente recordar que los cambios más habituales e importantes son los secundarios a hiperplasia ósea que se observa más habitualmente asocida a mielofibrosis con metaplasia mieloide pero también a otros procesos que no deben olvidarse, en especial a metástasis de carcinomas y a mieloma múltiple. La osteoporosis secundaria a pérdida de matriz ósea es muy habituale en los pacientes hematológicos, que con frecuencia siguen largos tratamientos con esteroides, pero las biopsias de cresta ilíaca sometidas a descalcificación no son el material idóneo para su valoración.
La última parte de la evaluación sistemática de las biopsias de médula ósea lo dedicamos a estos hallazgos. La detección de granulomas, metástasis y microorganismos en estas biopsias forma también parte del acervo clásico de la patología general y tampoco merece la pena extenderse más en ello. La aparición de métodos de detección más sensibles de cuadros infecciosos ha puesto en un segundo plano el papel de la biopsia medular en el diagnóstico de pacientes con fiebre de origen desconocido de manera que el hallazgo de microorganismos en una biopsia es casi una casualidad. La excepción a este hecho la constituye el Síndrome de Inmunodeficiencia Adquirida que suele someterse a biopsias de médula ante la sospecha de linfomas o infecciones sistémicas y en los que con frecuencia se diagnostica en ellas procesos infecciosos siendo en nuestra experiencia los diagnósticos más frecuentes en este material y por este orden la leishmaniasis, la criptococosis diseminada y las infecciones por micobacterias. Nosotros incluimos siempre en la evaluación de biopsias de pacientes de SIDA una tinción para bacilos ácido alcohol resistentes.
Es muy importante recordar los campos en los que la biopsia no puede ofrecer información alguna porque escapa a su poder de resolución o porque existen otras técnicas superiores a ella. No debe olvidarse tampoco que el aspirado y la biopsia son técnicas complementarias y no contrapuestas. En esta breve conferencia se ha hablado con claridad de las limitaciones de la biopsia en la detección y evaluación de los blastos leucémicos en mielodisplasias y procesos relacionados. En general los detalles finos citoplasmáticos escapan al poder de resolución de las biopsias incluidas en parafina; por ejemplo no es posible detectar sideroblastos en anillo, distinguir entre diferentes inclusiones intracorpusculares de la serie roja o detectar las distintas clases de granulaciones de la seria blanca. De la misma manera no suele ser tampoco posible observar bastones de Auer aunque en algunos casos en biopsias bien procesadas y si alcanzan un cierto tamaño pueden ser visibles.
Otro aspecto importante para considerar son los recuentos celulares. Éstos se llevan a cabo tradicionalmente sobre extensiones de los aspirados y no deben realizarse sobre cortes histológicos por razones lógicas que no es preciso analizar aquí. Los mismos razonamientos expuestos al hablar de las características dinámicas del tejido medular al analizar los parámetros histológicos de la médula ósea sirven para los aspirados, por lo que los datos numéricos obtenidos al hacer recuentos tienen muchas veces un valor relativo siempre en función del contexto clínico. En el caso de los aspirados se suma además el hecho de que no reflejan la realidad del contenido medular, sino sólo un aspecto parcial del mismo que puede estar además condicionado por factores presentes en la médula que no han podido ser aspirados o que alteran el producto de la aspiración tales como fibrosis, alteraciones estromales, infiltrados tumorales, etc. Por todos estos motivos, la estimación aproximada sobre celularidad, proporción de las series y gradiente madurativo que se hace el examinar los cortes histológicos, tiene muchas veces el mismo valor que los datos obtenidos en los recuentos. En mi opinión, con un entrenamiento y una curva de aprendizaje razonable estos parámetros no son difíciles de apreciar. No se debe olvidar sin embargo que en algunos procesos los datos de recuentos del aspirado medular son elementos claves para el diagnóstico y no pueden ser sustituidos por los hallazgos de la biopsia como es el caso del recuento de blastos en los síndromes mielodisplásicos y mieloproliferativos.
|



