|
RESPUESTA INMUNE EN LINFOMAS
Tomás Álvaro Naranjo*, Marylène Lejeune*, Silvia de Sanjose**
* Servicio de Anatomía Patológica. Hospital Verge de la Cinta. Tortosa (Tarragona) ESPAÑA
** Servei d’Epidemiologia i Registre del Cancer, Institut Catala d’Oncologia, Barcelona ESPAÑA
|
|
Resumen
fiogf49gjkf0d
Las células efectoras del sistema inmune del huésped, células T, células NK y células citotóxicas, poseen la capacidad de reconocer los antígenos tumorales y atacar mediante diversos mecanismos a las células neoplásicas. En el grupo de tumores linfoma y leucemia, en el cual diversas entidades ofrecen alteraciones moleculares distintivas, el papel del microambiente se ha estudiado de forma extensa. Linfocitos (células T citotóxicas –CTL- y natural killer –NK-), macrófagos, células dendríticas y neutrófilos se han visto como efectores potenciales de la inmunidad antitumoral. Sin embargo, en este como en otros grupos de tumores, un número creciente de evidencias sugieren que en determinadas circunstancias, estas células puedan más bien promover que inhibir el crecimiento y el desarrollo del tumor.
En el grupo de síndromes linfoproliferativos, las diferencias obvias en los perfiles de expresión de genes de las células malignas no siempre determinan la agresividad del linfoma; mientras que aportaciones recientes determinan que el papel del microambiente celular adquiere una importancia creciente en el pronóstico de la enfermedad y se brinda como una herramienta más a modular con intención terapéutica.
En la presente conferencia, nos disponemos a realizar una revisión de los conocimientos acumulados en la actualidad sobre respuesta inmune antitumoral en un linfoma B de bajo grado (el linfoma folicular), uno de alto grado (el linfoma difuso de células grandes), un linfoma de células T (ALCL) y linfoma de Hodgkin. Acabaremos nuestra revisión con un apartado dedicado a los genes mediadores de la inmunidad y virus, el papel de la respuesta inmune sobre los mecanismos fisiopatológicos de apoptosis y proliferación, el importante papel de las células T reguladoras y finalmente las esperanzadoras perspectivas de la aplicación de todos estos conocimientos a la terapia de los linfomas.
densidad celular. Se requiere, por tanto, el desarrollo y mejora de los algoritmos necesarios para la identificación precisa de los marcadores a estudio.
Trabajo financiado por el Fondo de Investigación Sanitaria (FIS 02/1367) y por la Red de Investigación de Linfomas (G03/179). Instituto de Salud Carlos III. Ministerio de Sanidad y Consumo.
|
|
Introduccion
fiogf49gjkf0d INTRODUCCIÓN
La mayoría de tumores malignos derivan de una o unas pocas células normales que expresan genes mutados o la desregulación de genes normales. Los productos de estos genes contribuyen al crecimiento y a la invasión de dichas células, así como a la expresión de proteínas capaces de estimular la respuesta inmunitaria por parte del huésped que sufre el tumor. La simple observación histológica de cualquier tumor transmite siquiera sea de forma aproximada, la capacidad inmunogénica del tumor, en forma de infiltrados reactivos mono- y polinucleares, cuyo estudio más detallado muestra una composición por linfocitos T, células NK y macrófagos, entre otras. Por alguna razón algunos tumores son más proclives a presentar una respuesta inmunitaria más intensa, como ocurre con el seminoma testicular, el timoma o el carcinoma medular de mama. Otro hecho con el que el patólogo se encuentra familiarizado y que transmite la respuesta inmunitaria del huésped, es la observación de la hiperplasia reactiva de los ganglios linfáticos en los lugares de drenaje del tumor. La respuesta inmunitaria del huésped es capaz de conseguir la regresión espontánea de algunos tumores. Es decir, que las células tumorales expresan antígenos tumorales, que pueden ser reconocidos y que despiertan una reacción por parte del sistema inmune del huésped. Pero por otra parte, hace tiempo que se viene invocando una estrecha relación entre la inflamación crónica y el cáncer, y se piensa que algunos mediadores de la inflamación como la IL-6 pueden ser responsables de este fenómeno ( 1).
A nivel celular, las células efectoras del sistema inmune del huésped, células B, células T, células NK y células citotóxicas, poseen la capacidad de reconocer los antígenos tumorales y atacar mediante diversos mecanismos a las células neoplásicas hasta conseguir su muerte. Existen numerosos ejemplos clínicos de este hecho, tanto a nivel experimental animal como humano, que se pone especialmente de manifiesto cuando falla el sistema, como ocurre en sujetos inmunodeficientes, o como establece la presencia de un denso infiltrado en la correlación clínico-patológica de algunos tumores, como es el caso del carcinoma medular de mama o el melanoma maligno. También en el campo de la patología tumoral linfoide existen ejemplos bien conocidos, como son la remisión del síndrome linfoproliferativo de los pacientes sometidos a inmunosupresión con la sola retirada de dicho tratamiento, o la progresión de una clona presente durante un largo periodo de tiempo tras una agresión al sistema inmune por una infección viral o por el propio mecanismo de la inmunosenescencia, tal y como parece ocurrir en la papulosis linfomatoide.
Sin embargo, si el sistema inmune es un sistema complejo de diversos tipos de células y de moléculas cuya función principal en cáncer es actuar como un sistema eficaz supresor de tumor, lo cierto es que el sistema puede comportarse de manera ineficaz, como indica el hecho de la aparición de tumores en sujetos inmunocompetentes. Así, junto al concepto de inmunovigilancia, surge el de inmunoestimulación ( 2), y es que aunque queda claro que el papel de la respuesta inmune en cáncer es principalmente el reconocimiento y la eliminación de células tumorales y que diversos mecanismos que podrían inducir inmunosupresión (virus, trasplante..) aumentan la probabilidad de cáncer ( 3), existe la aparente paradoja de que la formación del tumor en individuos inmunológicamente intactos sugiere que la respuesta inmune no solo podría ser ineficaz sino que podría contribuir a la propia progresión del tumor ( 4). Es decir, que el sistema inmune posee la capacidad de actuar como una arma de doble filo, lo que indica que la eliminación tumoral requiere una buena coordinación de los diversos elementos del sistema inmune.
El porqué la respuesta inmunitaria es débil o no es eficaz representa un importante foco de atención en la investigación oncológica actual, cuyo objetivo radica en el desarrollo de métodos para aumentar la eficacia de la respuesta inmune antitumoral del huésped, y así el sistema inmune es tenido en cuenta como pieza fundamental incluso en la generación de modelos matemáticos enfocados sobre la inmunoterapia de los linfomas ( 5).
En el grupo de tumores linfoma y leucemia, en el cual diversas entidades ofrecen alteraciones moleculares distintivas, el papel del microambiente se ha estudiado extensivamente y linfocitos (células T citotóxicas –CTL- y natural killer –NK-), macrófagos, células dendríticas y neutrófilos se han visto como efectores potenciales de la inmunidad antitumoral. Sin embargo, nuevamente en este grupo de tumores, más y más evidencias sugieren que estas células puedan más bien promover que inhibir el crecimiento y el desarrollo del tumor ( 4). A la revisión por grupos de síndromes linfoproliferativos de lo que se conoce de la respuesta inmune en estos tumores, es a lo que se dedica esta conferencia.
|
|
Inmunidad antitumoral
fiogf49gjkf0d INMUNIDAD ANTITUMORAL
El lector con conocimientos de inmunidad antitumoral puede dirigirse directamente a la sección siguiente, mientras que aquellas personas especialmente interesadas en el tema harán bien en revisar cualquier libro de Inmunología que incluya al menos un apartado específico dedicado a la materia (véase por ejemplo Inmunología celular y molecular, de Abbas AK, et al., McGraw Hill, 5ª ed., 2003). Solo para quien desee refrescar los conceptos fundamentales de inmunidad antitumoral puede ser útil este apartado.
Tal y como queda dicho, las células tumorales pueden expresar moléculas reconocidas como extrañas por el sistema inmune, y parece claro que los patrones de expresión de estos antígenos difieren entre los distintos tumores. Estos antígenos tumorales se clasifican en:
- Antígenos específicos de tumor (TSA, tumor-specific antigens), que se expresan exclusivamente en células tumorales y evocan fácilmente respuestas inmunitarias.
- Antígenos característicos de tumor o antígenos de tumor único, son TSA que se expresan únicamente en uno o en unos pocos tumores clonales, reflejando mutaciones peculiares características de estos tumores solamente.
- Antígenos asociados al tumor (TAA, tumor-associated antigens), que se expresan tanto en células normales como tumorales, y que con frecuencia son incapaces de inducir respuesta inmunitaria por la autotolerancia.
- Antígenos virales, proteínas virales extrañas de tumores producidos por virus oncogénicos.
Existe cierta tendencia a clasificar los antígenos tumorales según estos sean reconocidos por células T o anticuerpos. Los antígenos tumorales reconocidos por células T (generalmente linfocitos CD8+) representan las dianas principales de la inmunidad antitumoral, y son presentados por moléculas MHC de clase I; es decir, que las células tumorales se comportan como células presentadoras de antígenos (APC), presentando sus propios antígenos a las células T. Naturalmente también APC profesionales pueden presentar antígenos a linfocitos CD4+ a través de MHC de clase II. Los tumores pueden ser destruidos mediante CTL específicos del antígeno tumoral, como ha sido probado en animales y en el hombre, siendo posible verificar respuestas clonales de CTL específicos de tumor, si bien, como es obvio, no siempre son los suficientemente fuertes y eficaces como para erradicar el tumor. El interés de este punto radica en que el incremento de la inmunogenicidad del tumor se acompaña del rechazo específico del mismo.
Ciertos antígenos tumorales representan versiones mutadas de proteínas celulares normales, que aunque pierden su función, no están relacionadas con el fenotipo maligno y si confieren inmunogenicidad. Sin embargo, la mayoría de antígenos tumorales identificados mediante CTL específicos son productos de genes de expresión aberrante y, sorprendentemente, no están mutados. También los productos de oncogenes y genes supresores de tumores mutados pueden ser presentados en asociación a moléculas MHC de clase I y/o de clase II. Tanto las células T CD4+ como CD8+ pueden responder a los productos de estos genes, como ras mutado, p53 y bcr-abl, sin embargo parece ser que estas respuestas son escasamente protectoras en el hombre. El péptido derivado del oncogén HER-2/neu estimula la respuesta tanto de células T CD4+ como CD8+ en carcinomas de ovario, mama y pulmón.
Otros antígenos tumorales son productos de genes normalmente silentes que no se expresan en tejidos normales o solo lo hacen durante el desarrollo temprano. Y otros antígenos tumorales son codificados por virus tanto ARN como ADN que están implicados en el desarrollo de tumores. Por tanto, las células tumorales sintetizan y procesan complejos peptídicos virales que son presentados unidos a moléculas MHC de clase I, y que por tanto estimulan (y se convierten en dianas) respuestas de células T específicas. Estos antígenos codificados por virus no son específicos de cada tumor, sino que son compartidos por todos los tumores inducidos por el mismo tipo de virus. En particular, la función protectora del sistema inmune en el control de tumores inducidos por virus ADN viene dada por la elevada frecuencia de estos tumores en pacientes inmunodeprimidos, como linfomas asociados a VEB y tumores asociados a HPV. De nuevo, resulta de interés la demostración de lisis tumoral por CTL específicos en algunos de estos tumores.
Finalmente, se han reconocido antígenos de diferenciación específicos de tejido que son reconocidos por células T asimismo específicas de tumor. Puesto que estos Ag forman parte de las células normales, podría esperarse que indujeran tolerancia, sin embargo esto no siempre es así, y en algunos tumores se ha reconocido tanto una respuesta de linfocitos T CD4+ como CD8+ específica a estos antígenos.
Como decíamos más arriba, existen también antígenos tumorales reconocidos por anticuerpos. Generalmente se trata de Ag asociados a tumor, no Ag específicos de tumor, y por tanto son proteínas normales propias que suelen inducir tolerancia y no estimulan la respuesta inmunitaria, aunque el patólogo y el clínico se benefician con frecuencia de su presencia en el diagnóstico y tratamiento de estos tumores. A este grupo pertenecen Ag oncofetales como CEA y alfa fetoproteína; Ag glucolipídicos y glucoproteicos alterados como gangliósidos, Ag de grupos sanguíneos y mucinas (CA-125, CA-19.9, MUC-1); y finalmente Ag de diferenciación específicos de tejido, como puedan ser citoqueratinas, proteína S-100 o CD10. Debe señalarse que no existen pruebas contundentes de que las respuestas de Ac sean protectoras contra el tumor.
Mecanismos efectores en la inmunidad antitumoral
Sistemas efectores de la inmunidad tumoral relativamente específicos de tumor son los siguientes:
Linfocitos T:
- Los linfocitos T citotóxicos (CTL) proporcionan inmunidad antitumoral eficaz in vivo. Son predominantemente CD8+ ( Figura 1) y llevan a cabo su función de vigilancia mediante el reconocimiento y destrucción de células potencialmente malignas que expresan péptidos derivados de proteínas celulares mutantes u oncogénicas virales presentadas en asociación a moléculas MHC de clase I (Ver Esquema 1). - Los linfocitos infiltrantes de tumor (TIL) son las células mononucleares que infiltran los tumores sólidos. Incluyen los CTL específicos de tumor.
- Las células T colaboradoras CD4+ ( Figura 1) se han considerado tradicionalmente como no citotóxicas, aunque parece que empiezan a observarse indicios en contra. Desde luego uno de sus papeles principales radica en suministrar citoquinas para el desarrollo de CTL, además de ser capaces de secretar TNF e IFN-gamma, que pueden aumentar la expresión de MHC de clase I por la célula tumoral y por tanto su sensibilidad a la lisis por CTL. Se ha observado como las células T CD4+ de algunos pacientes son específicas de sus correspondientes antígenos tumorales. Una buena representación de la integración de las células T CD4+ en la lucha antitumoral queda representada en el ( Esquema 2). De especial interés resulta la subdivisión de los linfocitos T CD4+ según las citoquinas que expresan una vez que son activados en Th1, Th2 y Th3. o Th1: estos linfocitos secretan citoquinas que predominantemente activan las defensas intracelulares contra las bacterias. Entre muchas otras son representativas IFN-gamma, TNF-alfa e IL-2, que activan a los macrófagos.
o Th2: en contraste con las anteriores, algunos virus y parásitos, como VIH, el virus de la hepatitis B y C, y la malaria, inducen respuestas celulares de subtipo Th2, que se caracterizan por permitir a las células infectadas por los virus permanecer ocultas ante el sistema inmune. Las células Th2 secretan citoquinas como IL-4, IL-5, IL-6 e IL-10 que activan los mecanismos de defensa extracelular, y se conoce también como respuesta inmune atópica (no atópica la Th1) por asociarse generalmente a estas enfermedades, donde se estimulan polinucleares eosinófilos y células B.
o Th3: poseen características comunes tanto con Th1 como con Th2, pero además poseen un papel regulador y producen TGF-beta.
El esquema 3 muestra de forma simplificada el grupo de células Th1 y Th2. Merece la pena destacar que las células Th1 y Th2 secretan una serie de citoquinas comunes y otras (las que se han señalado), que resultan especificas, entre cuyas funciones se encuentra autoestimular a las células del propio grupo e inhibir la diferenciación y/o expansión del otro subgrupo (Ver Esquema 3). Es decir que el IFN-gamma inhibe el desarrollo de células Th2 mientras que la IL-4 inhibe a las Th1. Existe, por tanto, una regulación recíproca entre las células Th1 y Th2, lo que se conoce como el paradigma Th1-Th2. Sin embargo, es posible que esta hipótesis sea una excesiva simplificación y que estos tipos celulares representen ejemplos extremos de un espectro de fenotipos e incluso que una célula concreta no esté comprometida irrevocablemente con un fenotipo concreto. En la actualidad, este paradigma, que tiene ya unos 20 años, se encuentra en revisión.
o Antes de finalizar el apartado de células T CD4+ debe mencionarse el importante papel desempeñado por las células T reguladoras. Ya se ha mencionado el papel autorregulador mutuo de las células Th1 y Th2. Pero además existen otras células capaces de suprimir el desarrollo de otras de manera antígeno-específica, y estas son las llamadas Tr1 y las Th3. Aquí las citoquinas inmunoreguladoras desempeñan un importante papel, entre las que cabe destacar la IL-10 y el TGF-beta respectivamente. Finalmente las células T CD4+CD25+ desempeñan su efecto supresor de manera independiente de citoquinas.
Células citotóxicas naturales:
- Las células NK ( natural killer) (Figura 2 y Figura 3) son efectoras de las respuestas inmunitarias innata y específica, y pueden ser activadas directamente por el contacto con el tumor o como consecuencia del estímulo recibido por citoquinas como los interferones, TNF, IL-2 e IL-12, liberadas por los linfocitos T específicos del tumor y los macrófagos (ver Esquema 2 y Esquema 4). Su actividad, por tanto, está dotada de cierto grado de especificidad. Además, el reconocimiento por las células NK de moléculas MHC sobre la superficie celular tumoral, inhibe la lisis de esa diana, mientras que la regulación negativa de la expresión de MHC en las células tumorales, que permite su escape a la lisis por CTL, las convierte en dianas especialmente idóneas para las células NK. Finalmente las células NK también pueden estar dirigidas contra células recubiertas de Ac (ADCC, citotoxicidad celular dependiente de anticuerpos). - Células citotóxicas activadas por citoquinas (LAK, lymphokine-activated killer cells). Estas son en realidad un grupo de células NK activadas específicamente por IL-2. Parecen derivar de células sanguíneas periféricas o TIL en pacientes con elevadas concentraciones de IL-2, y muestran una elevada capacidad, en este caso inespecífica, para lisar las células tumorales.
Macrófagos:
- Los macrófagos ( Figura 6) son mediadores celulares capaces de lisar células tumorales mediante la liberación de una gran cantidad de enzimas lisosómicas y metabolitos reactivos de oxígeno (Ver Esquema 2). Una vez activados también producen citoquinas como el factor de necrosis tumoral (TNF), que desempeña un importante papel en la muerte del tumor a través de apoptosis mediada por macrófagos. El TNF desempeña su actividad citotóxica desencadenando apoptosis de manera similar a como lo hace Fas; tiene efectos indirectos sobre la vascularización del tumor produciendo trombosis vascular y; produce radicales libres de los que las células normales se protegen mediante la secreción de superóxido dismutasa, pero no así las tumorales.
Células Dendríticas:
- Las células dendríticas (DC) y otras células presentadoras de antígenos (APC) se encuentran dispersas entre los tejidos como centinelas o sistemas de alarma prestos a detectar la presencia de antígenos extraños ( Figura 4 y Figura 5). Mientras que en el microambiente tumoral la producción de IL-12 tiende a ser suprimida, lo que produce una disminución de la actividad Th1, las DC representan probablemente los reguladores más importantes de las células T vírgenes, con una gran capacidad de producir y liberar IL-12 (Ver Esquema 2). En su proceso de polarización, las DC se encuentran bajo el influjo de mediadores inflamatorios como las prostaglandinas, producidas por macrófagos, fibroblastos y células epiteliales y tumorales. Las DC estimuladas por el IFN-gamma procedente de células NK activadas y Th1 se polarizan en DC1, capaces de conducir la activación de la respuesta Th1, y las DC vírgenes estimuladas por PGE2 en DC2 para la respuesta Th2. El subgrupo de DC3 permite la emergencia de células Tr y las otras poblaciones de células reguladoras-supresoras. Recientemente se ha sugerido una nueva vía de unión entre la inmunidad innata y adaptativa a través de la interacción entre DC y células NK ( 6). Anticuerpos:
- Se considera que los Ac son menos importantes que las células T para mediar respuestas inmunitarias antitumorales. No obstante existen respuestas de Ac específicas contra Ag virales, como ocurre en pacientes con linfomas asociados a VEB; y también es posible que se generen Ac contra el tumor que a veces son compartidos por células normales. Como se dijo antes, no existen pruebas de la eficacia antitumoral de este tipo de respuesta. Lo que si se ha demostrado in vitro es el potencial para la destrucción de células tumorales mediada por Ac, atribuible a la activación del complemento, o bien a la citotoxicidad dependiente de Ac en que la muerte está mediada por otros elementos celulares, como macrófagos o células NK.
Identificación IHQ de subpoblaciones celulares
El patólogo tiene a su alcance de una manera relativamente sencilla numerosos Ac monoclonales que le permiten el estudio inmunohistoquímico de las diferentes subpoblaciones celulares que constituyen la respuesta inmunitaria in situ ( Figura 1 a Figura 7). En nuestro laboratorio hemos realizado una selección con la que trabajamos en la actualidad y que de forma orientativa mostramos a continuación: Tabla 1
Células inmunes/ anticuerpos |
Clone/Fuente |
Dilución |
Localización de la tinción |
|
|
|
|
|
|
CD4 |
1F6/ Novocastra |
1:5 |
Membrana |
|
CD8 |
1A5/ Novocastra |
1:20 |
Membrana |
|
|
|
|
|
| Células Natural killer |
|
|
|
|
CD56 |
1B6/ Novocastra |
1:25 |
Membrana |
|
CD57 |
NK1/ Dako |
1:50 |
Citoplásmica |
|
|
|
|
|
|
|
|
|
|
|
Granzima B |
11F1/ Novocastra |
1:40 |
Citoplásmica |
|
TIA1 |
2G9/ Master Diagnostica |
1:50 |
Citoplásmica |
|
Perforina |
2G9/ Master Diagnostica |
1:50 |
Citoplásmica |
|
|
|
|
|
|
Células dendríticas |
|
|
|
|
CD21 |
1F8/ Dako |
1:20 |
Membrana |
|
S-100 |
Polyclonal/ Dako |
1:2000 |
Citoplásmica |
|
|
|
|
|
|
Células plasmacitoides |
|
|
|
|
CD123 |
6H6/ EBioscience |
1:25 |
Citoplásmica/nuclear |
|
|
|
|
|
|
|
|
|
|
|
CD68 |
KP1/ Dako |
1:1200 |
Citoplásmica |
|
|
|
|
|
|
Células T reguladoras |
|
|
|
|
FOXP3 |
CNIO |
1:500 |
Nuclear |
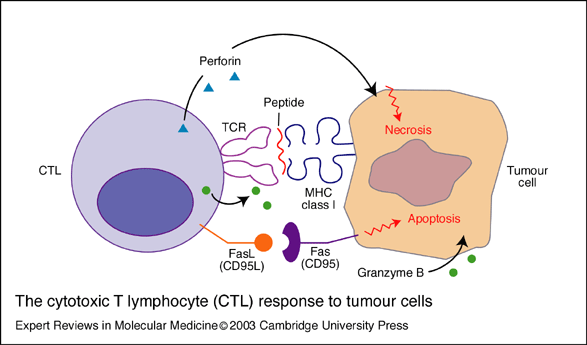 fiogf49gjkf0dEsquema 1. Respuesta de los linfocitos citotóxicos (CTL) contra las células tumorales. Las CTLs interaccionan con las células tumorales a través de la unión de sus receptores T (TCR) con moléculas del complejo mayor de histocompatibilidad (MHC) de clase I expresadas en la superficie de las células tumorales. La interacción implica también la unión entre moléculas de adhesión, como es el caso de la molécula de adhesión intercelular 1 (ICAM-1) que se une al antigéno asociado a la función leucocitaria (LFA-1) (no mostrado), y Fas (CD95) con Fas ligando (CD95L). La destrucción de la célula tumoral esta mediada por la exocitosis por parte de las CTL de perforinas (proteínas formadoras de poros), serina esterasas, interferón gamma (IFN-gamma), granzima B y/o el factor de necrosis tumoral alpha (TNF-alfa)
Este esquema 1 se puede encontrar en Expert Reviews in Molecular Medicine fiogf49gjkf0dEsquema 1. Respuesta de los linfocitos citotóxicos (CTL) contra las células tumorales. Las CTLs interaccionan con las células tumorales a través de la unión de sus receptores T (TCR) con moléculas del complejo mayor de histocompatibilidad (MHC) de clase I expresadas en la superficie de las células tumorales. La interacción implica también la unión entre moléculas de adhesión, como es el caso de la molécula de adhesión intercelular 1 (ICAM-1) que se une al antigéno asociado a la función leucocitaria (LFA-1) (no mostrado), y Fas (CD95) con Fas ligando (CD95L). La destrucción de la célula tumoral esta mediada por la exocitosis por parte de las CTL de perforinas (proteínas formadoras de poros), serina esterasas, interferón gamma (IFN-gamma), granzima B y/o el factor de necrosis tumoral alpha (TNF-alfa)
Este esquema 1 se puede encontrar en Expert Reviews in Molecular Medicine
Los autores son: Roshni Mitra, Sarvjeet Singh and Ashok Khar (2003) Antitumour immune responses. Exp. Rev. Mol. Med. Vol. 5, DOI: 10.1017/S1462399403005623">
Esquema 1 - fiogf49gjkf0d Esquema 1. Respuesta de los linfocitos citotóxicos (CTL) contra las células tumorales. Las CTLs interaccionan con las células tumorales a través de la unión de sus receptores T (TCR) con moléculas del complejo mayor de histocompatibilidad (MHC) de clase I expresadas en la superficie de las células tumorales. La interacción implica también la unión entre moléculas de adhesión, como es el caso de la molécula de adhesión intercelular 1 (ICAM-1) que se une al antigéno asociado a la función leucocitaria (LFA-1) (no mostrado), y Fas (CD95) con Fas ligando (CD95L). La destrucción de la célula tumoral esta mediada por la exocitosis por parte de las CTL de perforinas (proteínas formadoras de poros), serina esterasas, interferón gamma (IFN-gamma), granzima B y/o el factor de necrosis tumoral alpha (TNF-alfa)
Este esquema 1 se puede encontrar en Expert Reviews in Molecular Medicine
Los autores son: Roshni Mitra, Sarvjeet Singh and Ashok Khar (2003) Antitumour immune responses. Exp. Rev. Mol. Med. Vol. 5, DOI: 10.1017/S1462399403005623
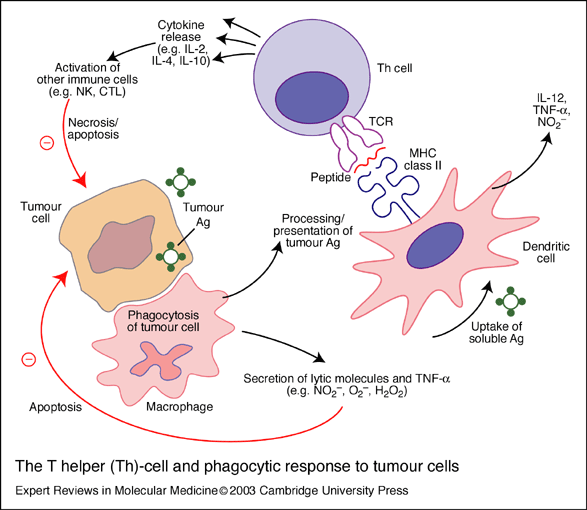 fiogf49gjkf0dEsquema 2. Respuesta de la célula T helper (Th) y respuesta fagocítica contra las células tumorales. Las células presentadoras de antígenos (APCs), como son los macrófagos y las células dendríticas, engloban las células tumorales y sus productos. Los antigénos tumorales son procesados y presentados a las células Th vía las moléculas del complejo mayor de histocompatibilidad (MHC) de clase II, que interacciona con el receptor de la célula Th (TCR) Las células Th responden secretando citoquinas, que activan otras células inmunes como las células NK y los linfocitos citotóxicos (CTL). Los macrófagos secretan también moléculas líticas como el oxido nítrico (NO2–), aniones superóxidos (O2–) y peróxido de hidrogeno (H2O2), además del factor de necrosis tumoral alpha (TNF-alfa). Las células dendríticas secretan ínterleucina 12 (IL-12), TNF-alfa y NO2–. fiogf49gjkf0dEsquema 2. Respuesta de la célula T helper (Th) y respuesta fagocítica contra las células tumorales. Las células presentadoras de antígenos (APCs), como son los macrófagos y las células dendríticas, engloban las células tumorales y sus productos. Los antigénos tumorales son procesados y presentados a las células Th vía las moléculas del complejo mayor de histocompatibilidad (MHC) de clase II, que interacciona con el receptor de la célula Th (TCR) Las células Th responden secretando citoquinas, que activan otras células inmunes como las células NK y los linfocitos citotóxicos (CTL). Los macrófagos secretan también moléculas líticas como el oxido nítrico (NO2–), aniones superóxidos (O2–) y peróxido de hidrogeno (H2O2), además del factor de necrosis tumoral alpha (TNF-alfa). Las células dendríticas secretan ínterleucina 12 (IL-12), TNF-alfa y NO2–.
Este esquema 2 se puede encontrar en Expert Reviews in Molecular Medicine
Los autores son: Roshni Mitra, Sarvjeet Singh and Ashok Khar (2003) Antitumour immune responses. Exp. Rev. Mol. Med. Vol. 5, DOI: 10.1017/S1462399403005623">
Esquema 2 - fiogf49gjkf0d Esquema 2. Respuesta de la célula T helper (Th) y respuesta fagocítica contra las células tumorales. Las células presentadoras de antígenos (APCs), como son los macrófagos y las células dendríticas, engloban las células tumorales y sus productos. Los antigénos tumorales son procesados y presentados a las células Th vía las moléculas del complejo mayor de histocompatibilidad (MHC) de clase II, que interacciona con el receptor de la célula Th (TCR) Las células Th responden secretando citoquinas, que activan otras células inmunes como las células NK y los linfocitos citotóxicos (CTL). Los macrófagos secretan también moléculas líticas como el oxido nítrico (NO2–), aniones superóxidos (O2–) y peróxido de hidrogeno (H2O2), además del factor de necrosis tumoral alpha (TNF-alfa). Las células dendríticas secretan ínterleucina 12 (IL-12), TNF-alfa y NO2–.
Este esquema 2 se puede encontrar en Expert Reviews in Molecular Medicine
Los autores son: Roshni Mitra, Sarvjeet Singh and Ashok Khar (2003) Antitumour immune responses. Exp. Rev. Mol. Med. Vol. 5, DOI: 10.1017/S1462399403005623
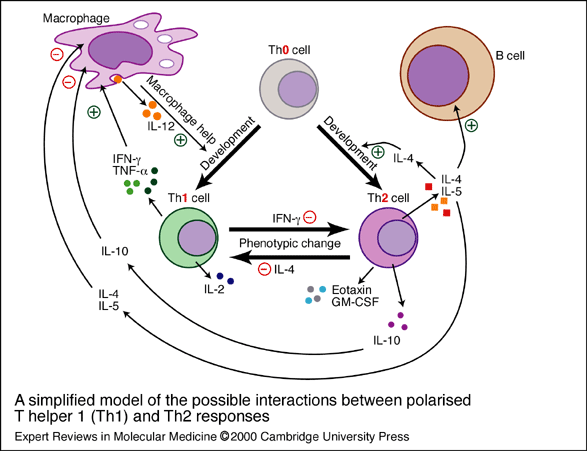 fiogf49gjkf0dEsquema 3. Un modelo simplificado de las posibles interacciones entre las respuestas polarizadas T helper 1 (Th1) y 2 (Th2). El modelo muestra las citoquinas producidas por cada tipo celular y como regulan positivamente (indicado por un signo +) y negativamente (indicado por un signo -) una a la otra. Inicialmente se propuso que las células Th1 atenúan las respuestas auto- y aloinmune, mientras las células Th2 promueven la tolerancia. Posteriormente, la simplicidad de esta respuesta polarizada ha sido puesta en duda, y hoy día parece claro que los fenotipos implicados en la tolerancia y la autoinmunidad no son absolutos. fiogf49gjkf0dEsquema 3. Un modelo simplificado de las posibles interacciones entre las respuestas polarizadas T helper 1 (Th1) y 2 (Th2). El modelo muestra las citoquinas producidas por cada tipo celular y como regulan positivamente (indicado por un signo +) y negativamente (indicado por un signo -) una a la otra. Inicialmente se propuso que las células Th1 atenúan las respuestas auto- y aloinmune, mientras las células Th2 promueven la tolerancia. Posteriormente, la simplicidad de esta respuesta polarizada ha sido puesta en duda, y hoy día parece claro que los fenotipos implicados en la tolerancia y la autoinmunidad no son absolutos.
Este esquema 3 se puede encontrar en Expert Reviews in Molecular Medicine
Los autores son: Mark Harber, Anette Sundstedt and David Wraith (2000) The role of cytokines in immunological tolerance: potential for therapy. Exp. Rev. Mol. Med. 27 November.">
Esquema 3 - fiogf49gjkf0d Esquema 3. Un modelo simplificado de las posibles interacciones entre las respuestas polarizadas T helper 1 (Th1) y 2 (Th2). El modelo muestra las citoquinas producidas por cada tipo celular y como regulan positivamente (indicado por un signo +) y negativamente (indicado por un signo -) una a la otra. Inicialmente se propuso que las células Th1 atenúan las respuestas auto- y aloinmune, mientras las células Th2 promueven la tolerancia. Posteriormente, la simplicidad de esta respuesta polarizada ha sido puesta en duda, y hoy día parece claro que los fenotipos implicados en la tolerancia y la autoinmunidad no son absolutos.
Este esquema 3 se puede encontrar en Expert Reviews in Molecular Medicine
Los autores son: Mark Harber, Anette Sundstedt and David Wraith (2000) The role of cytokines in immunological tolerance: potential for therapy. Exp. Rev. Mol. Med. 27 November.
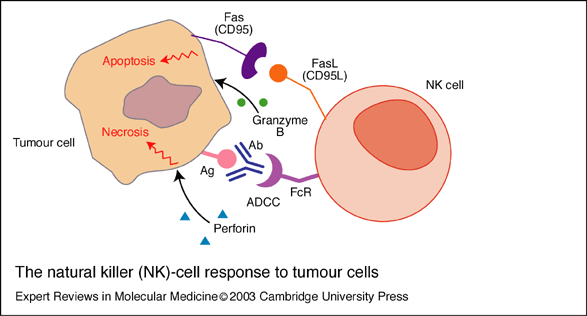 fiogf49gjkf0dEsquema 4. Respuesta de las células natural killer (NK) contra las células tumorales. Las células NK matan a las células tumorales a través de mecanismos que involucran: la citotoxicidad celular dependiente de anticuerpos (Ab) (ADCC), en la cual la porción Fc del anticuerpo acoplada al antígeno (Ag) presente en la superficie de la célula tumoral se une al receptor Fc (FcR) de la célula NK; la interacción Fas (CD95)–Fas ligando (CD95L); y la exocitosis de perforinas y Granzima B, que causan la apoptosis/necrosis de la célula tumoral. fiogf49gjkf0dEsquema 4. Respuesta de las células natural killer (NK) contra las células tumorales. Las células NK matan a las células tumorales a través de mecanismos que involucran: la citotoxicidad celular dependiente de anticuerpos (Ab) (ADCC), en la cual la porción Fc del anticuerpo acoplada al antígeno (Ag) presente en la superficie de la célula tumoral se une al receptor Fc (FcR) de la célula NK; la interacción Fas (CD95)–Fas ligando (CD95L); y la exocitosis de perforinas y Granzima B, que causan la apoptosis/necrosis de la célula tumoral.
Este esquema 4 se puede encontrar en Expert Reviews in Molecular Medicine
Los autores son: Roshni Mitra, Sarvjeet Singh and Ashok Khar (2003) Antitumour immune responses. Exp. Rev. Mol. Med. Vol. 5, DOI: 10.1017/S1462399403005623">
Esquema 4 - fiogf49gjkf0d Esquema 4. Respuesta de las células natural killer (NK) contra las células tumorales. Las células NK matan a las células tumorales a través de mecanismos que involucran: la citotoxicidad celular dependiente de anticuerpos (Ab) (ADCC), en la cual la porción Fc del anticuerpo acoplada al antígeno (Ag) presente en la superficie de la célula tumoral se une al receptor Fc (FcR) de la célula NK; la interacción Fas (CD95)–Fas ligando (CD95L); y la exocitosis de perforinas y Granzima B, que causan la apoptosis/necrosis de la célula tumoral.
Este esquema 4 se puede encontrar en Expert Reviews in Molecular Medicine
Los autores son: Roshni Mitra, Sarvjeet Singh and Ashok Khar (2003) Antitumour immune responses. Exp. Rev. Mol. Med. Vol. 5, DOI: 10.1017/S1462399403005623
 fiogf49gjkf0dEsquema 5. Papel de las citoquinas en la inducción y la función de las células T reguladoras. Una variedad de diferentes tipos y subtipos de célula han sido clasificadas como células naturales o inducidas reguladoras/supresoras. Unas tienen el potencial contra-regulador, como Th1 y Th2, mientras las otras suprimen de manera antigénica específica, como Tr1 y Th3. Las citoquinas inmunoreguladoras tienen un papel principal en la inducción y el funcionamiento de algunas células T reguladoras. Las células anérgicas y CD25+, sin embargo, pueden tener un efecto supresor independiente de estas citoquinas. fiogf49gjkf0dEsquema 5. Papel de las citoquinas en la inducción y la función de las células T reguladoras. Una variedad de diferentes tipos y subtipos de célula han sido clasificadas como células naturales o inducidas reguladoras/supresoras. Unas tienen el potencial contra-regulador, como Th1 y Th2, mientras las otras suprimen de manera antigénica específica, como Tr1 y Th3. Las citoquinas inmunoreguladoras tienen un papel principal en la inducción y el funcionamiento de algunas células T reguladoras. Las células anérgicas y CD25+, sin embargo, pueden tener un efecto supresor independiente de estas citoquinas.
Este esquema 5 se puede encontrar en Expert Reviews in Molecular Medicine
Los autores son: Mark Harber, Anette Sundstedt and David Wraith (2000) The role of cytokines in immunological tolerance: potential for therapy. Exp. Rev. Mol. Med. 27 November.">
Esquema 5 - fiogf49gjkf0d Esquema 5. Papel de las citoquinas en la inducción y la función de las células T reguladoras. Una variedad de diferentes tipos y subtipos de célula han sido clasificadas como células naturales o inducidas reguladoras/supresoras. Unas tienen el potencial contra-regulador, como Th1 y Th2, mientras las otras suprimen de manera antigénica específica, como Tr1 y Th3. Las citoquinas inmunoreguladoras tienen un papel principal en la inducción y el funcionamiento de algunas células T reguladoras. Las células anérgicas y CD25+, sin embargo, pueden tener un efecto supresor independiente de estas citoquinas.
Este esquema 5 se puede encontrar en Expert Reviews in Molecular Medicine
Los autores son: Mark Harber, Anette Sundstedt and David Wraith (2000) The role of cytokines in immunological tolerance: potential for therapy. Exp. Rev. Mol. Med. 27 November.
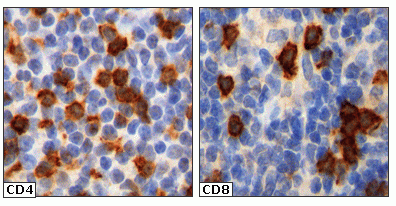 fiogf49gjkf0dFigura 1. Detección de linfocitos T CD4+ y CD8+ atacando las células tumorales de un linfoma folicular."> fiogf49gjkf0dFigura 1. Detección de linfocitos T CD4+ y CD8+ atacando las células tumorales de un linfoma folicular.">
Figura 1 - fiogf49gjkf0d Figura 1. Detección de linfocitos T CD4+ y CD8+ atacando las células tumorales de un linfoma folicular.
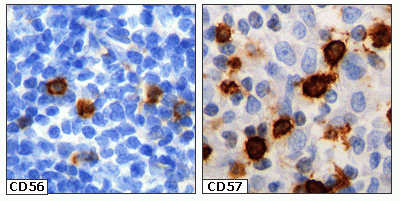 fiogf49gjkf0dFigura 2. Detección de células NK CD56+ y CD57+ infiltrando un linfoma folicular. Estas células van cargadas de gránulos de Granzima B, perforina y TIA-1, capaces de inducir el proceso apoptosis/necrosis de las células tumorales."> fiogf49gjkf0dFigura 2. Detección de células NK CD56+ y CD57+ infiltrando un linfoma folicular. Estas células van cargadas de gránulos de Granzima B, perforina y TIA-1, capaces de inducir el proceso apoptosis/necrosis de las células tumorales.">
Figura 2 - fiogf49gjkf0d Figura 2. Detección de células NK CD56+ y CD57+ infiltrando un linfoma folicular. Estas células van cargadas de gránulos de Granzima B, perforina y TIA-1, capaces de inducir el proceso apoptosis/necrosis de las células tumorales.
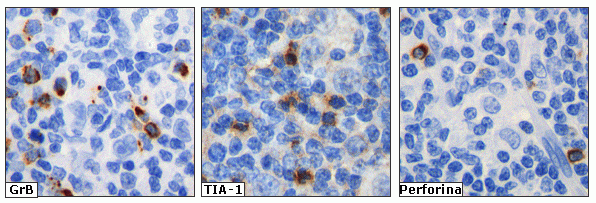 fiogf49gjkf0dFigura 3. Detección de células citotóxicas (CTL) Granzima B+ (GrB), TIA-1+ y perforina+. Independientemente del estado de activación, los gránulos de las CTL almacenan de forma constitutiva TIA-1 y perforina. Al contrario, la Granzima B se detecta principalmente en las CTL activadas."> fiogf49gjkf0dFigura 3. Detección de células citotóxicas (CTL) Granzima B+ (GrB), TIA-1+ y perforina+. Independientemente del estado de activación, los gránulos de las CTL almacenan de forma constitutiva TIA-1 y perforina. Al contrario, la Granzima B se detecta principalmente en las CTL activadas.">
Figura 3 - fiogf49gjkf0d Figura 3. Detección de células citotóxicas (CTL) Granzima B+ (GrB), TIA-1+ y perforina+. Independientemente del estado de activación, los gránulos de las CTL almacenan de forma constitutiva TIA-1 y perforina. Al contrario, la Granzima B se detecta principalmente en las CTL activadas.
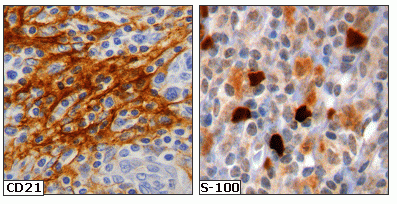 fiogf49gjkf0dFigura 4. Detección de células dendríticas CD21+ y S-100+ en estrecho contacto con la celularidad tumoral."> fiogf49gjkf0dFigura 4. Detección de células dendríticas CD21+ y S-100+ en estrecho contacto con la celularidad tumoral.">
Figura 4 - fiogf49gjkf0d Figura 4. Detección de células dendríticas CD21+ y S-100+ en estrecho contacto con la celularidad tumoral.
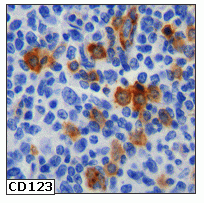 fiogf49gjkf0dFigura 5. Detección de células plasmacitoides CD123+ en linfoma folicular."> fiogf49gjkf0dFigura 5. Detección de células plasmacitoides CD123+ en linfoma folicular.">
Figura 5 - fiogf49gjkf0d Figura 5. Detección de células plasmacitoides CD123+ en linfoma folicular.
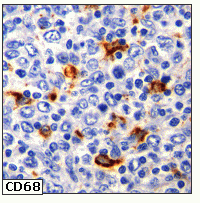 fiogf49gjkf0dFigura 6. Detección de macrófagos CD68+ capaces de secretar numerosas moléculas líticas y TNF-alpha."> fiogf49gjkf0dFigura 6. Detección de macrófagos CD68+ capaces de secretar numerosas moléculas líticas y TNF-alpha.">
Figura 6 - fiogf49gjkf0d Figura 6. Detección de macrófagos CD68+ capaces de secretar numerosas moléculas líticas y TNF-alpha.
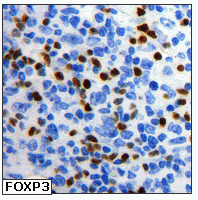 fiogf49gjkf0dFigura 7. Detección de células T reguladoras FOXP3+ en el seno de un linfoma folicular. Tinción nuclear."> fiogf49gjkf0dFigura 7. Detección de células T reguladoras FOXP3+ en el seno de un linfoma folicular. Tinción nuclear.">
Figura 7 - fiogf49gjkf0d Figura 7. Detección de células T reguladoras FOXP3+ en el seno de un linfoma folicular. Tinción nuclear.
|
|
Sindromes linfoproliferativos
fiogf49gjkf0d ACTIVIDAD ANTITUMORAL EN SÍNDROMES LINFOPROLIFERATIVOS
La hipótesis de la vigilancia inmunológica antitumoral postula que una de las principales funciones del sistema inmune sería la de reconocer a las células neoplásicas y eliminarlas antes de que formen tumores ( 7, 8, 9). Esta afirmación implica que en ausencia de un sistema inmune efectivo deberían aparecer mayores incidencias de cáncer y, efectivamente, existen evidencias que implican al sistema inmune en la protección contra ciertos tumores, especialmente los asociados a infecciones virales. Así, se ha observado un aumento en la incidencia de ciertos tipos de tumores en individuos mayores de edad ( 10), en pacientes trasplantados e inmunosuprimidos, en aquellos con linfoma asociado a virus de Epstein-Barr (EBV), en sarcoma de Kaposi y en pacientes con SIDA ( 11, 12). En individuos inmunocompetentes la naturaleza, la función y la especificidad de las células efectoras que son capaces de inhibir el crecimiento de linfomas de células T y B in vitro e in vivo se han estudiado ampliamente ( 13- 15). Resulta de interés la observación de que la presencia de un número aumentado de células T CD4 activadas en linfoma difuso de células grandes B y otros tumores inducidos por VS40 (virus de los simios 40), predice un pronóstico mejor ( 16), sin embargo el número y especialmente el estado de activación de estas células infiltrantes parecen ser independientes del grado del malignidad en diversos linfomas de células B (LH, LF, LDCGB) ( 17). Las diferentes entidades que corresponden al grupo de linfomas son distinguidas principalmente por factores clínicos específicos y alteraciones moleculares propias de los linfomas de baja y alta fracción de crecimiento. Entre los linfomas de menor fracción de crecimiento se incluyen el linfoma folicular (LF), los linfomas marginales (MZLs), el linfoma de células del manto (MCL) y la leucemia linfocítica crónica B (B-CLL), que como grupo comparten una combinación paradójica de estadios clínicos avanzados asociados a una baja agresividad clínica. Por el contrario, los linfomas de alta fracción de crecimiento, que incluyen el linfoma de célula grande B (LBCL) y el linfoma de Burkitt (BL) se asocian con frecuencia a un estadio clínico localizado pero a una alta agresividad clínica. Cada uno de estos grupos parecen acumular alteraciones apoptóticas y proliferativas específicas ( 18). Así pues, las diferencias obvias en los perfiles de expresión de genes de las células malignas no siempre determinan la agresividad del linfoma; mientras que el papel del microambiente celular adquiere una importancia creciente en el pronóstico de la enfermedad. En la presente conferencia, nos disponemos a realizar una revisión de los conocimientos acumulados en la actualidad sobre un linfoma B de bajo grado (el linfoma folicular), uno de alto grado (el linfoma difuso de células grandes), un linfoma de células T como el ALCL y linfoma de Hodgkin. Acabaremos nuestra revisión con un apartado dedicado a los genes mediadores de la inmunidad y virus, el papel de la respuesta inmune sobre los mecanismos fisiopatológicos de apoptosis y proliferación, el importante papel de las células T reguladoras y finalmente las esperanzadoras perspectivas de la aplicación de todos estos conocimientos a la terapia de los linfomas. En este sentido, recientemente nuestro grupo ha realizado y sigue inmerso en ellos, una serie de trabajos en síndromes linfoproliferativos con esta perspectiva, enfocados especialmente sobre linfoma folicular (remitido), linfoma de Hodgkin (19), células T autorreguladoras ( 20), genes mediadores de la inmunidad ( 21), relación entre respuesta inmune, apoptosis y proliferación (en preparación) y pacientes inmunodeprimidos ( 22).
Respuesta inmune en linfoma folicular
El LF es un linfoma generalmente indolente caracterizado por una larga supervivencia media, incluso sin tratamiento. Los datos moleculares disponibles en relación con esta enfermedad parecen representar una combinación de alteraciones genéticas de la celularidad inflamatoria acompañante junto a una serie de eventos que contribuyen a su evolución clonal. Puesto que el LF representa la contrapartida tumoral de las células B del centro germinal y recapitulan su arquitectura folicular, el desarrollo de este linfoma podría estar estrechamente ligado con las interacciones con los componentes celulares del microambiente, incluyendo las células dendríticas y las células T del interior del folículo ( Figura 8). En algunos pacientes con LF ocurren remisiones que podrían estar relacionadas con la respuesta inmune antitumoral. Tanto en LH como en LNH una vigilancia inmune efectiva depende principalmente del número de TIL, especialmente células citotóxicas y T reguladoras. En el caso de los LF, la supervivencia de los pacientes parece correlacionarse con las características moleculares de las células inmunes no neoplásicas presentes en el tumor en el momento del diagnostico y no con las anomalías oncogénicas adquiridas ( 23). Aunque muy discutido, este estudio destaca el hecho de que las células T, los macrófagos y las células dendríticas podrían promover o perjudicar la proliferación o la supervivencia a través de mecanismos de apoptosis y de proliferación de la clona maligna. Estos autores han creado un modelo multivariable que comprende dos patrones de expresión génica que ellos han llamado respuesta inmune tipo 1 y respuesta inmune tipo 2. El primero se asocia con una supervivencia más larga e incluye una mezcla compleja de células T y otras células inmunes. El tipo 2 se asocia a una supervivencia más corta e incluye genes que no codifican marcadores de células T pero sí marcadores de células del sistema inmune innato, fundamentalmente macrófagos. En definitiva, lo que este estudio sugiere es que son las diferencias en la biología de la respuesta inmune del huésped las que determinan el curso clínico y el pronóstico de los pacientes con LF, y no las alteraciones genéticas de las propias células tumorales. Recientemente nuestro grupo ha realizado un estudio en LF semejante al mencionado (remitido), donde se confirma la presencia de un gran número de linfocitos T (CD4+, CD8+) y células NK (CD57+) y un número moderado de células citotóxicas (TIA-1+), macrófagos (CD68+), células plasmacitoides (CD123+), y células T reguladoras (FOXP3) así como la expresión del producto del gen STAT1 entre el pool de células no tumorales. Los pacientes con características clínicas menos severas y con riesgo bajo según el IPI o el FLIPI, exhiben más frecuentemente mayor número de linfocitos T interfoliculares y macrófagos pero generalmente menor numero de células NK infiltrando el tumor. La expresión de STAT1 en las células inmunes posee un impacto adverso sobre la supervivencia global de estos pacientes.
Respuesta inmune en DLBCL
En pacientes con linfoma difuso de célula grande B (DLBCL) la presencia de un numero aumentado de células T CD4 + activadas ( 16, 24) así como de células dendríticas y macrófagos ( 25) parece predecir un mejor pronóstico ( Figura 9). Además, aquellos casos con un infiltrado superior al 20% de células CD4, en particular CD45RO+, presentan una tendencia hacia una mejor supervivencia ( 25). Se ha observado una expresión más alta de respuesta Th1 que Th2 en los pacientes con DLBCL que alcanzan la remisión completa ( 26); así como que una disminución significativa de IL-6 (respuesta Th2) durante las primeras semanas después de la terapia de pacientes con NHL agresivos parece predecir remisión completa ( 27). Además, en estos pacientes un fenotipo de centro germinal (bcl-6+/CD10+) se acompaña de un nivel mas bajo de IL-6 circulante en comparación con fenotipos activados ( 27). La paradoja existente entre la presencia de células antitumorales en pacientes con cáncer y la progresión de la enfermedad (cuando esta sucede), sugieren la existencia de mecanismos mediados por el tumor para evadir la respuesta del sistema inmune. Esta hipótesis aparece respaldada por la observación de pacientes con DLBCL negativos para la expresión del gen MHC II, que presentan pocas células T CD8+ infiltrando el tumor ( 28). Estos resultados han sido confirmados en pacientes con DLBCL nodal primario en los cuales un alto porcentaje de CTL activados representan también un potente factor pronóstico desfavorable ( 29). Por otra parte y como se dijo antes, las células tumorales parecen ser capaces de modular la maduración de las células dendríticas, que participan en la coordinación de la respuesta inmune, de modo que pueden suprimir la capacidad de estas células de presentar y de procesar los antígenos tumorales ( 30). Con respecto al importante papel de macrófagos y células dendríticas, un estudio reciente propone la identificación de un subgrupo específico de pacientes con DLBCL definido en función de la respuesta del huésped más que del tumor mismo ( 25). En este tipo de respuesta definida como "respuesta del huésped", se puede observar una expresión aumentada de receptores de células T/NK, marcadores de monocito-macrófagos y células dendríticas (DCs), así como mediadores inflamatorios. La presencia de células dendríticas interdigitantes asociadas con las células T infiltrantes participan en la coordinación de la respuesta inmune, sin embargo, también las células tumorales parecen ser capaces de modular la maduración de las células dendríticas de modo que pueden suprimir la capacidad de estas células de presentar y de procesar los antígenos tumorales ( 25). Respuesta inmune en linfomas de células T
Otro linfoma caracterizado por la presencia importante de linfocitos reactivos alrededor de las células tumorales es el linfoma anaplásico de células grandes (ALCL), donde la infiltración de un alto porcentaje de células citotóxicas activadas (Granzyme B+) constituye un marcador pronóstico desfavorable ( 31), especialmente cuando se combina con la carencia de expresión de ALK. Los mecanismos por los cuales las células tumorales escapan al ataque de las CTL han sido pocos investigados, aunque se consideran la regulación a la baja de las moléculas MHC I, la expresión de IL-10, la expresión de FAS-L en las células tumorales, la sobreexpresión de Bcl-2 y también la expresión de un inhibidor de la actividad proteolitica de la Granzima B, el PI9 ( 32, 33). Con respecto a este último, la forma extranodal agresiva de ALCL expresa un nivel muy alto de PI9 ( 34). Los niveles de sIL2R constituyen un buen marcador de actividad de la enfermedad en la leucemia de células peludas y la leucemia/linfoma de células T del adulto. En pacientes con ALCL, los niveles séricos de sCD30 así como de sIL2R se encuentran elevados y disminuyen en respuesta al tratamiento ( 35). Respuesta inmune en linfoma de Hodgkin
La presencia de un rico fondo inflamatorio característico distingue el linfoma de Hodgkin (LH) de otros linfomas y hace que esta enfermedad se preste de forma prototípica al estudio de la interacción entre el tumor y su microambiente. Existe un predominio de linfocitos T CD4+ en el fondo del tumor ( 36) además de un alto número de linfocitos citotóxicos ( 19, 37) alrededor de las células de Hodgkin/Reed Sternberg (H/RS) ( Figura 10). Pacientes con un número bajo de linfocitos CD8, CD56, CD57 y un número alto de células citotóxicas (Granzima B+ y TIA-1+) tienen tendencia a presentar un curso clínico desfavorable (leucocitosis, síntomas B, estadio clínico avanzado (III/IV), ausencia de respuesta al tratamiento) ( 16). Independientemente de las características clínicas y patológicas clásicas, algunos estudios han mostrado que la presencia de células T citotóxicas activadas (Granzima B+) se asocia con un seguimiento desfavorable en estos pacientes ( 37-39). Sin embargo, más recientemente, nuestro grupo ha observado que la presencia de células citotóxicas no activadas TIA-1+ también desempeñan un importante papel en el seguimiento de estos pacientes y mucho más cuando se asocian a la presencia de células T reguladoras FOXP3+ ( 20). Las variaciones en el nivel de células citotóxicas TIA-1+ y de células T reguladoras observadas durante el curso de la enfermedad podrían estar implicadas en la progresión del LH ( 20) ( Figura 11). Una explicación plausible del extenso infiltrado inflamatorio presente en el LH podría ser la secreción de una variedad de citocinas producidas tanto por las células tumorales como por el tejido estromal circundante. Las células de Hodgkin/Reed-Sternberg (H/RS) producen y secretan altas cantidades de chemoquinas, en particular TARC y MDC, que atraen los linfocitos que expresan el receptor CCR4, tales como los Th2 ( 40). Estas citocinas podrían contribuir a la patogenia de la enfermedad iniciando y sosteniendo la presencia del infiltrado reactivo. De forma alternativa, las células inmunes pueden producir citocinas responsables de la proliferación y supervivencia del tumor. La composición del infiltrado puede también diferenciarse en función del estado de inmunosupresión de los pacientes con LH. La infección del VIH afecta, por mecanismos directos o indirectos, tanto a los cambios reactivos como a los neoplásicos en tejidos linfoides. Recientemente hemos podido observar una importante pérdida intratumoral de células T CD4+ (inversión del ratio CD4/CD8) y una disminución de CTL activadas intratumorales en pacientes con LH infectados por el VIH ( 22) ( Figura 12).
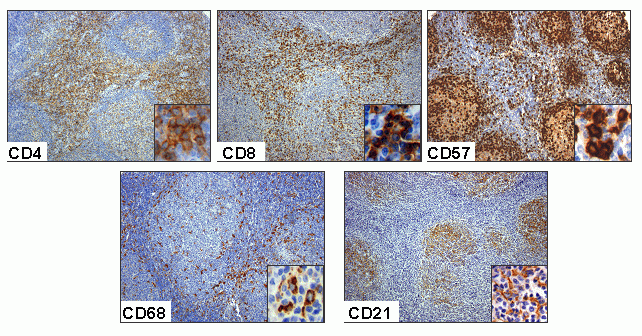 fiogf49gjkf0dFigura 8. Tinción inmunohistoquímica para linfocitos T (CD4 y CD8), células NK (CD57), macrófagos (CD68) y células dendríticas (CD21) en linfoma folicular. Obsérvese como la organicidad del tumor es impartida por las células dendríticas, mientras que existe una elevada cantidad de linfocitos T CD4+ y CD8+ preferentemente en la zona interfolicular. Los macrófagos presentan una disposición mas ubicua, mientras que existe una gran cuantidad de células NK en el interior de los nódulos tumorales."> fiogf49gjkf0dFigura 8. Tinción inmunohistoquímica para linfocitos T (CD4 y CD8), células NK (CD57), macrófagos (CD68) y células dendríticas (CD21) en linfoma folicular. Obsérvese como la organicidad del tumor es impartida por las células dendríticas, mientras que existe una elevada cantidad de linfocitos T CD4+ y CD8+ preferentemente en la zona interfolicular. Los macrófagos presentan una disposición mas ubicua, mientras que existe una gran cuantidad de células NK en el interior de los nódulos tumorales.">
Figura 8 - fiogf49gjkf0d Figura 8. Tinción inmunohistoquímica para linfocitos T (CD4 y CD8), células NK (CD57), macrófagos (CD68) y células dendríticas (CD21) en linfoma folicular. Obsérvese como la organicidad del tumor es impartida por las células dendríticas, mientras que existe una elevada cantidad de linfocitos T CD4+ y CD8+ preferentemente en la zona interfolicular. Los macrófagos presentan una disposición mas ubicua, mientras que existe una gran cuantidad de células NK en el interior de los nódulos tumorales.
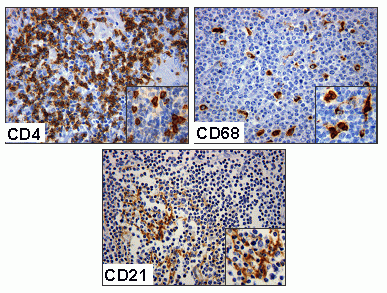 fiogf49gjkf0dFigura 9. Tinción inmunohistoquímica para linfocitos T (CD4), macrófagos (CD68) y células dendríticas (CD21) en linfoma difuso de células grandes. La presencia de un numero elevado de elementos celulares constitutivos de la respuesta inmune anuncia mejor pronostico en LDCGB. El fenotipo de centro germinal versus activado se acompaña de niveles circulantes bien diferenciados de interleucinas."> fiogf49gjkf0dFigura 9. Tinción inmunohistoquímica para linfocitos T (CD4), macrófagos (CD68) y células dendríticas (CD21) en linfoma difuso de células grandes. La presencia de un numero elevado de elementos celulares constitutivos de la respuesta inmune anuncia mejor pronostico en LDCGB. El fenotipo de centro germinal versus activado se acompaña de niveles circulantes bien diferenciados de interleucinas.">
Figura 9 - fiogf49gjkf0d Figura 9. Tinción inmunohistoquímica para linfocitos T (CD4), macrófagos (CD68) y células dendríticas (CD21) en linfoma difuso de células grandes. La presencia de un numero elevado de elementos celulares constitutivos de la respuesta inmune anuncia mejor pronostico en LDCGB. El fenotipo de centro germinal versus activado se acompaña de niveles circulantes bien diferenciados de interleucinas.
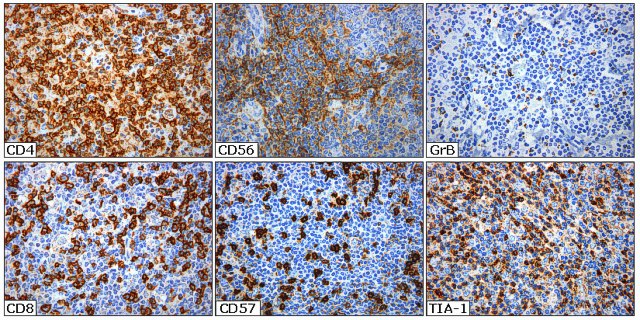 fiogf49gjkf0dFigura 10. Tinción inmunohistoquímica del fondo inflamatorio en linfoma de Hodgkin: linfocitos T (CD4 y CD8), células NK (CD56 y CD57) y células citotóxicas (GrB y TIA-1). Paradójicamente, un numero elevado de CTL anuncia un curso clínico adverso en LH."> fiogf49gjkf0dFigura 10. Tinción inmunohistoquímica del fondo inflamatorio en linfoma de Hodgkin: linfocitos T (CD4 y CD8), células NK (CD56 y CD57) y células citotóxicas (GrB y TIA-1). Paradójicamente, un numero elevado de CTL anuncia un curso clínico adverso en LH.">
Figura 10 - fiogf49gjkf0d Figura 10. Tinción inmunohistoquímica del fondo inflamatorio en linfoma de Hodgkin: linfocitos T (CD4 y CD8), células NK (CD56 y CD57) y células citotóxicas (GrB y TIA-1). Paradójicamente, un numero elevado de CTL anuncia un curso clínico adverso en LH.
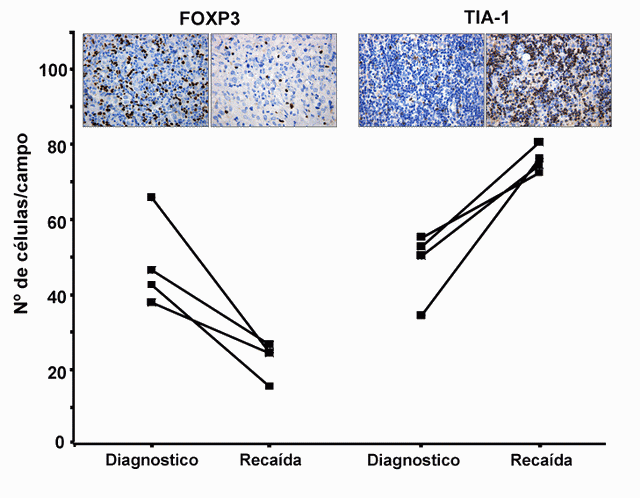 fiogf49gjkf0dFigura 11. Evolución dinámica de células citotóxicas TIA-1+ y células T reguladoras FOXP3+ en pacientes con linfoma de Hodgkin al momento del diagnostico y durante la recaída. Se puede apreciar los cambios a la inversa por parte de estos marcadores."> fiogf49gjkf0dFigura 11. Evolución dinámica de células citotóxicas TIA-1+ y células T reguladoras FOXP3+ en pacientes con linfoma de Hodgkin al momento del diagnostico y durante la recaída. Se puede apreciar los cambios a la inversa por parte de estos marcadores.">
Figura 11 - fiogf49gjkf0d Figura 11. Evolución dinámica de células citotóxicas TIA-1+ y células T reguladoras FOXP3+ en pacientes con linfoma de Hodgkin al momento del diagnostico y durante la recaída. Se puede apreciar los cambios a la inversa por parte de estos marcadores.
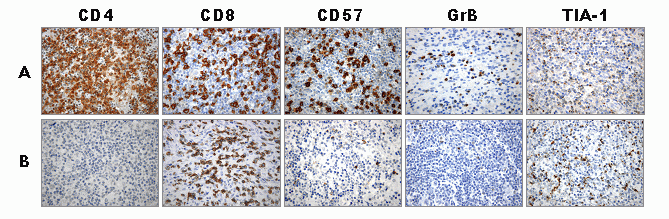 fiogf49gjkf0dFigura 12. Tinción inmunohistoquímica para las células T CD4+ y CD8+, células NK CD57+ y células citotóxicas en linfoma de Hodgkin no-infectados (A) e infectados (B) por el VIH. Obsérvese la disminución generalizada del infiltrado en los pacientes infectados por el VIH, incluyendo los CTL activados (CD57 y GrB+), pero no los CTL inactivados (TIA-1)."> fiogf49gjkf0dFigura 12. Tinción inmunohistoquímica para las células T CD4+ y CD8+, células NK CD57+ y células citotóxicas en linfoma de Hodgkin no-infectados (A) e infectados (B) por el VIH. Obsérvese la disminución generalizada del infiltrado en los pacientes infectados por el VIH, incluyendo los CTL activados (CD57 y GrB+), pero no los CTL inactivados (TIA-1).">
Figura 12 - fiogf49gjkf0d Figura 12. Tinción inmunohistoquímica para las células T CD4+ y CD8+, células NK CD57+ y células citotóxicas en linfoma de Hodgkin no-infectados (A) e infectados (B) por el VIH. Obsérvese la disminución generalizada del infiltrado en los pacientes infectados por el VIH, incluyendo los CTL activados (CD57 y GrB+), pero no los CTL inactivados (TIA-1).
|
|
Regulación de la respuesta inmune
fiogf49gjkf0d REGULACIÓN DE LA RESPUESTA INMUNE, APLICACIONES TERAPEUTICAS
Células T Reguladoras
Tal como hemos visto antes, en el linfoma de Hodgkin (HL) se ha considerado que los linfocitos T CD4+ producen citoquinas de tipo Th2 que podrían contribuir a la supresión local de la respuesta inmune celular mediada por Th1 ( 34, 41). Sin embargo, últimamente se han sugerido algunas dudas sobre la naturaleza de la respuesta Th2, y como ya hemos dicho, quizás la categorización de los linfocitos T CD4+ en Th1 y/o Th2 constituya una excesiva simplificación ( 42). Recientemente se ha visto que las células T reguladoras con fenotipo CD4+CD25+ no solo desempeñan un papel de control de la autoinmunidad, sino que además poseen efectos supresores sobre el desarrollo de linfocitos antígeno reactivos asociados a tumor ( 43- 46). La caracterización funcional y molecular de estas células se ha visto facilitada por la identificación de marcadores como FOXP3 y otros ( 47- 49). FOXP3 codifica un factor de transcripción conocido como Scurfina, expresado específicamente por células T CD4+CD25+, de las que ya se ha observado su contrapartida tumoral en forma de linfoma/leucemia de células T del adulto ( 50), y actúa convirtiendo células T vírgenes CD4+CD25- al fenotipo regulador CD4+CD25+ ( 51). Estas células T reguladoras pueden inhibir la producción tanto de IL-2 como regular al alta la expresión de IL-2Rα (CD25), esto es, retrasar o bloquear la activación de células CD8+ y natural killer (NK) contra los antígenos tumorales ( 52, 53). En el contexto de HL, las propiedades inmunosupresoras de las células T reguladoras aparecen como particularmente importantes, debido a su gran efecto sobre la citotoxicidad celular representada por los CTLs ( 54, 55) y células Natural Killer (NK) ( 56). Nuestro grupo ha demostrado la influencia combinada de la presencia de FOXP3+ y TIA-1+, que distingue tres grupos de riesgo de supervivencia a 5 años en LH de 100, 88 y 73% ( 20) ( Figura 13). La presencia de escaso número de células FOXP3+ y una consecuente alta proporción de TIA-1+ en el infiltrado representa un factor pronóstico independiente que influye de forma negativa en la supervivencia de la enfermedad. Además conforme la enfermedad progresa y recidiva, tiende asimismo a observarse mayor número de células TIA-1+ y menor proporción de FOXP3+ sobre el fondo reactivo del tumor ( Figura 11). Respuesta inmune, apoptosis y proliferación
En la dinámica tumoral aparece un desequilibrio entre proliferación y muerte celular. La expresión aberrante de proteínas implicadas en la regulación y la ejecución de la apoptosis y del ciclo celular de los linfocitos ha sido demostrado en varios tipos de linfomas así como la importancia del nivel de apoptosis y de proliferación en la agresividad clínica de los síndromes linfoproliferativos ( 18, 57- 61). Sin embargo, estas anomalías no son probablemente suficientes para explicar el desarrollo de los linfomas. Dentro de la complejidad de las interacciones entre el fondo reactivo y las células tumorales, las células inmunes presentes en el infiltrado han demostrado ser capaces de modular la apoptosis así como la proliferación de las células tumorales vía receptores apoptóticos, liberación citotóxica de los gránulos, factores del crecimiento o citoquinas inmunosupresoras ( 62- 66). En el caso de los LH, diferentes estudios han demostrado que la pérdida de la expresión de Rb, la sobreexpresión de una serie de proteínas como cíclina E, CDK2, CDK6, STAT3, Ki67, Hdm2, Bcl2, Bcl-X l, survivina y NF-kB así como la ausencia de expresión de LMP-1 eran factores que podían influir la supervivencia de estos pacientes ( 59, 67- 69). Un estudio inmunohistoquímico reciente de nuestro grupo demuestra que el perfil anti-apoptótico observado en células de H/RS se asocia a un aumento general de los linfocitos T CD4+ infiltrantes (relacionados con Bcl-XL y Mcl-1) y a una disminución general de los linfocitos infiltrantes T CD8+, de las células NK y de las células dendríticas (relacionados con el Bcl-XL y Bax). Por otra parte, la progresión de la fase G1/S tumoral (cíclina D, p16, p18, p27) y el alto índice de proliferación (MIB1, Bcl6) aparecen también asociados firmemente a una infiltración más alta de la reacción inmune global contra el tumor (datos no publicados). Aunque el significado biológico de estas observaciones no es fácil de establecer más allá de la relación estadística pura, la regulación de algunas proteínas implicadas en el camino apoptótico y proliferativo de células tumorales se ha visto relacionado con interacciones directas entre estas células y el microambiente inflamatorio circundante. Así, por ejemplo, la regulación de la cascada de la apoptosis y en particular de los miembros de la familia Bcl2 (Bcl2, Bcl-X L, Mcl1 y Bax) se ha visto afectada por diferentes citoquinas como IL-2, IL-4 y IL-6 ( 70- 73). De la misma manera las señales antiapoptóticas inducidas por la interacciones CD40/CD40L entre las células tumorales y las células inmunes pueden inducir la sobreexpresión de Bcl-X L y Mcl1 ( 71) e intervenir en la activación de NF-kB ( 75, 76). Mientras factores del crecimiento regulan positivamente la actividad G1/CDK del ciclo celular, otras señales fisiológicas del microambiente la inhiben (77, 78). La interacción directa entre las células B y las células citotóxicas parece inducir la desregulación permanente de p27 ( 78, 79). En cuanto al índice de proliferación, Bcl6 ha demostrado ser un regulador multifuncional capaz de regular a la baja la expresión de ciclina D2 y de p27 (80) pero también de inhibir la expresión de Bcl-X L (81).
Genes mediadores de la inmunidad y virus
Como se deduce de lo anterior, los linfomas tienden a ser tumores mediados por respuestas inflamatorias. Mientras que los mecanismos de la patogénesis no son todavía bien conocidos, varios componentes genéticos y ambientales incluyendo citocinas han sido considerados en la patogenia de este grupo de tumores. Las citocinas constituyen mediadores solubles producidos por las células activadas ( Ver esquema 5), que ejercen su función biológica vía unión a receptores específicos expresados en las células diana y están implicadas en el desarrollo normal de células hematopoiéticas. Varias evidencias sugieren que también influencian el desarrollo de tumores de linaje tanto mieloide como linfoide. Dado que las células hematopoieticas están en contacto directo con una amplia gama de antígenos, los mediadores funcionalmente relevantes del proceso inflamatorio pueden ser factores de riesgo importantes para las enfermedades hematológicas incluyendo sus tumores. Puesto que las diferencias en concentraciones de citoquinas entre las poblaciones parecen ser debidas, al menos en parte, a polimorfismos de los genes de las citoquinas, tal y como en la actualidad estamos estudiando en nuestro grupo ( 21), su genotipado puede proporcionar una idea de perfiles de citocinas asociados al riesgo de linfoma. Varias citoquinas y interleucinas son producidas por las células neoplásicas en los linfomas como TNF-a, IL-1, IL-2, IL-4, IL-6, IL-8, IL-10 e INF. Mientras que cada tipo de linfoma puede tener diferencias en términos de qué tipo de citoquinas están implicadas en su patogenia, existe al menos una via común entre el linfoma de Hodgkin y linfomas no-Hodgkin de células B, que incluye TNF-a, IL-1, IL-6 y NF-kB (una proteína proinflamatoria antiapoptótica). Además, hay cada vez mas evidencia que sugiere un cambio en el equilibrio entre Th1 y Th2 en la patogénesis del linfoma y que este cambio induce la reactivación de infecciones virales latentes, incluyendo EBV, implicado especialmente en la historia natural del LH . La IL-1 parece conducir la proliferación de células leucémicas mediante mecanismos autocrinos y paracrinos ( 82). La producción constitutiva o inducida de IL-1b por las células neoplásicas se ha demostrado en CLL y HCL ( 83) y en MM ( 84, 85), y los niveles crecientes de IL-1b en el suero se han correlacionado con el estadio y la actividad de la enfermedad ( 83, 86). Por otra parte, IL-1b es producida por células de Reed-Sternberg en cultivo ( 87), y la IL-3 posee una importante actividad biológica como factor de crecimiento y antiapoptótico para las células de Hodgkin y R-S ( 88). Los niveles en suero del antagonista del receptor de la IL-1 (IL-1ra) están elevados en pacientes con LH, los pacientes con síntomas B tienen niveles perceptiblemente más bajos de IL-1ra que aquellos sin síntomas ( 89). En LNH la elevación simultánea de IL-6 e IL-10 anuncia fuertemente un curso pronóstico adverso ( 90). El papel de los genes mediadores de la inmunidad puede ser importante en la falta de control inmunitario adecuado a infecciones comunes como el EBV o el Helicobacter pylori y/o a la adquisición de nuevas infecciones menos comunes como VIH, HCV o HHV8. Por ejemplo, recientemente se ha descrito que el HHV-8 es capaz de regular a la baja las moléculas MHC de clase I y disminuir la actividad de las células NK ( 91). El estudio de variaciones genéticas, polimorfismos, en los genes codificantes de las citoquinas (TNF-a, IL-1, IL-2, IL-4, IL-6, IL-8, IL-10, INF y NF-kB) en combinación con marcadores de infección puede identificar grupos de población más susceptibles a la linfomagénesis. El conocimiento de estos mecanismos puede tener utilidades terapéuticas.
Respuesta inmune y terapia
El interés de la observación de los diferentes mecanismos de escape inmune en linfomas es que pueden representar unas bases estratégicas para una terapia efectiva. Básicamente, existen dos formas de inmunoterapia: la inmunoterapia pasiva que consiste en la transferencia de anticuerpos o células previamente generados in vitro para reaccionar contra el tumor, y la inmunoterapia activa que intenta activar in vivo el sistema inmune para que pueda elaborar una respuesta especifica contra el tumor. Los principales modificadores de la respuesta biológica, para reforzar, dirigir o restaurar la habilidad del organismo para combatir la enfermedad, están representados principalmente por los interferones, las interleucinas, los factores estimulantes de colonias, los anticuerpos monoclonales y las vacunas. Otro ejemplo lo constituye el incremento de la respuesta inmune con factores estimuladores de colonias que tanta cobertura mediática ha tenido recientemente en nuestro país ( 92). El foco de las vacunas contra el cáncer está dirigido a la generación de la respuesta celular específica mediada por linfocitos T. Hasta ahora, las vacunas anticáncer no son preventivas, sino más bien terapéuticas. Estas intentan la activación del sistema inmune contra moléculas sobre-expresadas o mutadas, presentes en las células tumorales, con el fin de eliminar tumores preexistentes en el huésped. Otro enfoque lo constituye la modificación molecular de los idiotipos en LNH-B para la expresión en DC, como una estrategia para inducir respuestas eficaces de linfocitos T CD4+ y CD8+ ( 93). Debido a la inmunosupresión observada en pacientes con cáncer avanzado se ha intentado estimular terapéuticamente una respuesta inmune empleando citoquinas proinflamatorias recombinantes ( 94). Entre estas se destaca la IL-2, que in vitro ha demostrado potenciar la proliferación y la activación de los linfocitos T. Tanto IL-2 como IFN-g cuyo efecto principal es inducir la presentación antigénica en las APC, incluyendo las células tumorales, son las citoquinas más utilizadas en la inmunoterapia del cáncer. De momento, estos tratamientos tienen un efecto parcial y necesitan concentraciones altas que provocan efectos secundarios importantes ( 94). Su efecto, en todo caso, es lo suficientemente importante como para ser un tratamiento alternativo en algunos tipos de cáncer. Se ha intentado también expandir in vitro la capacidad de los linfocitos activados capaces de destruir células tumorales con la ayuda de citoquinas como la IL-2. Reinyectadas en los pacientes, estas células CTL superactivadas y células NK poseen una menor efectividad que las CTL específicas. Al parecer, los glucocorticoides consiguen expandir la población de células NK y se ha invocado su uso en la inmunoterapia del cáncer ( 95). En pacientes NHL avanzados, un ensayo en fase 1 ha demostrado que la terapia por transferencia adoptiva de células T autólogas co-estimuladas es factible y se asocia a una recuperación rápida de los linfocitos ( 96). Durante los últimos años, las células presentadoras de antígeno profesionales como las células dendríticas (DC) han adquirido una mayor relevancia en la inducción de la respuesta inmune contra los tumores. Las DC, activadas y expandidas en cantidades suficientes para inmunizar in vitro, pueden ser cargadas exógenamente con péptidos antigénicos o transfectadas con genes que codifican estos antígenos de manera que pueden presentar de uno a múltiples antígenos tumorales ( 97- 99). En síndromes linfoproliferativos, las vacunas terapéuticas son de interés en numerosos casos de linfomas de células B y T. La utilización de vacunas en pacientes que presentan periodos largos de estabilidad de la enfermedad (como los linfomas foliculares) parece ser un buen medio para inducir el sistema inmune a reaccionar, y debido a la lenta progresión, hay suficiente tiempo para constituir una respuesta inmune exponiendo las células a múltiples dosis del inmunógeno. En el caso de una progresión mas rápida de la enfermedad, la vacuna es menos atractiva debido a que el tumor puede crecer antes de que la reacción inmune pueda ser estimulada y resultar eficaz (linfoma del manto). Otra situación viene representada por la administración de vacunas terapéuticas tras la quimioterapia para reducir la carga tumoral. Antes de dar la vacuna, la quimioterapia puede probablemente eliminar el 90%-99% del tumor, así que el 1%-10% restante seria tratado por la reacción inmune, y en este caso es más probable que la reacción inmune sea eficaz. En LH actualmente se están llevando a cabo una serie de ensayos basados en compuestos como inmunotoxinas, radioinmunoterapia, moléculas biespecíficas y nuevos Ac monoclonales ( 100). Así, un Ac Mo (Ki-4) basado en un conjugado con I 131 se ha mostrado eficaz en pacientes con LH refractario, y un nuevo Ac Mo anti-CD30 se está testando ya en fase clínica I/II. Las proteínas asociadas a VEB no solo en diversos síndromes linfoproliferativos, sino también en algunos carcinomas, constituyen dianas de la inmunoterapia con CTL antígeno específicas ( 101). En LNH un Ac Mo anti-CD69 (un regulador de la respuesta inmune que modula la producción de citoquinas) consigue inducir una significativa respuesta antitumoral mediada por células NK ( 102). En definitiva, en la actualidad puede decirse que debido a la complejidad insospechada de la interacción inmunológica entre el tumor y su huésped, la promesa de una inmunoterapia específica y efectiva de los linfomas ofrece un horizonte esperanzador, así como una comprensión más profunda del funcionamiento del sistema inmune abre buenas perspectivas para el tratamiento generalizado de cierto tipo de tumores.
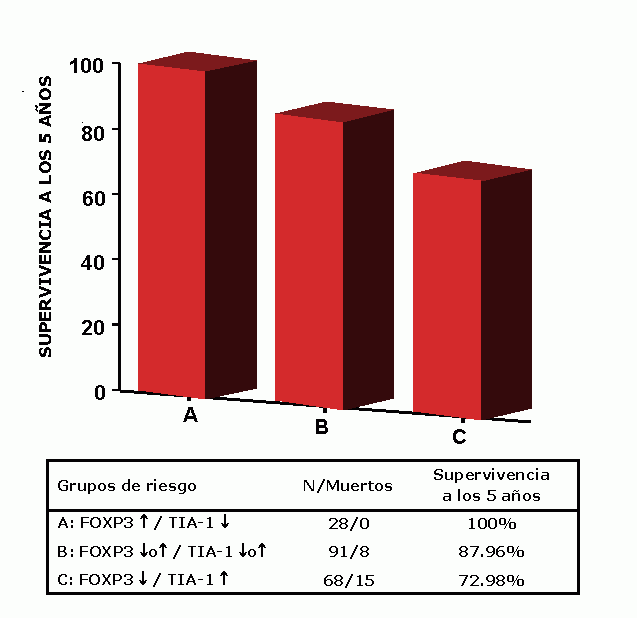 fiogf49gjkf0dFigura 13. Linfoma de Hodgkin: la presencia en el infiltrado de células T reguladoras FOXP3+ conjuntamente con la presencia de células citotóxicas TIA-1+ puede predecir la supervivencia de estos pacientes. Obsérvese como conforme el número de células autorreguladoras FOXP3+ aumenta, el de células TIA1+ disminuye y viceversa. A mayor número de células TIA1+, la supervivencia media a los 5 años se reduce drásticamente. (ver ref. 20 para ampliar información)"> fiogf49gjkf0dFigura 13. Linfoma de Hodgkin: la presencia en el infiltrado de células T reguladoras FOXP3+ conjuntamente con la presencia de células citotóxicas TIA-1+ puede predecir la supervivencia de estos pacientes. Obsérvese como conforme el número de células autorreguladoras FOXP3+ aumenta, el de células TIA1+ disminuye y viceversa. A mayor número de células TIA1+, la supervivencia media a los 5 años se reduce drásticamente. (ver ref. 20 para ampliar información)">
Figura 13 - fiogf49gjkf0d Figura 13. Linfoma de Hodgkin: la presencia en el infiltrado de células T reguladoras FOXP3+ conjuntamente con la presencia de células citotóxicas TIA-1+ puede predecir la supervivencia de estos pacientes. Obsérvese como conforme el número de células autorreguladoras FOXP3+ aumenta, el de células TIA1+ disminuye y viceversa. A mayor número de células TIA1+, la supervivencia media a los 5 años se reduce drásticamente. (ver ref. 20 para ampliar información)
|
|
Apartado 4
|
|
Agradecimientos
|
|
Bibliografía
1.- Hodge DR, Peng B, Cherry JC, Hurt EM, Fox SD, Kelley JA et al. Interleukin 6 supports the maintenance of p53 tumor suppressor gene promoter methylation. Cancer Res 2005;65:4673-4682.8
2.- Ichim CV. Revisiting immunosurveillance and immunostimulation: Implications for cancer immunotherapy. J Transl Med 2005;3:8.
3.- Burnet M. Cancer; a biological approach. I. The processes of control. Br Med J 1957:779-786.
4.- Prehn RT. The immune reaction as a stimulator of tumor growth. Science 1972;176:170-171.
5.- Page K, Uhr JW. Mathematical models of cancer dormancy. Leuk Lymphoma 2005;46:313-327.
6.- Adam C, King S, Allgeier T, Braumuller H, Luking C, Mysliwietz J et al. DC-NK cell cross talk as a novel CD4+ T-cell-independent pathway for antitumor CTL induction. Blood 2005;106:338-344.
7.- Burnet FM. The concept of immunological surveillance. Prog Exp Tumor Res 1970;13:1-27.
8.- Gatti RA, Good RA. Aging, immunity, and malignancy. Geriatrics 1970;25:158-168.
9.- Burns EA, Leventhal EA. Aging, immunity, and cancer. Cancer Control 2000;7:513-522.
10.- Newell GR, Spitz MR, Sider JG. Cancer and age. Semin Oncol 1989;16:3-9.
11.- Sorensen HT, Mellemkjaer L, Nielsen GL, Baron JA, Olsen JH, Karagas MR. Skin cancers and non-hodgkin lymphoma among users of systemic glucocorticoids: a population-based cohort study. J Natl Cancer Inst 2004;96:709-711.
12.- Tomita N, Kanamori H, Fujimaki K, Fujisawa S, Ishigatsubo Y. Epstein-Barr virus-associated extranodal NK/T-cell lymphoma following mosquito bites in an elderly patient without prior hypersensitivity. Leuk Lymphoma 2004;45:2153-2155.
13.- Gonthier M, Llobera R, Arnaud J, Rubin B. Self-reactive T cell receptor-reactive CD8+ T cells inhibit T cell lymphoma growth in vivo. J Immunol 2004; 173:7062-7069.
14.- Smyth MJ, Hayakawa Y, Takeda K, Yagita H. New aspects of natural-killer-cell surveillance and therapy of cancer. Nat Rev Cancer 2002; 2:850-861.
15.- Ikeda H, Old LJ, Schreiber RD. The roles of IFN gamma in protection against tumor development and cancer immunoediting. Cytokine Growth Factor Rev 2002; 13:95-109.
16.- Ansell SM, Stenson M, Habermann TM, Jelinek DF, Witzig TE. CD4+ T-cell immune response to large B-cell non-Hodgkin's lymphoma predicts patient outcome. J Clin Oncol 2001;19:720-726.
17.- Bosshart H. T helper cell activation in B-cell lymphomas. J Clin Oncol 2002;20:2904-2905; author reply 2905.
18.- Sanchez-Beato M, Sanchez-Aguilera A, Piris MA. Cell cycle deregulation in B-cell lymphomas. Blood 2003;101:1220-1235.
19.- Álvaro-Naranjo T, Lejeune M, Salvadó-Usach M, Bosch-Príncep R, Reverter-Branchat G, Jaén-Martínez J et al. Tumor-infiltrating cells as a prognostic factor in Hodgkin's lymphoma. A quantitative tissue microarray study in a large retrospective cohort of 267 patients. Leukemia & Lymphoma 2005;In press
20.- Alvaro T, Lejeune M, Salvado MT, Bosch R, Garcia JF, Jaen J et al. Outcome in Hodgkin's lymphoma can be predicted from the presence of accompanying cytotoxic and regulatory T cells. Clin Cancer Res 2005;11:1467-1473.
21.- Brown E, Benavente Y, Goedert J, Rothman N, Chanock S, Garcia M, Alvaro T et al. Common variations in immune-mediated genes and risk of B-cell and Hodgkin lymphonas. ACCR 96th Annual Meeting 2005, Anaheim/Orange County, CA, USA, April 16-20, Abstract 4925.
22.- Bosch R, Lejeune M, Salvadó M, Jaén J, Pons L, Álvaro T. Decreased number of granzyme-B+ activated CD8+ cytotoxic T lymphocytes in the inflammatory background of HIV-associated Hodgkin's Lymphoma. Ann Hematol 2005;Online DOI: 10.1007/s00277-005-1051-3
23.- Dave SS, Wright G, Tan B, Rosenwald A, Gascoyne RD, Chan WC et al. Prediction of survival in follicular lymphoma based on molecular features of tumor-infiltrating immune cells. N Engl J Med 2004;351:2159-2169.
24.- Xu Y, Kroft SH, McKenna RW, Aquino DB. Prognostic significance of tumour-infiltrating T lymphocytes and T-cell subsets in de novo diffuse large B-cell lymphoma: a multiparameter flow cytometry study. Br J Haematol 2001;112:945-949.
25.- Monti S, Savage KJ, Kutok JL, Feuerhake F, Kurtin P, Mihm M et al. Molecular profiling of diffuse large B-cell lymphoma identifies robust subtypes including one characterized by host inflammatory response. Blood 2005;105:1851-1861.
26.- Mori T, Takada R, Watanabe R, Okamoto S, Ikeda Y. T-helper (Th)1/Th2 imbalance in patients with previously untreated B-cell diffuse large cell lymphoma. Cancer Immunol Immunother 2001;50:566-568.
27.- Pedersen LM, Klausen TW, Davidsen UH, Johnsen HE. Early changes in serum IL-6 and VEGF levels predict clinical outcome following first-line therapy in aggressive non-Hodgkin's lymphoma. Ann Hematol 2005
28.- Rimsza LM, Roberts RA, Miller TP, Unger JM, LeBlanc M, Braziel RM et al. Loss of MHC class II gene and protein expression in diffuse large B-cell lymphoma is related to decreased tumor immunosurveillance and poor patient survival regardless of other prognostic factors: a follow-up study from the Leukemia and Lymphoma Molecular Profiling Project. Blood 2004;103:4251-4258.
29.- Muris JJ, Meijer CJ, Cillessen SA, Vos W, Kummer JA, Bladergroen BA et al. Prognostic significance of activated cytotoxic T-lymphocytes in primary nodal diffuse large B-cell lymphomas. Leukemia 2004;18:589-596.
30.- Whiteside TL, Stanson J, Shurin MR, Ferrone S. Antigen-processing machinery in human dendritic cells: up-regulation by maturation and down-regulation by tumor cells. J Immunol 2004;173:1526-1534.
31.- ten Berge RL, Dukers DF, Oudejans JJ, Pulford K, Ossenkoppele GJ, de Jong D et al. Adverse effects of activated cytotoxic T lymphocytes on the clinical outcome of nodal anaplastic large cell lymphoma. Blood 1999;93:2688-2696.
32.- ten Berge RL, Meijer CJ, Dukers DF, Kummer JA, Bladergroen BA, Vos W et al. Expression levels of apoptosis-related proteins predict clinical outcome in anaplastic large cell lymphoma. Blood 2002;99:4540-4546.
33.- Oudejans JJ, ten Berge RL, Meijer CJ. Immune escape mechanisms in ALCL. J Clin Pathol 2003;56:423-425.
34.- Bladergroen BA, Meijer CJ, ten Berge RL, Hack CE, Muris JJ, Dukers DF et al. Expression of the granzyme B inhibitor, protease inhibitor 9, by tumor cells in patients with non-Hodgkin and Hodgkin lymphoma: a novel protective mechanism for tumor cells to circumvent the immune system? Blood 2002;99:232-237.
35.- Janik JE, Morris JC, Pittaluga S, McDonald K, Raffeld M, Jaffe ES et al. Elevated serum-soluble interleukin-2 receptor levels in patients with anaplastic large cell lymphoma. Blood 2004;104:3355-3357.
36.- Poppema S, Potters M, Visser L, van den Berg AM. Immune escape mechanisms in Hodgkin's disease. Ann Oncol 1998;9:S21-24.
37.- Oudejans JJ, Jiwa NM, Kummer JA, Ossenkoppele GJ, van Heerde P, Baars JW et al. Activated cytotoxic T cells as prognostic marker in Hodgkin's disease. Blood 1997;89:1376-1382.
38.- Kanavaros P, Vlychou M, Stefanaki K, Rontogianni D, Gaulard P, Pantelidaki E et al. Cytotoxic protein expression in non-Hodgkin's lymphomas and Hodgkin's disease. Anticancer Res 1999;19:1209-1216.
39.- ten Berge RL, Oudejans JJ, Dukers DF, Meijer JW, Ossenkoppele GJ, Meijer CJ. Percentage of activated cytotoxic T-lymphocytes in anaplastic large cell lymphoma and Hodgkin's disease: an independent biological prognostic marker. Leukemia 2001;15:458-464.
40.- Skinnider BF, Mak TW. The role of cytokines in classical Hodgkin lymphoma. Blood 2002;99:4283-4297.
41.- Poppema S, Potters M, Emmens R, Visser L, van den Berg A. Immune reactions in classical Hodgkin's lymphoma. Semin Hematol 1999;36:253-259.
42.- Marshall NA, Christie LE, Munro LR, Culligan DJ, Johnston PW, Barker RN et al. Immunosuppressive regulatory T cells are abundant in the reactive lymphocytes of Hodgkin lymphoma. Blood 2004;103:1755-1762.
43.- Suri-Payer E, Amar AZ, Thornton AM, Shevach EM. CD4+CD25+ T cells inhibit both the induction and effector function of autoreactive T cells and represent a unique lineage of immunoregulatory cells. J Immunol 1998;160:1212-1218.
44.- Fontenot JD, Gavin MA, Rudensky AY. Foxp3 programs the development and function of CD4+CD25+ regulatory T cells. Nat Immunol 2003;4:330-336.
45.- Curiel TJ, Coukos G, Zou L, Alvarez X, Cheng P, Mottram P et al. Specific recruitment of regulatory T cells in ovarian carcinoma fosters immune privilege and predicts reduced survival. Nat Med 2004;10:942-949.
46.- Wei WZ, Morris GP, Kong YC. Anti-tumor immunity and autoimmunity: a balancing act of regulatory T cells. Cancer Immunol Immunother 2004;53:73-78.
47.- Takahashi T, Tagami T, Yamazaki S, Uede T, Shimizu J, Sakaguchi N et al. Immunologic self-tolerance maintained by CD25(+)CD4(+) regulatory T cells constitutively expressing cytotoxic T lymphocyte-associated antigen 4. J Exp Med 2000;192:303-310.
48.- Shimizu J, Yamazaki S, Takahashi T, Ishida Y, Sakaguchi S. Stimulation of CD25(+)CD4(+) regulatory T cells through GITR breaks immunological self-tolerance. Nat Immunol 2002;3:135-142.
49.- Sutmuller RP, van Duivenvoorde LM, van Elsas A, Schumacher TN, Wildenberg ME, Allison JP et al. Synergism of cytotoxic T lymphocyte-associated antigen 4 blockade and depletion of CD25(+) regulatory T cells in antitumor therapy reveals alternative pathways for suppression of autoreactive cytotoxic T lymphocyte responses. J Exp Med 2001;194:823-832.
50.- Karube K, Ohshima K, Tsuchiya T, Yamaguchi T, Kawano R, Suzumiya J et al. Expression of FoxP3, a key molecule in CD4CD25 regulatory T cells, in adult T-cell leukaemia/lymphoma cells. Br J Haematol 2004;126:81-84.
51.- Hori S, Nomura T, Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3. Science 2003;299:1057-1061.
52.- Wolf AM, Wolf D, Steurer M, Gastl G, Gunsilius E, Grubeck-Loebenstein B. Increase of regulatory T cells in the peripheral blood of cancer patients. Clin Cancer Res 2003;9:606-612.
53.- Azuma T, Takahashi T, Kunisato A, Kitamura T, Hirai H. Human CD4+ CD25+ regulatory T cells suppress NKT cell functions. Cancer Res 2003;63:4516-4520.
54.- Shresta S, MacIvor DM, Heusel JW, Russell JH, Ley TJ. Natural killer and lymphokine-activated killer cells require granzyme B for the rapid induction of apoptosis in susceptible target cells. Proc Natl Acad Sci U S A 1995;92:5679-5683.
55.- Smyth MJ, Street SE, Trapani JA. Cutting edge: granzymes A and B are not essential for perforin-mediated tumor rejection. J Immunol 2003;171:515-518.
56.- Graubert TA, Ley TJ. How do lymphocytes kill tumor cells? Clin Cancer Res 1996;2:785-789.
57.- Hans CP, Weisenburger DD, Greiner TC, Chan WC, Aoun P, Cochran GT et al. Expression of PKC-beta or cyclin D2 predicts for inferior survival in diffuse large B-cell lymphoma. Mod Pathol 2005.
58.- Berglund M, Thunberg U, Amini RM, Book M, Roos G, Erlanson M, et al. Evaluation of immunophenotype in diffuse large B-cell lymphoma and its impact on prognosis. Mod Pathol 2005; 18:1113-1120.
59.- Garcia JF, Camacho FI, Morente M, Fraga M, Montalban C, Alvaro T et al. Hodgkin and Reed-Sternberg cells harbor alterations in the major tumor suppressor pathways and cell-cycle checkpoints: analyses using tissue microarrays. Blood 2003; 101:681-689.
60.- Bai M, Skyrlas A, Agnantis NJ, Kamina S, Papoudou-Bai A, Kitsoulis P et al. B-cell differentiation, apoptosis and proliferation in diffuse large B-cell lymphomas. Anticancer Res 2005; 25:347-362.
61.- Bai M, Tsanou E, Agnantis NJ, Chaidos A, Dimou D, Skyrlas A, et al. Expression of cyclin D3 and cyclin E and identification of distinct clusters of proliferation and apoptosis in diffuse large B-cell lymphomas. Histol Histopathol 2003; 18:449-457.
62.- Atkinson EA, Bleackley RC. Mechanisms of lysis by cytotoxic T cells. Crit Rev Immunol 1995; 15:359-384.
63.- Berke G. The CTL's kiss of death. Cell 1995; 81:9-12.
64.- Famularo G, De Simone C, Tzantzoglou S, Trinchieri V. Apoptosis, anti-apoptotic compounds and TNF-alpha release. Immunol Today 1994;15:495-496.
65.- de Visser KE, Kast WM. Effects of TGF-beta on the immune system: implications for cancer immunotherapy. Leukemia 1999; 13:1188-1199.
66.- Hahne M, Rimoldi D, Schroter M, Romero P, Schreier M, French LE et al. Melanoma cell expression of Fas(Apo-1/CD95) ligand: implications for tumor immune escape. Science 1996; 274:1363-1366.
67.- Morente MM, Piris MA, Abraira V, Acevedo A, Aguilera B, Bellas C et al. Adverse clinical outcome in Hodgkin's disease is associated with loss of retinoblastoma protein expression, high Ki67 proliferation index, and absence of Epstein-Barr virus-latent membrane protein 1 expression. Blood 1997; 90:2429-2436.
68.- Sanchez-Beato M, Martinez-Montero JC, Doussis-Anagnostopoulou TA, Gatter KC, Garcia J, Garcia JF et al. Anomalous retinoblastoma protein expression in Sternberg-Reed cells in Hodgkin's disease: a comparative study with p53 and Ki67 expression. Br J Cancer 1996; 74:1056-1062.
69.- Wang J, Taylor CR. Apoptosis and cell cycle-related genes and proteins in classical Hodgkin lymphoma: application of tissue microarray technique. Appl Immunohistochem Mol Morphol 2003; 11:206-213.
70.- Akbar AN, Borthwick NJ, Wickremasinghe RG, Panayoitidis P, Pilling D, Bofill M, et al. Interleukin-2 receptor common gamma-chain signaling cytokines regulate activated T cell apoptosis in response to growth factor withdrawal: selective induction of anti-apoptotic (bcl-2, bcl-xL) but not pro-apoptotic (bax, bcl-xS) gene expression. Eur J Immunol 1996; 26:294-299.
71.- Lomo J, Blomhoff HK, Jacobsen SE, Krajewski S, Reed JC, Smeland EB. Interleukin-13 in combination with CD40 ligand potently inhibits apoptosis in human B lymphocytes: upregulation of Bcl-xL and Mcl-1. Blood 1997; 89:4415-4424.
72.- Puthier D, Derenne S, Barille S, Moreau P, Harousseau JL, Bataille R et al. Mcl-1 and Bcl-xL are co-regulated by IL-6 in human myeloma cells. Br J Haematol 1999; 107:392-395.
73.- Song L, Li Y, Sun Y, Shen B. Mcl-1 mediates cytokine deprivation induced apoptosis of human myeloma cell line XG-7. Chin Med J (Engl) 2002; 115:1241-1243.
74.- Metkar SS, Manna PP, Anand M, Naresh KN, Advani SH, Nadkarni JJ. CD40 Ligand--an anti-apoptotic molecule in Hodgkin's disease. Cancer Biother Radiopharm 2001; 16:85-92..
75.- Hinz M, Loser P, Mathas S, Krappmann D, Dorken B, Scheidereit C. Constitutive NF-kappaB maintains high expression of a characteristic gene network, including CD40, CD86, and a set of antiapoptotic genes in Hodgkin/Reed-Sternberg cells. Blood 2001; 97:2798-2807.
76.- Lee HH, Dadgostar H, Cheng Q, Shu J, Cheng G. NF-kappaB-mediated up-regulation of Bcl-x and Bfl-1/A1 is required for CD40 survival signaling in B lymphocytes. Proc Natl Acad Sci U S A 1999; 96:9136-9141.
77.- Malumbres M, Barbacid M. To cycle or not to cycle: a critical decision in cancer. Nat Rev Cancer 2001; 1:222-231.
78.- Wagner EF, Hleb M, Hanna N, Sharma S. A pivotal role of cyclin D3 and cyclin-dependent kinase inhibitor p27 in the regulation of IL-2-, IL-4-, or IL-10-mediated human B cell proliferation. J Immunol 1998; 161:1123-1131.
79.- Blanchard DA, Affredou MT, Vazquez A. Modulation of the p27kip1 cyclin-dependent kinase inhibitor expression during IL-4-mediated human B cell activation. J Immunol 1997; 158:3054-3061.
80.- Shaffer AL, Yu X, He Y, Boldrick J, Chan EP, Staudt LM. BCL-6 represses genes that function in lymphocyte differentiation, inflammation, and cell cycle control. Immunity 2000; 13:199-212.
81.- Tang TT, Dowbenko D, Jackson A, Toney L, Lewin DA, Dent et al. The forkhead transcription factor AFX activates apoptosis by induction of the BCL-6 transcriptional repressor. J Biol Chem 2002; 277:14255-14265.
82.- Cozzolino F, Rubartelli A, Aldinucci D, Sitia R, Torcia M, Shaw A et al. Interleukin 1 as an autocrine growth factor for acute myeloid leukemia cells. Proc Natl Acad Sci U S A 1989;86:2369-2373.
83.- Aguilar-Santelises M, Amador JF, Mellstedt H, Jondal M. Low IL-1 beta production in leukemic cells from progressive B cell chronic leukemia (B-CLL). Leuk Res 1989;13:937-942.
84.- Cozzolino F, Torcia M, Aldinucci D, Rubartelli A, Miliani A, Shaw AR et Al. Production of interleukin-1 by bone marrow myeloma cells. Blood 1989;74:380-387.
85.- Kawano M, Yamamoto I, Iwato K, Tanaka H, Asaoku H, Tanabe O, Ishikawa H, Nobuyoshi M, Ohmoto Y, Hirai Y, et al. Interleukin-1 beta rather than lymphotoxin as the major bone resorbing activity in human multiple myeloma. Blood 1989;73:1646-1649.
86.- Barak V, Nisman B, Dann EJ, Kalickman I, Ruchlemer R, Bennett MA et al. Serum interleukin 1 beta levels as a marker in hairy cell leukemia: correlation with disease status and sIL-2R levels. Leuk Lymphoma 1994;14 Suppl 1:33-39.
87.- Hsu SM, Krupen K, Lachman LB. Heterogeneity of interleukin 1 production in cultured Reed-Sternberg cell lines HDLM-1, HDLM-1d, and KM-H2. Am J Pathol 1989;135:33-38.
88.- Aldinucci D, Olivo K, Lorenzon D, Poletto D, Gloghini A, Carbone A et al. The role of interleukin-3 in classical Hodgkin's disease. Leuk Lymphoma 2005;46:303-311.
89.- Gruss HJ, Dolken G, Brach MA, Mertelsmann R, Herrmann F. High concentrations of the interleukin-1 receptor antagonist in serum of patients with Hodgkin's disease. Lancet 1992;340:968.
90.- el-Far M, Fouda M, Yahya R, el-Baz H. Serum IL-10 and IL-6 levels at diagnosis as independent predictors of outcome in non-Hodgkin's lymphoma. J Physiol Biochem 2004;60:253-258.
91.- Sirianni MC, Libi F, Campagna M, Rossi D, Capello D, Sciaranghella G et al. Downregulation of the major histocompatibility complex class I molecules by human herpesvirus type 8 and impaired natural killer cell activity in primary effusion lymphoma development. Br J Haematol 2005;130:92-95.
92.- Bru A, Albertos S, Lopez Garcia-Asenjo JA, Bru I. Pinning of tumoral growth by enhancement of the immune response. Phys Rev Lett 2004;92:238101.
93.- Muraro S, Bondanza A, Bellone M, Greenberg PD, Bonini C. Molecular modification of idiotypes from B-cell lymphomas for expression in mature dendritic cells as a strategy to induce tumor-reactive CD4+ and CD8+ T-cell responses. Blood 2005;105:3596-3604.
94.- Rosenberg SA, Lotze MT, Yang JC, Aebersold PM, Linehan WM, Seipp CA et al. Experience with the use of high-dose interleukin-2 in the treatment of 652 cancer patients. Ann Surg 1989;210:474-484; discussion 484-475.
95.- Perez SA, Mahaira LG, Demirtzoglou FJ, Sotiropoulou PA, Ioannidis P, Iliopoulou EG et al. A potential role for hydrocortisone in the positive regulation of IL-15-activated NK-cell proliferation and survival. Blood 2005;106:158-166.
96.- Laport GG, Levine BL, Stadtmauer EA, Schuster SJ, Luger SM, Grupp S et al. Adoptive transfer of costimulated T cells induces lymphocytosis in patients with relapsed/refractory non-Hodgkin lymphoma following CD34+-selected hematopoietic cell transplantation. Blood 2003;102:2004-2013.
97.- de Gruijl TD, Curiel DT. Cancer vaccine strategies get bigger and better. Nat Med 1999;5:1124-1125.
98.- Hsu FJ, Benike C, Fagnoni F, Liles TM, Czerwinski D, Taidi B et al. Vaccination of patients with B-cell lymphoma using autologous antigen-pulsed dendritic cells. Nat Med 1996;2:52-58.
99.- Timmerman JM, Czerwinski DK, Davis TA, Hsu FJ, Benike C, Hao ZM et al. Idiotype-pulsed dendritic cell vaccination for B-cell lymphoma: clinical and immune responses in 35 patients. Blood 2002;99:1517-1526.
100.- Borchmann P, Schnell R, Engert A. Immunotherapy of Hodgkin's lymphoma. Eur J Haematol Suppl 2005:159-165.
101.- Gottschalk S, Heslop HE, Rooney CM. Adoptive immunotherapy for EBV-associated malignancies. Leuk Lymphoma 2005;46:1-10.
102.- Esplugues E, Vega-Ramos J, Cartoixa D, Vazquez BN, Salaet I, Engel P et al. Induction of tumor NK-cell immunity by anti-CD69 antibody therapy. Blood 2005;105:4399-4406.
|
|



