|
ENFERMEDAD DE KRABBE. EXPOSICIÓN DE UN CASO
Alejandro Antúnez Infante*, Mario Díaz Delgado*, Alicia Hernández Amate*, Sofía Pereira Gallardo*, Ricardo González Cámpora*
* Departamento de Anatomía Patológica. Hospital Universitario Virgen Macarena. Sevilla ESPAÑA
|
|
Resumen
fiogf49gjkf0d
Presentamos el caso de una niña con un desarrollo normal hasta los 4 meses, comenzando a esta edad con deterioro neurológico, que se diagnosticó de encefalopatía connatal progresiva con tetraparesia espástica. Nuestra paciente falleció a los 14 meses de vida.
La enfermedad de Krabbe es un proceso hereditario infantil con deterioro neurológico progresivo desde el nacimiento, de infausto pronóstico antes de los dos años en su forma infantil, generalmente consecuencia de una infección. Son niños normales al nacimiento, pero que antes de los 6 meses desarrollan irritabilidad extrema, espasticidad y retardo del desarrollo, y como consecuencia dificultades para la alimentación e hipertonía marcada. Se ha detectado un déficit de la actividad enzimática de galactocerebrosidasa (5%), depositándose galactosilceramida y otras beta-galactosas (p.e: galactosilesfingosina, cuyo acúmulo produce destrucción de la oligodendroglia y desmielinización).
|
|
Introduccion
fiogf49gjkf0d La enfermedad de Krabbe es una esfingolipidosis autosómica recesiva causada por la deficiencia de la hidrolasa lisosómica galactosilceramida beta-galactosidasa (GALC), enzima que degrada la galactosilceramida y otros esfingolípidos, cuyo acúmulo produce destrucción de oligodendrocitos y desmielinización con preservación relativa de neuronas y axones. Se trata de una enfermedad panétnica que afecta igualmente ambos sexos, y fue originalmente descrita como un proceso infantil con espasticidad y degeneración neurológica rápidamente progresiva. Su incidencia en Europa y EEUU es de 1 caso por cada 100.000 habitantes, siendo su máxima incidencia (6 por 1.000 habitantes) en la comunidad Draze israelí.
Actualmente se distinguen 4 subtipos clínicos según la edad de aparición:
Tipo 1: Infantil (3-6 meses)
Tipo 2: Infantil tardía (6 meses - 3 años)
Tipo 3: Juvenil (3-8 años)
Tipo 4: Adulta (>8 años). Este tipo es más frecuente en el sur de Europa.
|
|
Material y Métodos
fiogf49gjkf0d Presentamos el caso de una niña con un desarrollo normal hasta los 4 meses, comenzando a esta edad con deterioro neurológico, que se diagnosticó de encefalopatía connatal progresiva con tetraparesia espástica. Nuestra paciente falleció a los 14 meses de vida.
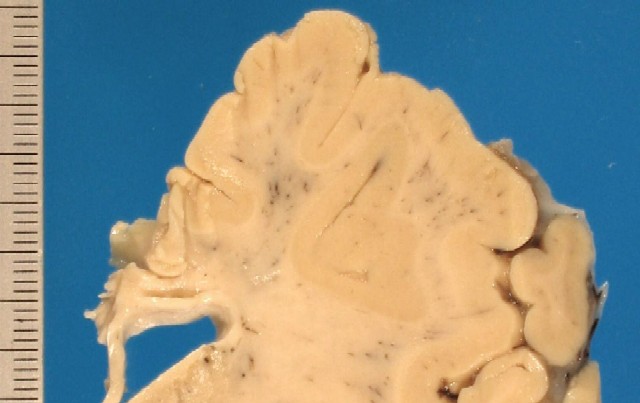
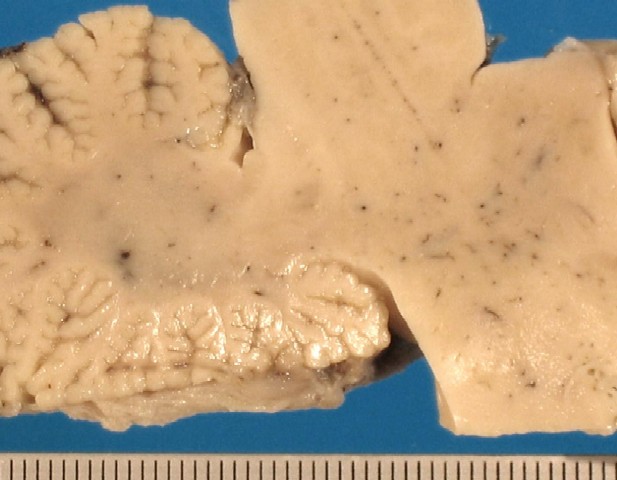
Al realizar la autopsia, se extrajo el encéfalo y se fijó en formolina al 10% durante 15 días. A los cortes seriados observamos múltiples áreas de coloración grisácea-amarillenta en la sustancia blanca tanto de tronco como de diencéfalo, que respetaban la zona subcortical ( figura_1 y figura_2). Se realizó el procesado habitual con parafina y se obtuvieron cortes de 5 micras que se tiñieron con H&E, PAS y Luxol. Igualmente se realizaron tinciones inmunohistoquímicas con anticuerpos para Kp1, Neurofilamentos y PAGF.
 fiogf49gjkf0dFigura 1."> fiogf49gjkf0dFigura 1.">
figura_1 - fiogf49gjkf0d Figura 1.
 fiogf49gjkf0dFigura 2."> fiogf49gjkf0dFigura 2.">
figura_2 - fiogf49gjkf0d Figura 2.
|
|
Resultados
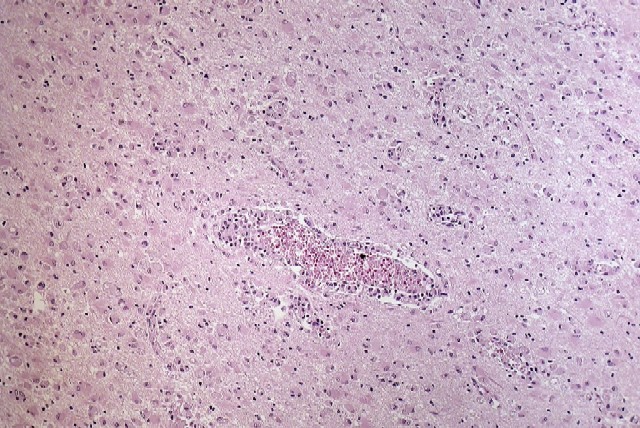
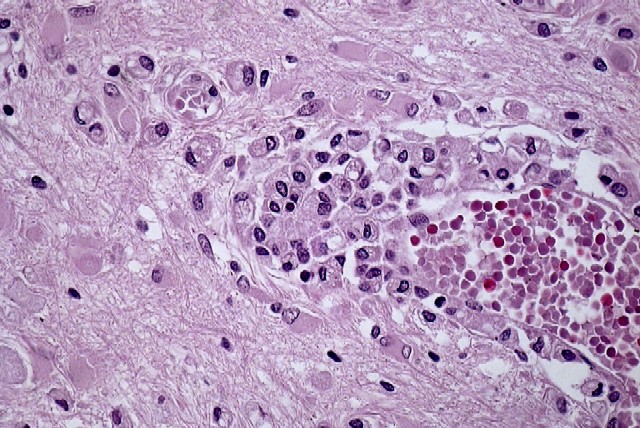
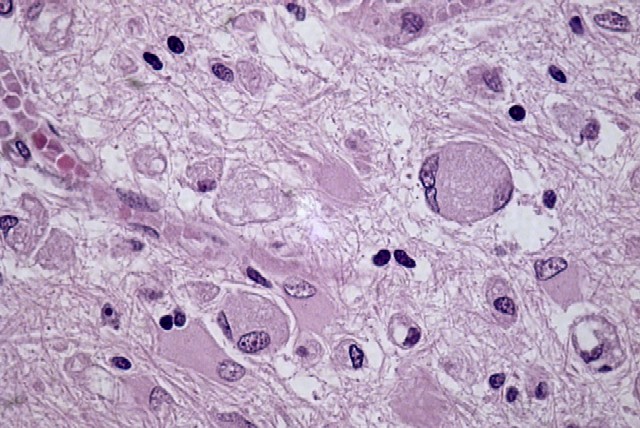
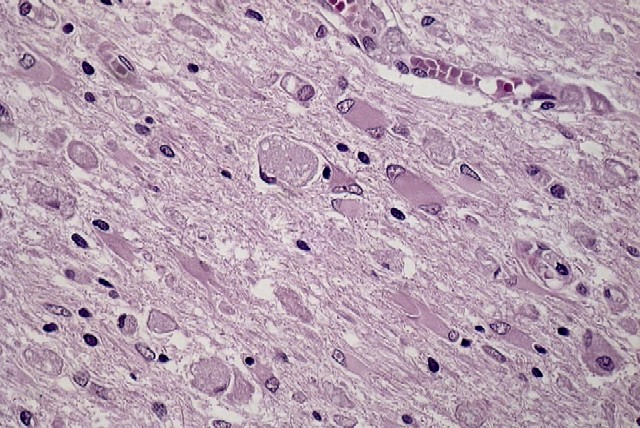
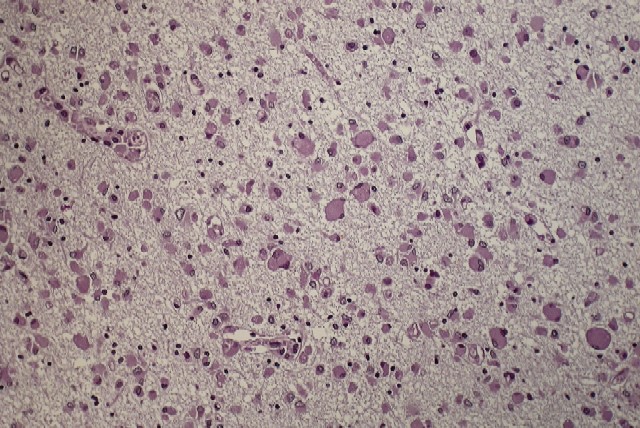
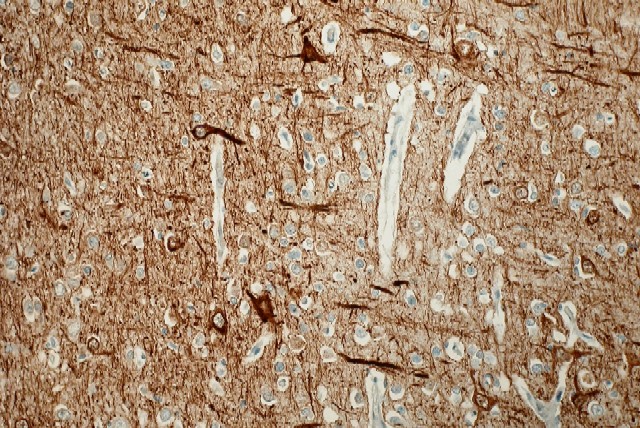
fiogf49gjkf0d El estudio microscópico reveló amplias áreas de sustancia blanca en las que existía pérdida de la arquitectura normal del sistema nervioso central, con gliosis, desmielinización, disminución del número de oligodendrocitos y abundantes macrófagos, algunos multinucleados, distribuídos de forma más o menos heterogénea por todo el parénquima, especialmente alrededor de los vasos sanguíneos. Estos macrófagos también son llamados células globoides, de ahí el nombre de leucodistrofia de células globoides ( figuras_3-6). Las tinciones de Luxol y PAS ( figura_7) teñían intensamente los citoplasmas de los macrófagos. Estudio inmunohistoquímico: La tinción con Kp1 reveló positividad moderada en la microglía, siendo muy intensa en las células globoides ( figura_8). Esto producía un marcado contraste a poco aumento entre las áreas afectadas y las áreas respetadas. Igualmente ocurría con la tinción para PAGF, que fue positiva en toda la matriz neurofibrilar (lesionada o no) y en los macrófagos ( figura_9). La tinción de los neurofilamentos mostró presencia desorganizada de éstos ( figura_10) en relación con el parénquima normal ( figura_11).
 fiogf49gjkf0dFigura 3."> fiogf49gjkf0dFigura 3.">
figuras_3 - fiogf49gjkf0d Figura 3.
 fiogf49gjkf0dFigura 4."> fiogf49gjkf0dFigura 4.">
figura_4 - fiogf49gjkf0d Figura 4.
 fiogf49gjkf0dFigura 5."> fiogf49gjkf0dFigura 5.">
figura_5 - fiogf49gjkf0d Figura 5.
 fiogf49gjkf0dFigura 6."> fiogf49gjkf0dFigura 6.">
figura_6 - fiogf49gjkf0d Figura 6.
 fiogf49gjkf0dFigura 7. PAS."> fiogf49gjkf0dFigura 7. PAS.">
figura_7 - fiogf49gjkf0d Figura 7. PAS.
 fiogf49gjkf0dFigura 8. KP1."> fiogf49gjkf0dFigura 8. KP1.">
figura_8 - fiogf49gjkf0d Figura 8. KP1.
 fiogf49gjkf0dFigura 9. PAGF."> fiogf49gjkf0dFigura 9. PAGF.">
figura_9 - fiogf49gjkf0d Figura 9. PAGF.
 fiogf49gjkf0dFigura 10. Neurofilamentos."> fiogf49gjkf0dFigura 10. Neurofilamentos.">
figura_10 - fiogf49gjkf0d Figura 10. Neurofilamentos.
 fiogf49gjkf0dFigura 11. Neurofilamentos."> fiogf49gjkf0dFigura 11. Neurofilamentos.">
figura_11 - fiogf49gjkf0d Figura 11. Neurofilamentos.
|
|
Discusión
fiogf49gjkf0d La galactosilceramida está a altas concentraciones en las vainas de mielina, siendo sintetizada por la oligodendroglia y las células de Schwann. La galactosilesfingosina se sintetiza directamente por galactosilación de la esfingosina. Ambas sustancias son degradadas por la enzima GALC. El pico de síntesis coincide con el periodo de formación de la mielina, durante los 18 primeros meses de vida.En esta enfermedad, la actividad de la GALC desciende al 0 a 5%, y el acúmulo de sus metabolitos origina las células globoides.
Para el diagnóstico de certeza es necesario un análisis molecular. El locus del gen de la GALC corresponde a 14q24.3-32.1, y se han detectado hasta 70 mutaciones en dicho gen. No obstante, la mayoría de los casos se corresponde con una delección de 30 kb (subtipo infantil homozigoto) que a veces se asocia a otra mutación (subtipo infantil heterozigoto) dando un fenotipo más severo. La mutación G>A809 aparece frecuentemente en pacientes con la forma tardía de la enfermedad. Si dicha aberración se presenta con la delección de 30 kb en el segundo alelo, también tendremos una forma tardía. El test genético se usa en los siguientes casos:
-Familias con mutaciones conocidas
-Diagnóstico genético prenatal
-Diagnóstico genético preimplantación
El diagnóstico prenatal se realiza mediante detección de la actividad de la GALC en cultivos de amniocitos o vellosidades coriónicas. También puede utilizarse otras técnicas, tales como la TAC, RMN, EEG, EMG, potenciales evocados, etc.
El único tratamiento curativo es el transplante de médula ósea (en tipos 3 y 4), y debe realizarse antes del deterioro neurológico. Aún así, el pronóstico es infausto, y especialmente precoz en los tipos 1 y 2.
Además de los cambios histológicos observados en la sustancia blanca puede verse degeneración neuronal en la sustancia gris; así como desmielinización, fibrosis endoneural y proliferación fibroblástica en los nervios periféricos.
|
|
Conclusiones
fiogf49gjkf0d Una historia de desarrollo normal durante los primeros meses seguida de deterioro psicomotor diferencia la enfermedad de Krabbe de otros desórdenes congénitos o perinatales no progresivos del sistema nervioso central. Debemos incluir en el diagnóstico diferencial:
1. Leucodistrofia metacromática: Proceso autosómico recesivo con mutaciones en la enzima Arilsulfatasa A, dando un fenotipo similar a la forma tardía de enfermedad de Krabbe. El diagnóstico diferencial con el Krabbe debe hacerse mediante estudio enzimático en leucocitos.
2. Gangliosidosis GM1 (sd.Morquio): Defecto en beta-galactosidasa, que presenta baja actividad sólo en leucocitos.
3. Gangliosidosis GM2 (Tay-Sachs): Deficiencia de hexosaminidasa.
4. Adrenoleucodistrofia: Podemos diferenciarla mediante RMN o por elevación en plasma de ácidos grasos de cadena larga.
5. Enfermedad de Canavan: Enfermedad autosómica recesiva con niveles elevados de N-acetilaspártico en orina.
6. Enfermedad de Pelizaeus-Merzbacher: Proceso con alteración de la mielinogénesis por alteración del gen PLP1.
7. Enfermedad de Alexander: Autosomía recesiva que presenta al microscopio fibras de Rosenthal en astrocitos, consecuencia de mutaciones en la PGFA.
En general, las diferencias deben ser establecidas desde los puntos de vista clínico, genético y bioquímico.
|
|
Agradecimientos
|
|
Bibliografía
Robbins, Patología estructural y funcional. Cotran, Kumar, Collins. Ed.McGraw Hill.
Chen YQ et al. Cloning and expression of cDNA encoding human galactocerebrosidase, the enzyme deficient in globoid cell leukodystrophy. Hum Mol Genet 2:1841-5
|
|



