|
Evolución del trasplante renal al año.
Dra. Milagros Hernández Fernández*, Dr. Alejandro S. Ruiz Méndez*, Dr. Jorge López Romero*, Téc. Yuneisy Ulacia Sánchez*
* Hospital Universitario “Arnaldo Milián Castro”, Santa Clara, Villa Clara. CUBA
|
|
Resumen
Se realizó un estudio descriptivo retrospectivo en el Hospital Universitario Provincial “Arnaldo Milián Castro” de Santa Clara con la finalidad de evaluar la evolución al año obtenida por 56 pacientes a quienes se efectuó trasplante renal en el período comprendido de junio del 2001 a abril del 2003. Se registraron variables del donante y del receptor, así como se siguieron evolutivamente con determinación seriada de la creatinina sérica. Predominaron en nuestro estudio los pacientes del sexo masculino y el grupo de edades de 35 a 48 años; así mismo se observó como complicación médica más frecuente la infección urinaria y la complicación quirúrgica predominante lo constituyó la fístula urinaria. La causa principal de pérdida del injerto se correspondió con el rechazo agudo. La sepsis generalizada fue el motivo más frecuente de mortalidad en nuestros pacientes. Se demostró una supervivencia del paciente y del injerto al año de 87.5% y 71% respectivamente. Los resultados de este estudio sugieren que la edad del donante y el receptor, el sexo del receptor, la causa de muerte del donante, los tiempos de isquemia, la causa de insuficiencia renal crónica, la solución de preservación, el tiempo en diálisis, la necrosis tubular aguda y las crisis inmunológicas de rechazo, conjuntamente con el protocolo de inmunosupresión utilizado como terapia de inducción, son variables con posible influencia en los patrones de comportamiento en la función renal del injerto y de la supervivencia a corto y mediano plazo en nuestro medio.
|
|
Introduccion
fiogf49gjkf0d El trasplante es el tratamiento de elección para los pacientes con Enfermedad Renal Crónica Terminal (ERT), avalado por el incremento en el número de trasplantes realizados y los resultados obtenidos en los últimos años 1-3
Los primeros intentos conocidos de esta actividad en humanos con la utilización de anastomosis vascular y donde se utilizaron animales que incluían primates fue Francia y Alemania, realizada por el cirujano Alexis Carrel, entre 1906 y1923, los cuales tuvieron resultados catastróficos 4-6.
Se consiguió el primer trasplante renal en un donante no idéntico en 1953 4. El trasplante renal de donantes vivos relacionados tuvo éxito en 1954, con el trasplante renal en gemelos homocigóticos realizado por Merrill y col, después de varios intentos de inducir tolerancia en el huésped mediante irradiación total del cuerpo, los resultados con dicha irradiación que se obtuvieron hicieron derivar los estudios hacia el uso de la inmunosupresión química.
En Febrero de 1970, se inició el trasplante renal en Cuba, el que contó con un grupo de cirujanos y nefrólogos, que habían adquiridos experiencias considerables en el manejo del paciente con ERT con tratamiento dialítico, así como profundos conocimientos en inmunología; los resultados obtenidos en este primer año fueron estimulantes 5.
Los logros obtenidos fueron expuestos por primeros vez en el I Congreso de la Sociedad Latinoamericana de Nefrología y V Congreso de la Sociedad Internacional de Nefrología celebrado en México en 1972.
Pese a la indudable utilidad de las técnicas dialíticas en el tratamiento de la ERT, resulta evidente que el trasplante renal constituye el tratamiento de elección para la mayoría de los pacientes y está condicionado por el número de órganos disponibles y limitado por las características del donante y del receptor. Cada vez son más los pacientes que se benefician con el mismo, gracias a la elevada tasa de donación de órganos. Los cambios en las características de los donantes y receptores traen consigo una redefinición de los criterios de inclusión de los pacientes en lista de espera para recibir dicho trasplante y afectan también otros aspectos relacionados con este tratamiento 2.
En nuestra provincia de Villa Clara se inició la realización del trasplante renal en 1979 sin obtener resultados significativos y la misma se reinició en junio del 2001, lo que nos ha motivado a evaluar su comportamiento desde junio del 2001 hasta el 30 de abril del 2003, mediante el análisis de las variables relacionadas con el donante y el receptor de trasplante renal, lo cual permitirá hacer una valoración integral de los factores que pueden influir en la supervivencia del injerto al año de realizado.
OBJETIVOS
General
Evaluar el comportamiento de la evolución del trasplante renal al año de su realización.
Específicos
1. Describir la frecuencia según sexo y grupo de edades de los pacientes trasplantados.
2. Evaluar la función renal según variables relacionadas con el donante y receptor de trasplante renal.
3. Identificar las principales complicaciones, tanto médicas como quirúrgicas presentadas en los pacientes objeto de estudio.
4. Investigar las causas de pérdida del injerto y fallecimiento en los receptores de trasplante renal.
5. Precisar la supervivencia del trasplante y el receptor al año de efectuado.
|
|
Material y Métodos
fiogf49gjkf0d Se realizó un estudio observacional descriptivo de cohorte retrospectivo. La muestra estuvo constituida por 56 pacientes que fueron trasplantados en el Hospital Universitario “Arnaldo Milián Castro” de Santa Clara en el período de Junio del 2001 a Abril del 2003 y que supervivieron al año de trasplantados con un seguimiento evolutivo de la función renal.
Variables relacionadas con el receptor Escala
Edad 20-34, 35-48, 49-59, 60 y más
Sexo Masculino – Femenino
Causa de la insuficiencia renal crónica Nefropatía Diabética, Nefroangioesclerosis, Glomerolopatias, Obstructivas, otras.
Función Inicial Inmediata - Retardada
Necrosis tubular aguda Si / No
Rechazo agudo Tiempo aparición:
1 mes
1 – 3 meses
3 – 6 meses
mayor de 6 meses
Tipo rechazo:
1. Mediado por anticuerpo
2. Rechazo agudo activo
Tubulointerticial IA, IB
Vascular II A, II B
3. Vascular Transmural III
Complicaciones médicas y quirúrgicas Cuáles
Protocolo de inmunosupresión de inducción (Est, Csa, Azat)
(Est, Csa)
(Est, IORT3, Azat, Csa)
Causa de pérdida de injerto Rechazo, Vasculares, NTA
Tiempo en diálisis Menor de 3 años, 1-3 años, 3-5 años, mayor de 5 años
Variables relacionadas con el donante Escala
Edad Mayor 50 años Menor 50 años
Sexo Masculino – Femenino
Tiempo de isquemia fría primaria Mayor de 20 horas, menor de 20 horas
Tiempo de isquemia caliente secundaria Mayor de 40 minutos, menor de 40 minutos
Solución de preservación Wisconsin, Collins, Celsio
DEFINICIONES UTILIZADAS
Función renal inmediata: se consideró a la aparición de diuresis inicial, con recuperación paulatina de la función renal, habitualmente en la primera semana.
Función renal retardada: se considera a aquellos pacientes trasplantados que t tuvieron necesidad de diálisis en la primera semana.
Necrosis tubular aguda (NTA): son los cambios estructurales que se producen a nivel tubular como consecuencia de un insulto isquémico o tóxico y que se expresa desde el punto de vista clínico con las manifestaciones del fracaso renal agudo. Su diagnóstico se basó en los datos clínicos y la confirmación histológica.
Rechazo agudo: conjunto de manifestaciones clínicas, funcionales, anatomopatológicas e inmunológicas, que pueden aparecer en el receptor de un aloinjerto renal, desde minutos hasta años más tarde, como consecuencia de una respuesta inmunitaria dirigida contra el injerto. Para su diagnóstico y clasificación se utilizó la clasificación de Banff del año 1997 7. Su diagnóstico se basó en los datos clínicos y al confirmación histológica.
Se tuvieron en cuenta los datos clínicos y de confirmación de las mismas con los resultados el estudio histológico de las biopsias realizadas en el Departamento de Anatomía Patológica del Hospital.
Protocolo de inmunosupresión de inducción: es la terapéutica de drogas inmunosupresoras utilizadas por cada centro, para evitar reacción de rechazo, tanto en la inducción, como mantenimiento del trasplante renal.
Causas vasculares de pérdida del injerto: se consideró si fue por trombosis arterial o venosa no dependiente de la reacción de rechazo.
Tiempo de isquemia fría primaria: es el período de tiempo transcurrido en el almacenamiento en frío o en perfusión automatizada.
Tiempo de isquemia caliente secundaria: se considera desde que los riñones son extraídos de la bolsa (enfriamiento), hasta el inicio de la reperfusión.
Soluciones de preservación: solución fría a 4ºc de composición conocida que tiene como base la inhibición del metabolismo celular, para evitar el edema celular, la acidosis intracelular y proveer de precursores para regenerar los componentes fosfatados de alta energía.
Índice de supervivencia del injerto al año: refleja el comportamiento de la sobre vida del 100% de los injertos realizados a través del tiempo, evaluados cada tres meses en el período de un año.
Índice de supervivencia del paciente al año: es el que refleja el comportamiento de la sobrevida del paciente durante el período de un año (curvas de supervivencia del Kaplan - Meyer).
Para la evaluación del comportamiento de la función renal se emplearon los valores de la media y la desviación estándar de la creatinina con una valoración trimestral, ya que la determinación de la creatinina sérica expresado en micromoles por litros es la que se utiliza en nuestro medio.
|
|
Análisis y discusión de los resultados
fiogf49gjkf0d En la (Tabla 1) se distribuyen los pacientes según edad y sexo. El mayor número de trasplantes renales se efectuaron en el grupo de edades de 35 – 48 años con 22 pacientes, le continuó en orden de frecuencia el grupo de 20 – 34 años con 17 enfermos. Estos resultados coinciden con lo informado en otros estudios donde se plantea la existencia de gran cantidad de pacientes aptos para trasplantes renal en los programas de diálisis en estos grupos de edades7.
En nuestro país desde 1989 la diálisis es irrestricta y el acto de trasplante renal se ha extendido en edad 8. Diversos autores señalan que a medida que aumenta la edad en pacientes con insuficiencia renal crónica en tratamiento dialítico se incrementa su morbilidad en los métodos depuradores y aparecen mayores riesgos durante la evolución del trasplante, lo cual puede contribuir a la disminución del número de pacientes trasplantados en edades mayores; 8-10 ello es válido también para nuestro estudio.
Por otra parte, en la medida en que se ha adquirido experiencia en el trasplante renal y con la introducción de nuevas drogas inmunosupresoras, los resultados obtenidos en pacientes de edades avanzadas, son similares a los encontrados en pacientes de edades más jóvenes 11.
Véase que el sexo masculino predomina en todos los grupos de edades en nuestro estudio; elevada significación alcanzó el grupo de 60 y más, con 7 de 8 pacientes trasplantados. Ello coincide con la literatura consultada donde se refleja que puede estar en relación con la mayor incidencia en el varón, de algunas enfermedades que son causas importante de insuficiencia renal crónica 12, 13.
En la tabla 2 se refleja el comportamiento de la función renal según la edad del donante, obsérvese que se comporta mejor los valores de la creatinina sérica en los receptores que recibieron injertos de donantes con edad inferior a 50 años, a los 3, 6, 9 y 12 meses respectivamente, sin que existieran diferencias significativas, en comparación con los receptores que se beneficiaron de aloinjertos de donantes mayores de 50 años, desde el punto de vista estadístico, p>0,05. Estos resultados de mejor evolución en los donantes menores de 50 años, también han sido evidenciados por otros grupo de autores que argumentan que los injertos procedentes de donantes de edad avanzada, son más susceptibles a la isquemia fría y tienen disminuida su reserva renal funcional, como normalmente ocurre con el incremento de la edad en sujetos sanos, lo que puede disminuir la supervivencia del injerto a corto, mediano y largo plazo 14-16.
En un estudio realizado por Gjerston con más de 30 000 trasplantados de donantes cadáveres, se comprobó que los donantes cuyas edades eran superior de 55 años, tenían una tasa de supervivencia de 1 y 2 años de 10 % y 14% a los logrados con donantes entre los 16 y 45 años de edad 16.
En estudios publicados por Eurotrasplant han evidenciado que los injertos de donantes de edad avanzada, aún con buena compatibilidad HLA, tienen una vida media, y claramente inferior a la obtenida con injertos de donantes más jóvenes y peor compatibilidad 6, 9 y 10 años 15. Otros autores no encuentran claras diferencias en la supervivencia de los injertos al menos a corto plazo18-20.
Nuestro grupo ha comenzado recientemente a practicar biopsias renales preimplantes a todos los donantes mayores de 50 años, con el objetivo de valorar si existe más del 20 % de esclerosis glomerular y fibrosis importante, lo que nos permite una mejor evaluación de los órganos a trasplantar.
En la tabla 3 se muestra el comportamiento de la función renal según el sexo del donante, se aprecia desde los primeros meses un mejor comportamiento de los valores de la creatinina sérica en los receptores que recibieron trasplante renal de donantes provenientes del sexo masculino, a los 3, 6, 9 y 12 meses respectivamente. Nuestro estudio se corresponde con resultados obtenidos en la bibliografía consultada donde se plantea que el sexo femenino puede tener un efecto negativo en la supervivencia del injerto, sobre todo en receptores varones. Una explicación para este hecho puede estar en una mayor expresión de antígenos de histocompatibilidad en los injertos femeninos y sobre todo en el aporte de una menor masa renal funcional si se produce una desproporción crítica entre la masa renal aportada y el índice corporal del receptor, lo que lo hace más susceptible a la hiperfiltración y glomeruloesclerosis 17, 18.
Estudios realizados por Shertow y Brenner: encontraron diferencias significativas entre receptores de riñones de mujeres, comparadas con las recibidas de donantes masculinos. En el primer año la supervivencia fue de un 82,3% para los receptores de mujeres y de 85,3% para hombres, la diferencia fue más significativa a los 3 años 69,8% y 74,8% respectivamente 22.
Cómo se comporta la función renal según la causa de la insuficiencia renal crónica es descrita en la tabla 4. Véase mayor incremento en los valores de la creatinina sérica en los trasplantados con antecedentes de nefropatía vascular, enfermedad glomerular primaria y diabetes mellitus respectivamente y con diferencias altamente significativa desde el punto de vista estadístico. La nefropatía vascular pretrasplante y postrasplante constituye un factor de riesgo para la supervivencia del injerto renal 22-24; lo que puede estar en relación con el grado de afectación previa sobre el cual se puede añadir los efectos que sobre la vasculatura ejerce el tratamiento inmunosupresor, el cual acelera el proceso de la aterogénesis que contribuyendo a la nefropatía crónica del aloinjerto 19.
El aumento de la creatinina sérica en los pacientes trasplantados con enfermedad glomerular de base, con relación al resto de las enfermedades originarias de la insuficiencia renal crónica, no se corresponde con lo consultado en la bibliografía, para el 1er. año de evolución en nuestro estudio, ya que se plantea que la pérdida del injerto por recurrencia de la enfermedad glomerular primaria, no es habitual, excepto en la hialinosis focal y segmentaria. La recurrencia de la enfermedad renal de base, puede ser hasta de 19% y en cualquier caso la pérdida del injerto por ese motivo es rara y no excede del 4% del total; 17 por lo que en nuestro trabajo la elevación de la creatinina sérica durante el año puede estar asociada con otros factores que están relacionados con la evolución del trasplante y también por un número reducido de pacientes trasplantados con estas enfermedades en nuestro estudio.
Un grupo particular lo constituyen los diabéticos que se trasplantan, en los cuales nuestro grupo ha tenido resultados satisfactorios, pues se han obtenido tasas de supervivencia al año superior al 85%, lo que coincide con lo informado por diferentes autores, 17 que han obtenido tasas de un 85% al año. En nuestro trabajo estos resultados pudieron estar influenciados por la edad más joven con que se trasplantan y un mayor cuidado en la selección del donante.
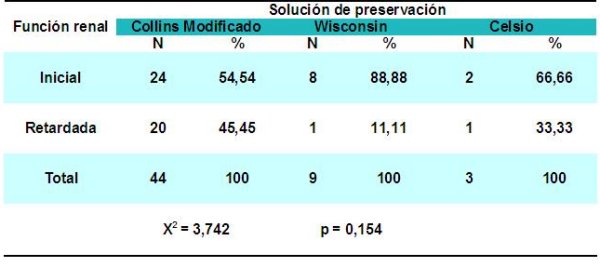
La tabla 5 representa el comportamiento de la función inicial del injerto según el tipo de solución de preservación utilizada, donde se aprecia que 88,88% y 66,66% de los pacientes en quienes se utilizaron como preservación, la solución de Wisconsin y Celsio respectivamente tuvieron función renal inicial, por lo que ambas superan a los pacientes en que emplearon la solución de Collins modificado, donde sólo 54,54% de los pacientes presentaron función inicial. Estos resultados se corresponden con un estudio prospectivo rabdomizado y multicéntrico realizado a nivel europeo, que comparó la preservación con solución de Eurocolins y Wisconsin. En el presente estudio se consideraron varios factores y se observó una reducción del 10% de la necesidad de diálisis en el grupo en que se usó Wisconsin contra aquel donde se utilizó Eurocolins 27, 28.
Todos los órganos mantenidos en preservación incluso tras breves períodos sufren un cierto grado de lesión, pero generalmente ésta es reversible, las causas de este daño no están muy claras. El fundamento de la preservación es la hipotermia, la cual reduce la velocidad de las enzimas intracelulares y la liberación de radicales libres de oxígenos 29, 30.
En el mayor número de nuestros enfermos se utiliza como solución de preservación el Collins modificado, que se obtiene añadiendo dextrosa al 50% a la solución; sólo un reducido número se beneficia con otras soluciones del tipo del Celsio, Wisconsin y Custodiol.
Algunos autores apuntan que estas soluciones superan en efectividad al Collins modificado, cuando el tiempo de preservación del órgano es superior a 20 horas 20, 31-34.
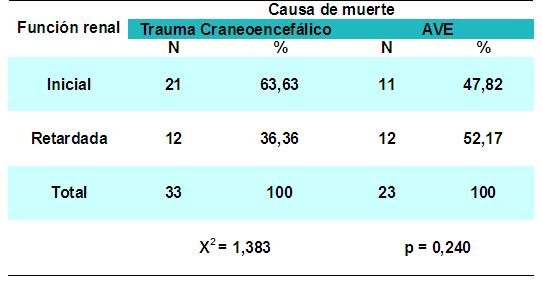
La causa de muerte del donante según función inicial del injerto se evidencia en la tabla 6, donde se observa un número superior de pacientes con trauma craneoencefálico (21 para 63,63%) con respecto a 11 enfermos con accidente vascular encefálico (47,82%). Estos resultados, aunque pueden estar influidos por otros factores que determinan la función inicial del injerto en su conjunto, ponen de manifiesto que los riñones provenientes de los donantes cuya causa de muerte es el accidente vascular encefálico, pudieran tener mayor afectación del árbol vascular, que lo hacen más susceptibles a los eventos que se relacionan con el trasplante 34-36.
En estudios realizados acerca de la supervivencia del injerto a corto plazo en relación con la causa de muerte del donante, se encuentra que la supervivencia al año en aquellos injertos recibidos de donantes cadáveres con trauma craneoencefálico, tenían una supervivencia del 86%, superior a aquellos que recibían injertos procedentes de cadáveres con diagnóstico de accidente vascular encefálico 83% 31, 32, 34.
Otros, como Valderrábano, 17 afirman que los injertos procedentes de donantes fallecidos por causa no traumática, pueden tener resultados inferiores a los logrados con los donantes fallecidos por traumatismo y exponen una diferencia en la supervivencia del injerto de 6,7% al año, aunque la frecuencia de accidente vascular encefálico se incrementa con la edad, su efecto sobre la supervivencia del injerto parece ser independiente de ese factor, puesto que se mantienen en todos los grupos de edades estudiados, sin distinción de géneros.
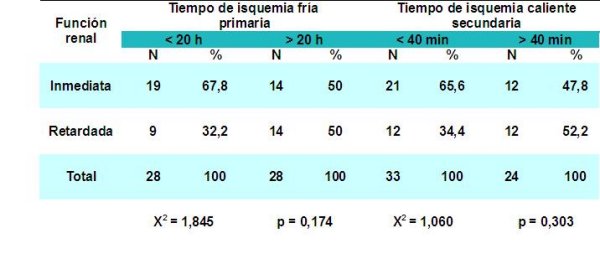
En el comportamiento de la función inicial del injerto con relación a los tiempos de isquemia, (tabla 7) obsérvese que ésta es mejor en aquellas personas con tiempo de isquemia fría inferiores a las 20 horas, para 67,8%, así como un mayor número de casos 65,6%, con función renal inicial en los que presentaron tiempos de revascularización inferiores a los 40 minutos. En otros estudios se han confirmado los resultados anteriormente señalados, ya que afirman que el tiempo de isquemia fría prolongada se relaciona con retraso en la función inicial del injerto e influencia en su pronóstico a corto plazo. El incremento de los tiempos de isquemia caliente se asocia a necrosis tubular aguda y se ha correlacionado con episodios de rechazo agudo en el primer año postrasplante porque induce mayor inmunogenicidad del injerto 17, 31, 33, 34.
La duración de los eventos de isquemia se relaciona con los daños en la reperfusión; largos períodos de isquemia se asocian con grandes daños en la reperfusión 35-37.
Azuma H, y col 38 reportaron que el tiempo de isquemia fría prolongado tuvo efectos significativamente perjudiciales, tanto a corto como a largo plazo en la supervivencia del injerto de receptores de cadáver.
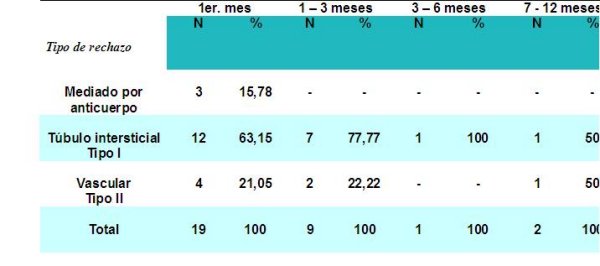
La tabla 8 describe cómo se comportó el tipo de rechazo según el tiempo de aparición, se observa que el rechazo tubuloinstersticial (Tipo I) se presentó con mayor frecuencia (12 pacientes para 63,15%) en el primer mes de trasplante y en 7 pacientes para 77,77% en el período comprendido de 1 a 3 meses; la frecuencia de presentación de rechazo después de este período, disminuyó. En la bibliografía consultada, Ramírez 39 informa que cerca del 50% de los receptores de donantes cadavéricos y 40% de los receptores de donantes vivos presentan un episodio de rechazo en los primeros 6 meses postrasplantes. Los rechazos después del primer año son más raros y se hallan principalmente en pacientes con inmunosupresión inadecuada (por ejemplo: niveles séricos de ciclosporina subterapéuticos.
En nuestro trabajo se expresa un por ciento de rechazo superior al consultado en la bibliografía, lo cual consideramos que puede estar relacionado, con no tener en cuenta el porcentaje de sensibilización actualizado de nuestros receptores y el tipaje con anticuerpos antileucocitarios humanos (HLA), al utilizarse criterios geográficos y inmediatez para el trasplante renal, además de no usarse en todos los casos tratamiento de inducción con anticuerpos monoclonales y policlonales.
El rechazo agudo es el predictor inmunológico más significativo de la evolución del trasplante renal y de la pérdida del injerto, su aparición es más frecuente en los primeros tres meses, aunque puede aparecer en cualquier momento, tras el trasplante renal 40.
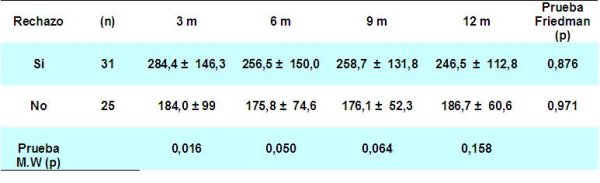
La tabla 9 expresa el comportamiento de la creatinina sérica según crisis de rechazo agudo durante el año, a lo largo del estudio hubo un mejor comportamiento de la función renal, expresada por los valores de la creatinina sérica en aquellos pacientes sin episodios de rechazo y fueron más significativas las diferencias desde el punto de vista estadístico, según prueba Mann Whiney, en el período de 1 a 6 meses p < 0,05.
Los resultados obtenidos en nuestro trabajo coinciden con estudios publicados por otros grupos, donde se evidencia que el rechazo es el predictor inmunológico más significativo para el desarrollo de disfunción crónica y pérdida del injerto renal 41.
Otros autores 17 asesoran que el rechazo agudo tiene un efecto sobre la supervivencia del injerto a corto y largo plazo, y que constituye uno de los principales determinantes del trasplante sobre todo en donantes muy jóvenes y ancianos. Un único episodio de rechazo agudo precoz, puede reducir la supervivencia del injerto en 18% y 27% según proceda de donante vivo o cadáver respectivamente.
Chertow GM 22 reportó que en los receptores de trasplante renal de donante cadáver, el riesgo de pérdida del injerto con un episodio de rechazo fue de 9%, con dos episodios fue de 38% y con tres episodios de rechazo, el riesgo de pérdida del injerto se incrementó en 50%.
En el presente estudio no consideramos el número de rechazos ni la severidad de los mismos, con el grado de disfunción al año en los riñones trasplantados, por ser considerada nuestra investigación una evolución general del comportamiento de trasplante renal al año de efectuada.
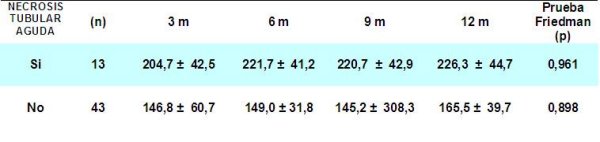
Se observa en la tabla 10 el comportamiento de la función renal según la Necrosis Tubular Aguda (NTA), donde desde los inicios es evidente que aquellos pacientes que no tuvieron antecedentes de la misma, la creatinina sérica a los 12 meses tuvo valores de 165.5 con respecto a 226.3 en los pacientes con NTA. Estos resultados están validados por el argumento de diversos autores que plantean que la necrosis tubular aguda puede disminuir significativamente la supervivencia del injerto 17.
En una serie de supervivencia al año del injerto, donde se interrelaciona la NTA y el rechazo; se planteó una supervivencia de 51% en contraposición al 88% de los injertos con buena función inicial sin rechazo 17. En nuestro trabajo el 50% de las biopsias realizadas en el primer mes, tenían asociados elementos estructurales de necrosis tubular aguda, con lesiones de rechazo a predominio tubulointersticial. Ello se corresponde con lo que exponen algunos autores con respecto a una mayor incidencia de rechazo agudo en los pacientes con el padecimiento, posiblemente por sobrexposición de antígenos de histocompatibilidad por parte de las células tubulares isquémicas 17, 43, 44.
Se ha postulado que a diferencia de lo que ocurre con el proceso en la población general, la NTA postrasplante renal, puede dejar un daño irreversible manifestado por una menor función renal final, 43,45 y efectivamente en nuestros pacientes que la padecían, la creatinina fue más elevada que en los pacientes trasplantados con función inicial del injerto.
Debemos señalar que hay autores que aclaran que la NTA se asocia con mayor frecuencia a donantes mayores de 50 años y de causa vascular de muerte, por lo que sugieren que esta pudiera ser más bien un marcador de donantes de menor calidad, que las causas de las deficiencias finales del riñón 45, 46.
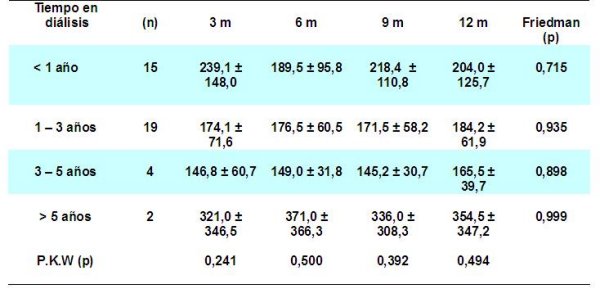
La creatinina sérica según el tiempo en diálisis y su comportamiento se describen en la tabla 11. Fue superior en la evolución de la función renal, en los pacientes que se mantuvieron bajo tratamiento dialítico con un tiempo inferior a los 5 años y existió un ascenso en el valor de las mismas en aquellos con un tiempo en diálisis superior a los 5 años. Aunque en este grupo se efectuaron dos trasplantes renales. Lo anterior se corresponde con estudios, donde expresan que los pacientes con una mayor longevidad en métodos depuradores, suelen tener mayor grado de sensibilización anti HLA, un mayor número de transfusiones y un estado micro inflamatorio crónico más severo, que pueden interferir en la supervivencia del injerto 34, 47.
Los efectos de la uremia en los órganos y sistemas, traen consigo una serie de alteraciones y anormalidades con repercusión sistémica; por ejemplo las anormalidades en el metabolismo lipídico, la hipertensión arterial, la hipertrofia de ventrículo izquierdo (como factor de riesgo de cardiopatía isquémica), disfunción gastrointestinal (que favorecen la malnutrición), el hiperparatiroidismo, con las alteraciones del metabolismo calcio y fósforo, las infecciones virales sobre todo por virus hepatitis B y C que son causa de hepatopatías crónicas, los trastornos inmunológicos. Todos estos factores se incrementan en la medida que el paciente se encuentra bajo tratamiento dialítico, 48-51 y tienen una repercusión en la supervivencia del injerto, postrasplante renal. Muchas de las alteraciones en los diferentes aparatos y sistemas regresan, pero muchas de éstas se perpetúan, después del mismo, asociado al tratamiento inmunosupresor, dentro de ellas las alteraciones del metabolismo de los lípidos, las alteraciones cardiovasculares, la hipertensión arterial, el hiperparatiroidismo, las hepatopatías por virus C y el estado de inmunosupresión, así como otras que aparecen de Novo tras esta terapéutica 53-57; que todas tienen una influencia en la supervivencia del injerto y del paciente a corto y mediano plazo.
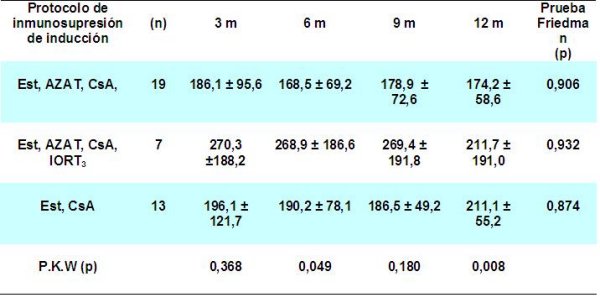
La tabla 12 muestra el comportamiento de la función renal según protocolo de inmunosupresión de inducción utilizado, véase un mejor comportamiento en la cifra de creatinina sérica a las 6, 9 y 12 meses en el grupo de pacientes donde se usaron como protocolo de inducción triple simultánea con esteroides (Est), Azatioprina (Azt), Ciclosporina A (Csa), con respecto a los enfermos en que se utilizó la terapia cuádruple secuencial que incluyó al anticuerpo monoclonal IORT3 y a aquellos en que se usó la doble simultánea con (Est, Csa). Estos resultados que se hallaron en nuestro estudio están favorecidos, porque el grupo de pacientes en que se usó la terapia triple simultánea, tenían como condición común tiempos de isquemia fría inferiores a 20 horas. En el caso de los pacientes en que se utilizó la terapia cuádruple secuencial incluida en su protocolo de inducción, fue en aquellos con tiempos de isquemia fría de más de 20 horas, retrasplantes o pacientes con alto riesgo inmunológico. Protocolos similares se aplican en varios países en que coinciden nuestros resultados con lo que ellos publican 36.
Otros autores 33 señalan resultados superiores con el uso de los anticuerpos monoclonales y policlonales, en pacientes sin alto riesgo inmunológico.
Diversos investigadores 36, 59, 60 dicen que en condiciones iguales el uso de la terapéutica cuádruple secuencial con inclusión de los anticuerpos monoclonales y policlonales la disfunción del injerto al año, es menor con relación al resto de los pacientes.
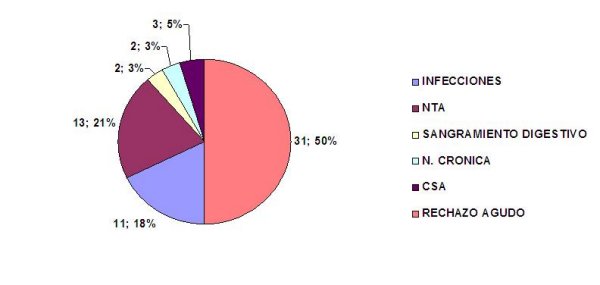
El (Gráfico 1) ilustra el comportamiento de las complicaciones médicas durante el primer año de trasplante renal. El rechazo agudo se presentó con mayor frecuencia en 31 pacientes para 50%, le sigue en orden de frecuencia, con 13 enfermos, la NTA que representa 20,9% y en tercer lugar se ubicaron las infecciones en 11 para 17,7%. Estos resultados son similares a los publicados por Ramírez 61 que plantea que cerca del 50% de los receptores de donantes cadáveres presentan al menos, un episodio de rechazo en los primeros seis meses postrasplantes, lo cual puede explicar el porqué el rechazo agudo es la complicación médica más frecuente.
En nuestro trabajo en alguna parte se hacen comentarios acerca de algunos factores que pudieran estar favoreciendo las crisis inmunológicas de rechazo.
La NTA está incluida dentro de la causa más frecuente de disfunción renal en el postrasplante inmediato oscilan entre 10 y 60% con duración desde unos pocos días hasta varias semanas 63. Como se aprecia se obtuvieron por cientos aceptables en cuanto a esta complicación, al compararlo con la bibliografía consultada. Nuestro criterio es que está favorecido porque el tiempo de isquemia fría promedio y de revascularización con que trasplanta nuestro grupo es de 20 horas y 45 minutos respectivamente.
La infección en el trasplante renal sigue siendo directa e indirectamente la causa más frecuente de morbilidad y mortalidad 64 y su correcto cuidado y atención es un factor esencial. Esto coincide con los resultados prácticos obtenidos en nuestro trabajo donde las infecciones fueron la principal causa de morbilidad.
Las infecciones por sistema según tiempo de aparición están relacionadas en la tabla 13. Hubo un predominio de la infección urinaria en 2 pacientes para 40% en el período menor de un mes, 3 (60%) en un período de 1 a 6 meses y uno en un tiempo mayor de 6 meses, siguiendo en orden de frecuencia las infecciones respiratorias (bronconeumonías), con 2 enfermos (4%) en el período menor de 6 meses y 2 (40%) entre 1 y 6 meses.
El paciente que recibe trasplante renal parte de una situación de inmunodeficiencia provocada por la uremia y el tratamiento dialítico, a ello se añaden otros factores como la rotura de la barrera cutáneomucosa que produce el acto quirúrgico, los fármacos inmunosupresores, la infección por determinados virus que amplifican el estado de inmunosupresión, todo ello en su conjunto configuran una situación de gran susceptibilidad a las infecciones.
Nuestros resultados se corresponde con lo planteado por otros autores que expresan que la infección del tracto urinario es común después del trasplante renal; en muchos casos las infecciones se corresponden con gérmenes gram negativos, y los factores de riesgo se encuentran en los catéteres vesicales, traumatismo del uréter durante la cirugía y las anomalías asociadas al trasplante renal (como el reflujo vesicoureteral y vejiga neurogénica) sobre todo en pacientes diabéticos, y a la inmunosuporesión 65-67. La infección del tracto urinario constituye la infección más frecuente del trasplante renal que afecta a más del 90% de los pacientes en las series clásicas y con una incidencia entre 5 y 26% en las series actuales 64.
Según estudios publicados, la infección del tracto respiratorio inferior, afecta de un 10 a un 40% de estos pacientes y es en sí misma la causa más frecuente de infección grave y de muerte asociadas en el trasplante renal, lo que avala los resultados obtenidos en nuestro trabajo 17.
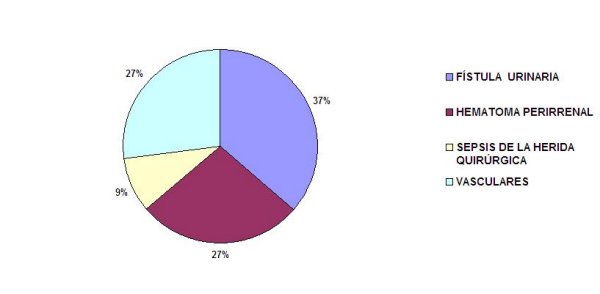
El (Gráfico 2) muestra las complicaciones quirúrgicas según la frecuencia de presentación. La fístula urinaria con 4 pacientes para 7,1% fue la que se presentó en mayor número, siguiendo en orden de frecuencia el hematoma perirrenal con 3 para 5,3%. En el caso de fístula urinaria nuestros resultados se corresponden con lo planteado por diferentes autores quienes reflejan que su incidencia es de 3 a 10%, aunque en la actualidad con una mejor técnica quirúrgica, tanto de extracción como de implante tiene una tendencia importante a disminuir su frecuencia en todos los grupos. Estas fístulas pueden ser caliciales, piélicas, ureterales y vesicales. Esta complicación urológica le concierne un pronóstico reservado al trasplante renal.
Con relación a la hemorragia postoperatoria como causa de hematoma perirrenal, nuestro grupo mostró 5,3%, valor por encima de lo que reportan otros autores 33, 34, 37; otros, expresan resultados similares a los nuestros y los relacionan con el sangramiento de pequeños vasos del hilio renal, que no se manifiesta inicialmente, por el cierre aparente causado por el vasoespasmo, donde después de la intervención quirúrgica cuando la perfusión mejora, estos vasos hiliares pueden sangrar 68.
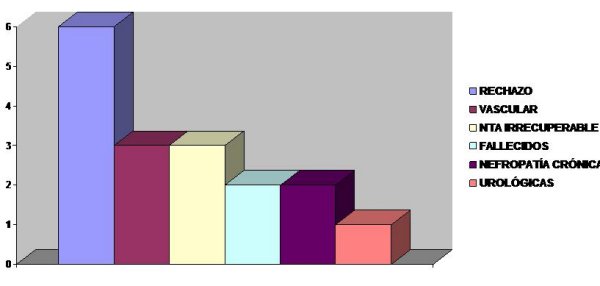
El (Gráfico 3) representa las causas de pérdidas del aloinjerto. En él se observa que el rechazo constituyó la principal causa de pérdida del injerto con 6 pacientes (35,2%); le sigue en orden descendente la causa vascular con 17% y ocupó el tercer lugar la NTA irrecuperable con 17,6%. Aunque nuestros resultados particulares están por encima de los de esta serie, se le atribuye al alto por ciento del rechazo que anteriormente fue descrito en nuestro trabajo y que se relacionaron con no contar con algunos factores para el implante como el HLA y el por ciento de sensibilización actualizado de nuestros receptores.
En cuanto a la causa vascular está planteado en la literatura, que la misma presenta una baja incidencia como complicación quirúrgica 31, 33, 34 lo cual no coincide con nuestros resultados. Consideramos que puede estar relacionado con el número de enfermos estudiados y con el efecto centro del hospital.
Con respecto a la NTA, fue incluida en nuestro estudio como causa de pérdida del injerto, con afectación de la supervivencia al año, lo que otros autores no la consideran y la ubican en el grupo de los riñones que nunca funcionaron 29, 30.
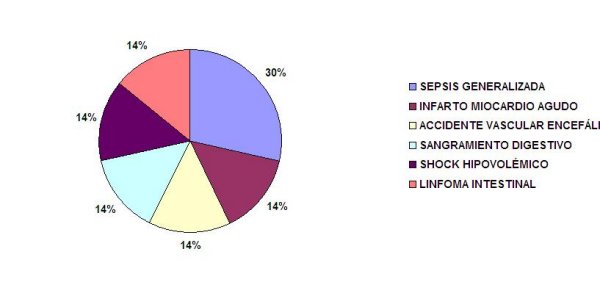
El (Gráfico 4) describe las causas de muerte del receptor en el primer año del trasplante; fue la sepsis generalizada la principal causa con 30%, con un comportamiento similar en los otras causas para 14% de presentación, como infarto agudo del miocardio, accidente cerebrovascular, linfoma shock hipovolémico y sangramiento digestivo respectivamente. Lo expuesto se corresponde con lo planteado por Ramos: 31 donde en las mayoría de las series publicadas la causa más importante de muerte después del trasplante renal ha sido la infección y la enfermedad cardíaca, seguida de una etiología variada que incluye patología gastrointestinal, pulmonar, neoplasias, enfermedad hepática, lo cual se corresponde con nuestro estudio. Ello se debe a que la terapéutica inmunosupresora desempeña una función cardinal en la aparición de complicaciones infecciosas en los períodos de máxima inmunosupresión, la cual se asocia con infecciones bacterianas, sepsis por citomegalovirus, bacterias y hongos oportunistas que constituyen un riesgo para la vida del trasplantado por ser consideradas como graves 64, 67.
En el (Gráfico 5) véase el comportamiento de la supervivencia actuarial del injerto y el paciente trasplantado al año. Se evidencia que las cifras presentadas son de 71% y 87,5% respectivamente. En cuanto a la supervivencia del injerto al año después del trasplante de donante cadáver (primer trasplante) bajo algún régimen que incluya ciclosporina como droga primaria es del 85% 31, 37. Como hemos planteados nuestra investigación muestra resultados inferiores a los estudios, lo cual pudiera estar en relación con la alta incidencia de rechazos presentados y la utilización de una ciclosporina con mucha variabilidad en la absorción, biodisponibilidad y dificultades en el seguimiento de la monitorización de sus niveles en sangre, y quizás al efecto centro por el que ha transitado nuestro grupo 17, 34; además el papel de la histocompatibilidad dado por antígeno leucocitario humano (HLA) es controvertido; 33, 34 para el primer año. Se afirma que los riñones perfectamente compatibles (6 antígenos) tienen un índice de supervivencia de injerto al año del 95%, sin embargo para cualquier otra compatibilidad que no sea perfecta la función del HLA no ha tenido impacto; lo cierto es que nuestro colectivo no puede considerar éste por la inestabilidad de los Kiz para realizar el HLA en los receptores.
Actualmente muchos grupos no incluyen para el cálculo de la supervivencia los riñones que nunca funcionaron en los primeros meses 13, 29, 30; aspecto este que se tuvo en consideración en este trabajo, donde se incluyeron todo los pacientes trasplantados.
Con la incorporación de inmunosupresores más potentes en la década del 90, como tacrolimus, en experiencia multicéntrica, se ha reportado un índice de supervivencia del injerto al año, en donantes cadavéricos en el primer trasplante de adulto de 91% 31. Nuestro equipo no tiene experiencia con este fármaco por lo costosa que resulta su adquisición.
La supervivencia actuarial al año, de los pacientes en los últimos 10 años en el trasplante renal de donante cadavérico ha permanecido estable entre 92 y 95% 31; importante contribución tienen los últimos inmunosupresores como el tacrolimus. Los resultados que aquí se exponen están por debajo de lo consultado, aunque coincidimos en que las infecciones aparecen como primera causa de muerte en el primer año. Estos resultados inferiores pueden estar relacionados en nuestro grupo con el uso de inmunosupresores menos potentes y al efecto centro por el que hemos transitado.
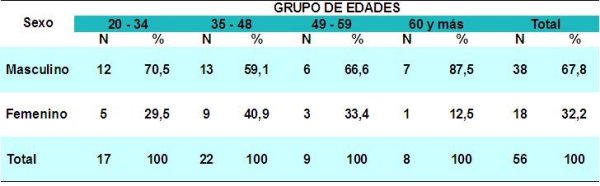 fiogf49gjkf0dTabla 1: DISTRIBUCIÓN DE LOS PACIENTES SEGÚN SEXO. X2 = 7, 143 p = 0,008
"> fiogf49gjkf0dTabla 1: DISTRIBUCIÓN DE LOS PACIENTES SEGÚN SEXO. X2 = 7, 143 p = 0,008
">
Tabla 1 - fiogf49gjkf0d Tabla 1: DISTRIBUCIÓN DE LOS PACIENTES SEGÚN SEXO. X2 = 7, 143 p = 0,008
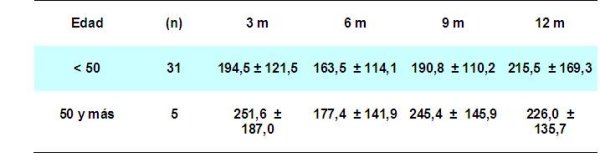 fiogf49gjkf0dTabla 2: MEDIA Y DESVIACIÓN ESTÁNDAR DE LA CREATININA SEGUN EDAD."> fiogf49gjkf0dTabla 2: MEDIA Y DESVIACIÓN ESTÁNDAR DE LA CREATININA SEGUN EDAD.">
Tabla 2 - fiogf49gjkf0d Tabla 2: MEDIA Y DESVIACIÓN ESTÁNDAR DE LA CREATININA SEGUN EDAD.
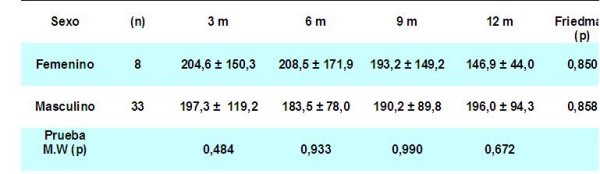 fiogf49gjkf0dTabla 3: MEDIA Y DESVIACIÓN ESTÁNDAR DE CREATININA SEGUN SEXO"> fiogf49gjkf0dTabla 3: MEDIA Y DESVIACIÓN ESTÁNDAR DE CREATININA SEGUN SEXO">
Tabla 3 - fiogf49gjkf0d Tabla 3: MEDIA Y DESVIACIÓN ESTÁNDAR DE CREATININA SEGUN SEXO
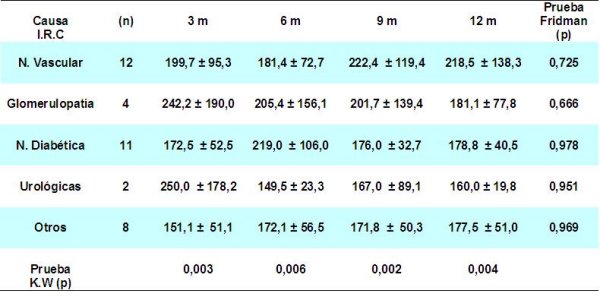 fiogf49gjkf0dTabla 4: MEDIA Y DESVIACIÓN ESTÁNDAR DE CREATININA SEGÚN CAUSA DE IRC"> fiogf49gjkf0dTabla 4: MEDIA Y DESVIACIÓN ESTÁNDAR DE CREATININA SEGÚN CAUSA DE IRC">
Tabla 4 - fiogf49gjkf0d Tabla 4: MEDIA Y DESVIACIÓN ESTÁNDAR DE CREATININA SEGÚN CAUSA DE IRC
 fiogf49gjkf0dTabla 5: FUNCIÓN INICIAL SEGÚN SOLUCIÓN DE PRESERVACIÓN"> fiogf49gjkf0dTabla 5: FUNCIÓN INICIAL SEGÚN SOLUCIÓN DE PRESERVACIÓN">
Tabla 5 - fiogf49gjkf0d Tabla 5: FUNCIÓN INICIAL SEGÚN SOLUCIÓN DE PRESERVACIÓN
 fiogf49gjkf0dTabla 6. FUNCIÓN INICIAL DEL INJERTO SEGÚN CAUSA DE MUERTE"> fiogf49gjkf0dTabla 6. FUNCIÓN INICIAL DEL INJERTO SEGÚN CAUSA DE MUERTE">
Tabla 6 - fiogf49gjkf0d Tabla 6. FUNCIÓN INICIAL DEL INJERTO SEGÚN CAUSA DE MUERTE
 fiogf49gjkf0dTabla 7:FUNCIÓN RENAL INICIAL DEL INJERTO Y TIEMPO DE ISQUEMIA"> fiogf49gjkf0dTabla 7:FUNCIÓN RENAL INICIAL DEL INJERTO Y TIEMPO DE ISQUEMIA">
Tabla 7 - fiogf49gjkf0d Tabla 7:FUNCIÓN RENAL INICIAL DEL INJERTO Y TIEMPO DE ISQUEMIA
 fiogf49gjkf0dTabla 8: TIPO DE RECHAZO Y TIEMPO DE APARICIÓN"> fiogf49gjkf0dTabla 8: TIPO DE RECHAZO Y TIEMPO DE APARICIÓN">
Tabla 8 - fiogf49gjkf0d Tabla 8: TIPO DE RECHAZO Y TIEMPO DE APARICIÓN
 fiogf49gjkf0dTabla 9: MEDIA Y DESVIACIÓN ESTÁNDAR DE LA CREATININA Y RECHAZO AGUDO"> fiogf49gjkf0dTabla 9: MEDIA Y DESVIACIÓN ESTÁNDAR DE LA CREATININA Y RECHAZO AGUDO">
Tabla 9 - fiogf49gjkf0d Tabla 9: MEDIA Y DESVIACIÓN ESTÁNDAR DE LA CREATININA Y RECHAZO AGUDO
 fiogf49gjkf0dTabla 10:MEDIA Y DESVIACIÓN ESTÁNDAR DE LA CREATININA Y NECROSIS TUBULAR AGUDA"> fiogf49gjkf0dTabla 10:MEDIA Y DESVIACIÓN ESTÁNDAR DE LA CREATININA Y NECROSIS TUBULAR AGUDA">
Tabla 10 - fiogf49gjkf0d Tabla 10:MEDIA Y DESVIACIÓN ESTÁNDAR DE LA CREATININA Y NECROSIS TUBULAR AGUDA
 fiogf49gjkf0dTabla 11: MEDIA Y DESVIACIÓN ESTÁNDAR DE LA CREATININA Y TIEMPO EN DIÁLISIS"> fiogf49gjkf0dTabla 11: MEDIA Y DESVIACIÓN ESTÁNDAR DE LA CREATININA Y TIEMPO EN DIÁLISIS">
Tabla 11 - fiogf49gjkf0d Tabla 11: MEDIA Y DESVIACIÓN ESTÁNDAR DE LA CREATININA Y TIEMPO EN DIÁLISIS
 fiogf49gjkf0dTabla 12: MEDIA Y DESVIACIÓN ESTÁNDAR DE LA CREATININA Y`PROTOCOLO DE INMUNOSUPRESIÓN"> fiogf49gjkf0dTabla 12: MEDIA Y DESVIACIÓN ESTÁNDAR DE LA CREATININA Y`PROTOCOLO DE INMUNOSUPRESIÓN">
Tabla 12 - fiogf49gjkf0d Tabla 12: MEDIA Y DESVIACIÓN ESTÁNDAR DE LA CREATININA Y`PROTOCOLO DE INMUNOSUPRESIÓN
 fiogf49gjkf0dGráfico 1: PRESENTACIÓN DE LAS COMPLICACIONES MÉDICAS"> fiogf49gjkf0dGráfico 1: PRESENTACIÓN DE LAS COMPLICACIONES MÉDICAS">
Gráfico 1 - fiogf49gjkf0d Gráfico 1: PRESENTACIÓN DE LAS COMPLICACIONES MÉDICAS
 fiogf49gjkf0dGráfico 2: PRESENTACIÓN DE LAS COMPLICACIONES QUIRURGICAS"> fiogf49gjkf0dGráfico 2: PRESENTACIÓN DE LAS COMPLICACIONES QUIRURGICAS">
Gráfico 2 - fiogf49gjkf0d Gráfico 2: PRESENTACIÓN DE LAS COMPLICACIONES QUIRURGICAS
 fiogf49gjkf0dGráfico 3: CAUSA DE PÉRDIDA DEL INJERTO"> fiogf49gjkf0dGráfico 3: CAUSA DE PÉRDIDA DEL INJERTO">
Gráfico 3 - fiogf49gjkf0d Gráfico 3: CAUSA DE PÉRDIDA DEL INJERTO
 fiogf49gjkf0dGráfico 4: CAUSAS DE MUERTE EN EL PRIMER AÑO"> fiogf49gjkf0dGráfico 4: CAUSAS DE MUERTE EN EL PRIMER AÑO">
Gráfico 4 - fiogf49gjkf0d Gráfico 4: CAUSAS DE MUERTE EN EL PRIMER AÑO
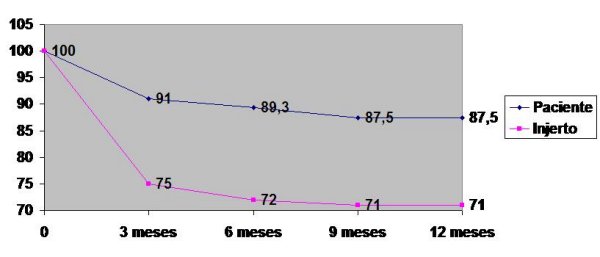 fiogf49gjkf0dGráfico 5: SUPERVIVENCIA DEL PACIENTE E INJERTO"> fiogf49gjkf0dGráfico 5: SUPERVIVENCIA DEL PACIENTE E INJERTO">
Gráfico 5 - fiogf49gjkf0d Gráfico 5: SUPERVIVENCIA DEL PACIENTE E INJERTO
|
|
Discusión
|
|
Conclusiones
fiogf49gjkf0d
- Predominan dentro de nuestros pacientes el grupo de edades de 35 a 48 años y el sexo masculino.
- La edad y el sexo del donante, la edad del receptor, causa de muerte del donante, los tipos de isquemia (caliente secundaría y fría), la solución de preservación, la NTA, las crisis inmunológicas de rechazo, la causa de la insuficiencia renal crónica y el tiempo de diálisis, son variables con posible influencia en la función inicial del injerto y en la supervivencia a corto y a mediano plazo.
- Las principales complicaciones médicas y quirúrgicas fueron la sepsis y la fístula urinaria respectivamente.
- La sepsis generalizada constituyó la principal causa de fallecimiento en nuestra serie de estudio.
- Se observó que la principal causa de pérdida del injerto se correspondió con las crisis inmunológicas de rechazo.
- En nuestro estudio se evidencia una supervivencia del injerto al año superior a la mitad (71%) y porcentaje de supervivencia del paciente del 87,5%.
|
|
Bibliografía
1. Port F K, Wolfe R A, Maunger E A, Berlin D P, Jena K. Campevision of survival probabilitic for Dialysys patient vs Cadaveric renal. Traspant recipíents1993; 270: 1339-1343.
2. Cleries M, Vela E, Boscha A. Evolución de trasplante Renal en Cataluña período 1984 –1997. Nefrología 2000; XX (Sup 5) : 55-62.
3. Bonal 1, Cleries M, Vela E. Transplantation versos hemodialysis in elderly patients. Nephrol Dial transplant 1997; 12: 261-264.
4. Merrill JP, Murray JF, Harrinson JR, Guild WR. Successfull homotrasplantation of the human kidney betwen identical twins. 1956; 160: 277.
5. Buch A. Trasplante Renal con Riñón del Cadáver en Cuba. México: V Congreso Internacional de Nefrología; 1972. p 156 (Resumen).
6. Hariharan S, Jhonson cp, Bresnahan BA. Improvegraft survival after renal trasnplantation in the united states, 1988, to 1996. N Engl J Med 2000; 342:605-612.
7. Solez Kin. International standarization of criteria for the histologia diagnosis of renal allograft relection: the banff workin classification ok kidney tranplant pathology. Kidney int 1999; 44: 411-422.
8. Oreopoulus DG, Dialyzing the elderly benefit of burden?. Nefrologia 1997; 17 (Sup 3) S2-S8.
9. Johson DW, Herzigk, Purdie D, Brown AM, Rigby RJ, Nicol DL. Et al. A Comparison of the effects of dialysis and renal transplantation on the survival of order uremic patients. Transplantation 2000 69: 794-799.
10. Jassal SV. Olpez G. Cole E. Transplantation on the elderly. A review Geriatric Nephrol urol 1997; 7: 157-165.
11. Lagoa MR. Simposio sobre patología del trasplante: grupo Banff. [Fecha de acceso 14 de Noviembre de 2003] URL disponible en:
http://www.diariomedico.com
12. Mizrai R. Donante Marginal Renal. Riñón apto para trasplante. XIII Congreso Latinoamericano de Nefrología 2004; 2 (1).
13. Luno J, García de Vinvesa S, Gómez Campdera F. Factores predictivos en la progresión de deterioro funcional. Nefrología 1999; 19: 253-531.
14. Wolfe RA, Held PJ, Port FK. Delsyed graft function: risk factors and implications for renal allograft survival. Transplantation 1997 Apr 15; 63 (7): 968-74.
15. Neylan JF. The Allocation of Cadaver Kidney for Transplantation in the United States. Consecuencias y controversy. Am soc Nephrol 1999; 10: 2237-2243.
16. Gjertson DW. Impact of delayed graft function and acute rejection on kidney graft survival. Clin transpl 2000; (2): 467-80.
17. Valderrábano F, Alonso Hernández A. Resultados y factores pronósticos en el Trasplante Renal. En: Llach F, Valderrábano F. Insuficiencia Renal Crónica, Diálisis y Trasplante Renal. Madrid: Editorial Normal; 1997. p. 1696-1711.
18. Schnitzler MA. The Economic implications of HLA matching in cadaveric renal transplantation. New Engl J Med 1999; 341 (19): p. 532-537.
19. Mazzuchi N. Informe de Trasplante Renal 2000. Nefrología Latinoamericana 2000 Sept; 7 (3).
20. Opelz G. Is HLA. Matching worth the effort? Transplantation Proceedings 1999; 31: 717-720.
21. Opelz G. Factor Influencing Long-Term Graft Loss. Transplantation Proceedings 2000; 69: 319-326.
22. Chertow GM, Brenner BM, Mackenzie HS. Nonlmmunologic Predictors of Chronic Renal Allograft rejection. Kidney 1997; 52 (suppl. 63): S71-74.
23. Fellstrom B, Uppsala S. Nomimmune ri sk factor for chronic renal allograft dysfunction. Trasplantation 2001; 71 (11): 5512.
24. Cosio F6, Pesavento TE, OSE JK. Post-transplant diabetes Mellitus, increasing incidence in rend allograft recipient, trasplanted in reent years, Kidney international 2001; 59: 732-737.
25. Ploeg R, Boclcel J, Langendijk P. Effect of preservation solution on results of cadaveric kidney transplantation the lancet 1996; 340: 129-136.
26. Toledo-Pereyra L, Rodríguez F. Scientific basis and current status of organ preservation. Trasplant proc 1994; 26: 309-311.
27. Belzer F, Southard J. Principles of solid. organ preservation by cold storage. Transplantation 1999; 45: 673-676.
28. Berzer F, Southard J. Organ preservation annu rev Med 1995; 46: 235-247.
29. Finn W. Prevention of ischemi injury in renal transplantation. Kidney Int 1990; 37: 171-182.
30. Glassock RJ. Selection and Preparation of donors and recipients for trasplantation. En: Massry SG, Glassock RJ. Nefrología Clínica. Baltimore: Jonathan; 1995; p: 1638-1640.
31. Ramos Kelly JR, Toledo-Pereira LH. El Trasplante de Riñón. Médico Interamericano 1999; 18. (4): 143-152.
32. Pirsch JD, Ploeg Ej, Gange. Determinants of graft survival after renal transplantation. Transplantation 1996; 61: 1581-1586.
33. Dianne BM, Milford EL, Tolfoff Rubin NE. Clinical aspect of renal transplantation. En: Brenner BM. The kidney Vol II. 6ta ed. Philadelphia: W.B Saunders Company; 2000. p. 2542-2605.
34. Glassock RJ, Cecka JM. Long-Term Outcome of Renal Transplantation. Massry SG, Glassock RJ. Nefrología Clínica. Baltimore: Jonathan W. 1995; p. 1718-1727.
35. McLaren AJ, Jassem W, Gray DW, Fuggle SV, Welsh KI, Morris PJ. et al. Delayed graft function: risk factors and the relative effects of early function and acute rejection on long-term survival in cadaveric. Clin Transplant 1999 Jun; 13 (3): 266-72.
36. Moreso F, Seron D, Gil-Vernet S, Riera L, Fulladosa X, Ramos R, et al. Donor age and delayed graft function as predictors of renal allograft survival in rejectionfree patients. Nephrol Dial Transplant 1999 Apr; 14 (4): 930-5.
37. Boom H, Mallat MJ, Fijter JW, Zwinderman AH, Paul LC. Delayed graft function influences renal function, but not survival. Kidney Int 2000 Aug; 58 (2): 859-66.
38. Azuma H, Nanadeau K, Takada M, Cellular and molecular predictors of chronic renal dysfunction after initial ischemia/reperfusion injury of a single. Sidney Transplantation 1997; 64: 190.
39. Ramírez García CG. Rechazo. Clasificación y Diagnóstico de disfunción del injerto. En: Treviño Becerra A. Tratado de Nefrología. Madrid. Editorial Prado, 2003. p. 1845-1862.
40. Paul LC. Inmunnologic Risk factor for chronic rend allograft disfuntion. Trasplantation 2001 June 15; 71(11): 5517-5523.
41. Koning OHJ, Ploeg RJ, Van Bockel JH. Risk factors for delayed graft function in cadaveric kidney transplantation. Transplantation 1997; 66: 1620-28.
42. Massy ZA, Guijarro C, Bertan L. Clinical predictors of chronic renal allograft rejection. Kidney 1995; 48 (sup 52): S85-S88.
43. Pfaff WW, Howard RJ, Patton PR, Adams VR, Rosen CB, Reed AL. Delayed graft function after renal transplantation. Transplantation 1998 Jan 27; 65(2): 219-23.
44. Pérez Fontan M, Rodríguez-Carmona A, Bouza P, Valdes F. The prognostic significance of acute renal failure after renal transplantation in patients treated with cyclosporin. QJM 1998 Jan; 91(1): 27-40.
45. Moreso F, Seron D, Gil-Vernet S, Riera L, Fulladosa X, Ramos R, et al. Donot age and delayed graft function as predictors of renal allograft survival in rejectionfree patients. Nephrol Dial transplant 1999 Apr; 14(4): 930-5.
46. Gjertson DW. Impact of delayed graft function and acute rejection on kidney graft survival. Clin Transpl 2000; (2): 467-80.
47. Asderakis A, Dyer P, Augustine T, Worthington J, Campbell B, Johson RW. Effect of cold ischemic time arid HLA matching in kidneys coming from “young” and “old” donors: do not leave for tomorrow what you can do tonight. Transplantation 2001 Aug 27; 72(4): 674-8.
48. Consentino F, Chaff C, Pedmonte M. Risk factor influencing survival in uci aceite renal Failure. Nephrol Dial Transplant 1994; 9 (Suppl 4): 179-182.
49. Fellner SK, Lang RM, Neumann A. Physiological mechanismo for calcium-Induced changes in sistemic artenal pressure in stable dialysis patient. Hypertension 1998; 13: 213.
50. Marekmann P. Nutritional status of patients on Hemodialysis and pentoneal dialysis. Clin nephrol 1998; V(4): 2975.
51. Bonomini V, Orsoni G, Sorrentino MA, Todeschini P. Hormonal changes in hemodialysis. Blood Purif 1990; 8: 54.
52. Ayús JC, Lorenzo V, Hernández D. Complicaciones Cardiacas en la Insuficiencia Renal Crónica y tras el Trasplante Renal. En: Llach F, Valderrábano F. Insuficiencia Renal Crónica. Diálisis y Trasplante Renal. 5ta. ed. Madrid: Editorial Normal; 1997. p: 1445-1562.
53. Hüting J. Course of left ventricular hipertophy and function in end – stage renal disease after trasnplantation. Am J Cardiol 1992; 70: 1481-1484.
54. Rao V, Anderson W. Liver disease after renal transplantation. Am J kid Dis 18 2000; (5): 429-433.
55. Lukert B, Raiz L. Glucocorticoid – induce osteo porosis: Pathogenesis and management. Ann Intern Med 1990; 112: 352-364.
56. Hojo M, Monmoto T, Malnecio M. Cyclosporine induces cancer progresión by a cell-autonomus mechanism. Nature 1999; 4: 397-530.
57. Dianne B, Mc Kaydeggar L, Milford NE, Rubin T. Clinical aspect of renal transplantation. En: Brenner BM. The Kidney Vol 2. 6ta ed. Philadelphia: WB Sauders Company; 2000. p. 2542-2590.
58. Danovitch GM. Immunosupressive medications and protocols for kidney transplantation. En: Danovitch GM. “Handbook of kidney transplantation”. Boston: Litlle, Brown and Company; 1996. p. 55-94.
59. Hong JC, Kahan BD. A calcineurin-free strategy for induction immunosuppression for delayed grath function in cadaveric. Kidney Transplantation 2000; 69: S259.
60. European Multicentre Trial Group. Cyclosporin in cadaveric renal transplantation: one-year follow-up of a multicentre trial. Lancet 1983; 2: 809-989.
61. Ramírez García CG. Rechazo. Clasificación y Diagnóstico de la disfunción del injerto. En: Dr. Alejandro Trimiño Becerra y col. Tomo II Tratado de Nefrología. México. ed. Prado, SA de C.V. 2003; p. 1845-1862.
62. González Posada JM, Tamajon LP. Disfunción Renal Postrasplante. En: Lorenzo V. ed. Manual de Nefrología Clínica, Diálisis y Trasplante: Harcourt Brace. 2002; p. 897-926.
63. Lehtonen SR, Isoniemi HM, Salmela KT. Long-term graft outcome is not necessarily affected by delayed onset of graft function and early acute rejection. Transplantation. 1997 Jul 15; 64 (1): 103-7.
64. Bouza E, Santiago M. Infecciones después del Trasplante Renal. En: Llach F, Valderrábano F. Insuficiencia Renal Crónica, Diálisis y Trasplante Renal. Madrid: Editorial Normal; 1997. p. 1447-1519.
65. Hamsher RJ, Chisholm GD, Shackman R. Late urinary tract infection after renal trnasplantation. Lancet 1999; 354: 793-6.
66. Krieger JW. Urinary infection in kidney transplantation. Urology 1997; 19: 130-32.
67. Santiago-Delpin AE, Morales AH. Infecttions in kidney transplantation in Latin American. Transplant Proc 1999; 24: 1791-94.
68. Gritsch HA, Rosenthal T. The transplant operation and its surgical complication. En: Danovitch GM. Hambook of kidney transplantation. California: Editorial Lippincott William; 2002. p. 175-180.
69. Serrallach N, Franco E, Rien L. Cirugía y complicaciones quirúrgicas del trasplante renal. En: Llach F, Valderrábano F. Insuficiencia Renal Crónica, Diálisis y Trasplante Renal. Madrid: Editorial Normal; 1997: 1487-1517.
70. Bertram L, Kasiske. Long-Term post transplantation management and complications. En: Danovitch GM, Handbook of kidney transplantation. California: Editorial Lippincott William; 2002; p. 182-219.
|
|



