

|
M Andújar*, M Pavcóvich**, MA Sánchez**, A Torres***, MD Arias**, JM de Lera**, L León**, T Hernández**, B Vega***, JM Flacón-Santana***, A Lubrano***, O Falcón-Vizcaíno***, O Arencibia***, E Salido****, J Doreste***** |
|||||||||||||||||||||
|
ANTECEDENTES Y ESTADO ACTUAL DEL TEMA 1. INTRODUCCIÓN El carcinoma de cérvix uterino representa mundialmente el 12% de todos los tumores de la mujer, es la segunda neoplasia maligna más frecuente, siguiendo al carcinoma de mama, y es el más frecuente en países en vías de desarrollo. Su incidencia y prevalencia presentan gran variabilidad según la zona geográfica estudiada, y así se estima que para el año 2000 el número de casos será de más de 400.000 casos, dándose el 80% de ellos en países en desarrollo (Pontén et al, 1995; Ferlay et al, 1998; Parkin et al, 1999).
Según los datos consultados de mortalidad por cáncer en España para 1997 del Servicio de Epidemiología del Cáncer del Centro Nacional de Epidemiología, la tasa ajustada según la población estándar europea es de 2,48/105, la tasa ajustada según la población mundial es de 1,84/105 y la tasa cruda es de 2,81/105. En nuestra comunidad autónoma y según los datos aportados por el Registro Poblacional de Tumores de la Comunidad Autónoma Canaria, el carcinoma de cérvix ocupa el octavo lugar en causas de mortalidad por cáncer. Los casos de carcinoma de cérvix entre 1993 y 1996 suponen junto con el carcinoma de ovario el 9% de todos los cánceres de la mujer entre 15 y 34 años, y entre los 35 y 62 años se dan cifras del 6%. La tasa bruta de incidencia del cáncer "in situ" de cuello uterino fue de 19,93/105 en 1993 y de 17,54/105 en 1994; lo que respecta al cáncer de cuello uterino invasor en las mujeres canarias fue de 8,7/ 105 en 1993 y de 10,74/105 en 1994 según los datos recogidos del Plan de Salud de Canarias del año 1997.
Por otra parte y según los datos de la Unidad de Oncología Ginecológica del Hospital Universitario Materno Infantil de Las Palmas de Gran Canaria, reflejados en las memorias anuales de actividad que viene realizando, se observa una tendencia de incremento del número de carcinomas invasivos atendidos en su unidad. De igual forma la Unidad de Patología Cervical del mismo hospital comparte similar tendencia en lo que respecta a lesiones precursoras del cáncer invasivo. El Plan de Salud de Canarias (http://www.gobcan.es/psc) anteriormente citado incluye dentro de los objetivos para el apartado “Cáncer” algunos (apartados 22 al 24) que hace referencia explícita a la prevención, y tratamiento del cáncer cervical, así como a la implantación del diagnóstico precoz del mismo en la población susceptible.
2. HISTORIA NATURAL DE LA LESIÓN DISPLÁSICA Que el carcinoma escamoso invasor de cérvix se desarrolle a partir de precursores lesionales fue una brillante hipótesis propuesta a principios de este siglo por los investigadores del momento que observaron lesiones intraepiteliales muy similares a la lesión infiltrante adyacentes a ésta última; describieron entonces lo que hoy denominamos como CIN III (displasia intensa – carcinoma “in situ”). El empleo de los programas de detección precoz del cáncer cervical dio la posibilidad de reconocer otras lesiones no tan agresivas como el CIN I, pero que dejadas a su libre evolución también podían progresar a carcinoma invasor: se les denominaron displasias. Se propuso en los años setenta (Richart & Barron, 1969) la idea de un espectro o continuo lesional que se denominó CIN (“cervical intraepithelial neoplasia”).
Se comprobó que estas lesiones displásicas (CIN) cuando no fueron tratadas tenían capacidad para progresar a carcinoma invasor. El ejemplo más claro y desafortunado lo tenemos en el estudio realizado en los años setenta en Auckland (Nueva Zelanda) donde se trató de manera conservadora a todas las mujeres con lo que en aquel entonces se denominaba “carcinoma in situ”; el resultado fue que un 22% desarrollaron carcinoma invasor (con relación a un 1,5% del grupo control) falleciendo por esta causa un poco más de un tercio de ellas (McIndoe et al, 1984).
De los estudios epidemiológicos (Ostor, 1993; Holowaty et al, 1999) y clínico-patológicos de las lesiones displásicas y el carcinoma de cérvix se desprenden los siguientes hechos: · que las lesiones escamosas intraepiteliales surgen como lesiones de bajo grado (displasia leve, CIN I), · que aproximadamente un 60% de los CIN I desaparecen, el 30% persisten como tales, el 10% progresa a CIN III y 1% a carcinoma invasor · que un 40% de los CIN II desaparecen, otro 40% persisten, un 20% progresan a CIN III y un 5% a carcinoma invasor · que un 34% de los CIN III desaparecen, un 30-50% persisten y un 16%-36% de los progresan a carcinoma invasor. · que el periodo de latencia estimado entre una lesión displásica (CIN) y carcinoma invasor puede ser de 12-13 años · y que este periodo de latencia es mayor en pacientes de edad joven y se acorta con pacientes de más edad.
Otro aspecto bastante discutido, aunque generalmente aceptado sobre la historia natural de las lesiones displásicas, es la posible regresión de un porcentaje importante de las mismas. La tasa de regresión aportada por diferentes estudios varía entre en 6% (Richart & Barron, 1969), hasta el 80%, siendo las lesiones de menor grado y en mujeres más jóvenes donde este fenómeno se da más frecuentemente (van Oortmarssen & Habbema, 1991; Holowaty et al, 1999).
3. ETIOPATOGENIA DE LA CARCINOGÉNESIS CERVICAL.
En la patogenia de la lesión displásica intraepitelial hay que considerar varios aspectos. El primero de ellos es el origen de la lesión. Los estudios de clonalidad tumoral sugieren que estas lesiones precursoras cervicales surgen por expansión clonal (Park et al, 1996) encontrándose que las de alto grado son todas monoclonales, al igual que los dos tercios de las lesiones de bajo grado; es por ello que se describen dos tipos de lesiones de bajo grado que además guardan una interesante relación con los genotipos de VPH. Las lesiones de alto grado podría corresponder a clonas de alto poder proliferativo y de transformación en el seno de una lesión de menor grado donde se expandirá en su progresión. Esta génesis “anidada” de lesiones de alto grado dentro de otras de bajo, modifica en cierto sentido el esquema evolutivo clásico: lesión de bajo grado, lesión de alto grado, carcinoma.
El segundo aspecto de la patogenia lesional es la naturaleza de la carcinogénesis tumoral, un proceso que muy probablemente se desarrolla en múltiples pasos y en la que están implicados una serie de genes junto con el efecto epigenético ambiental que interacciona con éstos últimos. El desarrollo de procesos proliferativos reactivos-reparativos, como lo es la metaplasia escamosa del epitelio cervical en la zona de transformación, hacen de las células de esta zona un área especialmente susceptible a las mutaciones y a las alteraciones genéticas, con la consiguiente activación de ciertos oncogenes y con la inactivación o supresión de la actividad de genes supresores tumorales (Lazo, 1999; zur Hausen, 2000). Dentro de los factores implicados en la patogenia de la enfermedad hay que destacar al virus del papiloma humano (VPH).
4. VIRUS DEL PAPILOMA HUMANO (VPH) Desde los primeros estudios epidemiológicos se ha sugerido una relación causal entre el carcinoma de cérvix y sus lesiones precursoras con el VPH (Koutsky et al, 1992; Franco et al, 1999; Bosch et al, 2002; Bosch & Sanjosé, 2003) y a su vez con la actividad sexual, el número de compañeros sexuales y el comienzo de las relaciones sexuales de las pacientes (Bosch et al, 1992; Bosch et al, 1995; Bosch et al, 1996; Kjellberg et al, 2001). Otro elemento importante para las mujeres en general y para aquellas con patología cervical displásica o tumoral es el contacto con un “compañero de alto riesgo” caracterizado por una historia de promiscuidad sexual junto con contactos con mujeres con lesión cervical presente o pasada. De hecho se han detectado la presencia de genotipos de alto riesgo en el semen (Olatunbosun et al, 2001) de compañeros sexuales de mujeres que eran igualmente positivas para este tipo, reforzando la importancia de la transmisión de la enfermedad (Franceschi et al, 2002). En este sentido recientemente se ha comunicado la asociación entre circuncisión y menor riesgo de infección por VPH en el varón (Castellsague et al, 2002)
De todos los agentes microbiológicos investigados en estas pacientes y sus compañeros el único en el que se ha demostrado una relación importantísima con el carcinoma de cérvix y sus lesiones precursoras es el VPH (Kyo et al, 1994; Bosch et al, 1996; Franco et al, 1999).
Los VPH se han clasificado atendiendo a la especificidad tisular (cutáneos y de mucosas) y de acuerdo con su asociación con lesiones benignas y malignas (oncogénicos y no oncogénicos). Hasta el momento se han recogido unos noventa y cinco genotipos de VPH y presentan claras diferencias de afinidad y especificidad con el tipo de lesiones que originan y con su monoclonalidad (Park et al, 1996). Se han identificado veintitrés tipos que infectan el tracto anogenital: 6, 11, 16, 18, 30, 31, 33, 35, 39, 40, 42-45, 51-58, y el 61. Los tipos 6, 11, 16 y 53 son los tipos más frecuentemente en mujeres con enfermedad cervical y vulvar, encontrándose algún subtipo al menos en el 80% de las lesiones displásicas.
En las lesiones de bajo grado (Condiloma y CIN I) predominan los tipos 6 y 11 en aproximadamente 20-22% de los casos. En las displasias de alto grado (CIN II-CIN III) predomina el subtipo 16 entre 30-77%; tres cuartas partes de estas lesiones están también relacionadas con el 18 y algunos del grupo de los treinta (31, 33, 35, 39...). Para los carcinomas infiltrantes se ha realizado una actualización de la clasificación epidemiológica de los tipos virales en estas neoplasias. Así el grupo de alto riesgo se incluyen 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 y 82; se considera igualmente a los tipos 26, 53 y 66 como de probable capacidad carcinogénesis. En el grupo de bajo riesgo están 6, 11, 40, 42, 43, 44, 54 61, 72, 81, CP6108. Los tipos 26, 53, 66, 73 y 82 han sido reclasificados de un grupo anteriormente como de riesgo indeterminado a ser incluidos en los de alto riesgo. Los tipos 16, 18, 31, 33, 35, 45, 52, 58 suman el 95% de los carcinomas escamosos (Muñoz et al, 2003).
Una alta prevalencia de la infección por VPH se ha correlacionado con un nivel socioeconómico bajo, presenta un pico en la edad adulta joven, disminuye con la edad y en estudios longitudinales se ha comprobado un incremento de la misma conforme los programas de detección se amplían (Poten et al, 1995).
Su presencia en las lesiones displásicas está ampliamente demostrada. En las pacientes con displasia de bajo grado los porcentajes de casos positivos para VPH16 llegan al 23,7% (Schiffman et al, 1993) y alcanzan niveles superiores cuando se trata de displasias de alto grado: 52% (Schiffman et al, 1993), 71% de las pacientes españolas estudiadas en Barcelona y en el 54% de las estudiadas en Colombia (de Sanjosé et al, 1994), el 75% en USA (Morrison et al, 1991), 72% en Reino Unido (Cuzick et al, 1994), y 59% en Holanda (Gaarenstroom et al, 1994). En general incrementa su presencia conforme aumenta el grado de la lesión displásica encontrada en el estudio histopatológico, desde el epitelio normal sin alteraciones hasta la displasia intensa y el carcinoma. En un 20%-30% de los casos se dan infecciones mixtas y la existencia de múltiples genotipos se ha asociado con un aumento en el riesgo de progresar a CIN III (Bosch et al, 1993). En cuanto a los carcinomas el porcentaje alcanza el 90,8% (Zheng et al, 1995) y del 93% (Bosch et al, 1995).
5. CRIBADO DEL CANCER DE CÉRVIX.
El cribado de cáncer de cérvix nunca ha sido evaluado en ensayos clínicos aleatorios; su efecto se ha comprobado por estudios con relación a su implantación y la variación en la incidencia de cáncer y la reducción de la mortalidad, así como por estudios de casos y controles en los que se evalúa la historia citológica de las pacientes (Poten et al, 1995).
Desde la introducción en los años sesenta de los programas de detección precoz del cáncer cervical y de sus lesiones precursoras, la mortalidad debida a esta neoplasia ha disminuido. Esto se desprende desde los primeros estudios de Cramer (1974) y Miller et al (1976) en los que correlacionaban cambios en el riesgo de padecer la enfermedad con la aplicación y difusión de los programas de detección precoz del cáncer cervical tanto en Canadá como en Estados Unidos de Norteamérica, de manera que a mayor detección, menor mortalidad y mayor prevalencia de estadios precoces y de lesiones premalignas.
Estudios posteriores como los llevados a cabo por Lynge (1983) en Dinamarca o los de Läärä et al (1987) en cinco países nórdicos corroboraron los beneficios de este tipo de cribado pero además comprobaron que las campañas organizadas tienen un mayor rendimiento que las que se cumplimentan por participación voluntaria de las mujeres (Sasieni et al, 1995; Quinn et al, 1999; Sigurdsson, 1999; Nieminen et al, 1999). Estudios de casos y controles han comprobado que el riesgo de desarrollar un carcinoma de cérvix invasivo es 3-10 veces mayor en mujeres que nunca habían participado en una campaña de cribado (Aristizabal et al, 1984; Herrero et al, 1992); además el riesgo se incrementa al aumentar el tiempo desde la última toma citológica o al disminuir la frecuencia de los estudios (Celentano et al, 1989; IARC, 1986). Sin embargo se ha comprobado que un estudio cada 2-3 años no incrementa de forma significativa el riesgo de carcinoma invasivo con relación al riesgo esperado con los estudios anuales (Kleinman & Kopstein, 1981; IARC, 1986).
La eficacia de una campaña de cribado depende de cuatro factores muy importantes (Poten et al, 1995; Sigurdsson, 1999): la tasa de participación de la población sobre la que se interviene, el tipo de participación, la sensibilidad del test empleado y la calidad del diagnóstico y del tratamiento suministrado. Está demostrado que el incremento en las tasas de participación de la población en estudio reporta un mejor cociente coste-efectividad que el incremento en la frecuencia del test en las mujeres que regularmente se realizan las pruebas del cribado; además se sabe que las mujeres que no participan en estas campañas suelen pertenecer a grupos y colectivos sociales con bajos recursos económicos y con poco acceso a la información, y coinciden con los grupos etarios y socioeconómicos en mayor riesgo para padecer lesiones displásicas del cérvix así como carcinomas. Por ello la captación de dichos grupos se hace necesario en la mejora de cualquier campaña de cribado de cáncer de cérvix, situación que es aplicable a nuestro entorno.
A pesar de los evidentes beneficios de estas campañas no son pocas las críticas a su eficacia, el modo de ejecutarse y la validez de una técnica como es la citología cervicovaginal (Herbert, 1997; Sutton, 1998; Womack & Warren, 1998; Herbert, 1998; Thorton et al, 1998). Recientemente se han publicado las conclusiones de una conferencia de consenso sobre el cribado poblacional del cáncer cervical, auspiciada por la Organización Mundial de la Salud y celebrada en Túnez en enero de 1999 (Miller et al, 2000), que suponen un importante documento para la planificación y realización de estas campañas.
En los países con escasos recursos sanitarios donde no se dan las condiciones para el desarrollo de estas campañas en toda su extensión se han estudiado desde el punto de vista epidemiológico otros modelos alternativos que incluyen cambios en la frecuencia de la toma citológica, el actuar sobre poblaciones seleccionadas por sus características sociosanitarias de alto riesgo, la inspección visual del cérvix por personal de enfermería o personal auxiliar y el empleo de técnicas auxiliares como es la detección de la infección por el VPH (Miller, 1992; Hoyo et al, 2000). De igual forma se ha desarrollado modelos matemáticos que estudian la eficiencia de las campañas clásicas o las que emplean técnicas moleculares de VPH de acuerdo a distintos esquemas de frecuencias en las tomas y los distintos grupos de edad a los que van dirigidas (Sherlaw-Johnson et al, 1997). Así se predice que un programa con una cobertura del 100% de la población y en el que sólo se realice una toma citológica en la vida de la mujer podría usar los recursos con mayor eficiencia que aquellos que aquellos programas que lo hacen más frecuentemente y podrían alcanzar reducciones de hasta un 30% en la incidencia de carcinoma de cérvix. Un examen citológico cada diez años podría duplicar esta reducción.
En lo que respecta a la edad se estima que son a los 37 años el momento idóneo para la realización de esa única toma anteriormente comentada; para mayores frecuencias el rango de edades a las que se podrían estudiar se reduce de 20-64 a 30-59 años. Incluso se han llevado a cabo estudios de modelos matemáticos sobre los programas desarrollados en el Reino Unido donde una hipotética, y siempre cuestionable, exclusión de mujeres mayores de 50 años de estas campañas suponen un riesgo muy bajo de carcinomas invasivos sin detectar y un ahorro del 25% del número de citologías realizadas y de un 18% de las colposcopias (Sherlaw-Johnson et al, 1999).
La sensibilidad de la citología cervicovaginal se estima, según los estudios considerados, entre el 49% y el 67%, siendo la especificidad entre el 62% y el 77% (Fahey et al, 1995). Además, desde la inclusión del sistema de Bethesda (Bethesda Workshop) para el diagnóstico citopatológico se consideró una nueva entidad citopatológica denominada “ASCUS” (atypical squamous cells of undetermined sifnificance – atipia de células escamosas de significado incierto) (Solomon et al, 1998) que como su nombre indica supone una incertidumbre diagnóstica que requiere el seguimiento citológico de las pacientes y en muchas ocasiones la realización de biopsia y/o colposcopia. Se estima que aproximadamente un 10% de estas ASCUS encierran una lesión escamosa de alto grado (displasias moderada y/o severa). Esto da idea de las limitaciones de esta prueba y justifica la búsqueda de métodos y medidas auxiliares que complementes su eficiencia (Meijer & Walboomers, 2000), entre las que se encuentran la optimización en la toma de la muestra con cepillos endo y exocervical, mejora de la calidad de las tinciones, mejor entrenamiento para personal citotécnico, el control de calidad de los diagnósticos realizados (“rescreening”)(Raab, 1997), la inclusión de examen del cérvix mediante espéculo ( y sobre todo la inclusión de nueva tecnología como es el desarrollo de la citología en medio líquido (Howell et al, 1998; Cuzick, 1999a), la automatización del cribado con aplicaciones de análisis de imagen (Mango & Radensky, 1998; Brown & Garber, 1999), la detección de la infección por el VPH (Cuzick et al, 1995; Sigurdsson, 1999; Sherman et al, 2002) o la combinación de ambos (Sherman et al, 1998). Un reciente acuerdo internacional recomienda el estudio de este tipo de lesiones con repetición de citología, colposcopia y determinación de VPH (Wright et al, 2002) y se obtiene con su uso un mejor rendimiento y un mejor coste-beneficio que otras estrategias en el manejo clínico de esta entidad (Kim et al, 2002).
6. CRIBADO DEL CARCINOMA DE CERVIX Y DETECCIÓN DE LA INFECCIÓN POR VPH. UTILIDAD Y APLICACIÓN CLÍNICA.
La utilización de técnicas moleculares en la detección de los distintos genotipos virales tiene en la actualidad tres áreas de indiscutible interés: el manejo de pacientes con ASCUS y lesiones de bajo grado (ASCUS Group, 2000, 2003), la vigilancia y seguimiento de pacientes tratados por displasias de alto grado y/o carcinoma microinvasor o invasor (Cecchini et al, 2004; Brink et al, 2005) y su relación con los programas de detección precoz del cáncer cervical. Este último apartado ha suscitado un debate todavía abierto en lo que se refiere a las mejoras que la inclusión de estas técnicas supondría en la sensibilidad y rendimiento de los programas, así como en la utilidad de reemplazar al estudio citológico convencional (Sherlaw-Johnson et al, 1997).
La rentabilidad de estos estudios complementarios en estas campañas dependerá de varios factores: · en primer lugar y de forma directa de la prevalencia de la enfermedad; · de los intervalos que se establezcan para la realización de los tests; · de los tipos de test empleados · de los controles de calidad de las técnicas utilizadas sobre todo en lo referente a los requerimientos mínimos (umbral) de positividad para una muestra.
Los estudios realizados en mujeres sin enfermedad displásica y con estudios citológicos normales aportan porcentajes en la prevalencia de la infección por VPH que varían considerablemente y se aportan cifras como las siguientes: 6% (Rozendaal et al, 1996), 10% (de Roda Husman et al, 1995), 12,8% (Hagmar et al, 1995), 15,4% (Kjær et al, 1997), 25,1% (Riethmuller et al, 1999), 26% (Hildesheim et al, 1994), 31,8% ( Zheng et al, 1995), 43,39% (Schiffman et al, 1993) y 60% (Bauer et al, 1993). En nuestro país encontramos tres estudios con cifras de 6,2% (Velasco et al, 1996), del 4,7% (Bosch et al, 1993) éste último con una población tres veces superior a la del primero y más recientemente del 3% (Sanjosé et al, 2003). Otro hecho recogido en la literatura es el alto porcentaje infección transitoria que se da generalmente en mujeres menores de treinta años con relaciones sexuales frecuentes (Hildesheim et al, 1994; Hinchliffe et al, 1995).
Un aspecto a considerar de la prevalencia del VPH en población sana es el elemento geográfico diferencial como lo demuestran estudios de distintos continentes y latitudes. Hasta el momento no hay ningún estudio realizado sobre dicha prevalencia en el archipiélago canario y como se especifica más adelante en el apartado de Hipótesis, es una impresión de los investigadores de este proyecto que la prevalencia debe ser mayor que los datos registrados en el resto del estado español. Otro elemento que respalda esta idea es el número tan elevado de patología displásica que se registra en la Unidad de Patología Cervical del HUMIC.
En lo que se refiere al método utilizado hay que considerar la técnica de Captura de Híbridos, sea ésta de primera o de segunda generación (HC-II) y la Reacción de la Polimerasa en Cadena (PCR). Generalmente, pero no en todos los estudios, la PCR da un porcentaje mayor de positividades que la HC-II (Cope et al, 1997; Riethmuller et al, 1999). Dentro de la PCR se pueden utilizar “consensus primers” combinados (Karlsen et al, 1996) de la región L1 versus cócteles de “consensus primers”, SPF10, PGMY (Kleter et al, 1998; Perrons et al, 2002; Coutlee ET AL, 2002) o mezclas de “consensus primers” con otros “primers” de regiones como E6-E7 (Zheng et al, 1995) o ensayos en un mismo tubo con diferentes cebadores para hacer PCR-anidada (Strauss et al, 2000).
La infección por VPH puede ser demostrada en el epitelio escamoso cervical y en las tomas citológicas del mismo con anterioridad a que las lesiones histopatológicas se desarrollen, encontrándose el virus mientras tanto con capacidad infectiva (Khanna et al, 2002). Se estima que en un tercio de las mujeres de edad más joven se da persistencia viral. Con la demostración de persistencia de la infección se detectan pacientes en riesgo suficiente de desarrollar lesiones infiltrativas incluso en ausencia de alteraciones citológicas (Schlecht et al, 2001; Acladious et al, 2002; Kjaer et al, 2002); por ello en algunos estudios se comenta el posible papel complementario de la detección y tipaje del HPV (Ho et al, 1995) afirmándose que hasta el 80% de las displasias de alto grado se puede predecir aplicando técnicas de PCR con una antelación de 3 años (Carozzi et al, 2000) prestando especial atención a los subtipos de alto riesgo como el VPH 16 (Liaw et al, 1999).
El gran atractivo de los test de VPH es su alta sensibilidad, incluso mayor del 90% con HC-II (Clavel et al, 1999; Cuzick et al, 1999) y mayor que la de la citología cervicovaginal (Clavel et al, 1998). Su gran inconveniente es su especificidad ya que se alcanzan falsos positivos de entre el 5% y el 20% (Cuzick et al, 1999a). Con la introducción de técnicas moleculares cuantitativas se ha discutido mucho sobre la mayor o menor sensibilidad de los métodos. Si la sensibilidad de los mismos no alcanza un fentogramo con técnicas de PCR, al menos el 20% de las lesiones de alto grado y de los carcinomas pueden no detectarse (Meijer et al, 1997). Recientemente (Schiffman et al, 2000) con la utilización de la HC-II el umbral se ha situado en 1 pg/ml consiguiéndose una sensibilidad para detectar lesión del alto grado del 88,4%, mayor que la obtenida con la citología convencional que alcanzó el 77%; sin embargo la especificidad para displasia de alto grado y para carcinoma fue del 89%, algo menor que con la citología.
Se podría afirmar que existe una tendencia a considerar en términos positivos la inclusión de técnicas para la detección de VPH en los programas de cribado de cáncer de cérvix (Meijer et al, 1992; Cuzick et al, 1995; Walboomers et al, 1995; Rozendaal et al, 1996; Jenkins et al, 1996; van Ballegooijen et al, 1997; Cuzick et al, 1999a; Kuhn et al, 2000; Cuzick, 2001) ya que se ha demostrado una detección de lesiones de alto grado con citologías negativas pero con positividad para VPH y más concretamente para subtipos de alto riesgo. Se postula por tanto que aquellas mujeres que no tienen alteraciones citológicas y que además son negativas para la detección molecular de VPH tienen un riesgo significativamente menor de tener lesiones displásicas posteriores así como de padecer lesiones infiltrantes. Son por ello subsidiarias de disminuir la frecuencia en la realización de los estudios citológicos con el consiguiente ahorro de malestar para las mujeres y de ahorro económico para el sistema de salud que lo soporta (Vassilakos et al, 2002). Incluso se ha estudiado la posibilidad de que las mujeres se realicen ellas mismas una toma vaginal para la detección de VPH (Hillemanns et al, 1999; Wright et al, 2000) y aunque existen limitaciones, se puede asumir que puede suponer un gran avance en el control de la enfermedad del cérvix, sobre todo en países subdesarrollados donde la posibilidad de otros estudios y controles colposcópicos y cervicográficos es escasa. Los últimos estudios en esta materia llegan a la conclusión de que para la detección de virus de alto riesgo, la autotoma es equivalente a la toma clínica y funciona en este contexto (Harper et al, 2002)
En un reciente informe del Servicio Nacional de Salud del Reino Unido sobre valoración tecnológica y cribado de cáncer de cérvix (Cuzick et al, 1999b), se reconoce el gran potencial de la detección de VPH por métodos moleculares, así como el ahorro de vidas y de dinero que supondría su aplicación. Sin embargo el informe enfatiza la necesidad de más estudios para su implantación sobre todo en los ámbitos donde no hay un programa organizado y eficiente de cribado. Esta misma recomendación la encontramos en las conclusiones de otras conferencias de consenso sobre cribado de cáncer de cérvix (Miller et al, 2000).
Más recientemente estudios como el HART (Cuzick et al, 2003) y otros (Bulkmans et a, 2005; Kim et al, 2005; Petignat et al, 2005; Holmes et al, 2005) abogan por la inclusión de la determinación de tipos virales de alto riesgo en el cribado poblacional con apoyos de coste efectividad contrastados (Holmes et al, 2005). En este sentido hay que resaltar el informe nº 151 del IARC (www.iarc.fr) donde se admite que existe evidencias de que la eficacia de un sistema validado para la detección del VPH, como método de cribado, y que éste reduce por si mismo la mortalidad del cáncer de cérvix..
Por último señalemos que no todas las voces siguen este discurso de apoyo a la implantación de esta tecnología y se cuestionan la innecesaria ansiedad que produce a las mujeres resultados positivos para el test sin un correlato claro y con seguimiento a veces de muchos años; otros destacan que con sus datos el incremento de la sensibilidad y del valor predicitivo negativo debe valorarse muy cuidadosamente ya que el empleo de esta tecnología elevaría de forma muy importante el número de mujeres catalogadas como positivas para tipos viral de escasa trascendencia, lo que elevaría los efectos indeseados tanto personales como sociosanitarios (Schiffman et al, 2005). En otros contextos geográficos y para otras poblaciones se cuestiona muy seriamente la validez de las auto-tomas por parte de las mujeres anulando un elemento importante para la valoración del paciente cual es el examen con espéculo del cérvix junto con otras consideraciones (Davey & Armanti, 2000).
|
||||||||||||||||||||||
|
|
|
|||||||||||||||||||||
|
|
Diseño: Se realizó un estudio transversal para estimar la prevalencia de la infección por HPV en mujeres mayores de edad que vivan en las islas de Gran Canaria.
Tipo de muestreo y procedimiento direccional de la población seleccionada: se realizó un muestreo aleatorio estratificado utilizando para ello la base de datos de Tarjeta Sanitaria dependiente de la Gerencia de Atención Primaria de la isla de Gran Canaria. Se establecerán nueve grupos etarios (grupo I: 18-25 años; grupo II: 26-30 años, grupo III: 31-35, grupo IV: 36-40 años, grupo V: 41-45 años, grupo VI: 46-50 años, grupo VII: 51-55 años, grupo VIII: 56-60 años y grupo IX: 61-65 años). La selección se hizo de forma proporcional a la población femenina registrada en el ultimo censo poblacional (año 2000) en cada grupo de edad y en cada área dependiente de un centro de salud.
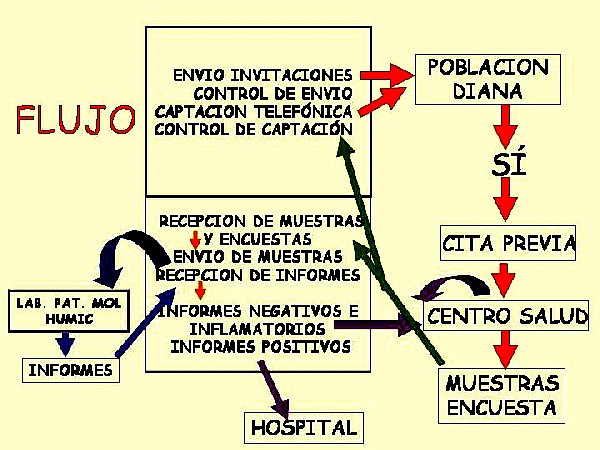
Las mujeres seleccionadas fueron invitadas a participar en el estudio mediante el envío de carta postal y posterior llamada telefónica, concertando en ese momento, si así lo quiere la entrevistada, una cita en el centro de atención primaria más cercano. Esta labor ha sido desarrollada por personal administrativo. Cuando acudieron a la cita fueron atendidas por especialistas en Ginecología y Obstetricia y/o personal de Enfermería (Matronas). Estos explicaron nuevamente a las pacientes el objetivo del estudio y sus implicaciones pasando, según la aceptación de la paciente, a cumplimentaron el consentimiento informado, realizaron la entrevista clínico-epidemiológica y se hicieron las tomas de muestras según se describe más abajo.
Tamaño de la muestra: tomando como base las estimaciones de prevalencia de HPV por grupo de edad, siendo éste máximo según la literatura consultada del 16%, con una diferencia máxima asumible de 1,5% y para un error a=5% se obtienen los siguientes tamaños muestrales por grupos de edad:
Esto hace un total de 2276 mujeres. Por cada una de las seleccionadas se cuenta con cuatro recambios del mismo grupo de edad y de la misma zona básica de salud para asegurar el cumplimiento del tamaño total, y asumiendo un 20% de participación.
Variables, recogida de datos y muestras:
Tras conseguir el consentimiento informado por escrito de las pacientes (Anexo nº 1), se le realizará:
· encuesta clínico-epidemiológica que incluyó apartados más específicos relacionados con los factores de riesgo referidos a la patología cervical.
· examen ginecológico que incluirá
- exploración abdominal
- inspección física de genitales externos
- inspección de vagina y cuello del útero
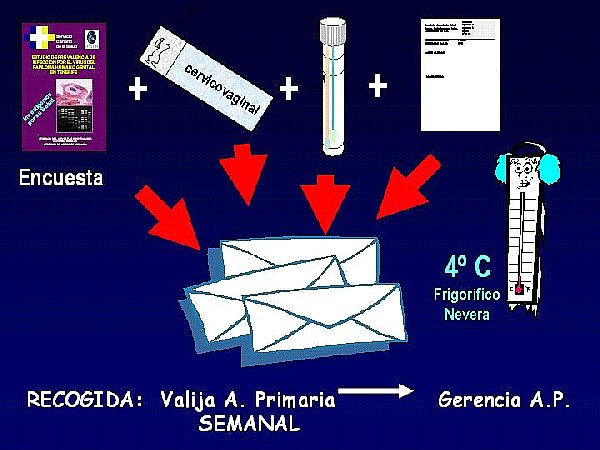
· recogida de muestras específicas para el estudio, que incluye:
- toma selectiva de citología cervicovaginal (endocervical+exocervix-vagina)
- una segunda muestra cervical (endo-exo-vaginal) destinada al estudio molecular y realizada con hisopo estéril que será preservada a 4ºC hasta el momento del traslado al Laboratorio de Patología Molecular de la Unidad de Apoyo a la Investigación del CHMI de Las Palmas.
Estudio citopatológico
Se realizó un estudio convencional con tinción de Papanicolau y se siguió el sistema de Bethesda para el diagnóstico
Estudio molecular
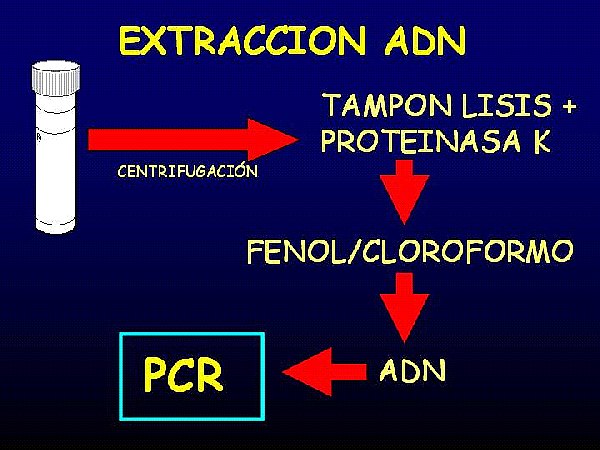
El botón celular obtenido del hisopo y cepillo endocervical estériles se sometieron a digestión con proteinasa K a 56ºC durante dos horas y posterior extracción fenólica para la obtención de ADN. El control de amplificación de este ADN se testó mediante PCR para un fragmento de 509 pares de bases de β-globina usando los cebadores P07-P03.
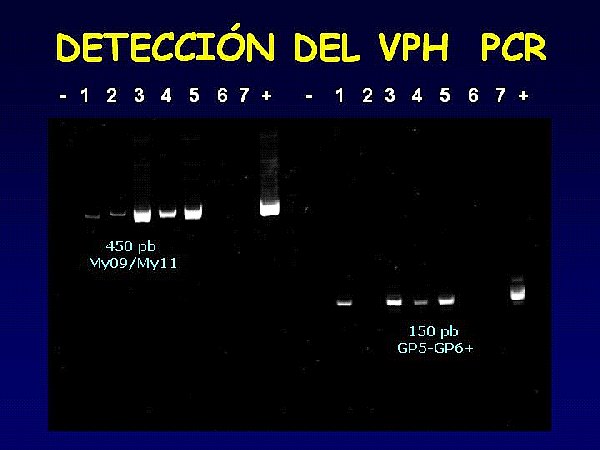
Para la detección del VPH mediante PCR se usaron los cebadores de consenso My09/11 con el que se obtiene un fragmento de 450 pares de bases y con Gp5-Gp6+ que da un segmento de 150 pares de bases. Las muestras positivas son testadas por duplicado, y se pasa mediante cebadores específicos a su tipificación por PCR.
Derivación hospitalaria para casos positivos
Aquellos casos diagnosticados en citología como ASCUS o superior independientemente del estudio molecular, y aquellos casos que teniendo citología negativa tuvieron alguno de los tests moleculares positivos se les consideraron pacientes para ser derivadas a la Unidad de Patología Cervical del Hospital Univ. Materno Infantil de Canarias. En dicha unidad de realizó nuevamente citología, colposcopia y biopsia en el caso necesario. A estas pacientes se les hace un seguimiento clínico de acuerdo a los protocolos de dicha unidad.
Análisis Estadístico:
El conjunto de variables a analizar en este estudio se procesará estadísticamente con el programa SPSS 10.0 en entorno Windowsâ. Para el estudio de variables cuantitativas se utilizarán: medidas de tendencia central: media, mediana; medidas de dispersión: error estándar de la media, desviación típica, rango; test de normalidad (test de Kolmogorov-Smirnov). En el caso de necesitar pruebas no paramétricas por falta de normalidad de la muestra, se emplearán el test de Kruskal-Wallis y el de Mann-Whitney. Los estudios de correlación entre variables cuantitativas se realizarán con el test de Spearman. Para variables cualitativas la prueba de Chi-cuadrado y el test exacto de Fisher. Por último para estudiar curvas de supervivencia (referidas al momento de aparición de las lesiones en la evolución, del tratamiento o de la recidiva) se utilizarán el método de Kaplan-Meier (test log-rank) y el análisis de regresión de Cox. El nivel de significación será para p<0.05. Se determinará la sensibilidad, especificidad y valor predictivo positivo; se tendrán en cuenta los posibles casos dudosos si los hubiere.
|
|||||||||||||||||||||
|
|
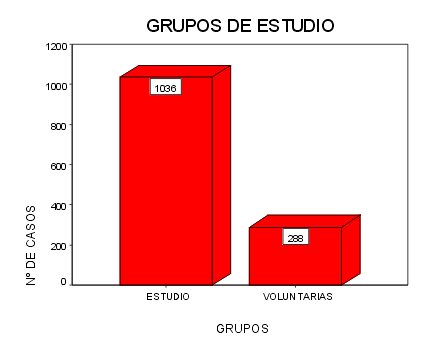
Tamaño muestral: el número de pacientes recogidas hasta el momento es de 1036 pacientes pertenecientes a los grupos aleatoriamente seleccionados (grupo “estudio”). Tras el comienzo del estudio recibimos la demanda de un gran numero de pacientes que manifestaron su interés por el mismo y las encuadramos en el grupo denominado “voluntarias” de las que hasta el momento hay 288.
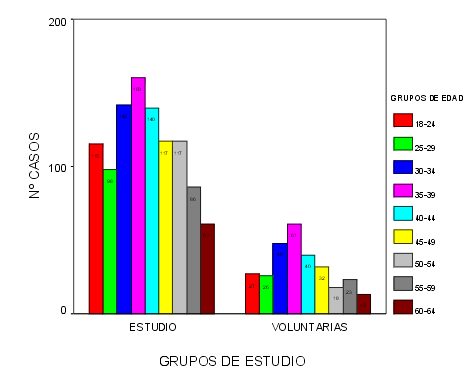
La distribución por grupos etarios se representa en el siguiente gráfico, observándose unas tendencias muy similares para ambos grupos con predominio de los grupos de edad de entre 30 a 45 años.
Resultados citológicos:
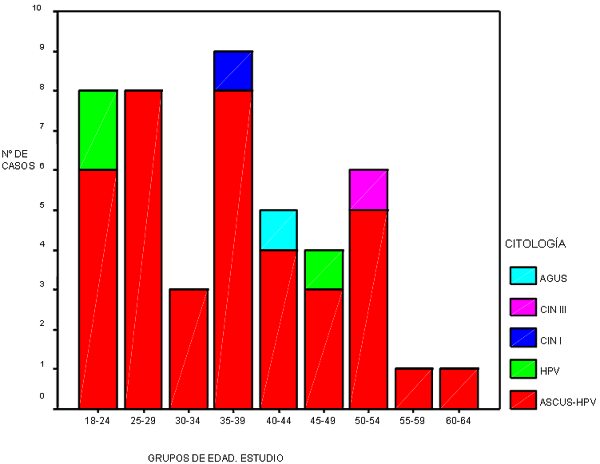
En el grupo de estudio se detectaron un 4,4 % de positividades. En ellas la distribución se expresa en el gráfico de la derecha, presentándose en el de la izquierda la distribución por edades
En el grupo de voluntarias el porcentaje alcanza el 10,8%, encontrándose mayor número de lesiones distintas y de mayor gravedad. A diferencia con el grupo estudio donde las lesiones se agrupaban en los grupos de edad de 25 a 45 años, en el grupo de voluntarias se desplaza hacia 35 y 55 años, siendo estas tendencias estadísticamente significativas en su diferencia.
Resultados moleculares:
En toda la población (ambos grupos) se ha detectado un 11,4% de positividades . El 54,8% de estos casos se han dado en el grupo estudio y el 45,2% en el grupo de voluntarias. El 70% de estos casos se dan en pacientes menores de 40 años.
En el grupo de estudio hemos detectado un 8,2% de positividades para alguno de los dos tests empleados, estando aproximadamente la mitad de ellos en pacientes menores de 35 años.
En el grupo de voluntarias el porcentaje llega al 14,6% y en su distribución por grupos etarios llama la atención que junto al pico de edad de menos de 40 años hay otro de menor magnitud entre 55 y 60 años.
El 28% de los test positivos corresponden al tipo 16 y sólo el 5% al tipo 18.
Correlaciones citológicas, moleculares y clínicas
Resultados positivos de PCR se relacionan con edad menor de 40 años, con el mayor número de embarazos, con en mayor número de compañeros sexuales, con precocidad en las relaciones sexuales y con nivel de estudios menor o igual a los estudios de secundaria. La existencia de citologías positivas y de PCR positivas se correlaciona con estado de soltería, el uso de ACO, en número de compañeros, la existencia de citologías previas positivas y con el antecedente de condiloma. No se encontraron correlación con el hábito tabáquico ni con las distintas zonas de salud.
|
|||||||||||||||||||||
|
|
Los resultados obtenidos en nuestro estudio tienen carácter preliminar ya que se ha captado aproximadamente la mitad de la población pensada en el diseño estadístico. No obstante consideramos que los datos son suficientemente consistentes para dar una idea del estado de la infección por el VPH.
Considerando la literatura en nuestro país el porcentaje de la población estudio está en rango similar a lo descrito en otros estudios (Muñoz et al, 1992, Sanjose et al, 2003) con poblaciones bastante similares. Como en éstos, los grupos de edad más joven son donde hay más casos de positividad y se correlacionan con factores de riesgo ya conocidos como la paridad, el número de embarazos, el número de compañeros sexuales, etc.
Cabe destacar la mayor prevalencia en el grupo de voluntarias, donde el número como el porcentaje de alteraciones citológicas es de mayor entidad que en el grupo estudio. Sin duda, la concienciación y conocimiento del estado de salud propio, así como de los factores de riesgo que favorecen la infección ha influido de forma determinante en la demanda de estudio por parte de este colectivo.
De aquí en adelante es intención de este grupo de concluir la captación de pacientes y de analizar el seguimiento de pacientes derivadas a la atención hospitalaria que serán objeto de otras comunicaciones.
|
|||||||||||||||||||||
|
|
Acladious NN, Sutton C, Mandal D, Hopkins R, Zaklama M, Kitchener H. Persistent human papillomavirus infection and smoking increase risk of failure of treatment of cervical intraepithelial neoplasia (CIN). Int J Cancer 2002;98:435-439. Aristizabal N, Cuello C, Correa P. The impact of vaginal cytology on cervical cancer risks in Cali, Colombia. Int J Cancer 1984;34:5-9. ASCUS-LSIL Traige Study (ALTS) Group. Human papillomavirus testing for triage of women with cytologic evidence of low-grade squamous intraepithelial lesions: baseline data from a randomized trial. The Atypical Squamous Cells of Undetermined Significance/Low-Grade Squamous Intraepithelial Lesions Triage Study (ALTS) Group. J Natl Cancer Inst. 2000;92:397-402. ASCUS-LSIL Traige Study (ALTS) Group. A randomized trial on the management of low-grade squamous intraepithelial lesion cytology interpretations. Am J Obstet Gynecol. 2003;188:1393-1400. ASCUS-LSIL Traige Study (ALTS) Group. Results of a randomized trial on the management of cytology interpretations of atypical squamous cells of undetermined significance. Am J Obstet Gynecol. 2003;188:1383-1392. Bray F, Loos AH, McCarron P, Weiderpass E, Arbyn M, Moller H, Hakama M, Parkin DM. Trends in cervical squamous cell carcinoma incidence in 13 European countries: changing risk and the effects of screening. Cancer Epidemiol Biomarkers Prev. 2005;14:677-686. Brink AA, Zielinski GD, Steenbergen RD, Snijders PJ, Meijer CJ. Clinical relevance of human papillomavirus testing in cytopathology. Cytopathology 2005 ;16:7-12. Bosch FX, Castellsague X, Muñoz N, et al. Male sexual behavior and human papillomavirus DNA: key risk factors for cervical cancer in Spain. J Natl Cancer Inst 1996;88:1060-1067. Bosch FX, Lorincz A, Munoz N, Meijer CJ, Shah KV. The causal relation between human papillomavirus and cervical cancer. J Clin Pathol 2002;55:244-265. Bosch FX, Manos MM, Muñoz N, et al. Prevalence of human papillomavirus in cervical cancer: a worldwide perspective. J Natl Cancer Inst 1995;87:796-802. Bosch FX, Muñoz N, de Sanjose S, et al. Risk factors for cervical cancer in Colombia and Spain. Int J Cancer 1992;52:750-758. Bosch FX, Muñoz N, de Sanjosé S, et al. Human papillomavirus and cervical intraepithelial neoplasia grade III/carcinoma in situ: a case-control study in Spain and Colombia. Cancer Epidemiol Biomarkers Prev 1993;2:415-422. Bosch FX, de Sanjose S. Chapter 1: Human papillomavirus and cervical cancer--burden and assessment of causality. J Natl Cancer Inst Monogr. 2003;(31):3-13. Brown AD, Garber AM. Cost-effectiveness of 3 methods to enhance the sensitivity of Papanicolaou testing. JAMA 1999;281:347-353. Bulkmans NW, Rozendaal L, Voorhorst FJ, Snijders PJ, Meijer CJ. Long-term protective effect of high-risk human papillomavirus testing in population-based cervical screening. Br J Cancer. 2005;92:1800-1802. Carozzi F, Ronco G, Confortini M, Noferini D, Maddau C, Ciatto S, et al. Prediction of high-grade cervical intraepithelial neoplasia in cytologically normal women by human papillomavirus testing. Br J Cancer 2000;83:1462-1467. Castellsague X, Bosch FX, Munoz N, Meijer CJ, Shah KV, de Sanjose S, et al; The International Agency for Research on Cancer Multicenter Cervical Cancer Study Group.Male circumcision, penile human papillomavirus infection, and cervical cancer in female partners. N Engl J Med. 2002;346:1105-1112. Celentano DD, Klassen AC, Weisman CS, et al. Duration of relative protection of screening for cervical cancer. Prev Med 1989;18:411-422. Cecchini S, Carozzi F, Confortini M, Zappa M, Ciatto S. Persistent human papilloma virus infection as an indicator of risk of recurrence of high-grade cervical intraepithelial neoplasia treated by the loop electrosurgical excision procedure. Tumori. 2004;90:225-228. Clavel C, Bory JP, Rieht S, Masure M, Duval-Benninger I, Putaud I, et al. Comparative analysis of human papillomavirus detection by hybrid capture assay and routinee cytologic screening to detect high-grade cervical lesions. Int J Cancer 1998;75:525-528. Clavel C, Masure M, Bory JP, et al. Hybrid capture II-based human papillomavirus detection, a sensitive test to detect in routine high-grade cervical lesions: a preliminary study of 1581 women. Br J Cancer 1999;80:1306-1311. Cope JU, Hildesheim A, Schiffman MH, Manos MM, Lorincz AT, Burk RD, et al. Comparison of the hybrid capture tube test and PCR for detection of human papillomavirus DNA in cervical specimens. J Clin Microbiol 1997;35:2262-2265. Coutlee F, Gravitt P, Kornegay J, Hankins C, Richardson H, Lapointe N, Voyer H, Franco E. Use of PGMY primers in L1 consensus PCR improves detection of human papillomavirus DNA in genital samples. J Clin Microbiol 2002;40:902-907. Cramer DW. The role of cervical cytology in the declining morbidity and mortality of cervical cancer. Cancer 1974;34:2018-2027. Cuzick J. Screening for cancer: future potential. Eur J Cancer 1999;35:1925-1932. Cuzick J. Time to consider HPV testing in cervical screening. Ann Oncol 2001;12:1511-1514. Cuzick J, Beverley E, Ho L, Terry G, Sapper H, Mielzynska I, et al. HPV testing in primary screening of older women. Br J Cancer 1999a;81:554-558. Cuzick J, Sasieni P, Davies P, Adams J, Normand C, Frater A, et al. A systematic review of the role of human papillomavirus testing within a cervical screening programme. Health Technol Assess 1999b;3:1-196. Cuzick J, Szarewski A, Terry G, et al. Human papillomavirus testing in primary cervical screening. Lancet 1995;345:1533-1536. Cuzick J, Szarewski A, Cubie H, Hulman G, Kitchener H, Luesley D, et al. Management of women who test positive for high-risk types of human papillomavirus: the HART study. Lancet. 2003;362:1871-1876. Cuzick J, Terry G, Ho L, Hollingworth T, Anderson M. Type-specific human papillomavirus DNA in abnormal smears as a predictor of high-grade cervical intraepithelial neoplasia. Br J Cancer 1994;69:167-171. Davey DD, Armenti CA. HPV primary screening for cervical cancer: more pain than protection. Diagn Cytopathol 2000;22:333-335. De Roda Husman AM, Walboomers JM, Hopman E, et al. HPV prevalence in cytomorphologically normal cervical scrapes of pregnant women as determined by PCR: the age-related pattern. J Med Virol 1995;46:97-102. Fahey MT, Irwig LM, Macaskill P. Meta-analysis of Pap test accuracy. Am J Epidemiol 1995;141:680-689. Ferlay J, Parkin DM, Pisani P. GLOBOCAN: cancer incidence and mortality worldwide. IARC Cancer Base 3, International Agency for Research on Cancer, Lyon (1998). Franceschi S, Castellsague X, Dal Maso L, Smith JS, Plummer M, Ngelangel C, et al. Prevalence and determinants of human papillomavirus genital infection in men. Br J Cancer 2002;86:705-711. Franco EL, Rohan TE, Villa LL. Epidemiologic evidence and human papillomavirus infection as a necessary cause of cervical carcinoma. J Natl Cancer Inst 1999;91:506-511. Gaarenstroom KN, Melkert P, Walboomers MM, Brule AJC van den, Bommel PFJ van, et al. Human papillomavirus DNA and genotypes: prognostic factors for progression of cervical intraepithelial neoplasia. Int J Gynecol Oncol 1994;4:73-78. Gyrd-Hansen D. Estimation of utility associated with participation in cancer screeening programmes”, ponencia presentada a The Second European Conference on the Economics of Cancer, Brussels, September 2000. Hagmar B, Kalantari M, Skyldberg B, Moberger B, Johansson B, Walaas L, et al. Human papillomavirus in cell samples from Stockholm Gynecologic Health Screening. Acta Cytol 1995;39:741-745. Hakim Z, Pathak DS. Modelling the Euroqol data: A comparison of discrete conjoint and conditional preference modelling. Health Economics 1999;8:103-116. Harper DM, Noll WW, Belloni DR, Cole BF. Randomized clinical trial of PCR-determined human papillomavirus detection methods: self-sampling versus clinician-directed--biologic concordance and women's preferences. Am J Obstet Gynecol 2002;186:365-373. Herbert A. Is cervical screening working? A cytopathologist's view from the United Kingdom. Hum Pathol 1997;28:120-126. Herbert A. The cervical screening muddle. Lancet 1998;351:1129-1130. Herrero R, Brinton LA, Reeves WC, et al. Screening for cervical cancer in Latin America: a case-control study. Int J Epidemiol 1992;21:1050-1056. Hildesheim A, Schiffman MH, Gravitt PE, et al. Persistence of type-specific human papillomavirus infection among cytologically normal women. J Infect Dis 1994;69:235-240. Hillemanns P, Kimmig R, Huttemann U, Dannecker C, Thaler CJ. Screening for cervical neoplasia by self-assessment for human papillomavirus DNA. Lancet 1999;354:1970.
Ho GYF, Burk RD, Klein S, et al. Persistent genital human papillomavirus infection as a risk factor for persistent cervical dysplasia. J Natl Cancer Inst 1995;87:1365-1371. Holowaty P, Miller AB, Rohan T, To T. Natural history of dysplasia of the uterine cervix. J Natl Cancer Inst 1999;91:252-258. Holmes J, Hemmett L, Garfield S. The cost-effectiveness of human papillomavirus screening for cervical cancer. A review of recent modelling studies. Eur J Health Econ. 2005;6:30-37. Howell LP, Belk T, Agdigos R, Davis R, Lowe J. AutoCyte Interactive Screening System. Experience at a university hospital cytology laboratory. Acta Cytol 1999;43:58-64. http://www.gobcan.es/psc. Gobierno de Canarias. Plan de Salud Canario. http://www.iarc.fr International Agency for Research on Cancer Working Group on Evaluation of Cervical Cancer Screening Programmes: Screening for squamous cervical cancer: duration of low risk after negative results of cervical cytology and its implication for screening policies. BMJ 1986;293:659-664. Jenkins D, Sherlaw-Johnson C, Gallivan S. Can papilloma virus testing be used to improve cervical cancer screening?. Int J Cancer 1996;65:768-773. Khanna N, Brooks SE, Chen TT, Simsir A, Gordon NJ, Taylor G.Human papillomavirus absence predicts normal cervical histopathologic findings with abnormal Papanicolaou smears: a study of a university-based inner city population. J Hum Virol 2001;4:283-287. Karlsen F, Kalantari M, Jenkins A, et al. Use of multiples PCR primer sers for optimal detection of human papillomavirus. J Clin Microbiol 1996;34:2095-2100. Karlsen F, Kalantari M, Jenkins A, Pettersen E, Kristensen G, Holm R, et al. Use of multiple PCR primer sets for optimal detection of human papillomavirus. J Clin Microbiol 1996; 34:2095-2100. Kim JJ, Wright TC, Goldie SJ. Cost-effectiveness of alternative triage strategies for atypical squamous cells of undetermined significance. JAMA 2002;287:2382-2390. Kim JJ, Wright TC, Goldie SJ. Cost-effectiveness of human papillomavirus DNA testing in the United Kingdom, The Netherlands, France, and Italy. J Natl Cancer Inst. 2005;97:888-895. Kjaer SK, van den Brule AJ, Bock JE, Poll PA, Engholm G, et al. Determinants for genital human papillomavirus (HPV) infection in 1000 randomly chosen young Danish women with normal Pap smear: are there different risk profiles for oncogenic and nononcogenic HPV types?. Cancer Epidemiol Biomarkers Prev 1997;6:799-805. Kjaer SK, van den Brule AJ, Bock JE, Paull G, Svare EI, Sherman ME, et al. Type specific persistence of high risk human papillomavirus (HPV) as indicators of high grade cervical squamous intraepithelial lesions in young women : population based prospective follow up study. B Med J 2002;325:1-7 Kjellberg L, Hallmans G, Ahren AM, Johansson R, Bergman F, Wadell G, et al. Smoking, diet, pregnancy and oral contraceptive use as risk factors for cervical intra-epithelial neoplasia in relation to human papillomavirus infection. Br J Cancer 2000;82:1332-1338. Kleinman JC, Kopstein A: Who is being screened for cervical cancer? Am J Pub Health 1981;71:73-76. Kleter B, van Doorn LJ, ter Schegget J, et al. Novel short-fragment PCR assay for highly sensitive broad-spectrum detection of anogenital human papillomaviruses. Am J Pathol 1998;153:1731-1739. Koutsky LA, Holmes KK, Critchlow CW, et al. A cohort study of the risk of cervical intraepithelial neoplasia grade 2 or 3 in relation to Papillomavirus infection. N Engl J Med 1992;327:1272-1278. Kuhn L, Denny L, Pollack A, Lorincz A, Richart RM, Wright TC. Human papillomavirus DNA testing for cervical cancer screening in low-resource settings. J Natl Cancer Inst 2000;92:818-825. Kyo S, Inoue M, Koyama M, Fujita M, Tanizawa O, Hakura A. Detection of high-risk human papillomavirus in the cervix and semen of sex partners. J Infect Dis 1994;170:682-685. Läärä E, Day NE, Hakama M. Trends in mortality from cervical cancer in the Nordic countries: associations with organized screening programmes. Lancet 1987;i:1247-1249. Lazo P. The molecular genetics of cervical carcinoma. Br J Cancer 1999;80:2008-2018. Liaw K-L, Glass AG, Manos M, Greer CE, Scott DR, Sherman M, et al. Detection of human papillomavirus DNA in cytologically normal women and subsequent cervical squamous intraepithelial lesions. J Natl Cancer Inst 1999;91:954-960. Lynge E. Regional trends in incidence of cervical cancer in Denmark in relation to local smear-tqaking activity. Int J Epidemiol 1983;12:405-413. Mandelblatt JS, Lawrence WF, Womack SM, Jacobson D, Yi B, Hwang YT, Gold K, Barter J, Shah K. Benefits and costs of using HPV testing to screen for cervical cancer. JAMA 2002;287:2372-2381. Mango LJ, Radensky PW. Interactive neural network-assisted screening. Acta Cytol 1998;42:233-245. McIndoe WA, McLean MR, Jones RW, Mullins PR. The invasive potential of carcinoma in situ of the cervix. Obstet Gynecol 1984;64:451-458. McIntosh et al. Using discrete choice experiments within a cost-utility analysis framework. Health Economics Study Group Meeting, University of Nottingham, Julio 2000. Meijer CJ, van den Brule AJ, Snijders PJ, Helmerhorst T, Kenemans P, Walboomers JM. Detection of human papillomavirus in cervical scrapes by the polymerase chain reaction in relation to cytology: possible implications for cervical cancer screening. IARC Sci Publ 1992;119:271-281. Meijer CJLM, Helmerhorst ThJM, Rozendaal L, van der Linden JC, Voorhorst FJ, Walboomers JMM. HPV typing adn testing in gynecological pathology: has the time come?. Histopathology 1998;33:83-86. Meijer CJLM, Walboomers JMM. Cervical cytology after 2000: where to go?. J Clin Pathol 2000;53:41-43. Miller AB. Cervical cancer screening programmes: managerial guidelines. World Health Organization, Geneva, 1992. Miller AB, Lindsay J, Hill GB. Mortality from cancer of the uterus in Canada and its relationship to screening for cancer of the cervix. Int J Cancer 1976;17:602-612. Miller AB, Nazeer S, Fonn S, Brandup-Lukanow A, Rehman R, Cronje H, et al. Report on consensus conference on cervical cancer screening and management. Int J Cancer 2000;86:440-447. Morrison EAB, Ho GYF, Vermund SH, Golsberg GL, Kadish AS, Kelley KF, et al. Human papillomavirus infection and other risk factors for cervical neoplasia: a case-control study. Int J Cancer 1991;49:6-13. Muñoz N, Bosch FX, de Sanjosé S, Herrero R, Castellsagué X, Shah KV, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med 2003;348:518-527. Nieminen P, Kallio M, Anttila A, Hakama M. Organised vs. spontaneous Pap-smear screening for cervical cancer: A case-control study. Int J Cancer 1999;83:55-58. Olatunbosun O, Deneer H, Pierson R. Human papillomavirus DNA detection in sperm using polymerase chain reaction. Obstet Gynecol 2001;97:357-360. Ostor AG. Natural history of cervical intraepithelial neoplasia: a critical review. Int J Gynecol Pathol 1993;12:186-192. Paraskevaidis E, Arbyn M, Sotiriadis A, Diakomanolis E, Martin-Hirsch P, Koliopoulos G, et al. The role of HPV DNA testing in the follow-up period after treatment for CIN: a systematic review of the literature. Cancer Treat Rev. 2004;30:205-211. Parkin DM, Pisani P, Ferlay J. Estimates of the worldwide incidence of 25 major cancers in 1990. Int J Cancer 1999;80:827-841. Perrons C, Kleter B, Jelley R, Jalal H, Quint W, Tedder R. Detection and genotyping of human papillomavirus DNA by SPF10 and MY09/11 primers in cervical cells taken from women attending a colposcopy clinic. J Med Virol 2002;67:246-252 Petignat P, Faltin D, Goffin F, Billieux MH, Stucki D, Sporri S, Vassilakos P. Age-related performance of human papillomavirus testing used as an adjunct to cytology for cervical carcinoma screening in a population with a low incidence of cervical carcinoma. Cancer. 2005 ;105:126-132. Poten J, Adami H-O, Bergström R, et al. Strategies for global control of cervical cancer. Int J Cancer 1995;60:1-26. Raab S. The cos-effectiveness of cervical-vaginal rescreening. Am J Clin Pathol 1997;108:525-536. Richart RM, Barron BA. A follow-up study of patients with cervical dysplasia. Am J Obstet Gynecol 1969;105:386-393. Riethmuller D, Gay C, Bertrand X, Bettinger D, Schaal JP, Carbillet JP, et al. Genital human papillomavirus infection among women recruited for routine cervical cancer screening or for colposcopy determined by Hybrid Capture II and polymerase chain reaction. Diagn Mol Pathol 1999;8:157-164. Rozendaal L, Walboomers JM, van der Linden JC, et al. PCR-based high-risk HPV test in cervical cancer screening gives objective risk assessment of women with cytomorphologically normal cervical smears. Int J Cancer 1996;68:766-769. Sanjosé S de, Muñoz N, Bosch FX, Reimann K, Pedersen NS, Orfila J, et al. Sexually transmitted agents and cervical neoplasis in Colombia and Spain. Int J Cancer 1994;56:358-363. Sanjose S de, Almirall R, Lloveras B, Font R, Diaz M, Munoz N, et al. Cervical human papillomavirus infection in the female population in Barcelona, Spain. Sex Transm Dis 2003;30:788-793. Sasieni P, cuzick J, Farmery E. Accelerated decline in cervical cancer mortality in England and Wales. Lancet 1995;346:1566-1567. Schlecht NF, Kulaga S, Robitaille J, Ferreira S, Santos M, Miyamura RA, Duarte-Franco E, Rohan TE, Ferenczy A, Villa LL, Franco EL. Persistent human papillomavirus infection as a predictor of cervical intraepithelial neoplasia. JAMA 2001;286:3106-3114. Schiffman MH, Bauer HM, Hoover RN, et al. Epidemiologic evidence showing that human papillomavirus infection causes most cervical intraepithelial neoplasia. J Natl Cancer Inst 1993;85:958–964. Schiffman M, Herrero R, Hildesheim A, Sherman ME, Bratti M, Wacholder S, et al. HPV DNA testing in cervical cancer screening: results from women in a high-risk province of Costa Rica. JAMA 2000;283:87-93. Schiffman M, Khan MJ, Solomon D, Herrero R, Wacholder S, Hildesheim A, et al; PEG Group; ALTS Group. A study of the impact of adding HPV types to cervical cancer screening and triage tests. J Natl Cancer Inst. 2005 Jan 19;97(2):147-50. Sherlaw-Johnson C, Gallivan S, Jenkins D. Evaluating cervical cancer screening programmes for developing countries. Int J Cancer 1997;72:210-216. Sherlaw-Johnson C, Gallivan S, Jenkins D. Withdrawing low risk women from cervical screening programmes: mathematical modelling study. BMJ 1999;318:356-360. Sherman ME, Mendoza M, Lee KR, Ashfaq R, Birdsong GG, Corkill ME, et al. Performance of liquid-based, thin-layer cervical cytology: correlation with reference diagnoses and human papillomavirus testing. Mod Pathol 1998;11:837-843. Sherman ME, Schiffman M, Cox JT; Atypical Squamous Cells of Undetermined Significance/Low-Grade Squamous Intraepithelial Lesion Triage Study Group. Effects of age and human papilloma viral load on colposcopy triage: data from the randomized Atypical Squamous Cells of Undetermined Significance/Low-Grade Squamous Intraepithelial Lesion Triage Study (ALTS). J Natl Cancer Inst 2002;94:102-107. Sigurdsson K. Cervical cancer, Pap smear and HPV testing: an update of the role of organized Pap smear screening adn HPV testing. Acta Obstet Gynecol Scand 1999;78:467-477. Solomon D, Frable WJ, Vooijs P, Wilbur DC, Amma S, Collins RJ, et al, ASCUS and AGUS criteria: IAC task force summary. Acta Cytol 1998;42:16-24. Strauss S, Jordens Z, Desselberger U, Gray JJ. Single-tube real-time nested polymerasen chain reaction for detecting human papillomavirus DNA. Diagn Mol Pathol 2000;9:151-157. Sutton G. The cervical screening muddle. Lancet 1998;351:1129. Taylor LA, Sorensen SV, Ray NF, Halpern MT, Harper DM. Cost-effectiveness of the conventional papanicolaou test with a new adjunct to cytological screening for squamous cell carcinoma of the uterine cervix and its precursors. Arch Fam Med 2000;9:713-721. The revised Bethesda System for reporting cervical/vaginal cytologic diagnoses: Report of the 1991 Bethesda Workshop. Acta Cytol 1992;36:273-276. Thornton H. The cervical screening muddle. Lancet 1998;351:1130-1131. Van Ballegooijen M, van den Akker-van Marle ME, Warmerdam PG, Meijer CJ, Walboomers JM, Habbema JD. Present evidence on the value of HPV testing for cervical cancer screening: a model-based exploration of the cost- effectiveness. Br J Cancer 1997;76:651-671. Van Oortmarssen GJ, Habbema JDF. Epidemiologic evidence for age-dependent regression of pre-invasive cervical cancer. Br J Cancer 1991;64:559-565. Vassilakos P, Petignat P, Boulvain M, Campana A. Primary screening for cervical cancer precursors by the combined use of liquid-based cytology, computer-assisted cytology and HPV DNA testing. Br J Cancer 2002;86:382-388. Velasco J, Fernandez Blanco C, Lopez Carrascosa I, Cueto Espinar A, Sampedro A. Disappearance of DNA HPV in sequential specimens of occult cervical infection in a "normal" population. Eur J Gynaecol Oncol 1996;:372-377. Walboomers JM, Husman AM, Snijders PJ, Stel HV, Risse EK, Helmerhorst TJ, et al. Human papillomavirus in false negative archival cervical smears: implications for screening for cervical cancer. J Clin Pathol 1995;48:728-732. Womack C, Warren AY. The cervical screening muddle. Lancet 1998;351:1129. Wright TC Jr, Cox JT, Massad LS, Twiggs LB, Wilkinson EJ; ASCCP-Sponsored Consensus Conference. 2001 Consensus Guidelines for the management of women with cervical cytological abnormalities. JAMA 2002;287:2120-2129. Wright TC Jr, Denny L, Kuhn L, Pollack A, Lorincz A. HPV DNA testing of self-collected vaginal samples compared with cytologic screening to detect cervical cancer. JAMA 2000;283:81-86. Zheng P-S, Li S-R, Iwasaka T, Song J, Cui M-H, Sugimori H. Simultaneous detection by consensus multiplex PCR of high and low-risk and other types of human papilloma virus in clinical samples. Gynecol Oncol 1995;58:179-183.
|
|||||||||||||||||||||
|
|
- Juan Pablo Garcia de la Torre (03/10/2005 13:13:45)
- Juan antonio Suarez Gonzalez (02/10/2005 1:34:21)
- Julio Alexander Diaz Perez (02/10/2005 22:15:12)
- Julio Alexander Diaz Perez (02/10/2005 22:04:57)
- María Eugenia Noguera de Avendaño (06/10/2005 3:59:14)
- JOHN JAIRO GAONA MORALES (07/10/2005 13:50:22)
- Carmen Nieves Hernández León (13/10/2005 14:43:16)
- ROSA N. RODRÍGUEZ RODRÍGUEZ (13/10/2005 20:04:09)
- ELSIE BEATRIZ PICOTT RANGEL (13/10/2005 22:26:42)
- SEBASTIAN ORTIZ REINA (15/10/2005 10:03:09)
- Alfredo Basilio Quiñones Ceballos (15/10/2005 21:01:09)
- Ileana Franco Zunda (15/10/2005 23:21:49)
- Cesáreo Corbacho Cuevas (16/10/2005 20:42:45)
- Javier Muñoz Moreno (17/10/2005 11:21:13)
- Pedro E Aleman Ramirez (24/10/2005 1:44:16)
- Adriana M. Balza Haddad (24/10/2005 1:58:26)
- marleny valencia (25/10/2005 0:38:27)
- nayvi fernandez diaz (25/10/2005 4:45:42)
- MIGUEL ANGEL CARRASCO GARCIA (25/10/2005 10:28:58)
- MARÍA ANTONIETA GÓMEZ LAGUNAS (02/11/2005 0:35:16)
- Amparo Benito Berlinches (08/11/2005 17:04:21)
|
|||||||||||||||||||||
|
|
|
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 14:10:50
.jpg) fiogf49gjkf0dFigura 1. Procedimiento">
fiogf49gjkf0dFigura 1. Procedimiento">
 fiogf49gjkf0dFigura 2. Flujo">
fiogf49gjkf0dFigura 2. Flujo">
.jpg) fiogf49gjkf0dFigura 3. Tomas">
fiogf49gjkf0dFigura 3. Tomas">
 fiogf49gjkf0dFigura 4. Encuesta">
fiogf49gjkf0dFigura 4. Encuesta">
 fiogf49gjkf0dFigura 5. Extracción ADN">
fiogf49gjkf0dFigura 5. Extracción ADN">
.jpg) fiogf49gjkf0dFigura 6. Detección del VPH. PCR">
fiogf49gjkf0dFigura 6. Detección del VPH. PCR">
 fiogf49gjkf0dFigura 7. Detección del VPH. PCR">
fiogf49gjkf0dFigura 7. Detección del VPH. PCR">
 fiogf49gjkf0dFigura 8. Protocolo hospitalario">
fiogf49gjkf0dFigura 8. Protocolo hospitalario">
 fiogf49gjkf0dGráfico 1. Grupos de estudio">
fiogf49gjkf0dGráfico 1. Grupos de estudio">
 fiogf49gjkf0dGráfico 2. Grupos. Edad">
fiogf49gjkf0dGráfico 2. Grupos. Edad">
 fiogf49gjkf0dGráfico 3. Grupos de edad. Estudio">
fiogf49gjkf0dGráfico 3. Grupos de edad. Estudio">
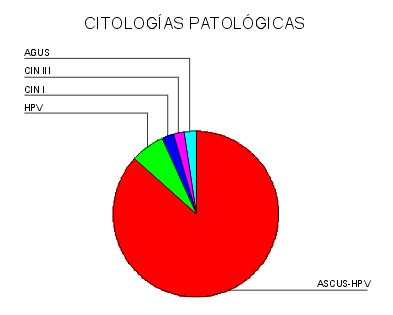 fiogf49gjkf0dGráfico 4. Citologías patológicas">
fiogf49gjkf0dGráfico 4. Citologías patológicas">
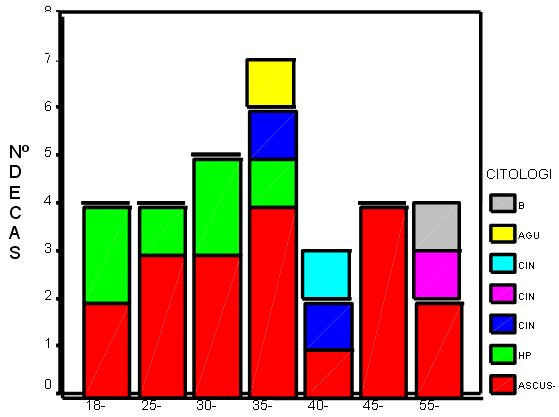 fiogf49gjkf0dGráfico 5. Grupos de edad. Voluntarias">
fiogf49gjkf0dGráfico 5. Grupos de edad. Voluntarias">
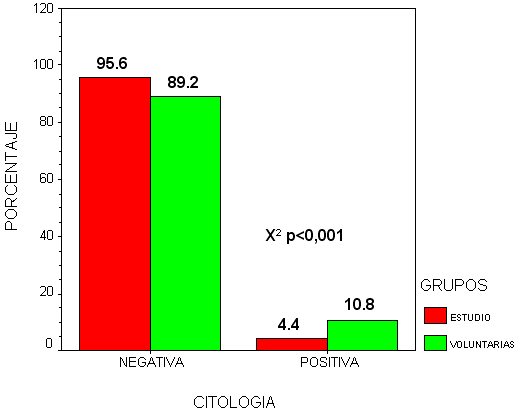 fiogf49gjkf0dGráfico 6. Citología">
fiogf49gjkf0dGráfico 6. Citología">
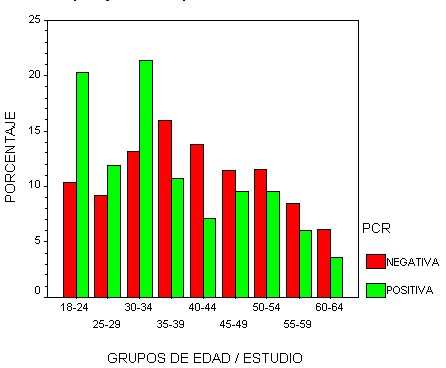 fiogf49gjkf0dGráfico 7. PCR. Grupos de edad/estudio">
fiogf49gjkf0dGráfico 7. PCR. Grupos de edad/estudio">
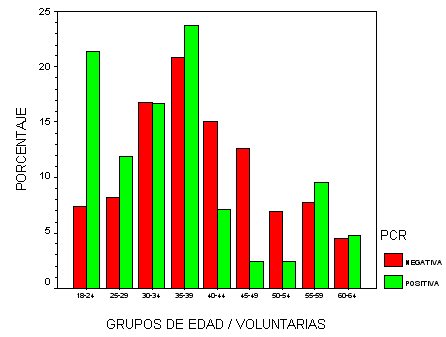 fiogf49gjkf0dGráfico 8. PCR. Grupos de edad/voluntarias">
fiogf49gjkf0dGráfico 8. PCR. Grupos de edad/voluntarias">
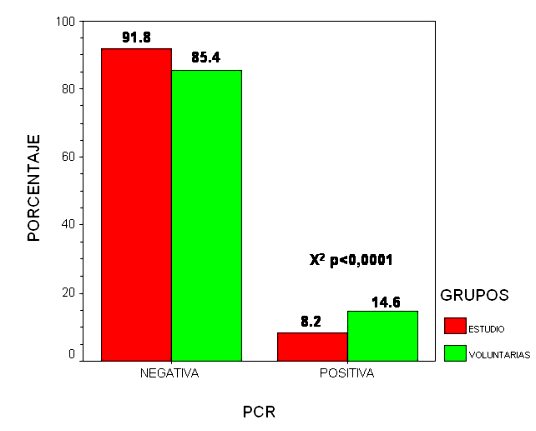 fiogf49gjkf0dGráfico 9. PCR/grupos">
fiogf49gjkf0dGráfico 9. PCR/grupos">