

|
Tumor de células gigantes de costilla. Presentación de un caso Carlos Manuel Yusef Angulo*, Alexis Verdecia Cedeño* |
|
|
Se presenta mujer de 24 años de edad, con antecedentes de salud, que tres meses antes al ingreso hospitalario se realizó radiografía simple de tórax debido a una infección respiratoria, de la cual evolucionó satisfactoriamente y cuyo éxamen radiológico resultó negativo. Después de transcurrido este tiempo comienza con dolor ligero a nivel de la parrilla costal derecha en el plano lateral acompañado de cansancio, se constata palidez cutánea y mucosa por lo que se solicita al laboratorio valores de hemoglobina resultando en 66 g/l, y velocidad de sedimentación de glóbulos de 102/h. Teniendo en cuenta estos resultados la referimos a un centro hospitalario donde mediante Rx torácico se encuentra una gran tumoración a nivel de lóbulos superior y medio del pulmón derecho, se practican una serie de estudios imagenológicos y de anatomía patológica (biopsias), así como endoscópicos que no deducen ningún diagnóstico exacto, por lo cual se decide intervenir quirúrgicamente practicándose una neumectomía total con resección de costillas 5, 6 y 7, de ganglios periesofágicos y peritraqueales. Unido a esta pieza se extrae una gran tumoración de 12 cm en su diámetro mayor adherida a la pared ósea e infiltrando parénquima pulmonar que tras varios estudios se define como tumor de células gigantes de costilla. La paciente tuvo una evolución favorable y actualmente se plantea una curación total.
|
||
|
|
El tumor de células gigantes (TCG)de hueso es un a entidad clinicopatológica bien definida que generalmente afecta la epífisis de huesos largos, como el fémur, la tibia y el radio; y se presenta entre los 20 y 40 años de edad, con un ligero predominio en mujeres(1,2). Con frecuencia se pueden apreciar los diversos nombres utilizados para designar la misma entidad: osteoclastoma, tumor mieloide, tumor a mieloplaxas, osteomielitis hemorrágica, entre otros. No obstante, el término tumor de células gigantes es el más aceptado y utilizado en la literatura(3). El objetivo de la presente comunicación es presentar un caso muy atípico en cuanto a su localización y evolución.
|
|
|
|
CASO CLÍNICO: Mujer de 24 años que aproximadamente 3 ½ meses antes al ingreso hospitalario comenzó con fiebre, tos y secreción nasal, interpretándose como una infección respiratoria aguda de etiología viral, durante la cual se realizó estudio radiológico AP del tórax, donde no se encontraron elementos positivos, no obstante persistió esta sintomatología, por lo que se comenzó tratamiento con eritromicina y se repitió estudio radiográfico, resultando también negativo. Paulatinamente fueron desapareciendo los síntomas respiratorios pero comenzó a aparecer dolor ligero en la cara lateral derecha del tórax que se irradiaba hacia la mama de ese lado; se realizó examen de la misma siendo negativo. Este dolor comenzó a intensificarse gradualmente; se pensó en una neuralgia intercostal tratándose con antineuríticos y analgésicos con alivio temporal del dolor pero sin desaparecer. Siendo así se decidió indicarle exámenes de sangre: hemoglobina 66 g/l. , hematocrito 026 %, eritrosedimentación 102 mm/h; por lo que es llevada al hospital Hermanos Ameijeiras donde se ingresa.
|
|
|
|
DATOS POSITIVOS AL EXAMEN FISICO: Mucosas: hipocoloreadas Piel: pálida Aparato respiratorio: Inspección: Normoconfigurado, expansión normal de ambos hemitórax, no polipnea ni tiraje. Palpación: Dolor exquisito a la palpación de quinto y sexto espacios intercostales derechos, más intenso a nivel de la línea medio axilar. Vibraciones vocales discretamente disminuidas en la zona de mayor dolor. Con la maniobra base-base se aprecia ligera disminución de la expansibilidad del hemitórax derecho. Percusión: No se precisó por ocasionar dolor intenso. Auscultación: Murmullo vesicular ligeramente disminuido a nivel del quinto y sexto espacios intercostales derechos en el plano lateral.
|
|
|
|
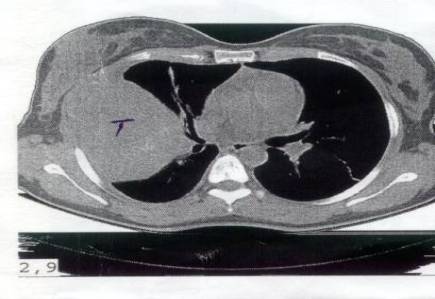
Hematológicos: Hematocrito 026% Hemoglobina 65 g/l Plaquetas 584X10-9/l Bioquímica sérica: Calcio 2.35 mmol/l Glucosa 4.4 mmol/l Creatinina 74 mmol/l Proteínas totales 92g/l Actividades enzimáticas en suero: TGP 4.1 mmol/l Fosfatasa alcalina 302 u/l VR (98- 279 u/l) LDH 1207 U/L VR(230-460 u/l) IMAGENOLOGICOS: Rayos X tórax PA y lateral: Tumoración grande periférica a nivel de 4to 5to y 6to arcos costales derechos ( figuras 3, 4, 5 ) Ultrasonido abdominal y ginecológico: Negativo Ultrasonido de tórax: Tumor grande sólido, muy vascularizado a 1 cm de profundidad con calcificaciones en su interior 9x8.5 cm. Ligero derrame pleural derecho. TAC de pulmón: Destrucción del 5to arco costal derecho vecino a la masa 8.2 x 8.1 cm. Tumor muy grande con calcificación en su interior. (6, 7, 8, 9 ) ANATOMIA PATOLOGICA: BAAF: Extendido hemorrágico con muy escasas células epiteliales. No elementos tumorales. CILINDRO: Escasos elementos tumorales. Impresiona tumor de células gigantes.
|
|
|
|
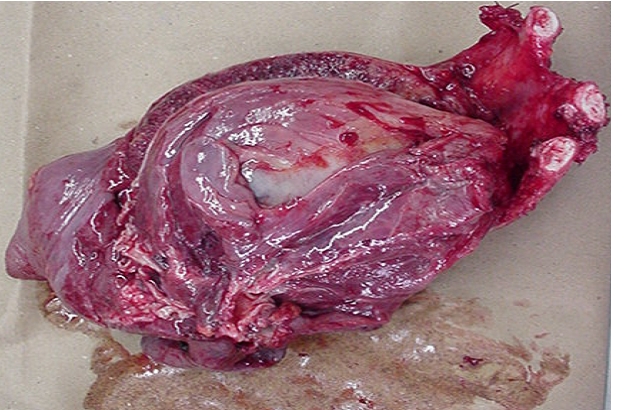
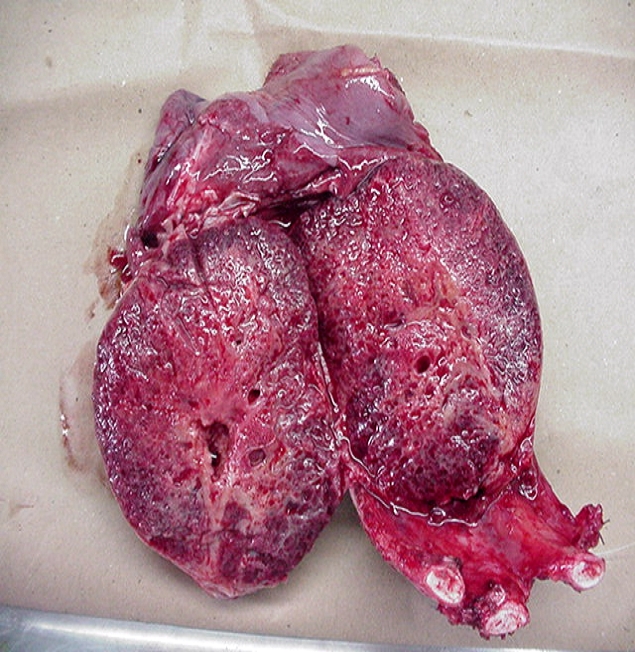
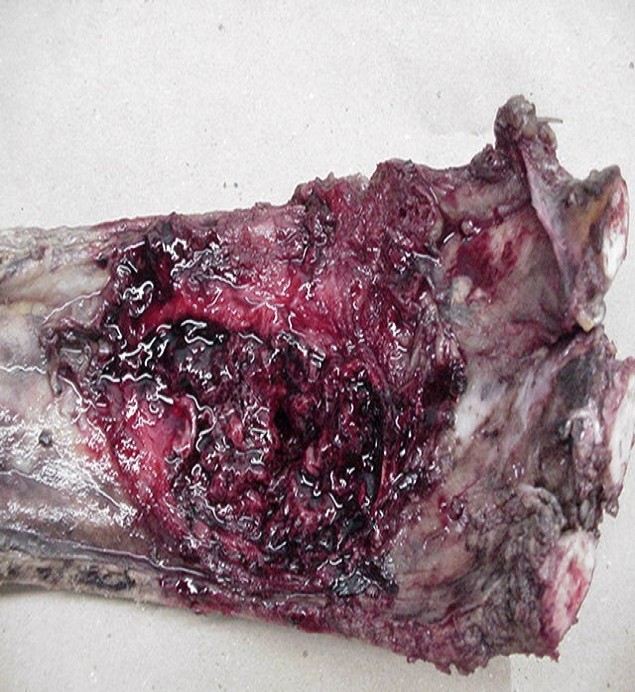
CONDUCTA TERAPEUTICA Y EVALUACION ANATOMOPATOLOGICA CONDUCTA TERAPEUTICA: Se procedió a tratamiento quirúrgico, realizándose neumectomía derecha total con resección de costillas 5,6 y 7, así como el resto de la pared hasta el tejido celular subcutáneo, también se resecaron los ganglios periesofágicos y peritraqueales. ANATOMIA PATOLOGICA:
Macroscopía: Pieza operatoria de neumectomía con pared costal, donde el tumor mide 12X8X9 cm. Al corte de consistencia blanda y color rojizo con zonas pardas; áreas cavitadas y hemorrágicas. Microscopía: Proliferación fusocelular con regular cantidad de mitosis, destacándose la presencia de múltiples células gigantes multinucleadas, distribuidas de forma regular y uniforme en todas las áreas tisulares examinadas. Hay producción de osteoide maduro y focos de calcificación.
|
|
|
|
DIAGNÓSTICO CLÍNICO PATOLÓGICO: Tumor de células gigantes óseo costal grado 2, estadío 3. COMENTARIOS: Comúnmente los tumores de costillas se deben a lesiones metastásicas. Dentro de las entidades primarias de esta región, las 2 terceras partes son malignas. Estos tumores primarios costales en orden de frecuencia aparecen de la siguiente manera: condrosarcoma 30%, linfomas y mieloma múltiple o solitario 17%, displasia fibrosa 12%, osteosarcoma 10%, osteocondroma 8%, sarcoma de Ewing 6%, granuloma eosinofílico 3% y otros tumores raros dentro de los que se incluyen: hemangioma, condrosarcoma mesenquimatoso, tumor neuroectodérmico, condroblastoma, fibroma condromixoide, tumor de células gigantes, tumor de células gigantes de la enfermedad de Paget, tumor de células gigantes del hiperparatiroidismo, histiocitoma fibroso, quiste óseo aneurismático, fibrosarcoma y angiosarcoma(4,5). NATURALEZA Y ORIGEN: Se ha discutido si el TCG es una neoplasia o no, por las múltiples teorías acerca de su origen, sobre todo en la primera mitad del siglo pasado. Sin embargo, autores como Jaffe, Goldeberg en los años 50 lo catalogaron como un proceso neoplásico, incluso con capacidad de dar metástasis pero conservando en ellos su patrón de benignidad, o desafortunadamente aparece como una variante de fibrosarcoma con focos de diseminación a distancia (6). Como una neoplasia, el TCG parece ser un crecimiento anormal del tejido conectivo de soporte de la médula ósea. Con respecto a las células gigantes, su origen parece ser las células del mismo estroma y no deben considerarse como el origen mismo del tumor; idea generalizada en el pensamiento médico, aunque estas producen las mismas enzimas que el osteoclasto fisiológicamente activo. Estudios de cinemicrografía han demostrado que se forman de la agregación de las células mononucleadas del estroma(6). En contraposición al concepto de neoplasia existe la teoría de que el TCG es un proceso anormal de cicatrización; teoría fácilmente descartable por algunos autores, quienes no lograron descartar un trauma o lesión previos en sus series, como para explicar el mencionado proceso cicatrizal(6). INCIDENCIA: El TCG representa alrededor del 4-5 % de todos los tumores primarios de hueso, y de los benignos el 18.2 % (7,8), El 75 % de los casos afecta a personas entre los 20 a 40 años de edad, siendo raro en menores de 10 años y en mayores de 50. Tiene mayor incidencia en el sexo femenino 57 %. Con relación a la distribución geográfica es más frecuente en países orientales que en occidentales (1,2,8). LOCALIZACION: Es mucho más frecuente en los extremos de los huesos largos comprometiendo la epífisis y la metafísis con localización excéntrica. Los tres sitios más afectados son: extremo inferior del fémur, extremo superior de la tibia y extremo distal del radio (entre estos conforman el 60-80% de los casos publicados), siguiendo otras localizaciones en huesos largos y muy raramente en la pelvis, rótula, vértebras, huesos del cráneo y costillas, apareciendo en este último lugar en menos del 1% de los casos. (1,2,6,7,8). DATOS MACROSCOPICOS Las dimensiones del TCG oscilan entre l cm. y l0 cm de diámetro. El tumor se compone de un tejido friable, muy vascular de color rojo pardusco con algunas tonalidades de gris. Los tumores de gran tamaño tienen zonas quísticas y hemorrágicas; llegan a perforar la corteza extendiéndose sobre los tabiques musculares invadiendo los tejidos blandos adyacentes. (8 ) DATOS MICROSCOPICOS: A este nivel las células gigantes tienen apariencia osteoclástica, lo cual ha sido confirmado con estudios por microscopio electrónico, histoquímico e inmunohistoquímico(8,9,10,11). La naturaleza de las células gigantes es mesenquimatosa más que hematopoyética; y los estudios en el ámbito de microscopía electrónica son compatibles con extirpe fibroblástico u osteoblástico. (8,12,13). Esto último es sostenido por el hecho de que un tercio de los TCG exhiben osteoide o hueso interpretado como una respuesta metaplásica de las células del estroma a una fractura o a un tratamiento inadecuado. (6). GRADOS HISTOLOGICOS: Los patólogos han dividido en tres grupos los patrones histológicos de este tumor, mirando las características del estroma, la diferenciación celular, la cantidad de mitosis y la presencia de necrosis (6). GRADO I: Estroma moderadamente vascular compuesto por células ovoides o fusiformes, sin mitosis y con gran población de células gigantes. GRADO II: Un intermedio con escasas mitosis, población moderada de células gigantes y escaso pleomorfismo en el estroma. GRADO III: Estroma pleomórfico, con núcleos de variadas formas y tamaños, mitosis muy comunes y células gigantes pequeñas y muy escasas. En la práctica clínica la clasificación descrita no es muy confiable para predecir el comportamiento del tumor, como en un principio se había pensado; ya que no existe relación entre el crecimiento lento o rápido del tumor y sus características histológicas; de tal manera que es mucho más útil la clasificación en estadíos de acuerdo a su comportamiento clínico. (6). ESTADIO I: Tumor latente, cuya historia natural es el crecimiento muy lento durante la infancia o la adolescencia para luego permanecer inerte o incluso curar espontáneamente. Limites muy precisos formados por hueso esclerótico, maduro y la zona reactiva presenta escasa neovasculatura y pocas células inflamatorias. Aproximadamente un 10% pertenece a esta categoría. ESTADIO II: Tumor activo, cuya historia natural es el crecimiento progresivo no autolimitado sin llegar a la latencia o a la curación espontánea. Los bordes son aún definidos e incluso se observa hueso maduro alrededor pero la zona reactiva muestra elementos mesenquimales inmaduros en extensión importantes dentro del hueso sano, circunstancia que implica una difícil remoción de toda la lesión. La mayoría de los TCG (80%) se encuentra en este estadio. ESTADIO III: Tumor agresivo, comportamiento invasivo, crecimiento rápido, los bordes son imprecisos y vemos nódulos tumorales protruyendo dentro de la cápsula del tumor. Llama la atención que la zona reactiva presenta aumento considerable de la neovasculatura, esta edematosa, es densa y la recurrencia después de la resección intracapsular es segura. Afortunadamente solo un 10% de los TCG presenta este comportamiento clínico. DIAGNOSTICO DIFERENCIAL Con respecto a este capítulo, podemos señalar que intervienen diferentes factores dependiendo de la localización, presentación clínica, manifestaciones radiológicas, entre otras. No obstante; si nos basamos en la presencia de las células gigantes primeramente hay que hacer este diagnóstico diferencial con los tumores pardos del hiperparatiroidismo, en el cual aparecen datos hormonales y de calcio en los exámenes, que precisan el diagnostico. Posteriormente entramos en un conjunto de entidades llamadas osteopatías gigantocelulares que histológicamente se asemejan al TCG y son: 1) Quiste óseo aneurismático 2) Quiste óseo simple 3) Condroblastoma epifisiario 4) Granuloma eosinófilo 5) Fibroma no osificante Pero con este caso en particular, a medida en que se avanzaba en el estudio aparecían dificultades para hacer el diagnóstico concreto. En primer lugar con ninguno de los exámenes imagenológicos se podía precisar con exactitud si la tumoración era primaria de costilla o de pulmón; se tenia la incertidumbre que si la lesión creció hacia el pulmón o agresivamente desde este hacia la pared costal por lo que unificando las características clínicas y los exámenes realizados se pensaba en primer lugar que la paciente era portadora de un tumor maligno de partes blandas (sarcoma); debido a la rápida progresión e invasividad de la neoplasia. Cuando se tomaron las primeras muestras para biopsia no se pudo definir con exactitud y no es hasta que se analiza histológicamente la pieza quirúrgica que se logra definir el diagnostico. EVOLUCION CLINICA O HISTORIA NATURAL El TCG debe ser considerado como un tumor de bajo grado de malignidad. En las series consultadas, la incidencia de recidivas intratables y metástasis fue del 10%. MC Donald y Col. (18) reportan un tasa de recidivas del 34% en pacientes tratados con curetaje de la lesión y del 7% en los casos tratados con resecciones quirúrgicas amplias. Existe una buena correlación entre el estadio clínico del TCG y el pronóstico (19). Así, Bertone y Col. (20) observaron diseminación metastásica en casos de TCG en estadio 3 con destrucción de la cortical ósea y extensión a los tejidos blandos. Otro fenómeno interesante esta dado por el hecho de que casi todos los casos de TCG con diseminación metastásica ocurrieron en pacientes intervenidos quirúrgicamente, sugiriendo la posibilidad de que la cirugía pudiera haber lesionado vasos sanguíneos con presencia de tejido tumoral intravascular (21). Como se ha visto el TCG es una entidad rara, y mucho mas aún, localizado en costillas, apareciendo muy pocos casos publicados. No encontramos ningún reporte de un TCG costal tan grande y con evolución tan rápida por lo que consideramos muy oportuno hacer este trabajo. Nuestra paciente se estudio sistemáticamente en busca de signos de recidiva, los cuales nunca aparecieron por lo cual se dio el alta y se definió como curada.
|
|
|
|
1- Campanacci M, Giunti A, Olmi R. Giant cell tumor of bone. Ital J Orthop Traumatol 1975;1:249-277. 2- Sunw HW. Giant cell tumor of bone. J Bone Joint Surg(Am) 1986;64:755-761. 3- Jaffe HL. Tumores y estados tumorales óseos y articulares. La prensa médica mejicana 1966;2:11-37. 4- Mirra JM. Unique tumors of the ribs 1989. 5- Chiles C. The chest wall and pleura. Ramepress 1993. 6- Soto MC. Experiencias en el tratamiento del tumor de células gigantes con criocirugía. Infomed 2001. 7- Huvos AG. Tumores óseos, diagnóstico, tratamiento y pronóstico. Editorial médica panamericana 1981;17:249-273. 8- Sants L.Tumor de células gigantes de rótula..Infomed 2001. 9- Athanason NA. An inmunohistological study of giant cell tumor of bone. J Pathol 1985 147:153-158. 10- Medeiros J. Giant cell and mononuclear cell of giant cell tumor of bone. Appl Inmunohystochem 1993;1:115-122. 11- Regezi Ja. Muramidase and, alfa 1 anttichymotripsin, and S-100 protein inmunoreactivity in giant cell lesion. Cancer 1987;59:64-68. 12- Aparisi T. Giant cell tumor of bone. Acta Orthop Scand 1978;173:1-38. 13- Aquel NM. Celular heteregeneity in giant cell tumor of bone. Histopathology 1988; 13: 675-685. 14- Goldring SR. Characterization of cell from human giant cell tumor of bone. Clin Orthop 1986;204:59-75. 15- Fonasier VL Virus like filamentous intranuclear inclusions in giant cell tumor. J Bone Joint Surg 1985; 67:333-336. 16- Negoescu A. The ultraestructure of nuclear inclusions in the giant cell tumor of bone. Pathol Res Pract 1989;184:410-417. 17- Schajowicz F. Virus like intranuclear inclusions in giant cell tumors of bone. Clin Orthop 1985; 201:247-250. 18- Mc Donald DJ. Giant cell tumor of bone. J Bone Joint Surg 1986; 68:235-242. 19- Present D, Bertoni F. The correlation between the radiologic staging and histopathologic findings in aggressive stage 3 giant cell tumor of bone. Cancer 1986;57:237-244. 20- Bertoni F, Present D. Giant cell tumor of bone with pulmonary matastases. J Bone Join Surg 1985; 67:890-900. 21- Rosai J. Ackerman’s Surgical Pathology 1996, 8va edición; vol 2, cap 24:1957-62. 22- Ocksner A. Tumors of the chest wall. Surg Clin North Am, 1996:46: 1447-1452. 23- Pairolero PC, Arnold PG. Chest wall tumors. J Thoracic Cardiovasc Surg 1985;90(3):367-372. 24- Schaefer PS, Burton BS. Radiologic evaluation of chest wall lesions. Surg Clinic North Am, 1989;69:911-946.
|
|
|
|
- Juan Pablo Garcia de la Torre (06/10/2005 14:01:36)
- Carlos Yusef (06/10/2005 22:51:18)
|
|
|
|
|
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 14:10:50
 fiogf49gjkf0d">
fiogf49gjkf0d">
 fiogf49gjkf0d
">
fiogf49gjkf0d
">
 fiogf49gjkf0dIMAGEN MACROSCÓPICA">
fiogf49gjkf0dIMAGEN MACROSCÓPICA">
 fiogf49gjkf0dIMAGEN MACROCÓPICA">
fiogf49gjkf0dIMAGEN MACROCÓPICA">
 fiogf49gjkf0dIMAGEN MACROCÓPICA">
fiogf49gjkf0dIMAGEN MACROCÓPICA">