Direccion de contacto
fiogf49gjkf0d msantamm@cfnavarra.es
|
|
LIMITACIONES DE LA PUNCIÓN ASPIRACIÓN CON AGUJA FINA EN LAS LESIONES DE MAMA. La “Zona Gris”
Mercedes Santamaría Martínez*, Pedro de Llano Varela*, María Asunción Arrechea Irigoyen**
* Hospital de Navarra. Pamplona
ESPAÑA
** Hospital de Navarra ESPAÑA
|
|
|
Resumen
fiogf49gjkf0d Espectro de la Zona Gris
En la citología de mama existe un amplio espectro de hallazgos citológicos que son difíciles de interpretar y que plantean problemas diagnósticos y de diagnóstico diferencial. Es importante el conocer estas circuntancias para evitar falsos diagnósticos positivos y negativos.
- ¿ Son lesiones pre-cancerosas ?.
- ¿ Son lesiones benignas que parecen malignas?
O al contrario
- ¿ Son lesiones malignas que no reúnen todos los requisitos necesarios para diagnosticarlas como tales ?: Corresponden a:
- Lesiones de difícil interpretación en cuanto a su benignidad-malignidad.
- Lesiones en las que se corre el riesgo de hacer un sobrediagnóstico o un infradiagnóstico.
Frecuencia según autores
|
Autores |
|
Biopsia benigna
Nº de casos
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Causas de la “zona gris”
- Técnicas (fig 1)
- Inexperiencia
- Superposición de lesiones benignas y malignas
- En estas ocasiones, no puede hacerse un diagnóstico definitivo por FALTA DE CRITERIOS O SUPERPOSICIÓN DE LOS MISMOS
La "zona gris" se da con frecuencia en:
- A-Fibroadenoma
- B-Neoplasias papilares
- C-Enfermedad fibroquística con hiperplasia
- D-Carcinoma apocrino de bajo grado
El propósito de esta exposición es revisar los hallazgos citológicos y dificultades diagnósticas de estas lesiones
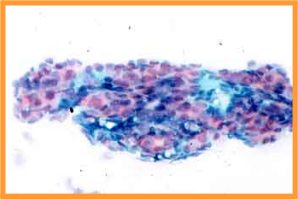 fiogf49gjkf0dFig 1-Artefacto que impide la correcta valoración citológica"> fiogf49gjkf0dFig 1-Artefacto que impide la correcta valoración citológica">
Causas - fiogf49gjkf0d Fig 1-Artefacto que impide la correcta valoración citológica
|
|
|
A- Fibroadenoma
fiogf49gjkf0d Fibroadenoma
- Frecuente
- Entre 20 y 35 años
- Generalmente nódulos únicos
- 20 % múltiples
- No más de 3 cms. de diámetro
- Macroscópicamente característico (Fig 2)
- El origen del carcinoma sobre FA es muy poco frecuente (0,1%). Se asocia a carcinoma lobular infiltrante y carcinoma in situ
Fibroadenoma
- Patrones microscópicos(Fig 3)
- Pericanalicular
- Intracanalicular
- Pero existen frecuentes variaciones morfológicas como son la calcificación, hialinización, transformación mixoide del estroma, la elevada densidad celular estroma y a veces la infartación hemorrágica
Fibroadenoma. Citología (Figs 4 y 5)
- Celularidad moderada
- Grupos de células epiteliales con buena cohesión
- Ramificaciones y proyecciones celulares
- Núcleos desnudos
- Fragmentos de estroma
- Escasas células espumosas y apocrinas
Fibroadenoma con atipia. Lo expresamos así cuando encontramos:
- Pérdida de cohesión celular
- Grupos papilares
- Atipia celular
- No hay necrosis
Vamos a considerar estas circunstancias en el diagnóstico diferencial:
- Atipia en fibroadenoma
- Citología semejante a EFQ
- Sospecha de CARCINOMA
1- Atipia en fibroadenoma (Fig 6)
- Núcleos aumentados
- Nucléolos aumentados
- Citoplasma basófilo aumentado
2. FA con EFQ (fig 7)
- Menor celularidad
- Pocos núcleos desnudos
- No estroma
- se trata en realidad de lesiones superpuestas
3. Sospecha de carcinoma (fig 8)
- Grupos de pocas células con poca cohesión
- Escasos núcleos desnudos
- Poca celularidad
- Defecto de técnica
Diagnóstico diferencial del fibroadenoma con atipia
- Papiloma y carcinoma papilar
- Papilomatosis en EFQ (no hay estroma)
- Phyllodes
- Adenoma (estroma acelular)
- Carcinoma ductal invasor de bajo grado o tubular(Fig 9)
- Carcinoma mucinoso
Posibles Mecanismos Patogénicos
- Respuesta a estimulación hormonal
- Actividad secretora focal
- Respuesta a la inflamación
- Cambios metaplásicos
- Multifactorial
Referencias
- Al-Kaisi N: The spectrum of the “gray zone” in breast cytology. A review of 186 cases of atypical and suspicious cytology.The spectrum of the “gray” Acta Cytol 1994, 38:898-908
- Stanley MW, Tani EM, Skoog L.: Fine-needle aspiration of fibroadenomas of the breast with atypia: a spectrum including cases that cytologically mimic carcinoma. Diagn Cytopathol. 1990;6(6):375-82.
- Ozkara SK, Ustun MO, Paksoy N. The gray zone in breast fine needle aspiration cytology. How to report on it? Acta Cytol. 2002 May-Jun;46(3):513-8.
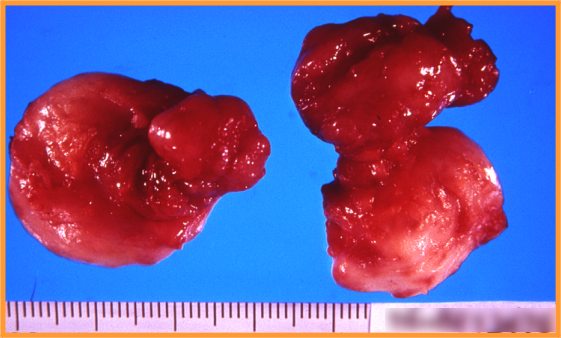 fiogf49gjkf0dFig 2-Fibroadenoma"> fiogf49gjkf0dFig 2-Fibroadenoma">
Fibroadenoma - fiogf49gjkf0d Fig 2-Fibroadenoma
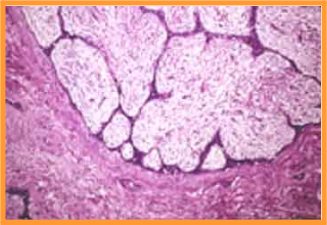 fiogf49gjkf0dFig 3.Fibroadenoma. Imagen microscópica"> fiogf49gjkf0dFig 3.Fibroadenoma. Imagen microscópica">
microscópicos - fiogf49gjkf0d Fig 3.Fibroadenoma. Imagen microscópica
 fiogf49gjkf0dFig 4.Fibroadenoma. Citología"> fiogf49gjkf0dFig 4.Fibroadenoma. Citología">
Fibroadenoma. Citología - fiogf49gjkf0d Fig 4.Fibroadenoma. Citología
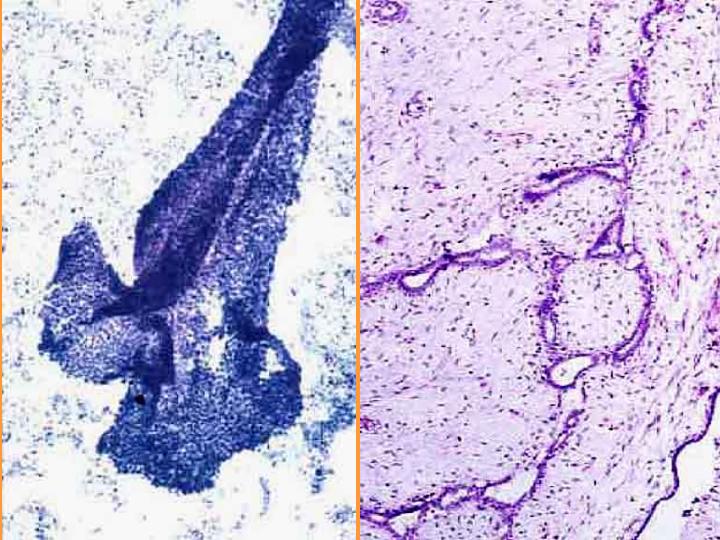 fiogf49gjkf0dFig 5.Fibroadenoma. Citología e histología"> fiogf49gjkf0dFig 5.Fibroadenoma. Citología e histología">
Fibroadenoma. Citología-2 - fiogf49gjkf0d Fig 5.Fibroadenoma. Citología e histología
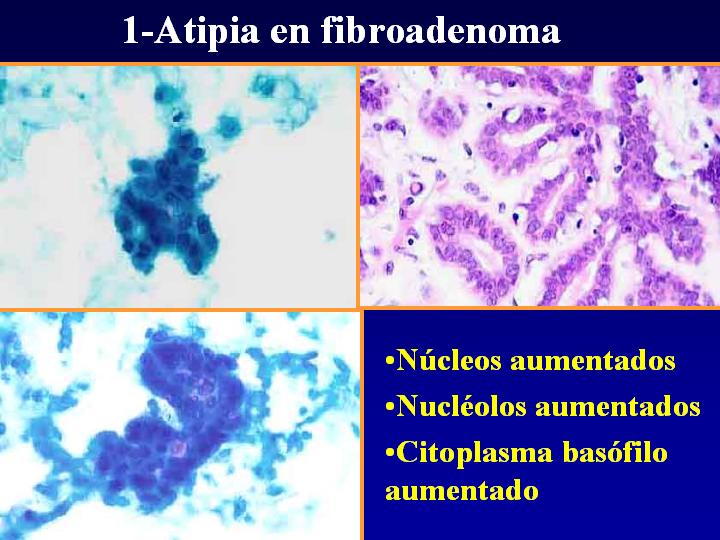 fiogf49gjkf0dFig 6.Atipia en fibroadenoma"> fiogf49gjkf0dFig 6.Atipia en fibroadenoma">
Atipia - fiogf49gjkf0d Fig 6.Atipia en fibroadenoma
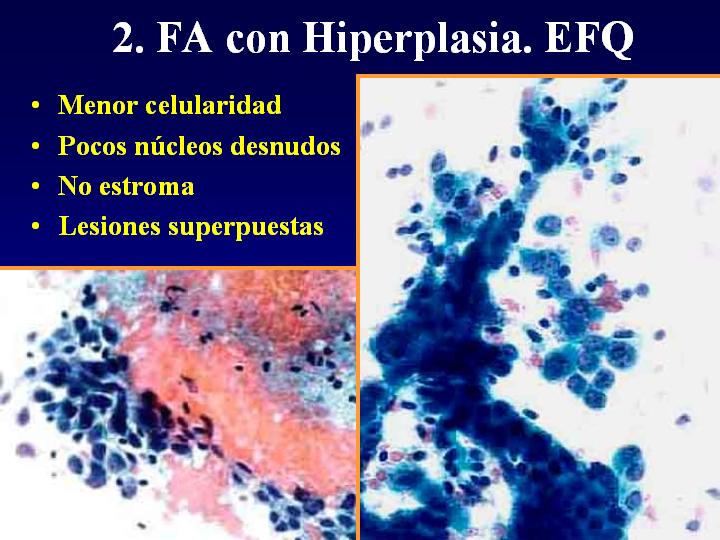 fiogf49gjkf0dFig 7.Fibroadenoma con Hiperplasia."> fiogf49gjkf0dFig 7.Fibroadenoma con Hiperplasia.">
con Hiperplasia - fiogf49gjkf0d Fig 7.Fibroadenoma con Hiperplasia.
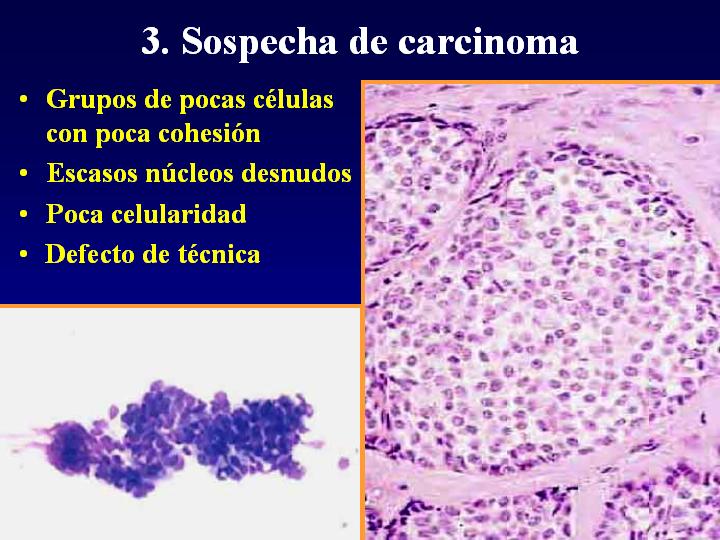 fiogf49gjkf0dFig 8.Sospecha de carcinoma"> fiogf49gjkf0dFig 8.Sospecha de carcinoma">
Sospecha - fiogf49gjkf0d Fig 8.Sospecha de carcinoma
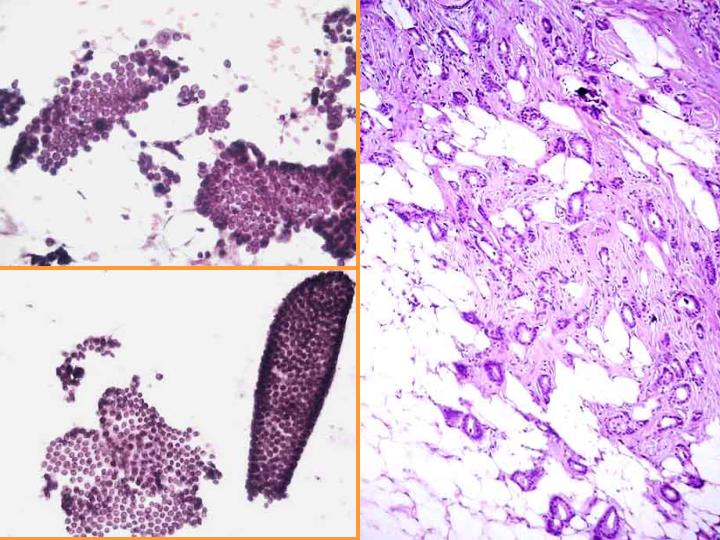 fiogf49gjkf0dFig 9. Sospecha de carcinoma"> fiogf49gjkf0dFig 9. Sospecha de carcinoma">
diapositiva17 - fiogf49gjkf0d Fig 9. Sospecha de carcinoma
|
|
|
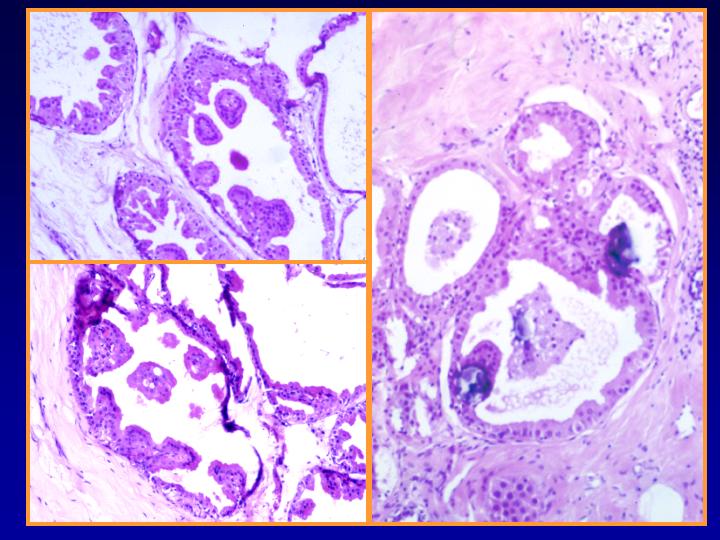
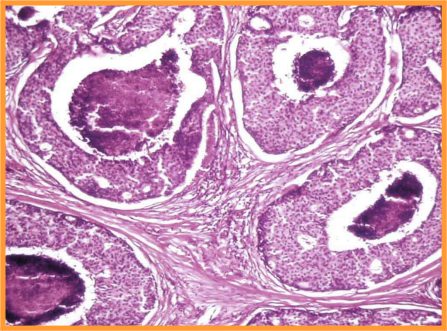
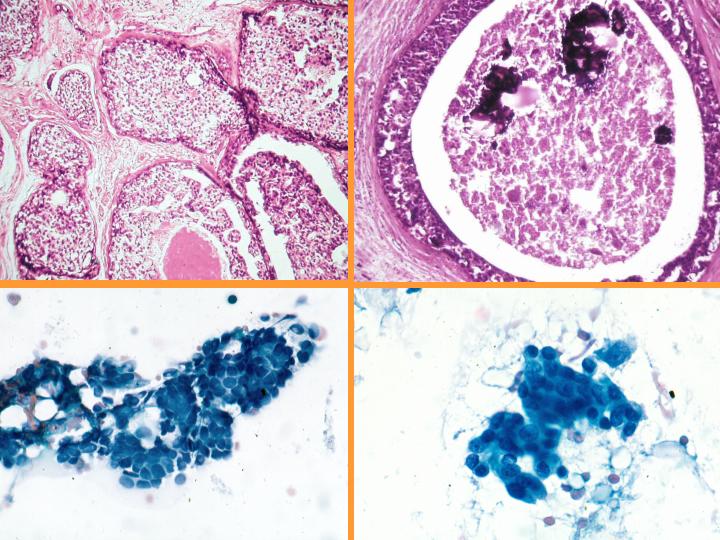
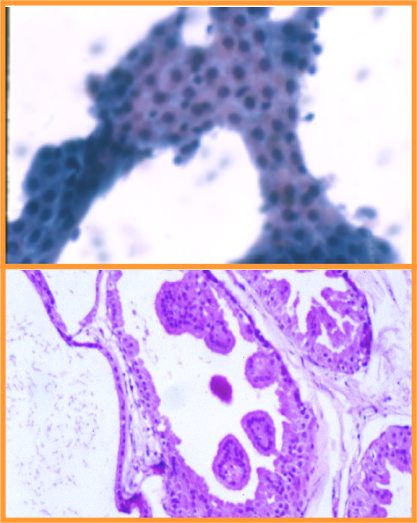
B- Neoplasias papilares
fiogf49gjkf0d Neoplasia papilar. La muestra puede obtenerse por:
- Secreción por el pezón
- Punción de lesión quística
- Punción aspiración de nódulo
- En general el patrón citológico muestra disposición tridimensional sin marcadas atipias ni mitosis.
- El diagnóstico será siempre descriptivo y de neoplasia papilar y por lo tanto no implica benignidad ni malignidad (Figs 10,11,12 y 13)
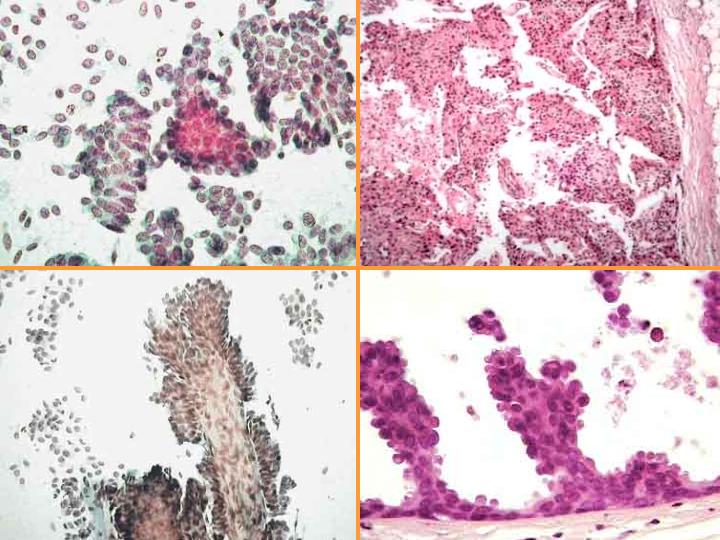
Papiloma (Figs 14,15 y 16)
- Puede interpretarse como maligno
- Menos células que en maligno
- Escasa células aisladas
- Células mioepiteliales
- Células apocrinas y espumosas
- Macrófagos con hemosiderina
Carcinoma Papilar (Figs 17 y 18)
- Diátesis hemorrágica
- Marcada celularidad
- Fragmentos papilares
- Numerosas células cuboidales aisladas
- Atipia escasa
- Macrófagos
- Núcleos bipolares
- Ausencia de células apocrinas
Diagnóstico diferencial en los siguientes casos
A- Papilomatosis en EFQ
B- Fibroadenoma
C- Carcinoma
A-EFQ-hiperplasia-papilomatosis (Fig 19)
- Diátesis hemorrágica
- Poca celularidad
- Fragmentos papilares
- Atipia escasa
- Células aisladas con citoplasma cuboidal
- Células espumosas apocrinas y núcleos bipolares
B-Fibroadenoma (Fig 20)
- Células epiteliales en disposición semejante a papilas
- No hay células columnares
- Núcleos desnudos
C-Carcinoma ductal (Fig 21)
- Componente micropapilar
- Depende del lugar de la punción
- Valorar criterios de malignidad
Referencias
- Jeffrey PB, Ljung BM.:Benign and malignant papillary lesions of the breast. A cytomorphologic study. Am J Clin Pathol. 1994.101(4):500-7.
- Simsir A, Waisman J, Thorner K, Cangiarella J.M: Mammary lesions diagnosed as "papillary" by aspiration biopsy: 70 cases with follow-up. Cancer. 2003; 25;99(3):156-65.
- Dawson AE, Mulford DK.: Benign versus malignant papillary neoplasms of the breast. Diagnostic clues in fine needle aspiration cytology. Acta Cytol. 1994;38(1):23-8
- Michael CW, Buschmann B.:Can true papillary neoplasms of breast and their mimickers be accurately classified by cytology? Cancer. 2002.25;96(2):92-100.
 fiogf49gjkf0dFig 10.Neoplasia papilar"> fiogf49gjkf0dFig 10.Neoplasia papilar">
papilar - fiogf49gjkf0d Fig 10.Neoplasia papilar
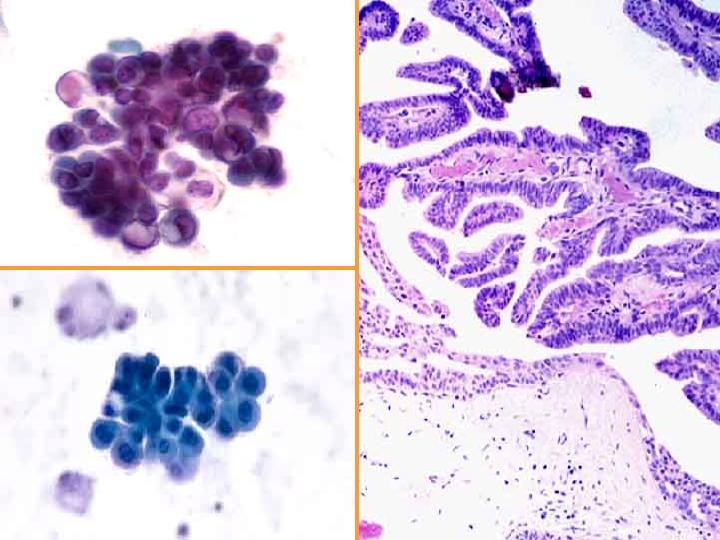 fiogf49gjkf0dFig 11.Neoplasia papilar"> fiogf49gjkf0dFig 11.Neoplasia papilar">
diapositiva23 - fiogf49gjkf0d Fig 11.Neoplasia papilar
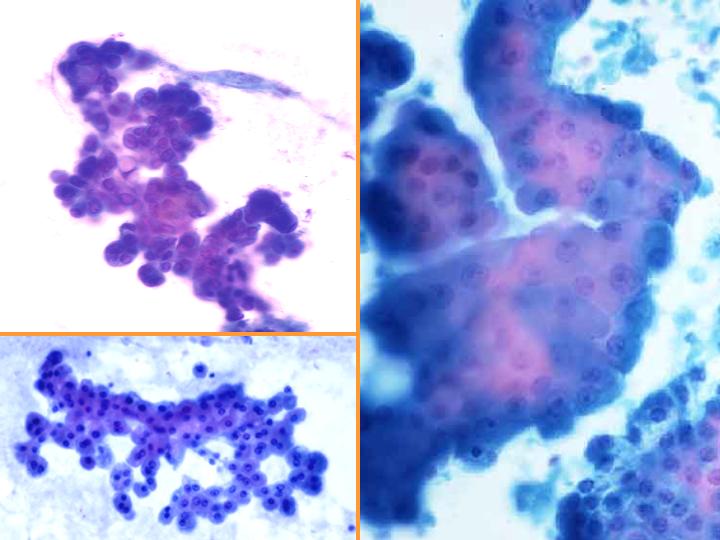 fiogf49gjkf0dFig 12.Neoplasia papilar"> fiogf49gjkf0dFig 12.Neoplasia papilar">
diapositiva24 - fiogf49gjkf0d Fig 12.Neoplasia papilar
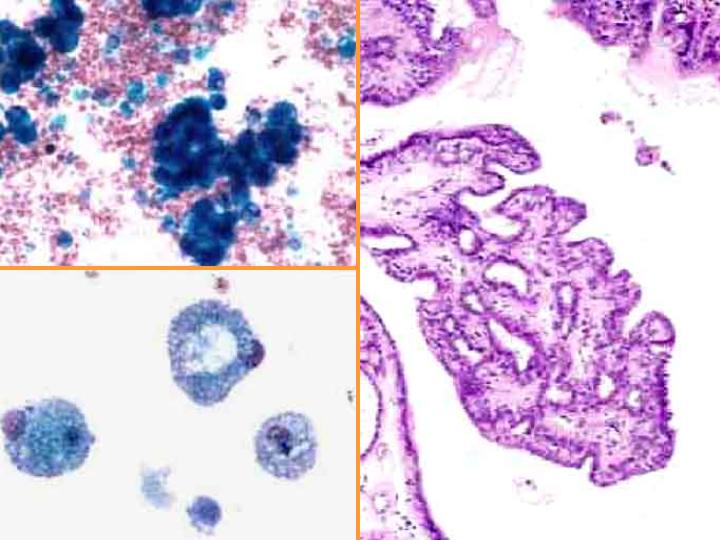 fiogf49gjkf0dFig 13.Neoplasia papilar"> fiogf49gjkf0dFig 13.Neoplasia papilar">
diapositiva25 - fiogf49gjkf0d Fig 13.Neoplasia papilar
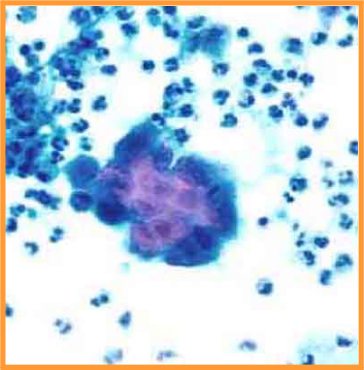 fiogf49gjkf0dFig 14.Papiloma"> fiogf49gjkf0dFig 14.Papiloma">
Papiloma - fiogf49gjkf0d Fig 14.Papiloma
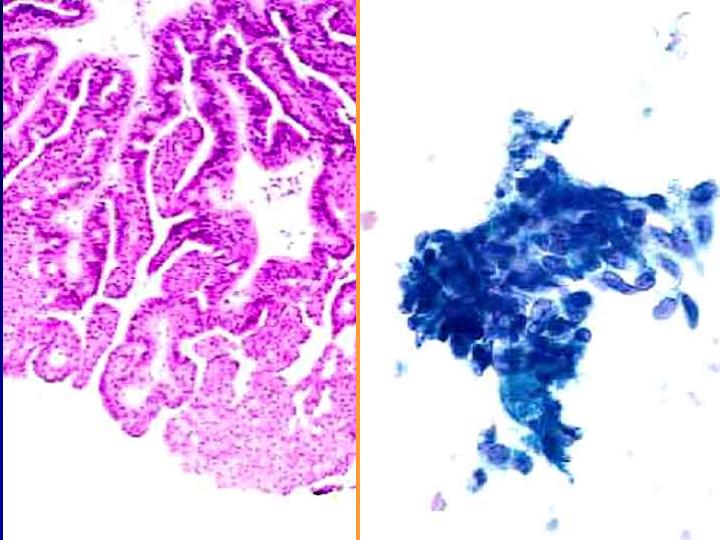 fiogf49gjkf0dFig 15.Papiloma"> fiogf49gjkf0dFig 15.Papiloma">
diapositiva27 - fiogf49gjkf0d Fig 15.Papiloma
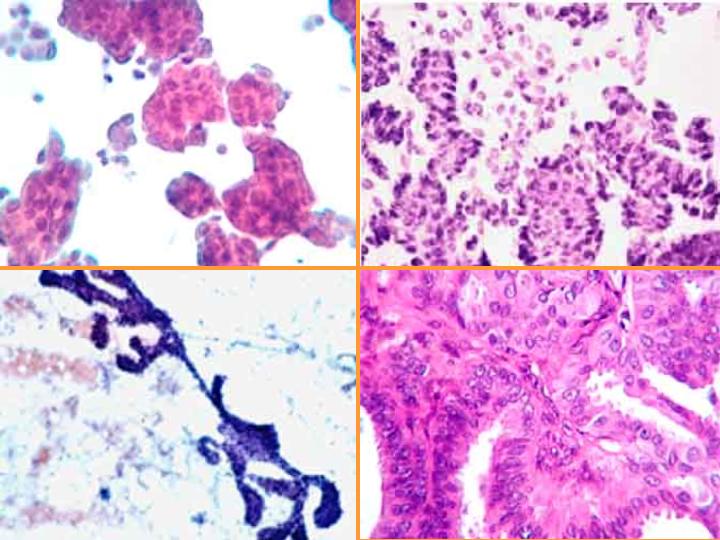 fiogf49gjkf0dFig 16.Papiloma"> fiogf49gjkf0dFig 16.Papiloma">
diapositiva28 - fiogf49gjkf0d Fig 16.Papiloma
 fiogf49gjkf0dFig 17.Carcinoma Papilar"> fiogf49gjkf0dFig 17.Carcinoma Papilar">
Carcinoma Papilar - fiogf49gjkf0d Fig 17.Carcinoma Papilar
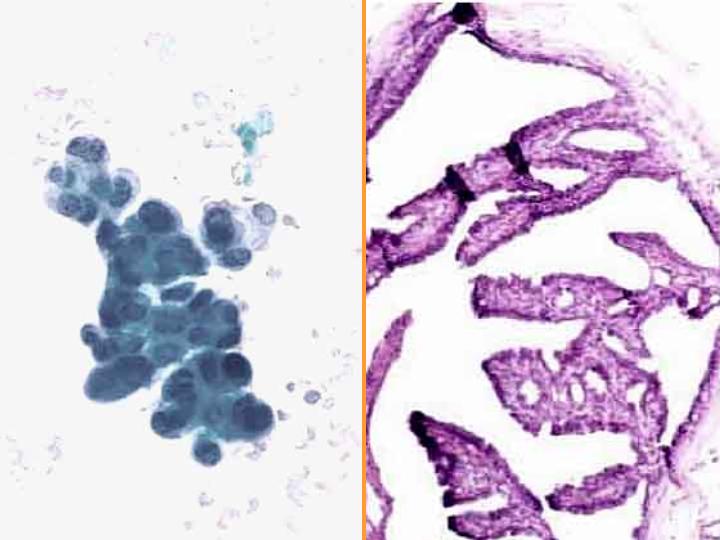 fiogf49gjkf0dFig 18.Carcinoma Papilar"> fiogf49gjkf0dFig 18.Carcinoma Papilar">
diapositiva31 - fiogf49gjkf0d Fig 18.Carcinoma Papilar
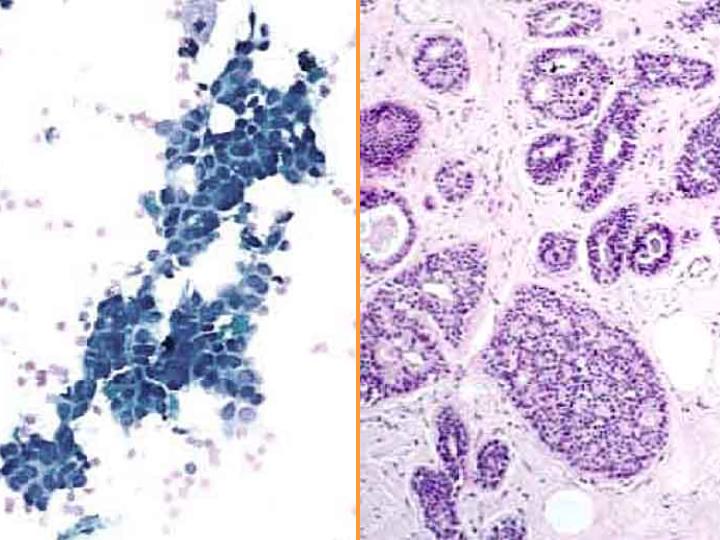 fiogf49gjkf0dFig 19.EFQ-hiperplasia-papilomatosis"> fiogf49gjkf0dFig 19.EFQ-hiperplasia-papilomatosis">
papilomatosis - fiogf49gjkf0d Fig 19.EFQ-hiperplasia-papilomatosis
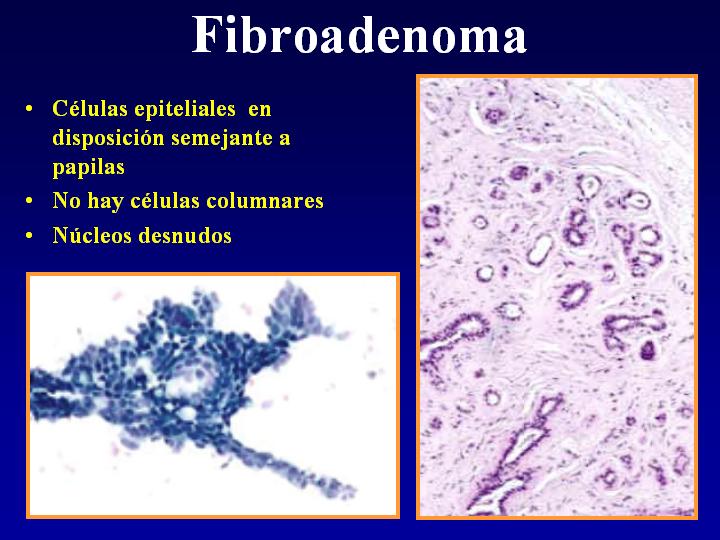 fiogf49gjkf0dFig 20.Fibroadenoma"> fiogf49gjkf0dFig 20.Fibroadenoma">
Fibroadenoma* - fiogf49gjkf0d Fig 20.Fibroadenoma
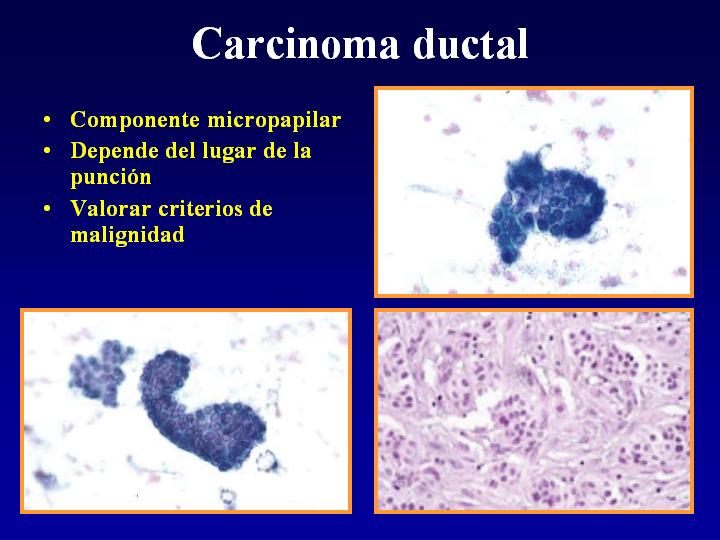 fiogf49gjkf0dFig 21.Carcinoma ductal"> fiogf49gjkf0dFig 21.Carcinoma ductal">
Carcinoma ductal - fiogf49gjkf0d Fig 21.Carcinoma ductal
|
|
|
C- Enfermedad fibroquística con hiperplasia
fiogf49gjkf0d EFQ - Hiperplasia - CDIS
- ¿Es práctico hacer la diferenciación entre hiperplasia atípica y CDIS en citología?
- En realidad se trata de un espectro continuo
- Lo IMPORTANTE desde el punto de vista citológico es diferenciar entre hiperplasia sin atipia y carcinoma. Hay que tener en cuenta que la interpretación es subjetiva y que además faltan los criterios arquitecturales
- Algunos procesos hiperplásicos benignos del epitelio de la mama cursan con grados de atipia citológica muy variables.
- Hay tumores tan diferenciados que son muy difíciles de distinguir de procesos hiperplásicos benignos.
- El porcentaje de carcinomas en hiperplasia atípica en relación al conjunto de pacientes con cáncer varia del 3,7 % al 22,2 % según autores
- La aparición de carcinoma tras el seguimiento de lesiones de hiperplasia atípica comprobadas en biopsia es del 5,1 % al 12,9 % según autores
Criterios generales a valorar en la EFQ
- Disposición de las células
- Pleomorfismo
- Anisonucleosis
- Células mioepiteliales
- Patrón de la cromatina
- Nucléolos
Gangopadhyay M, Nijhawan R, Joshi K, Gupta S.:Cytology of "significant" breast ductal proliferations.
Acta Cytol. 1997.41(4):1112-20.
EFQ- Hallazgos habituales (Figs 22 y 23)
- Poca celularidad
- Fragmentos de estroma y/o tejido adiposo
- Células en monocapa
- Células espumosas
- Células mioepiteliales
Hiperplasia sin atipias(Figs 24 y 25)
- Moderada celularidad
- Grupos con buena cohesión
- Ligera aumento del núcleo y pequeños nucléolos
- Células apocrinas, histiocitos y algunas calcificaciones
- Pérdida focal de la polaridad
- Algunas células mioepiteliales
Hiperplasia ductal. Otros criterios que pueden aplicarse (Fig 26)
- Grupos tridimensionales
- Crecimiento en “remolinos”
- Pequeñas luces. Pérdida de cohesión
- Moderada superposición nuclear
Gangopadhyay M, Nijhawan R, Joshi K, Gupta S.:Cytology of "significant" breast ductal proliferations. Acta Cytol. 1997.41(4):1112-20.
Hiperplasia con atipias (Figs 27 y 28)
- Muy celular
- Amoldamiento celular con superposición de los núcleos
- Anisocariosis
- Cromatina en grumos
- A veces nucléolos
- Células mioepiteliales
- Rara vez apocrinas y macrófagos
Hiperplasia con atipia. Otros criterios que pueden aplicarse
- Basado en criterios nucleares
- Anisocariosis
- Membrana nuclear irregular
- Cromatina en grumos
- Macronucléolos eosinófilos
- Disminución de las células mioepiteliales
Gangopadhyay M, Nijhawan R, Joshi K, Gupta S.:Cytology of "significant" breast ductal proliferations.Acta Cytol. 1997.41(4):1112-20.
EFQ-Hiperplasia. Frecuencia de aparición de estos criterios
- Grupos tridimensionales con células mioepiteliales, masas celulares en “remolino”y pequeñas hendiduras o luces irregulares y periféricas (65% de casos)
- Grupos irregulares de epitelio ductal con células mioepiteliales y proyecciones bulbosas encadenadas al epitelio ductal (29%)
- Diátesis con grupos de células ductales con bordes deshilachados (32%).
- Otros: moderado aumento de la celularidad, superposición nuclear, mínima atipia y pocas células aisladas
Dawson AE, Mulford DK, Sheils LA. :The cytopathology of proliferative breast disease. Comparison with features of ductal carcinoma in situ. Am J Clin Pathol. 1995.103(4):438-42.
Diagnóstico diferencial
A-CDIS no comedo
B-CDIS comedo
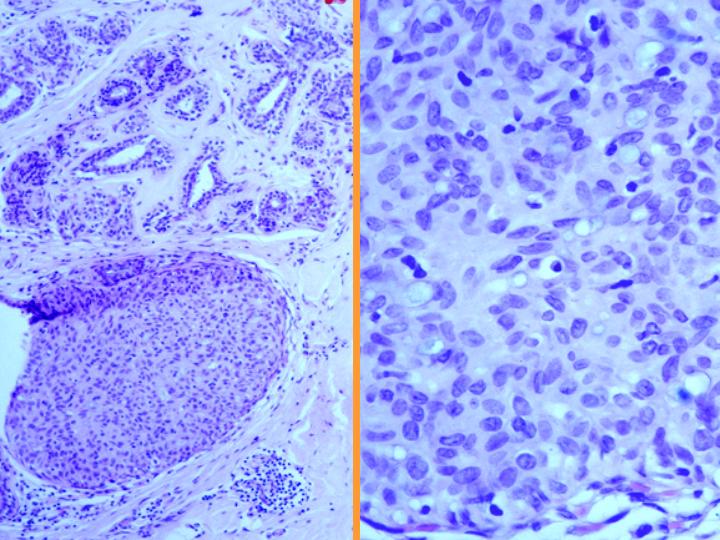
A-CDIS no comedo (Figs 29 y 30)
- Es la forma más similar a la hiperplasia atípica.
- Celularidad variable con células bastante monomorfas de tamaño pequeño o medio
- Se presentan en láminas o con patrón cribiforme o papilar.
- Ausencia de células mioepiteliales
B-CDIS comedo(Figs 31 y 32)
- Diátesis con necrosis
- Abundante celularidad
- Células atípicas pleomorfas
- Necrosis celular individual
- Ausencia de células mioepiteliales
- Ocasionales mitosis
Tabla de criterios para el diagnóstico diferencial
|
Criterios |
Hiperplasia |
CDIS |
|
Celularidad |
++ o +++ |
+ o ++ |
|
|
|
|
|
Atipia |
Mínima |
Moderada-marcada |
|
|
|
|
|
Nucleolo |
No o mínimo |
Presente |
|
|
|
|
|
Células aisladas |
No o pocas |
Moderado |
|
|
|
|
|
Hendiduras |
Sí |
Raras |
|
|
|
|
|
Luces rígidas |
Raras |
Sí |
|
|
|
|
|
Remolinos |
Sí |
Raros |
|
|
|
|
|
Células mioepiteliales |
En grupos |
Raras |
|
|
|
|
|
Diátesis |
Limpia |
Necrosis |
Dawson, 1995
Aplicación de Score en el diagnóstico diferencial
|
Disposición celular |
Monocapa |
Superposición nuclear |
Agupaciones |
Pérdida de cohesión |
|
Pleomorfismo |
Ausente |
Ligero |
Moderado |
Llamativo |
|
Cels. mioepiteliales |
Muchas |
Moderado |
Pocas |
Ausente |
|
Anisonucleosis |
Ausente |
Ligera |
Moderada |
Llamativa |
|
Nucleolo |
Ausente |
Micronucleolo |
Micro o macro |
Micronucleolo |
|
Grumos de cromatina |
Ausente |
Raros |
Ocasionales |
Frecuentes |
|
Score |
1 |
2 |
3 |
4 |
Score total: No proliferativa (6-10), proliferativa sin atipia (11-14), proliferativa con atipia (19-24)
Masood S et al: Prospective evaluation of radiologically detected fine needle aspiration biopsy of nonpalpable breast lesions. Cancer 1990; 66:1480-87,
Referencias
-
Kanhoush R, Jorda M, Gomez-Fernandez C, Wang H, Mirzabeigi M, Ghorab Z, Ganjei-Azar P.:'Atypical' and 'suspicious' diagnoses in breast aspiration cytology.Cancer. 2004.25;102(3):164-7.
-
Sneige N, Staerkel GA.:Fine-needle aspiration cytology of ductal hyperplasia with and without atypia and ductal carcinoma in situ. Hum Pathol. 1994.25(5):485-92.
-
Abendroth CS, Wang HH, Ducatman BS.: Comparative features of carcinoma in situ and atypical ductal hyperplasia of the breast on fine-needle aspiration biopsy specimens Am J Clin Pathol. 1991.96(5):654-9.
-
Masood S, Frykberg ER, McLellan GL, Dee S, Bullard JB. :Cytologic differentiation between proliferative and nonproliferative breast disease in mammographically guided fine-needle aspirates.
Diagn Cytopathol. 1991;7(6):581-90.
 fiogf49gjkf0dFig 22.Enfermedad fibroquística"> fiogf49gjkf0dFig 22.Enfermedad fibroquística">
EFQ - fiogf49gjkf0d Fig 22.Enfermedad fibroquística
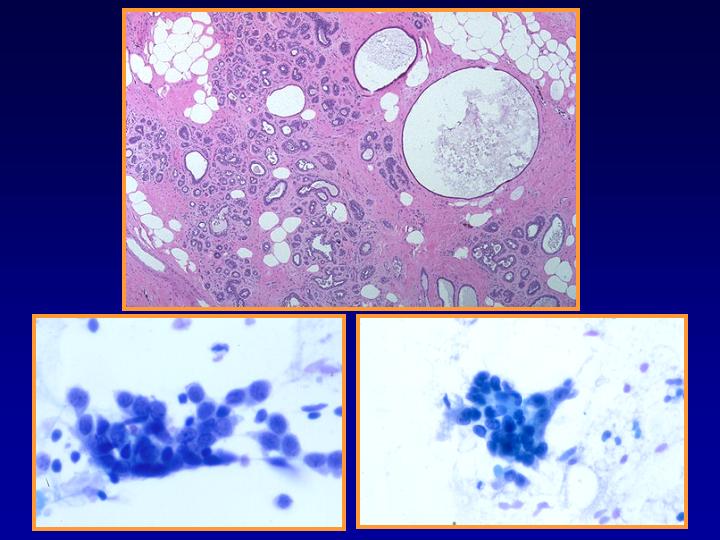 fiogf49gjkf0dFig 23.Enfermedad fibroquística"> fiogf49gjkf0dFig 23.Enfermedad fibroquística">
diapositiva43 - fiogf49gjkf0d Fig 23.Enfermedad fibroquística
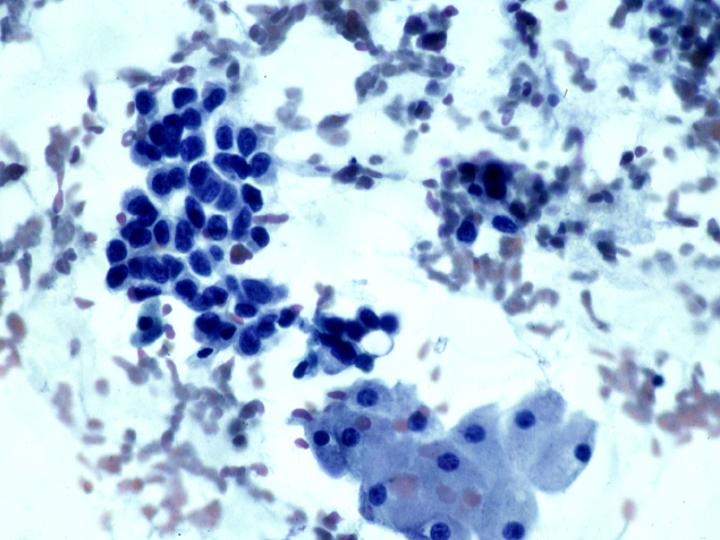 fiogf49gjkf0dFig 24.Hiperplasia sin atipias"> fiogf49gjkf0dFig 24.Hiperplasia sin atipias">
Hiperplasia - fiogf49gjkf0d Fig 24.Hiperplasia sin atipias
 fiogf49gjkf0dFig 25.Hiperplasia sin atipias"> fiogf49gjkf0dFig 25.Hiperplasia sin atipias">
diapositiva46 - fiogf49gjkf0d Fig 25.Hiperplasia sin atipias
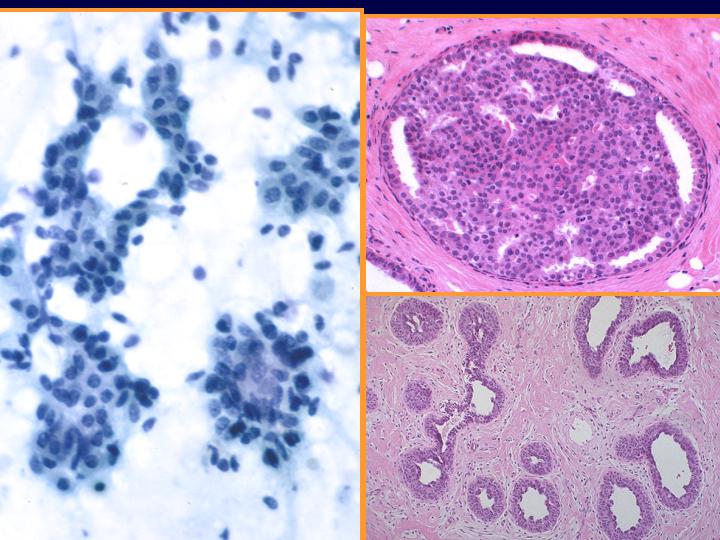 fiogf49gjkf0dFig 26.Hiperplasia ductal"> fiogf49gjkf0dFig 26.Hiperplasia ductal">
ductal - fiogf49gjkf0d Fig 26.Hiperplasia ductal
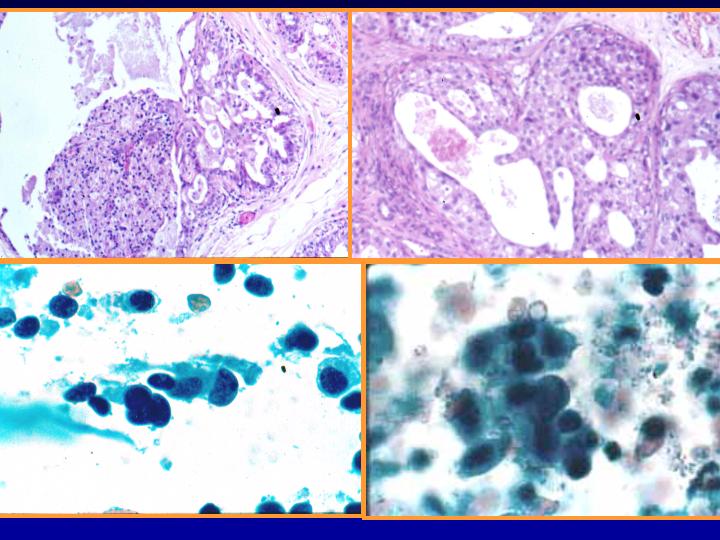 fiogf49gjkf0dFig 27.Hiperplasia con atipias"> fiogf49gjkf0dFig 27.Hiperplasia con atipias">
atipias - fiogf49gjkf0d Fig 27.Hiperplasia con atipias
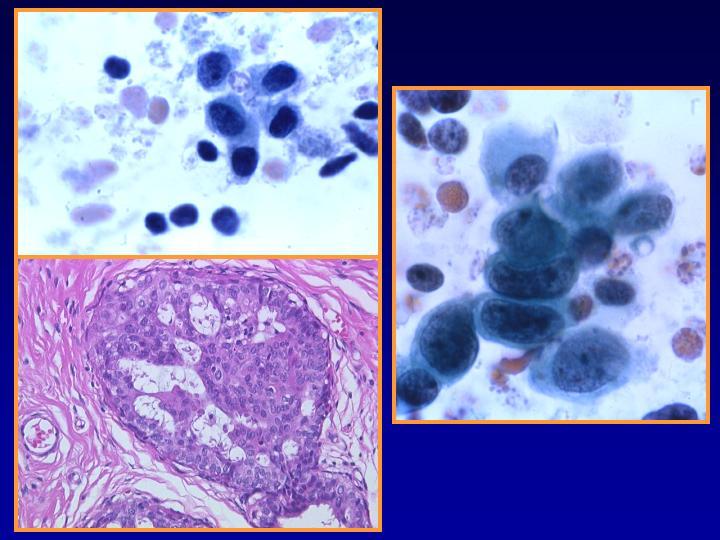 fiogf49gjkf0dFig 28.Hiperplasia con atipia"> fiogf49gjkf0dFig 28.Hiperplasia con atipia">
atipia - fiogf49gjkf0d Fig 28.Hiperplasia con atipia
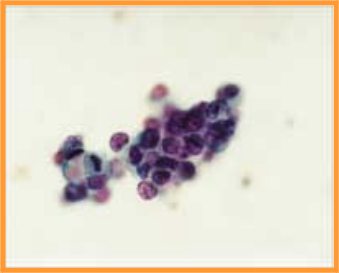 fiogf49gjkf0dFig 29.CDIS no comedo"> fiogf49gjkf0dFig 29.CDIS no comedo">
CDIS - fiogf49gjkf0d Fig 29.CDIS no comedo
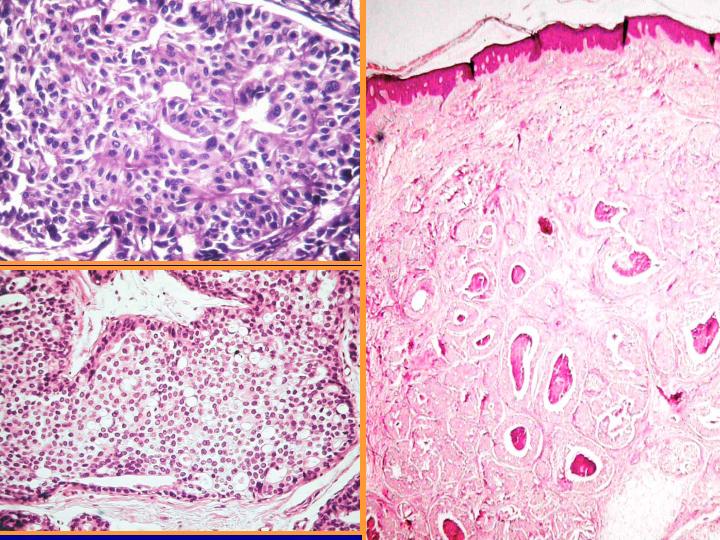 fiogf49gjkf0dFig 30.CDIS no comedo"> fiogf49gjkf0dFig 30.CDIS no comedo">
diapositiva55 - fiogf49gjkf0d Fig 30.CDIS no comedo
 fiogf49gjkf0dFig 31.CDIS comedo"> fiogf49gjkf0dFig 31.CDIS comedo">
comedo - fiogf49gjkf0d Fig 31.CDIS comedo
 fiogf49gjkf0dFig 32.CDIS comedo."> fiogf49gjkf0dFig 32.CDIS comedo.">
diapositiva57 - fiogf49gjkf0d Fig 32.CDIS comedo.
|
|
|
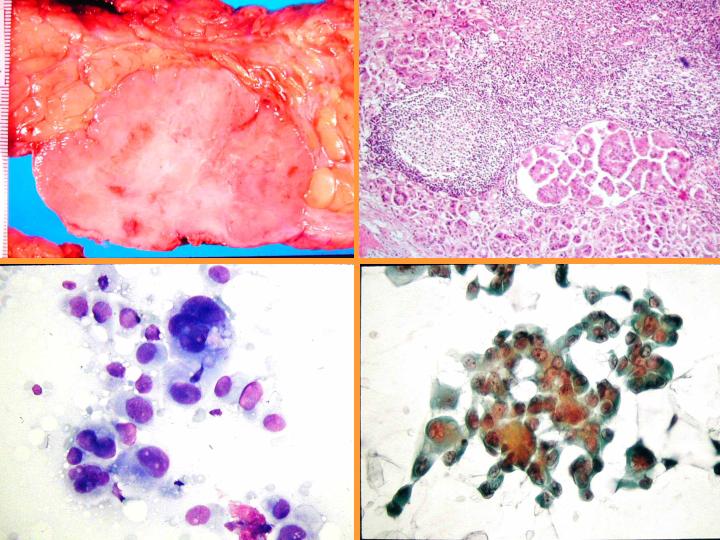
D- Carcinoma apocrino de bajo grado
fiogf49gjkf0d Metaplasia apocrina. Se da con frecuencia en:(Figs 33,34 y 35)
- EFQ
- Adenosis apocrina
- Adenosis esclerosante
- Cicatrices radiales
- Papiloma
- Adenoma ductal
• No sobrevalorar la atipia cuando el aspirado se obtiene de una lesión no palpable
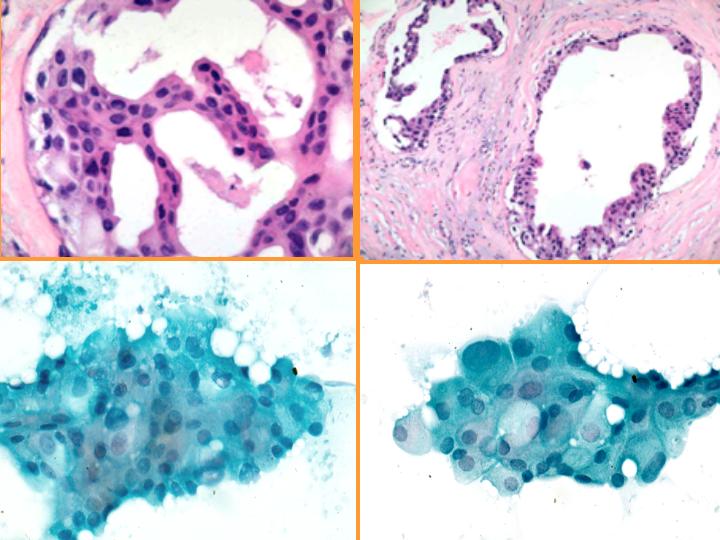
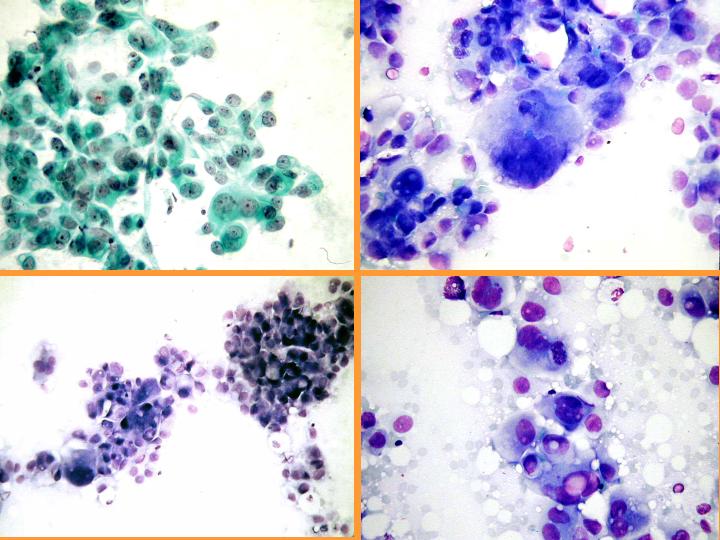
Carcinoma apocrino: características citológicas: (Figs 36 y 37)
- Células apocrinas atípicas con abundante citoplasma granular
- Núcleo grande e irregular
- Marcada anisocariosis
- Gran nucléolo - múltiple
- Diátesis inflamatoria
Ca apocrino. Diagnóstico diferencial
- EFQ con hiperplasia de células apocrinas (población polimorfa)
- Carcinoma secretor rico en lípidos (núcleos más uniformes y nucléolos menos visibles)
- Carcinoma ductal
Referencias
- O'Malley FP, Bane AL. The spectrum of apocrine lesions of the breast. Adv Anat Pathol. 2004;11(1):1-9.
Durham JR, Fechner RE. The histologic spectrum of apocrine lesions of the breast. Am J Clin Pathol. 2000;113(5 Suppl 1):S3-18.
- Seidman JD, Ashton M, Lefkowitz M.:Atypical apocrine adenosis of the breast: a clinicopathologic study of 37 patients with 8.7-year follow-up. Cancer. 1996;77(12):2529-37.
- O'Malley FP, Page DL, Nelson EH, Dupont WD.:Ductal carcinoma in situ of the breast with apocrine cytology: definition of a borderline category. Hum Pathol. 1994 Feb;25(2):164-8.
- Johnson TL, Kini SR.; The significance of atypical apocrine cells in fine-needle aspirates of the breast. Diagn Cytopathol. 1989;5(3):248-54.
- Yoshida K, Inoue M, Furuta S, Sakai R, Imai R, Hayakawa S, Fukatsu T, Nagasaka T, Nakashima N.:Apocrine carcinoma vs. apocrine metaplasia with atypia of the breast. Use of aspiration biopsy cytology. Acta Cytol;40(2):247-51.
- Ng WK, Kong JH, Wong WW.: Atypical apocrine metaplasia: a diagnostic pitfall in fine needle aspiration cytology of the breast. Acta Cytol. 2003 Jul-Aug;47(4):698-701.
- Gupta D, Wolf JA, Rubenchik IA, Middleton LP.:Diagnostic pitfalls in fine needle aspiration cytology of atypical apocrine metaplasia in a breast lesion. A case report. Acta Cytol. 2002;46(4):749-52.
 fiogf49gjkf0dFig 33.Metaplasia apocrina."> fiogf49gjkf0dFig 33.Metaplasia apocrina.">
Metaplasia - fiogf49gjkf0d Fig 33.Metaplasia apocrina.
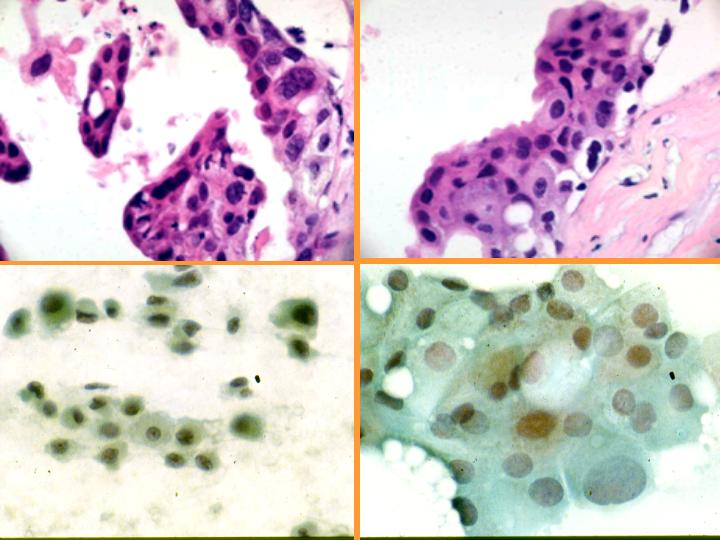 fiogf49gjkf0dFig 34.Metaplasia apocrina."> fiogf49gjkf0dFig 34.Metaplasia apocrina.">
diapositiva63 - fiogf49gjkf0d Fig 34.Metaplasia apocrina.
 fiogf49gjkf0dFig 35.Metaplasia apocrina."> fiogf49gjkf0dFig 35.Metaplasia apocrina.">
diapositiva64 - fiogf49gjkf0d Fig 35.Metaplasia apocrina.
 fiogf49gjkf0dFig 36.Carcinoma apocrino."> fiogf49gjkf0dFig 36.Carcinoma apocrino.">
diapositiva66 - fiogf49gjkf0d Fig 36.Carcinoma apocrino.
 fiogf49gjkf0dFig 37.Carcinoma apocrino."> fiogf49gjkf0dFig 37.Carcinoma apocrino.">
diapositiva67 - fiogf49gjkf0d Fig 37.Carcinoma apocrino.
|
|
|
Conclusiones
fiogf49gjkf0d
-
La zona “gris” abarca muchas lesiones de la citología de la mama.
-
La citología no refleja la arquitectura y es una limitación de la PAAF
-
El tipo de lesión histológica subyacente es muy variado
-
Gran complejidad en la valoración de las lesiones
-
Importante grado de subjetividad
-
Es precisa una nomenclatura uniforme
-
El fibroadenoma con atipia es una de las más frecuentes fuentes de error y debe ser valorada con precaución
-
El diagnóstico de neoplasia papilar debe ser interpretado como sospecha de malignidad
-
Marcadas dificultades en la categorización de las hiperplasias ductales
-
La diferenciación entre hiperplasia atípica-CDIS es imposible en la práctica
-
Valorar la metaplasia apocrina dentro del contexto global
La pregunta clave es: ¿cómo
informar la citología?
Descriptivo y de sospecha
SE RECOMIENDA SIEMPRE EL ESTUDIO HISTOLÓGICO
Ozkara SK, Ustun MO, Paksoy N.:The gray zone in breast fine needle aspiration cytology. How to report on it?Acta Cytol. 2002;46(3):513-8.
|
|
|
Bibliografía
· Al-Kaisi N: The spectrum of the “gray zone” in breast cytology. A review of 186 cases of atypical and suspicious cytology. The spectrum of the “gray”. Acta Cytol 1994, 38:898-908
· Stanley MW, Tani EM, Skoog L.: Fine-needle aspiration of fibroadenomas of the breast with atypia: a spectrum including cases that cytologically mimic carcinoma. Diagn Cytopathol. 1990;6(6):375-82.
· Ozkara SK, Ustun MO, Paksoy N.: The gray zone in breast fine needle aspiration cytology. How to report on it? Acta Cytol. 2002 May-Jun;46(3):513-8.
· Jeffrey PB, Ljung BM.:Benign and malignant papillary lesions of the breast. A cytomorphologic study. Am J Clin Pathol. 1994.101(4):500-7.
· Simsir A, Waisman J, Thorner K, Cangiarella J.M: Mammary lesions diagnosed as "papillary" by aspiration biopsy: 70 cases with follow-up. Cancer. 2003; 25;99(3):156-65.
· Dawson AE, Mulford DK.: Benign versus malignant papillary neoplasms of the breast. Diagnostic clues in fine needle aspiration cytology. Acta Cytol. 1994;38(1):23-8
· Michael CW, Buschmann B.: Can true papillary neoplasms of breast and their mimickers be accurately classified by cytology? Cancer. 2002.25;96(2):92-100.
· Kanhoush R, Jorda M, Gomez-Fernandez C, Wang H, Mirzabeigi M, Ghorab Z, Ganjei-Azar P.:'Atypical' and 'suspicious' diagnoses in breast aspiration cytology.Cancer. 2004.25;102(3):164-7.
· Sneige N, Staerkel GA.:Fine-needle aspiration cytology of ductal hyperplasia with and without atypia and ductal carcinoma in situ. Hum Pathol. 1994.25(5):485-92.
· Abendroth CS, Wang HH, Ducatman BS.: Comparative features of carcinoma in situ and atypical ductal hyperplasia of the breast on fine-needle aspiration biopsy specimens Am J Clin Pathol. 1991.96(5):654-9.
· Masood S, Frykberg ER, McLellan GL, Dee S, Bullard JB.: Cytologic differentiation between proliferative and nonproliferative breast disease in mammographically guided fine-needle aspirates.
Diagn Cytopathol. 1991;7(6):581-90.
· O'Malley FP, Bane AL. The spectrum of apocrine lesions of the breast. Adv Anat Pathol. 2004;11(1):1-9.
· Durham JR, Fechner RE. The histologic spectrum of apocrine lesions of the breast. Am J Clin Pathol. 2000;113(5 Suppl 1):S3-18.
· Seidman JD, Ashton M, Lefkowitz M.:Atypical apocrine adenosis of the breast: a clinicopathologic study of 37 patients with 8.7-year follow-up. Cancer. 1996;77(12):2529-37.
· O'Malley FP, Page DL, Nelson EH, Dupont WD.:Ductal carcinoma in situ of the breast with apocrine cytology: definition of a borderline category. Hum Pathol. 1994 Feb;25(2):164-8.
· Johnson TL, Kini SR.; The significance of atypical apocrine cells in fine-needle aspirates of the breast. Diagn Cytopathol. 1989;5(3):248-54.
· Yoshida K, Inoue M, Furuta S, Sakai R, Imai R, Hayakawa S, Fukatsu T, Nagasaka T, Nakashima N.: Apocrine carcinoma vs. apocrine metaplasia with atypia of the breast. Use of aspiration biopsy cytology. Acta Cytol;40(2):247-51.
· Ng WK, Kong JH, Wong WW.: Atypical apocrine metaplasia: a diagnostic pitfall in fine needle aspiration cytology of the breast. Acta Cytol. 2003;47(4):698-701.
· Gupta D, Wolf JA, Rubenchick IA, Middleton LP.: Diagnostic pitfalls in fine needle aspiration cytology of atypical apocrine metaplasia in a breast lesion. A case report. Acta Cytol. 2002: 46(4): 749-52
|
|
|
Comentarios
- Alina del Carmen Campos Viera (02/10/2005 21:35:26)
Felicito a la Dra: Mercedes Santamaría y sus colaboladores por este interesante trabajo y recopilación de datos que nos ayudan a tener una mejor clasificación de las lesiones en mamas y su mejor seguimiento.
- NATALIA MARTINEZ CASTILLO (03/10/2005 19:10:16)
Mis felicitaciones a los autores por el encare y la calidad de las imágenes. La dificultad mayor en mi experiencia siguen siendo las hiperplasias florida y atípica.
- María Caridad De Armas Fernández (04/10/2005 20:44:01)
Muy interesante el trabajo. Los casos comprendidos en la zona gris se nos presentan a diario.
Felicito a los autores. Las imagenes estan muy representativas .Las hiperplasias atipicas para mi siguen siendo de dificil diagnostico.
- Ernesto García Ureta (05/10/2005 12:40:19)
Muy importante revision del tema, magnificamente expuesto y acompañado de una excelente
iconografia.
Enhorabuena Mercedes Pedro y Asuncion
- Emilio Mayayo Artal (07/10/2005 19:18:19)
Felicidades autores. Excelente iconografía y mejores puntualizaciones sobre un tema que tenemos cada día en nuestros microscopios. Gracias por tanta información y tan bien expuesta. Emilio
- felipe junchaya (08/10/2005 14:44:36)
Felicitaciones a los autores. La didactica simple y objetiva resaltan la importancia de este congreso virtual. Se aprende mucho. Felipe.
- Francisco Javier Flores Figueroa (10/10/2005 23:44:53)
Muchas felicidades, las imagenes son bellisimas y la correlacion cito-histo excelente
- Juan Pablo Garcia de la Torre (11/10/2005 8:30:19)
Una buena revisión del tema y en mi opinión es siempre mejor un sospechoso de más que no un falso positivo de más ya que me he encontrado algunos cirujanos que se atreven a una tumorectomía/mastectomía tan sólo con un estudio citológico positivo, por lo que ante la más mínima duda es mejor un sospechoso de malignidad y recomendar confirmación histológica. Un saludo.
- SANDRA HERRERA LOMONACO (11/10/2005 15:33:37)
BUENA PRESENTACION, LA ZONA GRIS ES LO MAS DIFICIL EN PATOLOGIA. GRACIAS POR ESTE MAGNIFICO TEMA.
- MANUEL REMEZAL (15/10/2005 16:05:30)
Felicitaciones a los autores. Una excelente revisión en la que me atrevo a subrayar un aspecto que destacan en sus conclusiones y que me parece fundamental para valorar la PAAF de mama en su justa medida: "Importante grado de subjetividad". Por otra parte, recordar nuestra mayor queja siempre: "La ausencia de datos clínicos es nuestra mayor fuente de errores"
- Cesáreo Corbacho Cuevas (17/10/2005 18:23:00)
Una excelente revisión de un tema fundamental. Muchas gracias y un saludo muy cordial a los autores.
- JORGE QUIJANO RIVERA (20/10/2005 1:34:34)
En la zona gris surge la interrogante ¿cuál debe ser el nombre correcto? BAAF ó PAAF. Me inclino por PAAF. Biopsia implica que se conserva la arquitectura, la punción con aguja fina es un estudio citológico en donde es común la distorción ó pérdida de la arquitectura con disminución de la sensibilidad; hay clínicos que consideran que la mal llamada BAAF da un diagnóstico definitivo, soslayan la sensibilidad que es diferente, con riesgo de falsos negativos y lo que es peor falsos positivos. No hay que olvidar que la información de la clínica y la mastografía siempre nos deben ser proporcionadas.
Felicidades.
- MARÍA ANTONIETA GÓMEZ LAGUNAS (21/10/2005 20:05:22)
Es un tema muy importante tratar estas lesiones en mama, y considero que la clave cuando uno diagnostica estas lesiones es pedir la muestra para estudio histopatológico, ya que es muy frecuente que el estudio de las lesiones porpunción aspiración sean consideradas como definitvas y llevan a las pacientes a mastectomías no necesarias. Es bueno, entonces, tener comunicación muy cercana con los cirujanos.
Gracias por tratar el tema, y Saludos desde Toluca, México.
- Eliécer Anoceto Armiña (25/10/2005 17:11:23)
Mis felicitaciones a los autores que nos han presentado este tema tan interesante. Las imagenes son preciosas
- Domingo de Agustín Vázquez (25/10/2005 23:36:18)
Magnífica exposición de los problemas que podemos encontrar en la interpretación de la citopatología mamaria. Extenso a la vez que conciso y claro. Muchas gracias por el trabajo. Creo que lo tendré en la "cabecera" del microscopio.
- RAFAEL ESCALONA (27/10/2005 13:11:22)
Fantastico trabajo acerca de un aspecto tan complejo como la zona gris en la citologia mamaria.Revision minuciosa e iconografia excelente;como para tenerlo al alcance de la mano en caso de dudas.Felicitaciones!!!
- Omaira Valencia (28/10/2005 3:01:35)
Muchas gracias por la revisión de un tema de alta demanda y de difícil interpretacion. Especialmente ayuda, compartir la complejidad que reviste el dar diagnósticos conclusivos. Y excelente la respuesa a la pregunta clave de como informar la citologia
Omaira Valencia Valencia
- Julia Cecilia Cruz Mojarrieta (28/10/2005 20:20:26)
Mis felicitaciones magnífico trabajo, muy buenas fotografias, gracias por demostrar lo que nos encontramos a diario y que nos hace pensar en lo cotidiano esta lo difícil de nuestro trabajo.
- Victor Leonel Argueta Sandoval (01/11/2005 4:36:12)
Estoy de acuerdo con el enfoque de la revisión, porque se debe tener seguridad cuando se va a realizar un diagnóstico, pero creo que la PAAF o BAAF tiene sus desciripciones específicas, donde inclusive se habla de formas arquitecturales. Por su puesto que cuando estamos en la zona gris no se puede ser específico. Concluyo que la citología no cérvico-vaginal, que es la base de este diagnóstico, es tal vez muy relegada en la patología y que se tiene que estudiar mas.
- Caridad Socorro Castro (01/11/2005 17:12:20)
En nuestro medio la Dra Ileana Franco, inscrita en este congreso tiene un
trabajo de correlación histo-citológica de la zona gris, ella le podrá
comentar sobre sus hallazgos, Su trabajo lo he encontrado muy interesante
y amplio para el diagnóstico de las lesiones mamarias, principalmente
aquellas que pueden generar conflictos diagnósticos
- LILIA MARGARITA BERNAL MONDRAGÓN (03/11/2005 23:46:55)
Excelente revisión del tema, bellamente ejemplificado. Gracias por compartir tan complto material
- Maria Laura Haramboure (09/11/2005 19:12:05)
Un hermoso trabajo para tener al lado del microscopio. Resumido, didáctico y con excelentes fotos. Gracias por su colaboración para esas dudas de todos los días-
|
|
|
|
|


 fiogf49gjkf0dFig 1-Artefacto que impide la correcta valoración citológica">
fiogf49gjkf0dFig 1-Artefacto que impide la correcta valoración citológica">
 fiogf49gjkf0dFig 2-Fibroadenoma">
fiogf49gjkf0dFig 2-Fibroadenoma">
 fiogf49gjkf0dFig 3.Fibroadenoma. Imagen microscópica">
fiogf49gjkf0dFig 3.Fibroadenoma. Imagen microscópica">
 fiogf49gjkf0dFig 10.Neoplasia papilar">
fiogf49gjkf0dFig 10.Neoplasia papilar">
 fiogf49gjkf0dFig 14.Papiloma">
fiogf49gjkf0dFig 14.Papiloma">
 fiogf49gjkf0dFig 29.CDIS no comedo">
fiogf49gjkf0dFig 29.CDIS no comedo">
 fiogf49gjkf0dFig 31.CDIS comedo">
fiogf49gjkf0dFig 31.CDIS comedo">
 fiogf49gjkf0dFig 33.Metaplasia apocrina.">
fiogf49gjkf0dFig 33.Metaplasia apocrina.">