Direccion de contacto
fiogf49gjkf0d Prof. Dr. Lacy Cardoso de Brito Junior,
Universidade Federal do Pará,
Centro de Ciências Biológicas,
Departamento de Patologia,
Laboratório de Patologia Geral - Imunopatologia e Citologia,
Av. Augusto Corrêa n 01.
Bairro Guamá - CEP 66075-900 /
Belém - Pará
Fone (0XX91) 32301668 (resid~encia) e 31831102 (CCB)
|
|
AVALIAÇÃO MORFOLÓGICA DA CICATRIZAÇÃO DE LESÕES ÚLCERATIVAS ASSÉPTICAS TRATADAS COM SOLUÇÕES DE PAPAÍNA.
RITA PATRÍCIA DE AVELAR ROCHA*, WAGNER SARMENTO GURJÃO*, LACY CARDOSO BRITO JUNIOR*
* Laboratório de Patologia Geral - Imunopatologia e Citologia. Departamento de Patologia. Centro de Ciências Biológicas. Universidade Federal do Pará. BRASIL
|
|
|
Resumen
fiogf49gjkf0d OBJETIVOS: A papaína, uma enzima de origem vegetal, vem sendo bastante utilizada por profissionais de saúde como alternativa para o tratamento de feridas, principalmente por seus efeitos antiinflamatórios e cicatrizantes. Assim, nosso objetivo foi estudar, os aspectos morfológicos da cicatrização de lesões ulcerativas assépticas tratadas com soluções de papaína.
MÉTODOS E RESULTADOS: Foram utilizados ratos Wistar (n=18), machos, adultos, que passarem por procedimento cirúrgico para a retirada de uma seção quadrada de pele da região cervical dos mesmos, e posterior divisão destes em dois grupos: Grupo I - Controle (n=9), sem tratamento; e Grupo II – Tratados (n=9) com soluções de papaína de 10% (até o 7º dia), 6% (do 8º ao 14º dia) e 4% (do 15º ao 21º dia). A análise morfológica foi realizada após a retirada das áreas lesadas com 7, 14 e 21 dias, para posterior processamento histológico e coloração com Hematoxilina-eosina (H&E) e tricrômico de Masson. Como resultados verificamos que a papaína auxiliou na modulação do processo inflamatório; formação e amadurecimento do tecido de granulação, e organização das fibras colágeno; e acelerando a proliferação e organização da epiderme nas lesões ulcerativas em todos os dias estudados, em comparação com o grupo controle não tratado.
CONCLUSÕES: Nossos dados reforçam e complementam pesquisas que relacionam os efeitos cicatrizantes benéficos da ação da papaína sobre lesões ulcerativas principalmente por facilitar a organização do tecido de granulação, e possivelmente por modular a resposta inflamatória. No entanto, o mecanismo exato desta ação da papaína sobre tecidos não infectados ainda depende de mais estudos.
|
|
|
Introduccion
fiogf49gjkf0d Os processos de cicatrização tecidual, essenciais para a sobrevivência dos seres vivos, de um modo geral, são fenômenos que podem ser divididos didaticamente em quatro fases: (1) uma fase de Coagulação, de início imediato logo após o trauma, caracterizada pela formação de um tampão hemostático primário (crosta hemato-fibrinosa), formado por plaquetas, ativação dos fatores da coagulação e liberação de mediadores químicos solúveis, responsáveis pelo desencadeamento dos estágios subseqüentes; (2) uma fase inflamatória, responsável por alterações vasculares e influxo de células inflamatórias (polimorfonucleares, macrófago e linfócito) para o sítio da lesão; (3) uma fase de proliferação, caracterizada pela proliferação de células endoteliais de pequenos vasos sanguíneos (angiogênese), fibroblastos e produção de matriz colágeno, responsáveis pela formação do tecido de granulação, e início da proliferação de células epiteliais das camadas basais; e (4) uma fase reparadora, responsável pela remodelagem tecidual, com a substituição do tecido de granulação por tecido conjuntivo denso, e a recomposição celular da epiderme (GONÇALVES & PARIZOTTO, 1998; PEREIRA, 2002; STEVENS, 2000; ROBINS et al; 2005).
Os processos de cicatrização, porém, só se tornam completos depois que tenha sido devidamente controlada a resposta inflamatória, e removidos os detritos necróticos de maneira suficiente para permitir o crescimento do tecido de granulação. Assim, a utilização da papaína é indicada em todas as fases do processo de cicatrização de feridas sempre que o organismo não consegue eliminar estes interferentes teciduais (GONÇALVES & PARIZOTTO, 1998; PEREIRA, 2002; MANDELBAUM et al, 2003; MONETA, 1998; ROGENSKI et al., 1998; SANCHEZ NETO et al., 1993; ROGENSKI et al., 1995; JORGE & DANTAS, 2003).
A papaína, uma enzima proteolítica de origem vegetal, que tem a sua molécula constituída por 17 aminoácidos diferentes, com massa molecular relativa de 20900U, e apresentação comercialmente sob a forma liofilizada, tem como principais fatores adversos a sua inativa ao contato com agentes oxidantes, ferro, e a longos períodos de exposição ao ar; e como efeitos benéficos de sua utilização as suas ações debridante, antiinflamatória, bactericida e bacteriostática, e aceleradora e modeladora do tecido de granulação e dos processos de cicatrização tecidual, reduzindo a formação de quelóides. Além de poucos efeitos colaterais, a papaína tem a sua utilização associada aos baixos custos operacionais (CANDIDO, 2001; FONSECA et al., 2004; MANDELBAUM et al., 2003; MONETTA,1990; MONETA, 1998; SANCHEZ NETO et al., 1993; WISEMAN, 1990; STORER & MÉNARD, 1994; MONETA 1992; JORGE & DANTAS, 2003).
A utilização da papaína, porém, depende antes de tudo da determinação da concentração de uso desta enzima que deverá ser empregada em cada caso, visto que a determinação destas concentrações depende das características da lesão. Assim, feridas secas ou com tecido de granulação as concentrações de papaína podem variar entre 2 e 4%; quando da presença de exsudato purulento e/ou infecções, as concentrações de papaína podem variar entre 4 a 6%; e quando houver a presença de tecido necrótico abundante recomenda-se a utilização de papaína na concentração de 10% (MANDELBAUM et al, 2003; UDOD e STOROJUK, 1981; MONETTA,1990; MONETA, 1998; ROGENSKI et al., 1998; SANCHEZ NETO et al., 1993; WISEMAN, 1990; STORER & MÉNARD, 1994; MONETA 1992; ROGENSKI et al., 1995; NAGAPETYAN et al., 1986; MASINI e CALAMO, 1986; JORGE & DANTAS, 2003).
Desta forma, o presente estudo teve como objetivo analisar de forma experimental os aspectos morfológicos da cicatrização de lesões ulcerativas assépticas tratadas com soluções de papaína em concentrações variadas conforme as características das lesões.
|
|
|
Material y Métodos
fiogf49gjkf0d Animais de experimentação.
Foram utilizados 18 ratos (Wistar), machos, adultos, oriundos do Biotério do Centro de Ciências Biológica da UFPA, com peso entre 200 a 250g; distribuídos ao acaso em gaiolas individuais com livre acesso à água e dieta padrão, conforme a descrição dos seguintes grupos experimentais. Grupo I (Controle), formado por animais que passaram por procedimento cirúrgico e não receberam nenhum tipo de tratamento (n= 9). Grupo II (Tratado), formado por animais que passaram por procedimento cirúrgico, e foram tratados com papaína (n=9).
Procedimento Cirúrgico.
Todos os animais foram anestesiados com quetamine Kg/peso (i.p.), imobilizados em decúbito ventral, realizada a tricotomia da região dorsal (1,5 cm abaixo do pavilhão auricular na região cervical), anti-sepsia da mesma com álcool a 70%, e posterior procedimento cirúrgico com bisturi, para a retirada de uma seção quadrada de pele de aproximadamente 1,5 cm X 1,5 cm, do dorso dos animais, no sentido crânio-caudal, com exposição da fáscia muscular. Cessados os efeitos da anestesia os animais foram colocados em gaiolas individuais, com alimentação e água ad libidum.
Preparação da solução de Papaína.
Foi utilizado papaína liofilizada 6.000UI/MG, proveniente da Índia (Lote de fabricação EXC280212), Certificada pela Empresa ELY MARTINS de Ribeirão Preito-SP; diluída em tubos do tipo Falcon estéreis contendo 50 ml de água destilada deionizada para obtenção de soluções nas concentrações de 4% (2g/50ml), 6% (3g/50ml) e 10% (5g/50ml).
Tratamento das Lesões.
Todos os animais do Grupo II foram tratados, uma vez ao dia, com solução de papaína a 10% nos primeiros 07 dias de tratamento; com solução de papaína a 6% do 8ª dia ao 14º dia; e com solução de papaína a 4% do 15º até o 21º dia. Com todo o tratamento tendo sido realizado sem a necessidade cobertura de gazes ou qualquer outro produto sobre as feridas; e com a determinação da solução de papaína a ser administrada definida de acordo com os critérios utilizados para avaliar a evolução das lesões, no decorrer do tratamento, como à observação da presença ou não de tecido necrosado, crosta hemato-fibrinosa, processo inflamatório, tecido de granulação, aproximação das bordas da lesão, e do tempo de cicatrização total da lesão.
Sacrifícios dos animais.
Todos os animais foram sacrificados, através anestesia com quetamine Kg/peso (i.p.) e posterior deslocamento cervical, com 07, 14, e 21 dias pós-tratamento (GRUPO II), ou pós-cirúrgico (GRUPO I), para posterior avaliação do processo de cicatrização tecidual de acordo com o tratamento adotado.
Estudo histológico.
Todas as áreas das lesões foram retiradas, realizada a fixação do material em formol tamponado a 10% por 6 horas, seguida de desidratação em álcool a 70%, e posterior processamento histológico do material com coloração com Hematoxilina-eosina (H&E) e tricrômico de Masson. Para posterior avaliação histológica em microscopia de luz comum.
|
|
|
Resultados
fiogf49gjkf0d
Neste estudo foi observado, macroscopicamente, que as lesões teciduais experimentais assépticas, induzidas por procedimento cirúrgico, nos grupos controle e tratados com papaína obedeceram à mesma seqüência de eventos dependentes do tempo. Microscopicamente, entretanto, nas lesões dos animais do grupo tratado com papaína a 10% por 07 dias verificou-se ausência de crosta hemato-fibrinosa; presença de exsudato inflamatório mononuclear difuso, e tecido de granulação frouxo de quantidade moderada, com fibroblastos e fibras colágeno de distribuição desorganizada, e grande quantidade de vasos neoformados (Figuras 1C e D). Em quanto que, nas lesões dos animais do grupo controle, não tratados, para o mesmo período, observou-se à presença de crosta hemato-fibrinosa, exsudato inflamatório mononuclear difuso, tecido de granulação frouxo composto por moderada quantidade de vasos neoformados, e disposição desorganizada de fibroblastos e fibras colágeno (dados não mostrados).
Nas lesões tratadas com papaína a 6% no 14º dia observou-se a presença de tecido de granulação exuberante, composto por vasos neoformados de quantidade moderada, maior quantidade fibroblastos, e matriz colágeno organizada (Figura 1E); menor infiltrado inflamatório mononuclear (difuso), e proliferação de células da camada germinativa da epiderme, próximo as bordas da lesão, porém, ainda sensível a forças de tração (Figura 1F). Em quanto que, nas lesões dos animais do grupo controle, não tratados, para o mesmo período, observou-se à manutenção da crosta hemato-fibrinosa, com manutenção do exsudato inflamatório mononuclear, em comparação com o grupo tratado, porém, com tecido de granulação frouxo composto por pequena quantidade de vasos neoformados, sensíveis a forças de tração, e disposição desorganizada de fibroblastos e fibras colágeno (Figura 1A).
Com 21 dias de experimento, entretanto, observou-se que nas lesões tanto dos animais tratados com papaína a 4% como dos não tratados (Figura 1A) ocorreu à substituição do tecido de granulação por tecido conjuntivo denso composto por poucos fibroblastos e redução dos vasos neoformados (Figura 1G), além de epiderme totalmente reconstituída, com a presença em ordem decrescente das camadas lúcida, granulosa, espinhosa e germinativa (basal) madura (Figura 1H). Chama atenção, porém, o fato de que nos animais tratados com papaína a 4% a matriz colágeno apresentou-se mais organizada que nos animais não tratados.
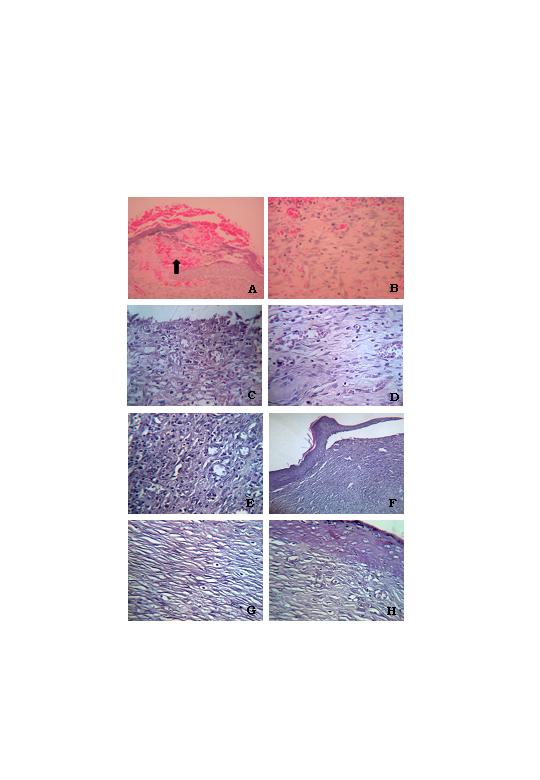 fiogf49gjkf0dFotomicrografias da evolução do processo de cicatrização tecidual de úlceras experimentais assépticas, em dorso de ratos wistar, não tratadas (Grupo I) com 14 dias (1A) e 21 dias (1B), e tratadas (Grupo II) com soluções de papaína a 10% com 7 dias (1C e D); a 6% com 14 dias (1E e F); e a 4% com 21 dias (1G e H). 1A e B. Grupo I: 14 dias, ausência de crosta hemato-fibrinosa, sensível a forças de tração, presença de fibrina e hemácias (seta), e exsudato inflamatório mononuclear (40X); e 21 dias, tecido conjuntivo denso com fibroblastos e fibras colágeno de disposição desorganizada (40X), respectivamente. 1C e D. Grupo II, 7 dias, ausência de crosta hemato-fibrinosa, com exsudato inflamatório difuso (10X); e tecido de granulação com moderada quantidade de vasos neoformados, fibroblastos, fibras colágeno, bem organizados (40X), respectivamente. 1E e F. Grupo II, 14 dias, tecido de granulação exuberante, matriz colágeno organizada e redução do infiltrado inflamatório (40X); e proliferação de células da epiderme próximo as bordas da lesão, porém, ainda sensível a forças de tração (40X), respectivamente. 1G e H. Grupo II, 21 dias, tecido conjuntivo denso com matriz colágeno organizada (40X), e epiderme totalmente reconstituída (20X), respectivamente."> fiogf49gjkf0dFotomicrografias da evolução do processo de cicatrização tecidual de úlceras experimentais assépticas, em dorso de ratos wistar, não tratadas (Grupo I) com 14 dias (1A) e 21 dias (1B), e tratadas (Grupo II) com soluções de papaína a 10% com 7 dias (1C e D); a 6% com 14 dias (1E e F); e a 4% com 21 dias (1G e H). 1A e B. Grupo I: 14 dias, ausência de crosta hemato-fibrinosa, sensível a forças de tração, presença de fibrina e hemácias (seta), e exsudato inflamatório mononuclear (40X); e 21 dias, tecido conjuntivo denso com fibroblastos e fibras colágeno de disposição desorganizada (40X), respectivamente. 1C e D. Grupo II, 7 dias, ausência de crosta hemato-fibrinosa, com exsudato inflamatório difuso (10X); e tecido de granulação com moderada quantidade de vasos neoformados, fibroblastos, fibras colágeno, bem organizados (40X), respectivamente. 1E e F. Grupo II, 14 dias, tecido de granulação exuberante, matriz colágeno organizada e redução do infiltrado inflamatório (40X); e proliferação de células da epiderme próximo as bordas da lesão, porém, ainda sensível a forças de tração (40X), respectivamente. 1G e H. Grupo II, 21 dias, tecido conjuntivo denso com matriz colágeno organizada (40X), e epiderme totalmente reconstituída (20X), respectivamente.">
Figura 1 - fiogf49gjkf0d Fotomicrografias da evolução do processo de cicatrização tecidual de úlceras experimentais assépticas, em dorso de ratos wistar, não tratadas (Grupo I) com 14 dias (1A) e 21 dias (1B), e tratadas (Grupo II) com soluções de papaína a 10% com 7 dias (1C e D); a 6% com 14 dias (1E e F); e a 4% com 21 dias (1G e H). 1A e B. Grupo I: 14 dias, ausência de crosta hemato-fibrinosa, sensível a forças de tração, presença de fibrina e hemácias (seta), e exsudato inflamatório mononuclear (40X); e 21 dias, tecido conjuntivo denso com fibroblastos e fibras colágeno de disposição desorganizada (40X), respectivamente. 1C e D. Grupo II, 7 dias, ausência de crosta hemato-fibrinosa, com exsudato inflamatório difuso (10X); e tecido de granulação com moderada quantidade de vasos neoformados, fibroblastos, fibras colágeno, bem organizados (40X), respectivamente. 1E e F. Grupo II, 14 dias, tecido de granulação exuberante, matriz colágeno organizada e redução do infiltrado inflamatório (40X); e proliferação de células da epiderme próximo as bordas da lesão, porém, ainda sensível a forças de tração (40X), respectivamente. 1G e H. Grupo II, 21 dias, tecido conjuntivo denso com matriz colágeno organizada (40X), e epiderme totalmente reconstituída (20X), respectivamente.
|
|
|
Discusión
fiogf49gjkf0d
O processo de cicatrização tecidual é um fenômeno complexo, que envolve várias etapas, inicialmente caracterizado por processos de inflamação, seguida de estágio de fibroplasia, com a formação do tecido de granulação e por fim pela remodelagem tecidual e formação de cicatriz tecidual, que é caracterizado pela substituição do tecido lesionado por tecido conjuntivo denso vascularizado e reepitelização da área lesada (GONÇALVES & PARIZOTTO, 1998; PEREIRA, 2002; STEVENS, 2000; ROBBINS et al., 2005).
Etapas estas, do processo de cicatrização, que foram observadas no presente trabalho tanto nas lesões tratadas com papaína como nas não tratadas, conforme os dias analisados. Entretanto, em relação ao processo de cicatrização dos animais com úlceras experimentais assépticas, tratadas com concentrações diferentes de papaína, chamou atenção o fato de que microscopicamente estas lesões tratadas com papaína tiveram uma melhor resposta, em relação ao controle, sob vários aspectos como: (1) a ausência de crosta hemato-fibrinosa, tecido de granulação variando de moderado a exuberante, formado por maior quantidade de vasos neoformados em animais tratados com papaína a 10% com 07 dias; (2) maior quantidade fibroblastos e matriz colágeno (organizada), e menor infiltrado inflamatório em animais tratados com papaína a 6% com 14 dias de experimento; e (3) melhor organização da matriz colágeno e fibroblastos nas lesões em animais tratados com papaína a 4% com 14 e 21 dias de experimento.
Estes dados são semelhantes aos resultados microscópicos obtidos por SANCHEZ et al. (1993) em seus estudos com animais tratados com papaína a 2%, exceto pelo fato de que estes autores observaram que, com 07 dias de análise, a manutenção da crosta hemato-fibrinosa; com 14 dias, moderado a reduzido infiltrado inflamatório; e com 21 dias, tecido de granulação rico em fibras colágeno menos organizado; o que diferem dos dados do observados em nossos estudos. Sugerindo assim, que a utilização da papaína em concentrações diferentes, conforme a fase em que se encontra a lesão, pode auxiliar de forma mais positiva no debridamento, redução do tempo de permanência da crosta hemato-fibrinosa, e no aumento da circulação local através do aumento do numero de vasos neoformados, durante o processo de cicatrização tecidual como, por exemplo, foi observado com a utilização de soluções de papaína a 10% no início do tratamento das lesões; ou mesmo no final do processo de cicatrização tecidual através da organização e redução da matriz colágeno e dos fibroblastos do tecido de granulação, principalmente após a utilização de concentrações de 6% ou 4% de soluções de papaína.
Considerando-se, assim, a natureza diversificada das lesões ulcerativas que podem ser encontradas em pacientes atendidos na rotina hospitalar e ambulatorial, como a Diabetes Mellitus (pé diabético), neuropatias, vasculopatias periféricas, imunodepressão, dentre outras; este estudo experimental visa de forma prática e aplicativa mostrar que, assim como é indicado na literatura para estudos clínicos (ROGENSKI et. al., 1995; ROGENSKI et al., 1998; MONETA, 1998; MONETA 1992; UDOD et al, 1981; MONETTA, 1987; MONETA, 1990;GUZMAN e GUZMAN, 1953; WISEMAN, 1990; STORER & MÉNARD, 1994; JORGE & DANTAS, 2003), o uso de concentrações diferentes de papaína, para cada fase de uma lesão tecidual, é importante para a obtenção de um resultado final satisfatório com a cicatrização e reepitelização da área lesada.
O presente estudo sugere, então, de forma aplicativa e em acordo com a literatura (ROGENSKI et. al., 1995; ROGENSKI et al., 1998; MONETA, 1998; MONETA 1992; UDOD et al, 1981; MONETTA, 1987; MONETA, 1990;GUZMAN e GUZMAN, 1953; WISEMAN, 1990; STORER & MÉNARD, 1994; JORGE & DANTAS, 2003), que todo profissional de saúde, antes de iniciar qualquer tratamento com soluções de papaína, deve levar em consideração a fase em que se encontra a lesão tecidual, o tipo de lesão e as características individuais de cada paciente, como a predisposição à formação de quelóides ou não, de modo que, este profissional venha a obter os resultados mais satisfatórios com esta metodologia e os menores riscos de infecções secundárias (oportunistas) na lesão primária. Semelhante ao que foi observado neste estudo experimental, onde não foi observada nenhuma infecção oportunista (dados não mostrados) nas lesões tratadas com concentrações diferentes de papaína, o que por sua vez, também pode explicar o relato de redução do exsudato inflamatório, com 14 dias de experimento após a utilização de soluções de papaína de 10% e 6%, diferente do encontrado também estudos experimentais, como os de SANCHEZ et al. (1993), após a utilização de concentrações de papaína a 2% para a mesma fase.
|
|
|
Conclusiones
fiogf49gjkf0d Em resumo, os resultados deste estudo experimental revelam que, a utilização de concentrações diferentes de papaína, conforme a fase da lesão, é um importante fator para o sucesso do processo de cicatrização de ulcerações teciduais. Tendo como resultados que falam em favor desta teoria a melhor resposta celular exercida pela papaína sobre as atividades de estimulação, proliferação e organização do tecido de granulação (fibroblastos e células endoteliais, para formação de novos vasos - neovascularização), principalmente até o 14º dia do início do processo de cicatrização; e células epiteliais (reepitelização). Além da possível a ação modular que a papaína exerce sobre o processo inflamatório no local da lesão, e a redução do risco de infecções secundárias (oportunista) nas mesmas durante todo o prcesso, graças ao poder bactericida e bacteriostático da papaína.
|
|
|
Bibliografía
1. ALVAREZ et al. Chemical debridement of pressure ulcers: a prospective, randomized, comparative trial of collagenase and papain/ureia formulations. Wounds 12 (2), 2001
2. CANDIDO, L.C. Nova abordagem no tratamento de feridas. Senac. São Paulo: 2001.
3. GONÇALVES, G.;PARIZOTTO, N. A. Fisiologia da Reparação Cutânea: Atuação da Fisioterapia. Rev. Bras.Fisiot., Campinas-SP, v. 3, n.1,p.5-13,,jun. 1998.
4. JORGE, S.A. & DANTAS, S.R.P.E. Abordagem Multiprofissional do Tratamento de feridas. Editora Atheneu. 2003.
5. KAMANOTO, E.E. FORTES, J.I. Fundamentos de enfermagem. 5.ed. EPU. São Paulo: 2003.
6. MASINI E., CALAMO M.A.: Uma forma de tratamento de lesões cutâneas com papaína e sacarose. Rev.Bras.Clín.Terap., v.15, n.8, p.245-8, 1986.
7. MONETTA, L. – Uso da papaína nos curativos feitos pela enfermagem. Rev.Bras.Enf., v.40, n.1, p. 66-73, 1987.
8. MONETTA L. – A importância da atuação científica do enfermeiro na execução dos curativos feitos com papaína. Rev.Bras.Enf., v.9, n.3, p.83-7, 1990.
9. MONETTA L. – Análise evolutiva do processo de cicatrização em Úlceras diabéticas, de pressão e venosa com uso da papaína. Dissertação de Mestrado. São Paulo: EEUSP, 1998.
10. MONETTA, L. –Utilização de Novos Recursos em Curativos num Consultório de Enfermagem. Rev.P.Enf., 11(1):19-26, 1992.
11. NAGAPETYAN, º; BAGDASARYAN, R. V.; MATINYAN, L.A.; MIRZOYAN, V. S. – Treatment of purulent wounds with lecopian in outpatient clinica. Khirurgia (Mosk), 6:17-21, 1986.
12. OTUKA E.S., PEDRAZZANI E.S., PIOTO M.P.: Uso da papaína na úlcera plantar. Rev. Bras. Enf., v.49, n.2, p.207-14, 1996.
13. OYIBO, S.O.; JUDE, E.B.; TARAWNEH, I.; NGUYEN, H;C; HARKLESS, L.B. and BOULTON, A.J.M. A Comparison of Two Diabetic Foot Ulcer Classification Systems. DIABETES CARE, vol. 24 (1), 2001.
14. ROBBINS, S. L., et al. – Patologia estrutural e funcional 3ª ed. Rio de Janeiro, Editora ELSEVIER, 2005, 1422 p.
15. ROGENSKI , N. M. B. et al. – Uso de papaína em infecções de vísceras. Rev. Bras. Enf., v.48, n.2, p.140-3, 1995.
16. ROGENSKI , N. M. B.; BAPTISTA, C. M. C.; SOFIA, M. H. – O uso da papaína a 2% nas lesões provocadas oela Síndrome de Fournier: a proposito de 14 casos. Rev. Paul. Enf., v.17, n 1/3, p. 39-45, 1998.
17. SANCHEZ NETO, R.; BARONE, B.; TEVES, D. C.; SIMÕES, M. J.; NOVO, N. F.; JULIANO, Y. – Aspectos morfológicos e morfométricos da reparação tecidual de feridas cutâneas de ratos com e sem tratamento com solução de papaína a 2%. Acta Cir. Bras., 8(1);18-23, 1993.
18. STEVENS, A., LOWE, J. Respostas teciduais ao dano. In: Patologia. Tradução de Ida Cristine Gubert & Flávia Galino Silvestre, 2.º ed, são Paulo, Manole, 2000, p. 35-50.
19. TIAGO, F. Feridas: etiologia e tratamento. 2.ed. CBL. São Paulo:1995.
20. UDOD, V. M. & STOROJUK, V. T. – Use of papain in treating suppurative postoperative soft tissue complications and deseases. Khirurgia (Mosk),5:99-101, 1981.
21. WISEMAN, A. – Topics in enzyme and fermentation biotechnology. Chischester, Ellis Horwood, 1990.
|
|
|
Comentarios
- Emilio Mayayo Artal (06/10/2005 19:52:20)
Trabajo experimental a tener en cuenta sobre todo si los tejidos humanos muestran similares respuestas. Pueden solucionar muchos problemas crónicos, de difícil tratamiento, a pacientes cansados de tratamientos diversos. Supongo que a bajo costo podemos tener grandes resultados clínicos. Enhorabuena. Emilio
- Lacy Cardoso Brito Junior (09/10/2005 17:40:52)
Em resposta ao comentário do Dr. Emilio Mayayo Artal, gostariamos de esclarecer que este trabalho experimental visa entre outras coisas dar sustentação científica aos achados clínicos experimentais, já comprobatórios da ação cicatrizante da papaína em pacientes com pé diabético. De modo que, o uso clínico da papaina nos processos de cicatrização tecidual a muito é conhecido como satisfatório, reduzindo os casos de amputações em pacientes com doenças crônicas, principalmente o pé diabético, e de baixo custo. Reduzindo os custos dos curativos e o tempo de internação do paciente, como pode ser comprovado em outros estudos do mesmo grupo.
|
|
|
|
|


