

|
Susi Davolio*, Adriana del Carmen Elías**, Sergio Gómez*, Georgina Nydia Torres Nieto de Mercau*, Guillermo Adolfo Mercau*, Diego Abdala*** |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
OBJETIVOS: Analizar la influencia de la Sacarina de Sodio sobre el número de células caliciformes en el intestino delgado de ratones bajo condiciones similares de edad, peso y con la preexistencia del estimulo de inyección de solución Fisiológica y Sacarina de Sodio a diferentes tiempos de exposición. MATERIALY METODOS: Se utilizaron como unidades experimentales a 60 ratones de dos meses de edad de la cepa Balb/c, endocriados, bajo condiciones ambientales controladas. Se formaron 4 grupos: 3 experimentales y 1 de control. A los grupos experimentales se les inyectó 0,1 ml de solución fisiológica adicionada con sacarina de sodio (1 mg/ml) por vía intraperitoneal durante 15 días (G1), 30 días (G2) y 60 días (G3). Los ratones del grupo control se separaron en tres lotes y se les inyectó 0,1 ml de solución fisiológica por vía intraperitoneal durante 15, 30 y 60 días. Inicialmente se pesaron todos los ratones y luego de cada período de tratamiento, para finalmente ser sacrificados con el objetivo de extraer los duodenos de cada animal para luego procesarlos con técnicas histológicas adecuadas para evidenciar y poder contar las células caliciformes de 5 vellosidades elegidas al azar de 3 cortes de duodeno de cada unidad. El estudio estadístico utilizado consideró técnicas descriptivas e inferenciales: Métodos gráficos, Análisis de datos apareados, ANOVA de dos vías (Tratamiento y días de exposición), Test de Tukey HSD, y análisis de la evolución de Tasas de Variación relativa de diferencias de pesos y del número de células caliciformes. Se utilizó el software estadístico SPSS versión 9.0.
RESULTADOS:
1) No se observaron diferencias significativas respecto de la evolución de las medias de las diferencias de pesos de los grupos en el tiempo.
2) Se observaron diferencias significativas en el número de células caliciformes. Este número fue significativamente menor en los grupos experimentales respecto al control, a los 15, 30 y 60 días de tratamiento. Las tasas de variaciones relativas del número de células caliciformes evidenciaron una disminución de por lo menos un 19 % con respecto al control en los distintos tiempos estudiados.
CONCLUSIONES: 1) El efecto del estrés que produjo sobre el peso, el estímulo de inyección de sacarina o de solución fisiológica, fue el mismo en ambos grupos de ratones.
2) La sacarina de sodio produjo una disminución del número de células calicifomes del duodeno del ratón, posiblemente por modificación de la velocidad de proliferación, diferenciación celular o por un incremento en la mortalidad de dichas células.
3) El observar una disminución en el número de células caliciformes llevaría a una disminución en el volumen secretado de mucus en el duodeno, esto podría producir una mayor exposición del epitelio a los productos ácidos provenientes del estomago.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
La tendencia de los patrones alimentarios de la sociedad actual es de consumir alimentos con bajo poder calórico, concentrados en azucares refinados y grasas. Con la finalidad de reducir el contenido calórico de alimentos elaborados en general se sustituye total o parcialmente el azúcar con aditivos alimentarios denominados “edulcorantes” que son sustancias no nutritivas utilizadas en la industria alimenticia desde hace muchos años también para conservar, dar color y sabor a los productos elaborados. (1), (2),(3) . Este aditivo es considerado un aditivo directo ya que es una sustancia añadida a un alimento con un propósito específico. (2). . En Argentina la ingesta de los mismos es directa e indirecta ya que los edulcorantes se utilizan en más de 170 productos alimenticios de consumo diario, en bebidas, golosinas, lácteos, galletitas, etc. (1). El consumo de alimentos con edulcorantes se realiza por lo general sin considerar los valores de ingesta diaria admisible (IDA), por lo que las cantidades consumidas podrían superar ampliamente los valores recomendados en nuestra legislación. Aún no se ha demostrado que los edulcorantes sean sustancias de riesgo (tóxicas) para el consumo humano. Sin embargo manifestaciones tóxicas se detectaron en animales de laboratorio a través de cambios funcionales y alteraciones inmunitarias siendo una de las más comunes las digestivas. (2). Los edulcorantes no nutritivos más utilizados son: sacarina, ciclamato, acesulfame-K, aspartamo, sucralosa. La Sacarina de sodio se obtiene a partir del tolueno y es muy dulce, existen sospechas de la no inocuidad en su consumo, por lo que es el edulcorante más cuestionado ya que en estudios experimentales con ratas se la utilizó como agente inductor o promotor en la aparición de neoplasias en intestino y vejiga, (8). Se sospecha además que puede actuar como un factor epigenético modificando el metabolismo celular, (4). En experiencias anteriores encontramos que la Sacarina de Sodio induce modificaciones en las células absortivas del intestino delgado y grueso del ratón, produciendo fusión de membranas y desprendimientos apicales celulares. (5), (6), (7). En este trabajo, el estudio se centró en la mucosa duodenal de los ratones tratados con sacarina. Se seleccionó como modelo experimental a ratones por su tamaño, vida relativamente corta, alta eficacia reproductiva, adaptación en grandes colonias, amplia variabilidad genética y por su susceptibilidad a agentes químicos y microbianos. En diversos estudios se demostró que este modelo es muy útil para estudiar los mecanismos de la carcinogenesis inducida por factores externos, (9), (10).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Se utilizaron como unidades experimentales a 20 ratones de dos meses de edad de la cepa Balb/c, edocrinados, bajo condiciones controladas de humedad, temperatura, horas de luz y oscuridad, separados en jaulas por tratamiento y por sexo.
Dado que el estudio producía destrucción del sujeto, se formaron 4 grupos: 3 experimentales y 1 de control. A los grupos experimentales se les inyectó 0,1 ml de solución fisiológica adicionada con sacarina de sodio (1mg/ml) por vía intraperitoneal durante 15 días (Grupo 1), 30 días (Grupo 2) y 60 días (Grupo 3). Los ratones del grupo control se separaron en 3 lotes y se les inyectó 0,1 ml de solución fisiológica por vía intraperitoneal, durante 15, 30 y 60 días.
Todos los ratones se pesaron inicialmente y luego de cada período de tratamiento, para finalmente, ser sacrificados con el objetivo de extraer los duodenos de los animal para luego realizar la coloración de Alcian Blue (pH 2,5) – PAS. Se contaron las células caliciformes de 5 vellosidades elegidas al azar de 3 cortes de duodeno de cada animal. Figura 1, Figura 2, Figura 3, Figura 4.
El estudio estadístico consistió en dos fases: Fase 1) Se realizó un estudio descriptivo de datos apareados, para determinar si el estímulo de inyección producía algún efecto no deseado en el peso, para el estudio se consideraron diferencias de los pesos
(di = Peso Final – Peso Inicial), para cada grupo a distintos días, además para el análisis se utilizaron Tasas de variación relativa y Coeficientes de Variación relativa
TVR = [( df - di )/ di ].100
con j = período de referencia, i = período de comparación
CVR = [SE/XM].100.
con SE = Error cuadrático medio , y XM = Media Muestral
Fase 2) Análisis de la Varianza con dos factores (Tratamiento y días de exposición), Test de Tukey HSD , y análisis de la evolución de las Tasas de Variación Relativa:
TVR=( ( NCE - NCC) / NCC ) ).100,
con NCE= No de Células Caliciformes Grupo Experimental y
NCC= No de Células Caliciformes Grupo Control.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Fase1) Respecto a la evolución de las medias de las diferencias de pesos de ambos grupos y en diferentes tiempos no se observaron diferencias significativas, sin embargo llamativamente, al analizar las Tasas de Variación Relativa (TVR), [Tabla No 1], y los Coeficientes de Variabilidad Relativa (CVR), [Tabla No 2], se observaron incrementos y disminuciones porcentuales muy elevadas: incrementos entre las diferencias entre los pesos en los 15 y 30 días con una TVR de 526% en el grupo control y de un 50% en el grupo experimental; seguido de una disminución entre los 30 y 60 días con una TVR de 107% en el grupo control y de 453% en el grupo experimental. Respecto a las variabilidades en las diferencias de pesos se observó que los valores del CVR en cada grupo fueron: Grupo Control: CVR 15días =347%, CVR 30días= 46% , CVR 60días = 308%
Grupo Experimental: CVR 15días =111%, CVR 30días= 142% , CVR 60días = 33%.
Nota: valores positivos indican incrementos, valores negativos indican disminuciones
Tabla No 2: Promedios y dispersión de diferencias pesos por días de Exposición y Grupos
Nota: Coeficiente de variabilidad relativa (CVR) indica el % en valor absoluto de la
variabilidad S.E. respecto a la media aritmética.
Fase 2) Respecto a la evolución de las medias del No de Células Caliciformes a partir del Análisis de la Varianza con dos factores (Grupo y Días de exposición) se encontraron diferencias significativas ( p<0,001) y al considerar las comparaciones de los grupos de a pares (Test de Tukey HSD), [Tabla No 3], se observaron diferencias significativas entre los grupos Experimental y Control (p <0,05), a los 15, 30 y 60 días. A partir de la TVR, [Tabla No 4], [Gráfico 1], se observo disminución en el No de Células Caliciformes (TVR 15días = - 26,6%, TVR 30días= -19,8% , TVR 60días = -38,2%).
Tabla No 4: Tasas de Variaciones Relativas de grupo experimental respecto a grupo control según días de Exposición
Tabla No 5: Comparación de grupo experimental respecto a grupo control según días de exposición. TEST DE TUKEY HSD
Tabla No 6: Velocidades de crecimiento para cada grupo respecto a días de exposición
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Los resultados obtenidos demostraron que: Las variaciones en los pesos se deben a la edad biológica de los ratones, indicando un incremento natural a través del tiempo, esto surge como consecuencia de no encontrar diferencias significativas en las medias de las diferencias de los pesos en ambos grupos, es decir que el tratamiento no modifica la evolución de los pesos de las unidades experimentales. Por lo tanto es posible concluir que: “el estrés que produce el estímulo de la inoculación de una sustancia por medio de inyección es el mismo en ambos grupos de ratones”. Además se debe resaltar que al observarse fluctuaciones tan altas en la variabilidad de los datos experimentales se deben controlar las condiciones de inicio del experimento tratando, en lo posible, lograr grupos homogéneos para el estudio. A partir de los resultados obtenidos, podemos concluir que la Sacarina de sodio produce una disminución en el número de células caliciformes del intestino delgado del ratón, (Gráfico 1),lo cual hace sospechar que podría modificar la velocidad de proliferación o diferenciación celular en las células caliciformes o un incremento de la mortalidad de dichas células, (Tabla No 6). Finalmente podemos inferir que el posible efecto que produciría la ingesta de sacarina de sodio, sería una disminución en el número de células caliciformes en el intestino delgado; lo que causaría una disminución en el volumen secretado de mucus en el duodeno, ocasionando una mayor exposición del epitelio a los productos ácidos provenientes del estomago.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
1 - TORRESANI M., CARDONE C., PALERMO C., RODRIGUEZ V., VIEGENER C., GARAVANO C., DI SANZO M., LLARIA C. "Manejo y consumo de productos dietéticos y edulcorantes no nutritivos". Re. Esp. Nutr. Comunitaria. 7(3-4): 61-68. 2001. 2 - GIANNUZZI LEDA. Conferencia: "Aspectos Toxicológicos y Tecnológicos de Aditivos Alimentarios". Rev. Panalimentos. http://www.panalimentos.org/info-panalimentos/boletin/htm1/1conf.htm. 3 - AMERICAN DIETETIC ASSOCIATION, Position of the American Dietetic Association: use of nutritive and nonnutritive sweeteners; J Am Diet Assoc, 104 (6): 1013, 2004. 4 - CHAPPEL CI; A review and biologic risk assessment of sodium saccharin; Regulatory Toxicology and Pharmacology 15: 253- 270, 1992. 5 - TORRES DE MERCAU G, MARTINEZ VILLA NR, VITALONE H, MERCAU G, GAMUNDI S, MARTINEZ RIERA N, SORIA N; Efecto de la Sacarina de Sodio sobre el epitelio traqueal del ratón; Medicina (Buenos Aires) 57: 437- 440, 1997. 6 - TORRES DE MERCAU G, RIERA DE MARTINEZ VILLA N, VITALONE H H, MERCAU GA, GAMUNDI SS, MARTINEZ RIERA N, SORIA N; Permanent morphological alterations induced by sodium saccharin on mice large intestine epithelium; BIOCELL 21(2): 115- 118, 1997. 7 - TORRES DE MERCAU G, RIERA DE MARTINEZ N, MERCAU GA, MARTINEZ RIERA N, SORIA DE SANTOS N, VITALONE H; Alteraciones en la citomembrana y células de superficie del intestino grueso por acción de los edulcorantes; Acta Gastroenterológica Latinoamericana 25, N° 1: 35- 39, 1995. 8 -LEE L.S., "Saccharub and cyclamate inhibit binding of epidermal growth factor". Proc. Natl. Acad. Sci. USA. Vol 78 No 2, pp. 1042-1046, Cell Biology. 1981. 9 - Sánchez Negrette, M.; Montenegro, M.A.; Lértora, W. J.; Borda, J.T.. “Estudio Histoquímica y ultraestructural de focos de criptas displásicas del intestino grueso induciod con 1,2-dimetilhidrazina en ratas”. Rev. Vet. 14:2, 2003. 10 - CORPET D., PIERRE F., "How good are rodent models of carcinogenesis in predicting efficay in human? A systematic review and meta-analysis of colon chemoprevention in rats, mice and men". European Jornal of Cancer. Elsevier. 41: 1911-1922. 2005.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
- ELSIE BEATRIZ PICOTT RANGEL (15/10/2005 3:44:14)
- Javier Muñoz Moreno (23/10/2005 1:09:21)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 14:10:50
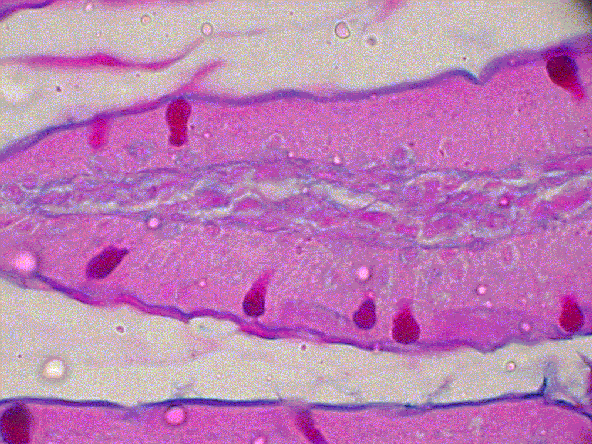 fiogf49gjkf0dGRUPO CONTROL
[15 días de exposición, Alcian Blue (pH 2,5) – PAS]">
fiogf49gjkf0dGRUPO CONTROL
[15 días de exposición, Alcian Blue (pH 2,5) – PAS]">
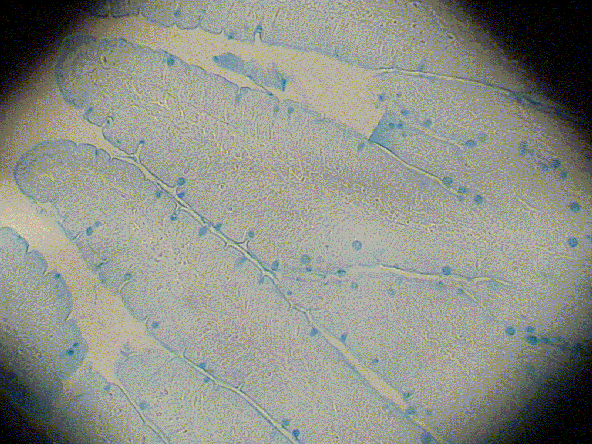 fiogf49gjkf0dGRUPO EXPERIMENTAL
[ 15 días de Exposición, Alcian Blue (pH 2,5) ]">
fiogf49gjkf0dGRUPO EXPERIMENTAL
[ 15 días de Exposición, Alcian Blue (pH 2,5) ]">
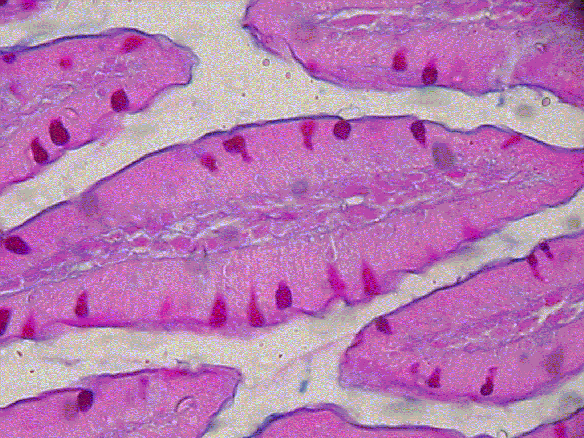 fiogf49gjkf0dGRUPO CONTROL
[30 días de Exposición, Alcian Blue (pH 2,5) – PAS]">
fiogf49gjkf0dGRUPO CONTROL
[30 días de Exposición, Alcian Blue (pH 2,5) – PAS]">
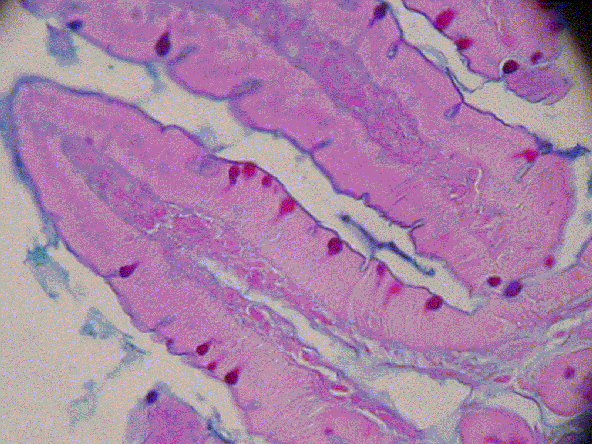 fiogf49gjkf0dGRUPO EXPERIMENTAL
[30 días de Exposición, Alcian Blue (pH 2,5) – PAS]">
fiogf49gjkf0dGRUPO EXPERIMENTAL
[30 días de Exposición, Alcian Blue (pH 2,5) – PAS]">