Direccion de contacto
fiogf49gjkf0d Jorge Tolivia: jtolivia@uniovi.es
|
|
Tinción fluorescente extrasensible para los depósitos amiloideos cerebrales utilizando el Rojo Congo en solución alcoholica
Jorge Tolivia Fernández*, Ana Navarro Incio*, Cristina Ordoñez Camblor*, Cristina Pérez Carbajales*, Eva Martínez Pinilla*
* Departamento de Morfología y Biología Celular
Universidad de Oviedo ESPAÑA
|
|
|
Resumen
fiogf49gjkf0d Introducción: La amiloidosis cerebral se caracteriza por el depósito de una proteína fibrilar anómala denominada amiloide la cual puede localizarse tanto en el parénquima cerebral como en los vasos sanguíneos de la zona. El amiloide aparece constituido por diferentes secuencias peptídicas que pueden corresponder a fragmentos de otras proteínas de mayor peso molecular. Dichos depósitos, pueden estar relacionados con varias patologías habiéndose publicado distintas técnicas para teñirlo diferencialmente. El Rojo Congo constituye la base de la mayor parte de las técnicas clásicamente utilizadas, basadas en una tinción previa con Rojo Congo y una posterior diferenciación en un medio con pH altamente básico. Estos tratamientos modifican las características tintoriales y antigénicas del tejido y el proceso de diferenciación puede afectar a la tinción selectiva de los acúmulos de amiloide más pequeños. En un trabajo previamente publicado por nuestro equipo se eliminaron los inconvenientes anteriormente comentados mediante la utilización de una solución de Rojo Congo en alcohol isopropilico que permite la tinción específica del amiloide en un solo paso sin necesidad del proceso de diferenciación posterior.
En la presente comunicación exponemos un método basado en la técnica previamente publicada y en la fluorescencia que adquiere el amiloide cuando es teñido con una solución de Rojo Congo. Cuando se aplica esta modificación se obtiene una tinción altamente específica y diferencial de todos los acúmulos de amiloide presentes en la sección incluidos los más pequeños que no se aprecian con ningún otro método.
Material y métodos: Para ello se utilizaron muestras de sistema nervioso humano procedentes del Servicio de Anatomía Patológica del H.G.A. Las muestras fueron obtenidas por necropsia y fijadas por inmersión en formol tamponado al 10%. Después de la fijación, los bloques fueron lavados, deshidratados e incluidos en parafina según la metodología clásica. A partir de los bloques de parafina se obtuvieron cortes de 10 mm, sobre los que se aplicó la tinción de Rojo Congo según nuestra metodología.
Resultados: Los depósitos de amiloide aparecen teñidos en un tono entre fucsia y anaranjado, dependiendo de la cantidad del mismo presente en el depósito, cuando se observa al microscopio de campo claro. Mediante la utilización de la microscopia de fluorescencia utilizando un sistema de filtros específicos para fluoresceína las fibras de amiloide emiten una intensa fluorescencia que va desde un tono anaranjado a uno rojo intenso, pudiendo visualizarse aquellos acumulos que por su tamaño no son apreciables en microscopia de campo claro. En el caso de las placas seniles se visualizan el inicio de formación de los depósitos en el parénquima nervioso. Finalmente por las características de la técnica se pueden someter a la misma secciones sin desparafinar, obteniéndose una tinción suave del amiloide en caso de existir, lo cual nos permite hacer una selección previa del material sin necesidad de procesarlo completamente.
|
|
|
Introduccion
fiogf49gjkf0d La amiloidosis cerebral se caracteriza por el depósito de una proteína fibrilar anómala denominada amiloide la cual puede localizarse tanto en el parénquima cerebral como en los vasos sanguíneos de la zona. El amiloide aparece constituido por diferentes secuencias peptídicas que pueden corresponder a fragmentos de otras proteínas de mayor peso molecular. Dichos depósitos, pueden estar relacionados con varias patologías habiéndose publicado distintas técnicas para teñirlo diferencialmente. El Rojo Congo constituye la base de la mayor parte de las técnicas clásicamente utilizadas, basadas en una tinción previa con Rojo Congo y una posterior diferenciación en un medio con pH altamente básico. Estos tratamientos modifican las características tintoriales y antigénicas del tejido y el proceso de diferenciación puede afectar a la tinción selectiva de los acúmulos de amiloide más pequeños. Un método complementario para aumentar la visualización de los depósitos amiloideos, es la combinación del Rojo Congo con técnicas inmuhistoquímicas (Linke et al. 1995) o mediante la visualización de la fluorescencia emitida por el Rojo Congo cuando se combina con el amiloide (Linke 2000). El estudio mediante el microscopio de fluorescencia se ha mostrado mas resolutivo para la detección del amiloide, pero debido a los defectos previamente comentados de las técnicas clásicas (fundamentalmente la necesidad de diferenciación) los depósitos iniciales siguen sin ser visualizados.
En un trabajo previamente publicado por nuestro equipo se eliminaron los inconvenientes anteriormente comentados mediante la utilización de una solución de Rojo Congo en alcohol isopropilico que permite la tinción específica del amiloide en un solo paso sin necesidad del proceso de diferenciación posterior (Navarro et al. 1999: Ver el foro técnico del congreso).
En la presente comunicación exponemos un método basado en la técnica previamente publicada y en la fluorescencia que adquiere el amiloide cuando es teñido con una solución de Rojo Congo. Cuando se aplica esta modificación se obtiene una tinción altamente específica y diferencial de todos los acúmulos de amiloide presentes en la sección incluidos los más pequeños que no se aprecian con ningún otro método.
|
|
|
Material y Métodos
fiogf49gjkf0d Se utilizaron diferentes muestras de sistema nervioso humano procedentes del Servicio de Anatomía Patológica del H.G.A. Las muestras fueron obtenidas por necropsia y fijadas por inmersión en formol tamponado al 10%. Después de la fijación, los bloques fueron lavados, deshidratados e incluidos en parafina según la metodología clásica. A partir de los bloques de parafina se obtuvieron cortes de 10 mm, sobre los que se aplicó la tinción de Rojo Congo según nuestra metodología. Una vez teñidos con el Rojo Congo no se realiza la tinción de contraste, sino que las secciones son sometidas a un proceso de inhibición de la autofluorescencia propia del tejido nervioso mediante Negro Sudán o por oxidación con permanganato potásico. Dependiendo de la intensidad de la oxidación se consigue un cambio en el color de los gránulos de lipofuscina (pasan a emitir en verde bajo el filtro de fluoresceína) o una inhibición total tanto del fondo como de la lipofuscina. Una vez realizado este paso se montan las preparaciones en un medio adecuado para su observación con un microscopio de fluorescencia.
|
|
|
Resultados
fiogf49gjkf0d Los depósitos amiloideos cuando se observan con el microscopio de campo claro aparecen teñidos en distintos tonos rojizos, que van desde el rosa al rojo oscuro dependiendo de la cantidad del mismo presente en el depósito (Fig 1). Cuando la preparación se observa mediante el microscopio de fluorescencia, utilizando un sistema de filtros para fluoresceína, los acúmulos de amiloide emiten una intensa fluorescencia de color rojo anaranjado cuya intensidad se ve poco afectada aunque la cantidad de amiloide sea escaso. Como consecuencia de ello se visualizan no solo los acúmulos de mayor tamaño ( Fig. 2 ) sino también acúmulos no visibles en campo claro (Fig 2). La finura de la tinción permite visualizar con gran detalle los finos entramados fibrilares presentes en ciertos acúmulos (Fig 3, 6) e incluso la observación previa a bajos aumentos pudiendo detectar la mayor parte de los acúmulos amiloideos presentes en la sección (Fig 4). Como complemento de la coloración se puede realizar una inhibición total del fondo (Fig 5), lo cual permite la observación de la muestra mediante microscopía confocal sin problemas de interferencia, o una inhibición parcial del mismo. Cuando es esto último lo que se realiza, se provoca un cambio de color en los gránulos de lipofuscina (que pasan a fluorescer en verde) lo que permite diferenciar las células de la zona claramente de los acúmulos amiloideos (Fig 3,4,6).
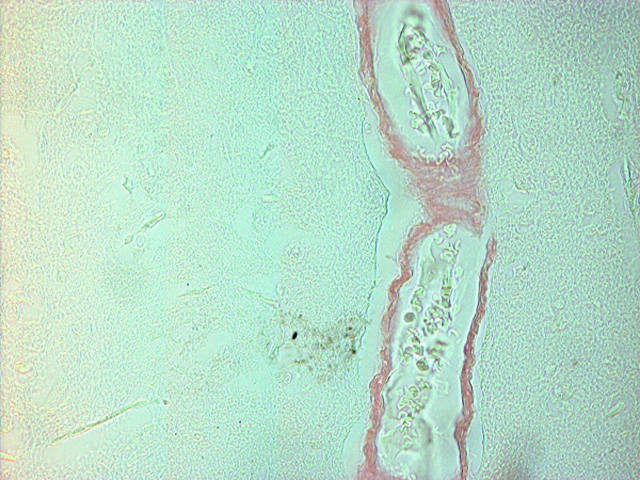 fiogf49gjkf0dFigura 1.- Vaso con amiloidosis en corteza frontal. Microscopia de campo claro (20x)"> fiogf49gjkf0dFigura 1.- Vaso con amiloidosis en corteza frontal. Microscopia de campo claro (20x)">
Figura 1 - fiogf49gjkf0d Figura 1.- Vaso con amiloidosis en corteza frontal. Microscopia de campo claro (20x)
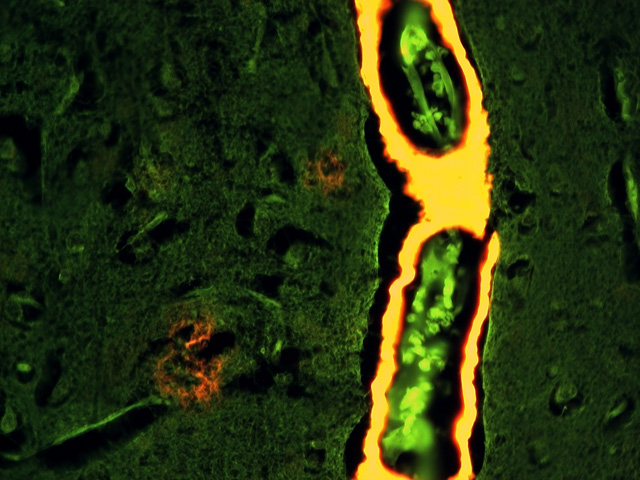 fiogf49gjkf0dFigura 2.- Misma que la anterior visualizada con microscopia de fluorescencia (20x). Obsérvense los acumulos de amiloide próximos al vaso y no visibles en la figura 1."> fiogf49gjkf0dFigura 2.- Misma que la anterior visualizada con microscopia de fluorescencia (20x). Obsérvense los acumulos de amiloide próximos al vaso y no visibles en la figura 1.">
Figura 2 - fiogf49gjkf0d Figura 2.- Misma que la anterior visualizada con microscopia de fluorescencia (20x). Obsérvense los acumulos de amiloide próximos al vaso y no visibles en la figura 1.
 fiogf49gjkf0dFigura 3.- Vaso de pequeño calibre con deposito amiloide. Microscopio de fluorescencia (40x). Nótese el entramado fibrilar asociado al mismo."> fiogf49gjkf0dFigura 3.- Vaso de pequeño calibre con deposito amiloide. Microscopio de fluorescencia (40x). Nótese el entramado fibrilar asociado al mismo.">
Figura 3 - fiogf49gjkf0d Figura 3.- Vaso de pequeño calibre con deposito amiloide. Microscopio de fluorescencia (40x). Nótese el entramado fibrilar asociado al mismo.
 fiogf49gjkf0dFigura 4.- Campo a bajo aumento de la corteza frontal humana donde se observan distintos depositos amiloideos tanto en vasos como en el neuropilo. Destacan también las células con lipofuscina que emiten en verde. Microscopia de fluorescencia (5x)."> fiogf49gjkf0dFigura 4.- Campo a bajo aumento de la corteza frontal humana donde se observan distintos depositos amiloideos tanto en vasos como en el neuropilo. Destacan también las células con lipofuscina que emiten en verde. Microscopia de fluorescencia (5x).">
Figura 4 - fiogf49gjkf0d Figura 4.- Campo a bajo aumento de la corteza frontal humana donde se observan distintos depositos amiloideos tanto en vasos como en el neuropilo. Destacan también las células con lipofuscina que emiten en verde. Microscopia de fluorescencia (5x).
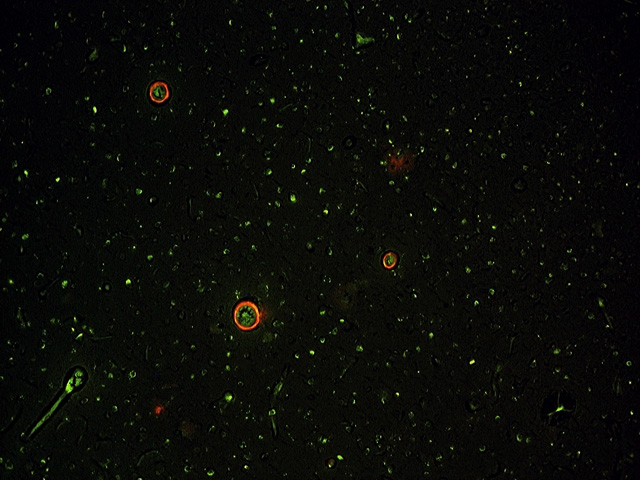
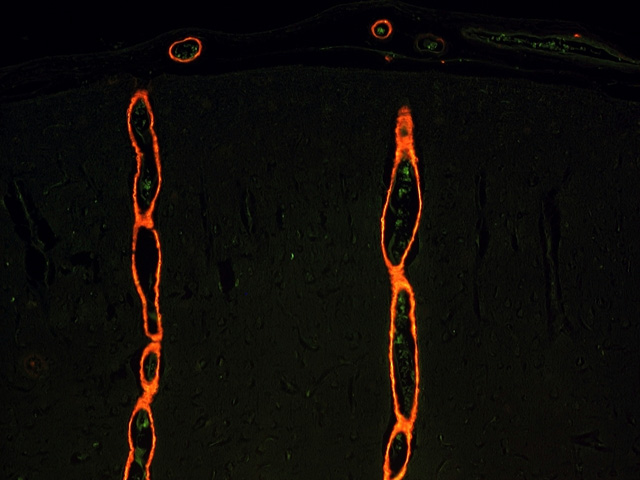 fiogf49gjkf0dFigura 5.- Vasos con amiloidosis sobre un fondo donde ha sido inhibida la autofluorescencia. Obsérvese que no se pierde intensidad en la señal. Microscopia fluoresecente (10x)."> fiogf49gjkf0dFigura 5.- Vasos con amiloidosis sobre un fondo donde ha sido inhibida la autofluorescencia. Obsérvese que no se pierde intensidad en la señal. Microscopia fluoresecente (10x).">
Figura 5 - fiogf49gjkf0d Figura 5.- Vasos con amiloidosis sobre un fondo donde ha sido inhibida la autofluorescencia. Obsérvese que no se pierde intensidad en la señal. Microscopia fluoresecente (10x).
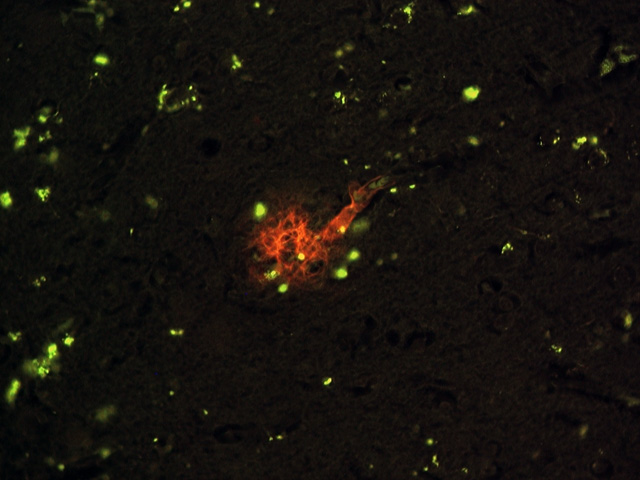
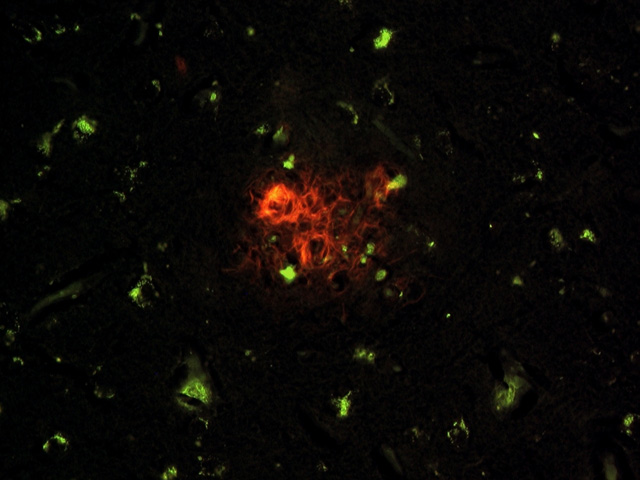 fiogf49gjkf0dFigura 6.- Placa senil en corteza parietal donde se observa el entramado fibrilar amiloideo y las células con lipofuscina asociadas a la misma (40x)."> fiogf49gjkf0dFigura 6.- Placa senil en corteza parietal donde se observa el entramado fibrilar amiloideo y las células con lipofuscina asociadas a la misma (40x).">
Figura 6 - fiogf49gjkf0d Figura 6.- Placa senil en corteza parietal donde se observa el entramado fibrilar amiloideo y las células con lipofuscina asociadas a la misma (40x).
|
|
|
Discusión
fiogf49gjkf0d La aplicación del método descrito en este trabajo permite la visualización de los acumulos de pequeño tamaño no detectables con los métodos clásicos no solo mediante el microscopio de campo claro sino tampoco con el de fluorescencia. Aunque la combinación de técnicas inmunohistoquímicas y las tinciones con Rojo Congo han sido consideradas más sensibles que esta última solamente (Linke et al., 1991; Michels y Linke, 1998), la visualización mediante fluorescencia de las técnicas clásicas ha demostrado tener más resolución (Linke, 2000). La especial sensibilidad de la observación mediante el microscopio fotónico de la tinción del Rojo ya fue comentada por Cohen et al. (1959) y confirmada por Cooper (1969) con posterioridad, aunque ambos trabajos consideraban el método como no utilizable rutinariamente, lo cual es rebatido posteriormente por Linke (2000).
La modificación de la tinción descrita por nuestro grupo (Navarro et al. 1999) mejora notablemente la tinción de los acumulos de amiloide no solo en campo claro sino que mediante la microscopia de fluorescencia se consigue una resolución muy superior a la obtenida con las técnicas clásicas (impregnación argéntica, inmunohistoquímica,….) tanto en campo claro como en fluorescencia.
Finalmente, nuestra técnica permite la observación de la tinción amiloide (en rojo) sobre un fondo totalmente oscuro (inhibición de fondo alta), con los gránulos de lipofuscina (verde) como marcadores de los tipos celulares presentes o en combinación con métodos inmunohistoquímicos para la detección de proteínas.
|
|
|
Conclusiones
fiogf49gjkf0d Podemos concluir que nuestro método de tinción del amiloide es de fácil aplicación, permite combinar las ventajas de distintos tipos de observación microscópica y es compatible con técnicas inmunohistoquímicas. Esto hace que se pueda utilizar de forma rutinaria en el diagnóstico de la amiloidosis en cualquier Servicio de Anatomía Patológica.
|
|
|
Agradecimientos
fiogf49gjkf0d Trabajo financiado por el F.I.S. (PI 022324 y RED 03/06).
|
|
|
Bibliografía
Cohen AS, Calkins E, Levene C (1959) Studies on experimental amyloidosis. I Analysis of histology and staining sections of casein-induced amyloidosis in rabbits. Am J Pathol 35: 971-989
Cooper JH (1969) An evaluation of current methods for the diagnostic histochemistry of amyloid. J Clin Pathol 22: 410-413
Linke RP (2000) Highly sensitive diagnosis of amyloid and various amyloid syndromes using Congo red fluorescence. Virchows Arch 436: 439-448
Linke RP, Gärtner HV, Michels (1995) High sensitive diagnosis of AA-amyloidosis using congo red and immunohistochemistry detects missed amyloid deposits. J Histochem Cytochem 9:863-869
Michels H, Linke RP (1998) Clinical benefits of diagnosing incipient AA amyloidosis in pediatric rheumatic diseases as estimated from a retrospective study. Amyloid. Int J Exp Clin Invest 5: 200-207
Navarro A, Tolivia J, del Valle E (1999) Congo red method for demonstrating amyloid in paraffin sections. J Histotech 22:305-307
|
|
|
Comentarios
- David Cubero Rego (05/10/2005 2:51:15)
Interesante trabajo bellamente ilustrado. Me gustaría conocer si los autores tienen experiencia con la técnica de plata metenamina acelerada con el horno de microhondas en la identificación de la patología tipo Alzheimer y la sesibilidad comparada de esta técnica con la aplicada en el trabajo.
- Jorge Tolivia Fernández (06/10/2005 14:17:02)
Quien esté interesado en como quedan las imágenes con el método original, en campo claro y combinadas con inmuno, las puede encontrar en el foro técnico.
- Mirta Garcia Jardon (07/10/2005 15:46:44)
Felicidades, les queda muy bien y muy demostrativo. ¿Existe alguna posibilidad de acceso al procedimiento técnico? El Alzheimer es tan corriente ahora que haríamos cualquier cosa con tal de demostrarlo. Cordiales saludos.
- Jorge Tolivia Fernández (18/10/2005 21:05:42)
Con respecto al comentario sobre la metenamina de plata, esta técnica por sus características logra una mayor definición y tiene mayor sensibilad a la hora de detectar peqéños acúmulos y fibras muy finas, no presentando ademas el problema de los posibles depósitos inespecíficos típicos de las técnicas argénticas
|
|
|
|

 Comunciación libre
Comunciación libre