Direccion de contacto
fiogf49gjkf0d Santiago Montes Moreno. Departamento de Anatomía Patológica. Hospital Universitario 12 de Octubre. Avda. de Córdoba S/N 28041 Madrid, España. e-mail: santi_montes@hotmail.com
|
|
PSEUDOARTROSIS INFANTIL DE LA TIBIA ASOCIADA A NEUROFIBROMATOSIS TIPO 1. PRESENTACIÓN DE UN CASO Y REVISIÓN DE LA LITERATURA.
Santiago Montes Moreno*, Beatriz Segovia Blázquez*, Cristina Murillo Lázaro*, Claudio Ballestín Carcavilla*, Huberto García Muñoz*
* Departamento de Patología.
Hospital Universitario 12 de Octubre.
Madrid, España. ESPAÑA
|
|
|
Resumen
fiogf49gjkf0d INTRODUCCIÓN.
La neurofibromatosis (NF) tipo 1 es uno de los síndromes genéticamente determinados más frecuentes con una incidencia de uno cada 3000-4000 recién nacidos vivos. La incidencia de pseudoartrosis infantil de la tibia se calcula cerca de 1 cada 190.000 nacidos vivos. Ésta es una entidad que plantea serios problemas funcionales y ortopédicos. El desarrollo de NF tipo 1 en pacientes con pseudoartrosis de la tibia es frecuente, calculándose entre el 40 y el 80 %, según las series. La naturaleza del tejido de la pseudoartrosis no está actualmente bien definida pero varios trabajos han demostrado la ausencia de neurofibroma en el mismo. Tanto la etiopatogenia de la pseudoartrosis como el sustrato de su asociación con NF no están aclarados por el momento.
PRESENTACIÓN DEL CASO.
Se trata de un paciente varón de 3 años de edad que presenta, desde el nacimiento, incurvación anterolateral de tibia y peroné izquierdos junto con una lesión pseudoartrósica en la tibia. Tiene más de 15 manchas café con leche y una madre con NF. La lesión pseudoartrósica se mantiene refractaria al tratamiento quirúrgico en la actualidad. Histológicamente está compuesta por un tejido de tipo fibromatoso sin atipia con abundante vascularización y focos de metaplasia condroide, ósea y sinovial. Las células proliferantes son positivas para vimentina y actina específica de músculo liso, de forma difusa y homogénea. También son positivas, de forma focal y heterogénea para calponina. La proteína S100, desmina, caldesmón y CD34 son negativas. El índice proliferativo es del 1%.
DISCUSIÓN.
A pesar de la baja incidencia de pseudoartrosis infantil de la tibia, la evidencia acumulada demuestra una clara asociación con neurofibromatosis de tipo 1. Histológicamente el tejido que ocupa la pseudoartrosis es de naturaleza mesenquimal con aspecto fibromatoso y focos de metaplasia condroide, ósea y sinovial. No es distinto al que aparece en otras pseudoartrosis, asociadas a neurofibromatosis o no. Nuestro trabajo demuestra el inmunofenotipo miofibroblástico del tejido proliferativo. Ni en este caso ni en los referidos en la literatura se han encontrado elementos neurofibromatosos en el lugar de la pseudoartrosis.
El mecanismo de formación de la pseudoartrosis no está actualmente aclarado. Parecen implicados problemas estructurales de formación inadecuada del hueso y otros de posterior organización del tejido de reparación. De qué modo la condición neurofibromatosa altera esta reparación normal no está aclarado. Sí se ha demostrado que las pseudoartrosis asociadas a neurofibromatosis tienen una peor respuesta al tratamiento. En resumen, este caso es otro ejemplo más de la asociación de displasias esqueléticas con un síndrome neurocutáneo como es la NF tipo 1. Si bien los tumores neurales que se desarrollan frecuentemente en estos pacientes condicionan su pronóstico vital, la repercusión clínica de las alteraciones esqueléticas suponen una importante merma funcional. Los más recientes avances en la biología de la osteogénesis y el papel que juega la neurofibromina en la misma parecen apuntar hacia el posible sustrato de esta frecuente asociación.
|
|
|
INTRODUCCIÓN.
fiogf49gjkf0d La neurofibromatosis tipo 1 es uno de los síndromes genéticamente determinados más frecuentes con una incidencia de uno de cada 3000-4000 recién nacidos vivos (1, 2). La incidencia de pseudoartrosis infantil de la tibia es de cerca de 1 de cada 190.000 nacidos vivos (1, 3). Esta es una entidad que plantea serios problemas funcionales y ortopédicos (1). El desarrollo de neurofibromatosis tipo 1 en pacientes con pseudoartrosis de la tibia es frecuente, calculándose entre el 40 y el 80 %, según las series (1). Además de la pseudoartrosis infantil, se han descrito varios tipos de lesión esquelética asociados a neurofibromatosis tipo 1, como son la cifoescoliosis distrófica, el fibroma no osificante, el querubismo (4) y el alargamiento de huesos largos (5-7). La naturaleza del tejido de la pseudoartrosis no está actualmente bien definida, siendo considerado por algunos autores como una especie de hamartoma mesenquimal (13). Lo que sí está claramente demostrado es la ausencia de neurofibroma en esta lesión (8, 11, 14). Tanto la etiopatogenia de la pseudoartrosis como el sustrato de su asociación con neurofibromatosis no están aclarados por el momento.
|
|
|
PRESENTACIÓN DEL CASO.
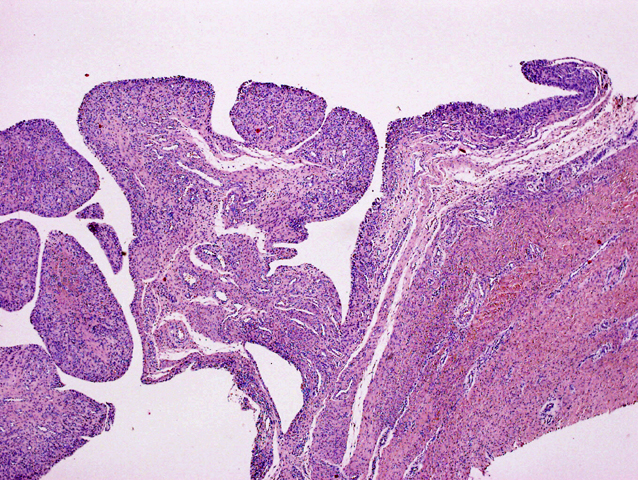
fiogf49gjkf0d Se trata de un paciente varón de 3 años de edad que presenta, desde el nacimiento, incurvación anterolateral de tibia y peroné izquierdos junto con una lesión pseudoartrósica de la tibia (figura 1). Presenta criterios clínicos de neurofibromatosis tipo 1 (2) con más de 15 manchas café con leche y una madre que padece neurofibromatosis. La lesión pseudoartrósica se mantiene refractaria al tratamiento quirúrgico en la actualidad (figura 2). Histológicamente está compuesta por un tejido de tipo fibromatoso, constituido por células de hábito fibroblástico, sin atipia, entre las cuales se deposita colágeno en cantidad variable (figuras 3-5). Se observan focos de aspecto inmaduro con células más rechonchas con núcleos ovoides (figura 6). Entre los fascículos fibroblástico-fibrosos se encuentran abundantes vasos de pequeño calibre con cambio mixoide perivascular (figura 7) y focos de metaplasia condroide y ósea (figura 8) y otras zonas con metaplasia sinovial (figura 9). También se encuentran aisladas células gigantes multinucleadas de tipo osteoclástico, junto con focos de tejido adiposo maduro (figura 10). Las células fusiformes son positivas para vimentina y actina específica de músculo liso, de forma difusa y homogénea (figuras 11 y 12). También son positivas, de forma focal y heterogénea para calponina (figura 13). Las tinciones con S100, desmina, caldesmón y CD34 son negativas (figura 14). El índice proliferativo (MIB-1) es del 1% (figura 15).
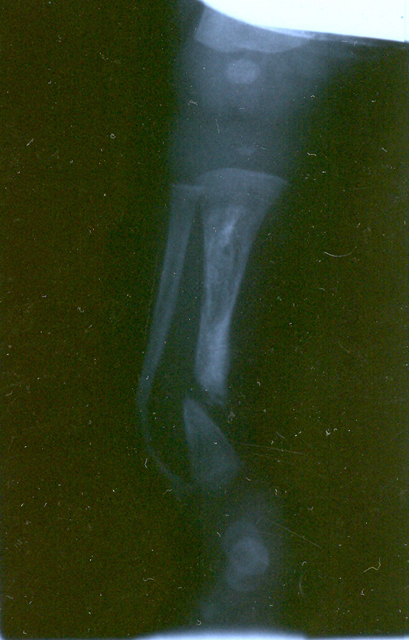 fiogf49gjkf0dFIGURA 1: Proyección oblicua del miembro inferior izquierdo que muestra lesión pseudoartrósica del tercio distal de la tibia asociada a arqueamiento anterolateral del peroné."> fiogf49gjkf0dFIGURA 1: Proyección oblicua del miembro inferior izquierdo que muestra lesión pseudoartrósica del tercio distal de la tibia asociada a arqueamiento anterolateral del peroné.">
- fiogf49gjkf0d FIGURA 1: Proyección oblicua del miembro inferior izquierdo que muestra lesión pseudoartrósica del tercio distal de la tibia asociada a arqueamiento anterolateral del peroné.
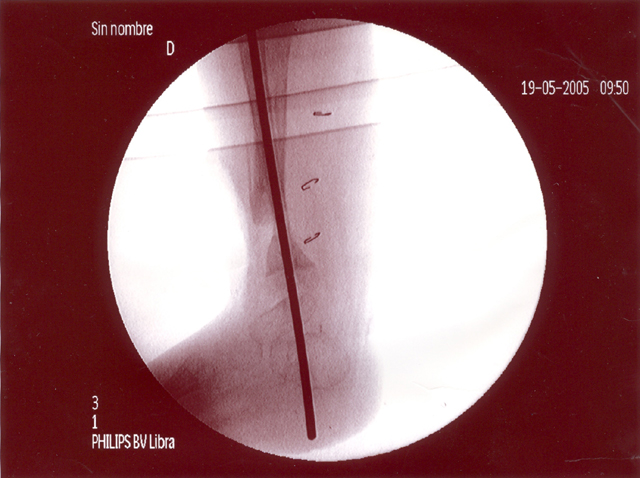 fiogf49gjkf0dFIGURA 2: Proyección lateral del mismo miembro en la actualidad que muestra persistencia de la lesión pseudoartrósica con presencia de clavo endomedular."> fiogf49gjkf0dFIGURA 2: Proyección lateral del mismo miembro en la actualidad que muestra persistencia de la lesión pseudoartrósica con presencia de clavo endomedular.">
- fiogf49gjkf0d FIGURA 2: Proyección lateral del mismo miembro en la actualidad que muestra persistencia de la lesión pseudoartrósica con presencia de clavo endomedular.
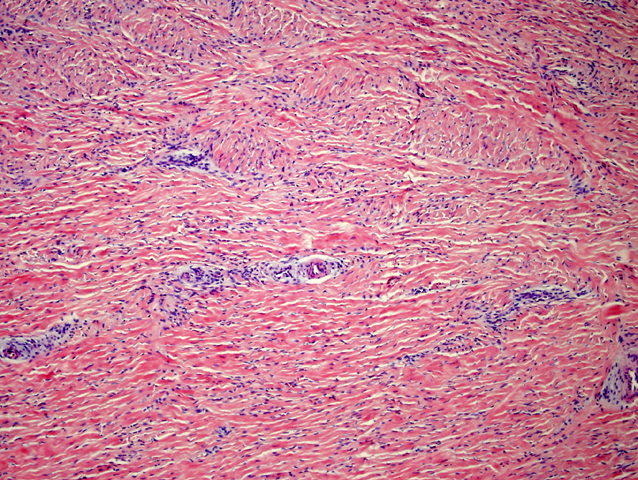 fiogf49gjkf0dFIGURA 3: HE que muestra una lesión compuesta por células fusiformes que se dispone de forma desordenada y con depósito colágeno entre las mismas. Se observan cordones vasculares prominentes."> fiogf49gjkf0dFIGURA 3: HE que muestra una lesión compuesta por células fusiformes que se dispone de forma desordenada y con depósito colágeno entre las mismas. Se observan cordones vasculares prominentes.">
- fiogf49gjkf0d FIGURA 3: HE que muestra una lesión compuesta por células fusiformes que se dispone de forma desordenada y con depósito colágeno entre las mismas. Se observan cordones vasculares prominentes.
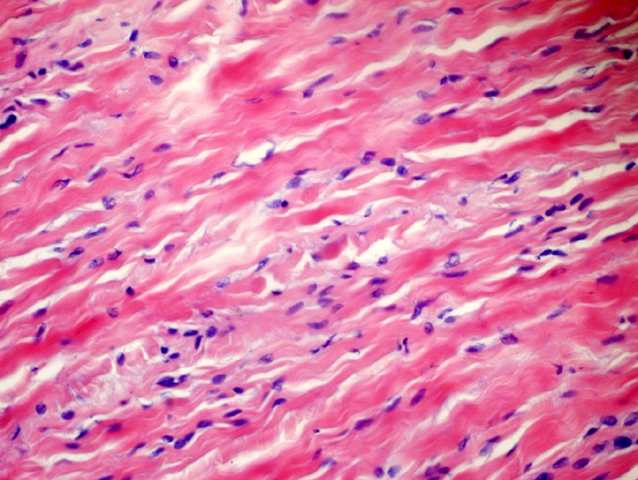 fiogf49gjkf0dFIGURA 4: HE en detalle que muestra una celularidad de hábito fibroblástico sin atipia y colágeno en haces gruesos."> fiogf49gjkf0dFIGURA 4: HE en detalle que muestra una celularidad de hábito fibroblástico sin atipia y colágeno en haces gruesos.">
- fiogf49gjkf0d FIGURA 4: HE en detalle que muestra una celularidad de hábito fibroblástico sin atipia y colágeno en haces gruesos.
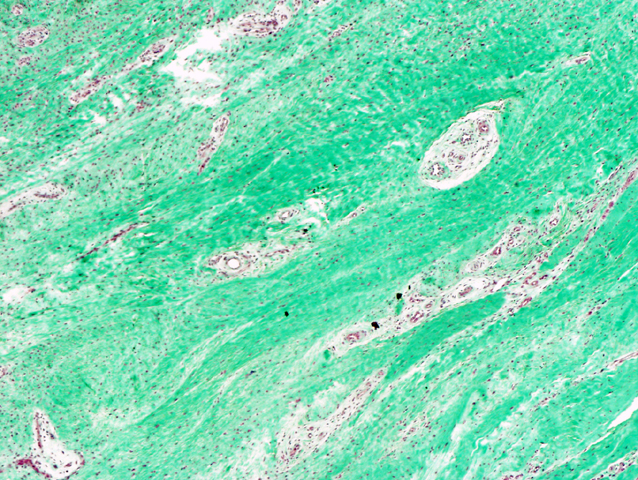 fiogf49gjkf0dFIGURA 5: Tricrómico de Masson que resalta el colágeno depositado en el espacio intercelular."> fiogf49gjkf0dFIGURA 5: Tricrómico de Masson que resalta el colágeno depositado en el espacio intercelular.">
- fiogf49gjkf0d FIGURA 5: Tricrómico de Masson que resalta el colágeno depositado en el espacio intercelular.
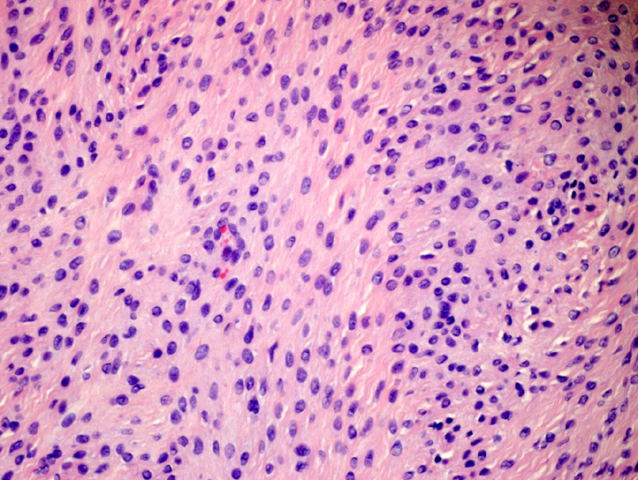 fiogf49gjkf0dFIGURA 6: HE que muestra áreas menos colagenizadas, con celularidad más inmadura (contornos redondeados y núcleos ovoideos) y abundante. Los núcleos siguen mostrando un aspecto inocente."> fiogf49gjkf0dFIGURA 6: HE que muestra áreas menos colagenizadas, con celularidad más inmadura (contornos redondeados y núcleos ovoideos) y abundante. Los núcleos siguen mostrando un aspecto inocente.">
- fiogf49gjkf0d FIGURA 6: HE que muestra áreas menos colagenizadas, con celularidad más inmadura (contornos redondeados y núcleos ovoideos) y abundante. Los núcleos siguen mostrando un aspecto inocente.
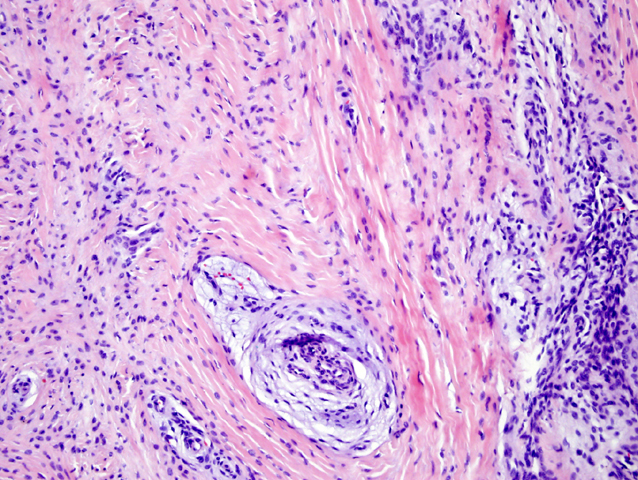 fiogf49gjkf0dFIGURA 7:HE. Detalle de los tractos vasculares que muestran cambio mixoide del intersticio perivascular con edema."> fiogf49gjkf0dFIGURA 7:HE. Detalle de los tractos vasculares que muestran cambio mixoide del intersticio perivascular con edema.">
- fiogf49gjkf0d FIGURA 7:HE. Detalle de los tractos vasculares que muestran cambio mixoide del intersticio perivascular con edema.
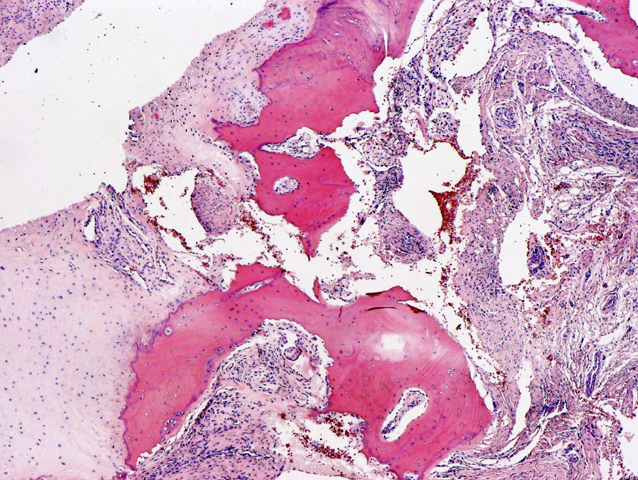 fiogf49gjkf0dFIGURA 8:HE que muestra focos de metaplasia condroide y ósea. Ambos elementos son maduros."> fiogf49gjkf0dFIGURA 8:HE que muestra focos de metaplasia condroide y ósea. Ambos elementos son maduros.">
- fiogf49gjkf0d FIGURA 8:HE que muestra focos de metaplasia condroide y ósea. Ambos elementos son maduros.
 fiogf49gjkf0dFIGURA 9:HE. En otras áreas se encuentra extensa metaplasma sinovial de aspecto hiperplásico que remeda el recubrimiento de una cavidad articular inexistente."> fiogf49gjkf0dFIGURA 9:HE. En otras áreas se encuentra extensa metaplasma sinovial de aspecto hiperplásico que remeda el recubrimiento de una cavidad articular inexistente.">
- fiogf49gjkf0d FIGURA 9:HE. En otras áreas se encuentra extensa metaplasma sinovial de aspecto hiperplásico que remeda el recubrimiento de una cavidad articular inexistente.
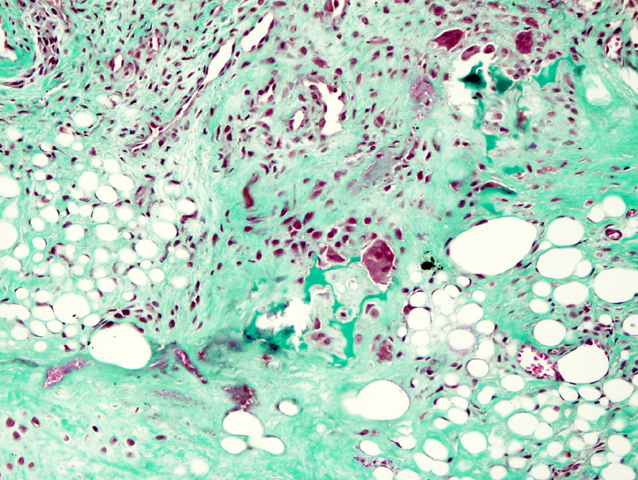 fiogf49gjkf0dFIGURA 10: Tricrómico de Masson en el que se observan aisladas células gigantes multinucleadas de tipo osteoclástico junto con focos de tejido adiposo maduro."> fiogf49gjkf0dFIGURA 10: Tricrómico de Masson en el que se observan aisladas células gigantes multinucleadas de tipo osteoclástico junto con focos de tejido adiposo maduro.">
- fiogf49gjkf0d FIGURA 10: Tricrómico de Masson en el que se observan aisladas células gigantes multinucleadas de tipo osteoclástico junto con focos de tejido adiposo maduro.
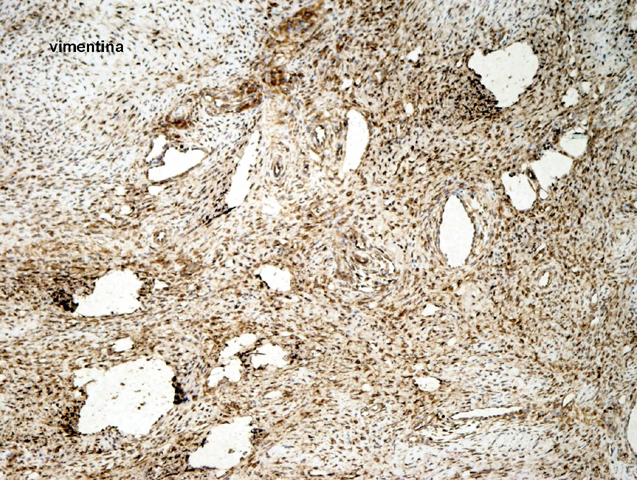 fiogf49gjkf0dFIGURA 11: Tinción IHQ para vimentina, positiva de forma difusa y homogénea."> fiogf49gjkf0dFIGURA 11: Tinción IHQ para vimentina, positiva de forma difusa y homogénea.">
- fiogf49gjkf0d FIGURA 11: Tinción IHQ para vimentina, positiva de forma difusa y homogénea.
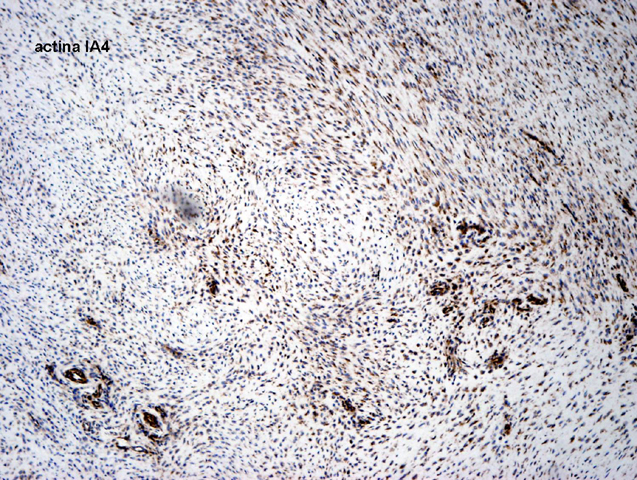 fiogf49gjkf0dFIGURA 12: Tinción IHQ para actina de músculo liso, positiva de forma difusa y homogénea."> fiogf49gjkf0dFIGURA 12: Tinción IHQ para actina de músculo liso, positiva de forma difusa y homogénea.">
- fiogf49gjkf0d FIGURA 12: Tinción IHQ para actina de músculo liso, positiva de forma difusa y homogénea.
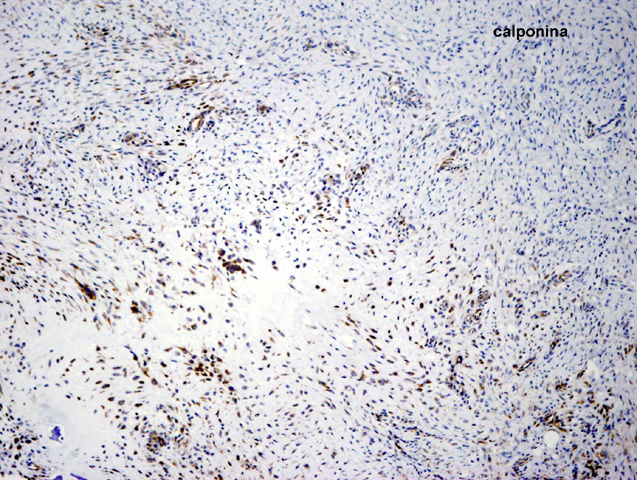 fiogf49gjkf0dFIGURA 13: Tinción IHQ para calponina con positividad focal y heterogénea."> fiogf49gjkf0dFIGURA 13: Tinción IHQ para calponina con positividad focal y heterogénea.">
- fiogf49gjkf0d FIGURA 13: Tinción IHQ para calponina con positividad focal y heterogénea.
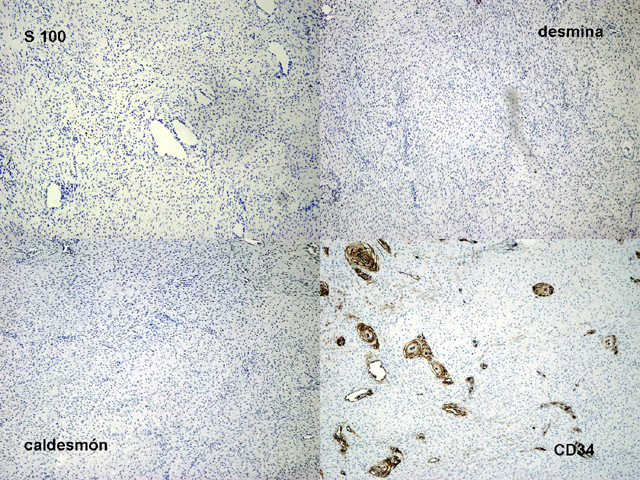 fiogf49gjkf0dFIGURA 14:Tinciones IHQ para S-100, desmina, caldesmón, y CD34, negativas en el componente fibromatoso. Se observa positividad para CD34 en el endotelio vascular."> fiogf49gjkf0dFIGURA 14:Tinciones IHQ para S-100, desmina, caldesmón, y CD34, negativas en el componente fibromatoso. Se observa positividad para CD34 en el endotelio vascular.">
- fiogf49gjkf0d FIGURA 14:Tinciones IHQ para S-100, desmina, caldesmón, y CD34, negativas en el componente fibromatoso. Se observa positividad para CD34 en el endotelio vascular.
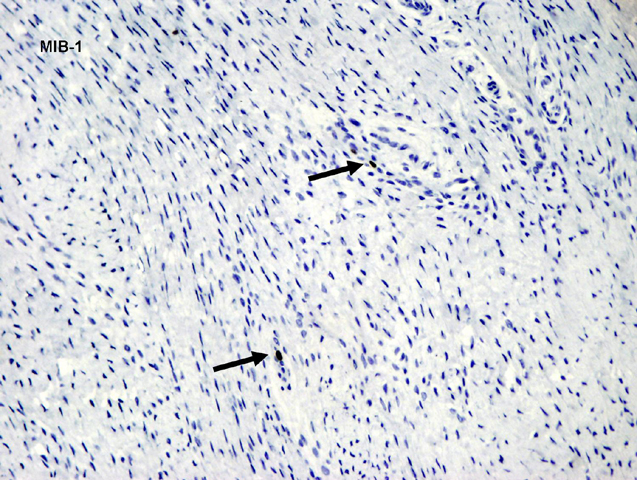 fiogf49gjkf0dFIGURA 15: Tinción IHQ con MIB-1 que muestra un índice proliferativo del 1% (flechas)."> fiogf49gjkf0dFIGURA 15: Tinción IHQ con MIB-1 que muestra un índice proliferativo del 1% (flechas).">
- fiogf49gjkf0d FIGURA 15: Tinción IHQ con MIB-1 que muestra un índice proliferativo del 1% (flechas).
|
|
|
DISCUSIÓN.
fiogf49gjkf0d A pesar de la baja incidencia de pseudoartrosis infantil (1, 3) de la tibia, la evidencia acumulada demuestra una clara asociación con neurofibromatosis de tipo 1 (3, 10, 11). Junto con otras anomalías musculoesqueléticas como la cifoescoliosis, supone un problema ortopédico importante (12, 13), como ocurre en el caso presentado.
Histológicamente el tejido que ocupa la pseudoartrosis es de naturaleza mesenquimal, con aspecto fibromatoso y focos de metaplasia condroide, ósea y sinovial. No es distinto al que aparece en otras pseudoartrosis, asociadas a neurofibromatosis o no (11). Estudios ultraestructurales previos han demostrado la naturaleza fibroblástica-miofibroblástica de la lesión (11, 14, 15).
Nuestro trabajo aporta evidencia suplementaria a dichas observaciones, demostrando el inmunofenotipo miofibroblástico del tejido proliferativo. Esta lesión podría interpretarse como un mesénquima inmaduro de inmunofenotipo miofibroblástico que muestra diferenciación hacia tejido sinovial, cartilaginoso, óseo y adiposo, pero que falla al reproducir la estructura anatómica previa. Desde nuestro punto de vista, se trata de una lesión displásica secundaria a un trastorno en la reparación normal de un hueso probablemente anómalo, más que de un proceso malformativo primario, por lo que no nos parece adecuado considerarlo un hamartoma, como han hecho otros autores (13). Aunque se ha descrito la existencia de neurofibromas (16-19) y schwannomas intraóseos y periósticos (20-25), ni en este caso, ni en los referidos en la literatura se han encontrado elementos neurofibromatosos en el lugar de la pseudoartrosis, ni con la microscopía convencional, ni con técnicas inmunohistoquímicas, ni ultraestructurales (1, 3, 8, 10, 11, 14).
El mecanismo de formación de la pseudoartrosis no está aclarado en la actualidad. En muchos casos, como en este, se observa arqueamiento anterolateral de los huesos de la pierna (1, 3, 11), aunque la pseudoartrosis es un defecto focal y localizado. En su etiopatogenia parecen estar implicados problemas estructurales de formación adecuada del hueso y otros de posterior organización del tejido de reparación (que conlleva formación de hueso a partir de un matriz condral neoformada). No está aclarado el modo en que la condición neurofibromatosa altera esta reparación normal. Sí se ha demostrado que las pseudoartrosis asociadas a neurofibromatosis tienen una peor respuesta al tratamiento que las no asociadas a este síndrome (11). Datos recientes procedentes de estudios in vitro, demuestran que la neurofibromina y su papel regulador de Ras, son importantes en la homeostasis de las células osteoprogenitoras (26). También se ha demostrado su presencia en el cartílago de crecimiento en las zonas donde cesa la proliferación y comienza la diferenciación de los condrocitos, así como en osteoblastos del periostio en ratones y ratas embrionarias y maduras (27).
En resumen, este caso es otro ejemplo más de la asociación de displasias musculoesqueléticas con un síndrome neurocutáneo como es la neurofibromatosis tipo 1. Si bien los tumores neurales que se desarrollan frecuentemente en estos pacientes condicionan su pronóstico vital, las repercusiones clínicas de las alteraciones esqueléticas suponen una importante merma funcional. Los más recientes avances en la biología de la osteogénesis y el papel que juega la neurofibromina en la misma parecen mostrar el posible sustrato de esta frecuente asociación.
|
|
|
Bibliografía
1. Hefti F, Bollini G, Dungl P, et al. Congenital pseudoarthrosis of the tibia: history, etiology, classification and epidemiologic data. J Pediatr Orthop B 2000; 9: 11-15.
2. Riccardi VM. Medical progress: Von Recklinghausen neurofibromatosis. N Eng J Med 1981; 305: 1617-1627.
3. Hisaoka H, Hashimoto H, Ohguri T et al. Congenital (infantile) pseudoarthrosis of the fibula associated with osteofibrous dysplasia. Skeletal Radiol. 2004 Sep; 33(9): 545-9. Epub 2004 Jul 16.
4. Martinez-Tello F, Manjón Luengo P, Martin Perez M et al. Skeletal Radiol. Epub 2005 Aug 11.
5. Gross ML, Soberman N, Dorfman HD, Seimon LP. Case report 556: Multiple non-ossifying fibroma of long bones in a patient with neurofibromatosis. Skeletal Radiol 1989; 18: 389-91.
6. Joseph KN, Bowen JR, MacEwen GD. Unusual orthopaedic manifestations of neurofibromatosis. Clin Orthop 1992; 278: 17-28.
7. Gupta SK, Tuli SM, Srivastava TP, et al. Skeletal overgrowth with modelling error in neurofibromatosis. Clin Radiol 1985; 36: 643-646.
8. Boyd HB. Pathology and natural history of congenital pseudoarthrosis of the tibia. Clin Orthop 1982; 166: 5- 13.
9. Rubenstein A. Neurofibromatosis: a review of the clinical problem. In : Rubenstein A, Bunge R, Housman D, eds. Neurofibromatosis. Ann NY Acad Sci 1986; 486: 1- 13.
10. Ippolito E, Corsi A, Grill F et al. Pathology of Bone Lesions associated with congenital pseudoarthrosis of the leg. J Pediatr Orthop 3. 2000 Jan; 9(1): 3-10.
11. Brown GA, Osebold WR, Ponseti IV. Congenital pseudoarthrosis of the long bones: a clinical, radiographic, histologic and ultrastructural study. Clin Orthop Relat Res 1977, Oct;(128): 228-242.
12. Vitale MG, Guha A, Skuggs DL. Orthopaedic manifestations of neurofibromatosis in children: an update. Clin Orthop Relat Res 2002 Aug; (401): 107-18.
13. Mariaud- Schmidt RP, Rosales- Quintana S, Bitar E, et al. Hamartoma involving the pseudoarthrosis site in patients with neurofibromatosis type 1. Pediatr DeV Pathol 2005 Feb 23.
14. Blauth M, Harms D, Schmidt D, Blauth W. Light and electron microscopic studies in congenital pseudoarthrosis. Arch Orthop Trauma Surg 1984; 103: 269-77.
15. Briner J, Yunis E. Ultrastructure of congenital pseudoarthrosis of the tibia. Arch Pathol 1973; 95: 97-9.
16. Green WT, Rudo N: pseudoarthrosis and neurofibromatosis. Arch Surg 1943; 46: 639.
17. Berk L, Mankin HJ. Spontaneous pseudoarthrosis of the tibia occurring in a patient with neurofibromatosis. J Bone Joint Surg 1964; 46-A: 619.
18. Jacobs JE, Kimmelstiel P, Thompson KR Jr. Neurofibromatosis and pseudoarthrosis. Arch Surg 1949; 59: 232. 19. Sane S, Yunis E, Greer R. Subperiosteal or cortical cyst and intramedullary neurofibromatosis. J Bone Joint Surg 1971; 53-A: 1194.
20. DeSanto DA, Burgess E. Primary and secondary neurilemmoma of bone. Surg Giynecol Obstet. 1940; 71: 454.
21. Friedman M. Intraosseous schwannoma. Oral Surg 1964; 18: 90.
22. Gordon EJ. Solitary intraosseous neurilemmoma of the tibia. Clin Orthop 1976; 117: 271.
23. Hant MS, Basom WC. Neurilemmoma involving bone. J Bone Joint Surg 1958; 40-A: 465.
24. Jacobs RL, Fox TA. Neurilemmoma of bone. Clin Orthop 1972; 87: 248.
25. Samter TG, Vellios F, Shafer WG. Neurilemmoma of bone. Radiology 1960; 75: 215.
26. Yu X, Chen S, Potter OL, et al. Neurofibromin and its inactivation of Ras are prerequisites fos osteoblast functioning. Bone 2005; 36: 793-802.
27. Kuprilehto T, Nissinen Mn Koivunen J, et al. NF1 tumor suppressor protein and mRNA in skeletal tissues of developing and adult normal mouse and NF1 deficient embryos. J Bone Minerv Res 2004; 19: 983-9.
|
|
|
Comentarios
|
|
|
|
|


