

|
ALTERACIONES HEPÁTICAS EN UN NUEVO MODELO EXPERIMENTAL DE HIPERTENSIÓN PORTAL CRÓNICA EN LA RATA MARÍA TERESA CORCUERA PINDADO*, MARTA MÉNDEZ LÓPEZ**, MAGDALENA MÉNDEZ**, MARÍA JOSÉ ALONSO MARTÍN*, MARÍA ANGELES ALLER***, FERNANDO GÓMEZ AGUADO*, MARÍA PAZ NAVA****, FERNANDO SÁNCHEZ PATÁN***, LAUDINO LÓPEZ**, ISABEL CASADO FARIÑAS*****, JORGE LUIS ARIAS**, JAIME ARIAS*** |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
INTRODUCCIÓN
Dos métodos experimentales de hipertensión portal crónica en la rata frecuentemente utilizados son la ligadura estenosante portal (LEP) y la administración oral de tioacetamida. Con el objeto de obtener un nuevo modelo experimental, se han asociado ambos métodos y se ha realizado el estudio anatomopatológico hepático del modelo resultante.
MATERIAL Y MÉTODOS
Ratas macho Wistar (n = 40) se dividieron en cuatro grupos para su estudio: I (control), II (triple ligadura estenosante de la vena porta, LEP), III (tioacetamida), IV (LEP y tioacetamida).
Los animales se sacrificaron tras tres meses de evolución. Se extrajo el hígado y se procedió a su estudio microscópico.
Los hallazgos histopatológicos se evaluaron de acuerdo con el índice de actividad histológica de Knodell y se valoró además proliferación vascular, apoptosis, y colangitis.
RESULTADOS
Los animales de los grupos I y II no presentaron alteraciones morfológicas hepáticas.
Los grupos III y IV mostraron alteraciones compatibles con hepatitis crónica y cirrosis con diferencia estadísticamente significativa respecto a los grupos I y II.
En el grupo III se observó proliferación ductular en el 50% de los animales y colangitis en el 30%. En el grupo IV (LEP + tioacetamida) disminuyó el porcentaje de proliferación ductular y de colangitis, respecto del grupo III. Asimismo en esta misma serie el número de células en apoptosis fue significativamente (p<0,05) menor respecto del grupo III.
DISCUSIÓN
En ratas con tioacetamida y LEP se evidencia cirrosis, aunque la existencia de circulación colateral portosistémica en las mismas reduce el efecto hepatotóxico de la tioacetamida. Por lo tanto la asociación de cirrosis y circulación colateral en este nuevo modelo experimental lo asemeja a las características propias de la insuficiencia hepática crónica en el ser humano.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Para estudiar la hipertensión portal crónica en rata se han utilizado dos tipos de modelos experimentales: unos inducen cirrosis mediante la administración de sustancias hepatotóxicas, como el tetracloruro de carbono o la tioacetamida (1,2); otros inducen hipertensión portal prehepática mediante técnicas quirúrgicas, como la ligadura de la vena porta (3,4,5). Estos últimos, además, originan un alto grado de circulación colateral portosistémica. Dado que en clínica humana la cirrosis se asocia frecuentemente con circulación colateral, un modelo experimental en rata que combine cirrosis con ligadura de la vena porta puede ser de gran utilidad para estudiar los mecanismos fisiopatológicos que tienen lugar en pacientes cirróticos. Con este objetivo, se diseñó un estudio experimental en el que se indujo cirrosis mediante la administración oral de tioacetamida e hipertensión portal prehepática mediante triple ligadura estenosante de la vena porta. En el presente trabajo nos centraremos en la descripción de las alteraciones histopatológicas observadas en el tejido hepático de las ratas sometidas a este tratamiento.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Diseño experimental: Se utilizaron 40 ratas macho Wistar de 242 a 250 g de peso corporal, divididas en cuatro grupos: Grupo I (control): animales sin intervención quirúrgica ni administración de tioacetamida. Grupo II (LEP): animales a los que se practicó una triple ligadura estenosante de la vena porta (LEP), según técnica descrita previamente (3,4). Grupo III (TAA): animales a los que se les suministró tioacetamida en el agua de bebida, siguiendo el protocolo descrito por Lee et al. (2) Grupo IV (LEP + TAA): animales a los que se practicó una triple ligadura estenosante de la vena porta y a los doce días de evolución postoperatoria se les suministró tioacetamida en el agua de bebida siguiendo el mismo protocolo que en el grupo III. Todos los animales se pesaron y se sacrificaron a los tres meses de evolución mediante sobredosis de éter. A continuación se disecó y se pesó el hígado. Estudio histopatológico: Se tomaron muestras del lóbulo medio hepático y se procesaron de forma rutinaria mediante fijación en formol e inclusión en parafina. Secciones de 5 µm se tiñeron con Hematoxilina-eosina y Tricrómico de Masson para su estudio microscópico. Se utilizó el índice de actividad histológica de Knodell (IAH) para evaluar necrosis, inflamación y fibrosis (6,7). Se valoraron también otros parámetros, como proliferación ductular, apoptosis y colangitis. Análisis estadístico:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Ningún animal falleció en el periodo experimental. Todos los animales incrementaron su peso corporal, siendo este incremento mayor en el grupo control respecto al resto. En la tabla I se muestran los incrementos de peso corporal y los pesos hepáticos. Tabla I. Incrementos de peso corporal (IPC) y pesos hepáticos (PH) en los distintos grupos de animales estudiados.* Diferencia estadísticamente significativa respecto del grupo I; ** diferencias estadísticamente significativas respecto de los grupos I y II; *** diferencias estadísticamente significativas respecto de los grupos I, II y III.
El estudio macroscópico de los hígados mostró una superficie micro-macronodular en la mayoría (80%) de los hígados de los animales del grupo III, no observándose alteraciones similares en el resto de los grupos. El estudio microscópico mostró que los animales de los grupos I y II no presentaron alteraciones morfológicas significativas, siendo en todos los casos el IAH de cero. Los hallazgos histológicos de los grupos III y IV (Figura 1 y Figura 2)se resumen en la Tabla II. Ambos grupos presentaron diferencia estadísticamente significativa en el IAH y en el estadío de hepatitis crónica respecto de los grupo I y II (p < 10-3). Sin embargo no se halló diferencia significativa entre los grupos III y IV.Tabla II. Resumen de los hallazgos histopatológicos observados en los hígados de los grupos III y IV. IAH: índice de actividad histológica de Knodell (0-18). HC: hepatitis crónica (1 – expansión fibrosa portal; 3 – fibrosis en puentes; 4 – cirrosis). PD: proliferación ductular.
En el grupo III se observó proliferación ductular en el 50% de los animales (diferencia estadísticamente significativa con el grupo IV) y colangitis en el 30%. Estas alteraciones no se observaron en ningún animal del grupo IV. Se evidenció mayor número de células apoptóticas en el grupo III respecto del IV (diferencia estadísticamente significativa).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Un modelo experimental ideal de hipertensión portal crónica en rata debería reproducir las alteraciones características de la clínica humana, con progresión discreta y gradual de los cambios patológicos, baja mortalidad y alta reproductibilidad. El modelo propuesto, que combina la ligadura de la vena porta con la administración oral de tioacetamida, cumple estos criterios. Así, la estenosis parcial de la vena porta produce vasculopatía venosa mesentérica y circulación colateral extrahepática portosistémica, mientras que la tioacetamida produce hipertensión portal y cirrosis, aunque su efecto hepatotóxico se reduce, probablemente por la existencia de circulación colateral. Dado que estas alteraciones coexisten en el paciente cirrótico, este nuevo modelo experimental puede ser útil para estudiar los mecanismos fisiopatológicos involucrados en esta patología.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
1 - Dashti H, Jeppsson B, Hägerstrand I, Hultberg B, Srinivas U, Abdulla M, Bengmark S. Thioacetamide-and carbon tetrachloride-induced liver cirrhosis. Eur Surg Res 1989; 21: 83-91. 2 - Lee X, Benjamin IS, Alexander B. Reproducible production of thioacetamide-induced macronodular cirrhosis in the rat with no mortality. J Heaptol 2002; 36: 488-493. 3 - Aller MA, Nava MP, Dieguez B, Palma MP, Arias JL, Arias J. Hipertensión portal prehepática crónica en la rata por triple ligadura estenosante portal. Cir Esp 2001;69:103-107 4 - Dieguez B, Aller MA, Nava MP, Arias JL, Lopez L, Arias J. Chronic portal hypertension in the rat by triple-portal stenosing ligation. J Inves Surg 2002; 15: 329-336. 5 - Halvorsen JF, Myking AO. Prehepatic portal hypertension in the rat. Immediate and long-term effects on portal vein and aortic pressure of a graded portal vein stenosis, followed by occlusion of the portal vein and splenorenal collaterals. Eur . Surg. Res 1979; 11:89-98 6 - Knodell RG, Ishak KG, Black WC, Chen TS, Graig R, Kaplowitz N et al. Formulation and application of a numerical scoring system for assessing histological activity in asymtomatic chronic active hepatitis. Hepatology 1981; 1431-435. 7 - Desmet VJ, Gerber M, Hoofnagle JH, Manns M, Schever PJ. Classification of chronic hepatitis: diagnosis, grading and staging. Hepatology 1994; 19: 1513-1519.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
- Rosa María Coro Antich (02/10/2005 21:07:11)
- Juliana Fariña (10/11/2005 22:16:30)
- Juliana Fariña (11/11/2005 0:04:36)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 14:10:50
.jpg) fiogf49gjkf0dImagen microscópica del hígado de una rata del grupo III (TAA) con arquitectura alterada a expensas de formación de nodulos de distintos tamaños rodeados por puentes fibrosos con infiltrado inflamatorio linfocitario e imágenes focales de necrosis "peace-meal". (Hematoxilina-eosina, 10x)">
fiogf49gjkf0dImagen microscópica del hígado de una rata del grupo III (TAA) con arquitectura alterada a expensas de formación de nodulos de distintos tamaños rodeados por puentes fibrosos con infiltrado inflamatorio linfocitario e imágenes focales de necrosis "peace-meal". (Hematoxilina-eosina, 10x)">
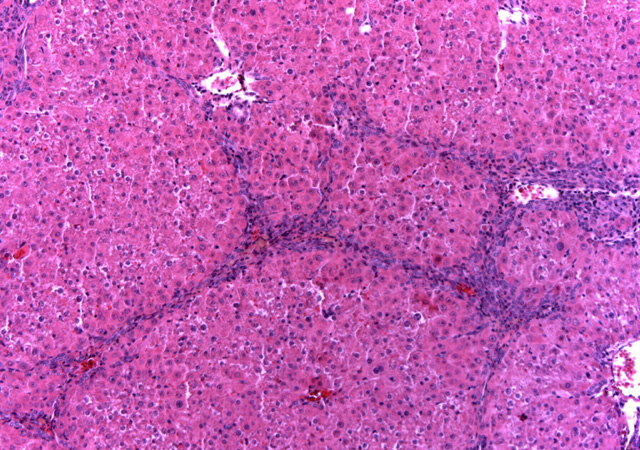 fiogf49gjkf0dImagen microscópica del hígado de una rata del grupo IV (LEP + TAA) con alteración parcial de la arquitectura a expensas de formación de puentes portoportales y portocentrales que ocasionalmente rodean algún nódulo. (Hematoxilina-eosina, 10x).">
fiogf49gjkf0dImagen microscópica del hígado de una rata del grupo IV (LEP + TAA) con alteración parcial de la arquitectura a expensas de formación de puentes portoportales y portocentrales que ocasionalmente rodean algún nódulo. (Hematoxilina-eosina, 10x).">