

|
Transporte transdérmico por electroporación: Estudio morfológico. Antonio Fructuoso*, Miguel Alcaraz Baños**, Vicente Vicente Ortega*, Maria Jose Yañez Gascón*, Nuria Alvarez* |
|
|
La electroporación por ondas electromagnéticas (OEM) de corrientes eléctricas de alto voltaje y pulsos cortos produce electropermeabilidad de la membrana celular, (“poros” reversibles y transitorios) facilitando el paso de sustancias. Estudiamos el paso de macromoléculas (tinta china negra) a través de la piel por microscopia óptica y electrónica. Material y Métodos Utilizamos 12 cobayas: A seis de ellos les administramos 4 ml de suspensión del colorante al 5% en liposomas. Simultáneamente aplicamos OEM de TDES® veinte minutos. A cinco, administramos el colorante sin aplicación de OEM y a uno se aplicó OEM sin colorante. Realizamos biopsias cutáneas, en zonas tratadas y control, al final de la sesión, a 24, 72, 96 horas y al mes. En el análisis de imagen valoramos los espacios intercelulares y los diámetros de las partículas colorantes en el Servicio de Análisis de imagen (Universidad de Murcia). Resultados y discusión: Inmediatamente al finalizar el tratamiento destacaban los depósitos de pigmento negro sobre el estrato córneo, en epidermis y folículos pilosos, mientras que en las biopsias posteriores se observó también en la dermis (macrófagos, alrededor de los vasos y fibras de colágena). Ultraestructuralmente observamos las partículas de tinta china en las células epiteliales y en los canales intercelulares en folículo piloso. Destacando en los folículos pilosos aberturas de los espacios intercelulares ( canales o “poros”) cuyos diámetros oscilaban entre 3,10 y 0,84 µm así como las partículas de tinta china ( En las muestras con tinta y sin exposición electromagnética observamos las partículas exclusivamente en las capas superficiales del estrato córneo , mientras que en las que solo se aplicaron OEM no observamos partículas de tinta. En ninguna biopsia observamos alteraciones tisulares ni ultraestructurales. Conclusión: El método de electroporación por OEM (TDES®) ha demostrado el transporte transdérmico de tinta china mediante la abertura de “poros” o canales intercelulares, y puede constituir una alternativa no invasiva de administración de macromoléculas.
|
||
|
|
La vía transdérmica constituye una alternativa a las vías tradicionales (oral, intramuscular y parenteral) de administración de principios activos y medicamentos. La electroporación induce un incremento en el transporte transmembrana celular (1) a través de pulsos de alto voltaje, que ha permitido ensayar la administración a través de la piel de distintas drogas en diversas patologías: inflamatorias (2 3) dolorosas (4) y en la quimioterapia del cáncer (5), tanto en neoplasias humanas (6 7 8 9) como en animales (10). Sin embargo, no hemos encontrado estudios sobre las características morfológicas del transporte transdérmico por este método. En este trabajo hemos estudiado morfológicamente el paso de sustancias macromoleculares ( tinta china y otros colorantes) a través de la piel, mediante el estudio sistematizado de biopsias periódicas de las zonas cutáneas tras la (tinta china negra y verde marcadora, hematoxilina, eosina y azul tripán) junto con las ondas electromagnéticas del electroporador TDES®-Dercont Dell®, con el fin de conocer las posibles vías o “poros” de penetración en la piel.
|
|
|
|
Hemos utilizado doce cobayas del Servicio de Animales de Laboratorio (nº REGAES 300305440012) que fueron sedados con 0,3 ml/ i.m. de clorhidrato de ketamina (Merial S.A., Lyon, Francia). A dos animales le administramos, mediante goteo, 5 ml de la suspensión de tinta china negra (Royal Talem, Holanda) al 5% en liposomas de lecitina de soja. Simultáneamente deslizamos el cabezal emisor de ondas electromagnéticas de alta frecuencia del equipo TDES® (Dercont Dell®,Murcia, España) durante veinte minutos. A otros cuatro les administramos, de igual forma, 4 ml de cada uno de los otros cuatro colorantes al 5% en liposomas de lecitina de soja: tinta marcadora indeleble verde (Thermo-Shando, Pacisa Girona, Barcelona, Spain); hematoxilina de Harris, eosina (Sigma Co, Madrid, Spain) y azul tripán (Merck, Germany). Los seis animales restantes fueron utilizados como controles: a cinco les administramos los colorantes de modo similar a los grupos anteriores tratados, aunque sin la aplicación de las ondas electromagnéticas, deslizando al mismo tiempo el cabezal emisor del equipo TDES® desconectado de la red eléctrica. Al animal restante le administramos 5 ml de lecitina de soja pero sin los colorantes y le aplicamos las ondas electromagnéticas deslizando el cabezal del equipo TDES® durante veinte minutos. Estudiomorfológico - ultraestructural: Realizamos biopsias punch de 8mm, a las zonas cutáneas tratadas y controles inmediatamente después de terminar la sesión, a las 24, 96 horas y al mes, que fueron fijadas en formol neutro tamponado al 10% y procesadas por el método habitual para su inclusión en parafina. Realizamos secciones de 4 μm que fueron teñidas con hematoxilina-eosina y con la técnica argéntica de Masson-Fontana. A las secciones histológicas correspondientes a las zonas cutáneas tratadas exclusivamente con Hematoxilina, se les realizó la técnica de tinción de H.E. sin pasar las muestras por hematoxilina y tiñendolas exclusivamente con eosina y al contrario a las muestras a las que se administró eosina. En las muestras tratadas con azul tripán se realizaron las secciones histológicas por congelación sin procesado previo en parafina, mediante criostato (Microm HM500, Walldorf, Germany). Para el estudio microscópico electrónico de transmisión, muestras cutáneas representativas de 1mm3 fueron fijadas en formaldehído/glutaraldehido (Karnovsky, 1965), postfijadas con tetróxido de osmio al 1%, teñidas con acetato de uranilo al 1.5%, deshidratadas con alcoholes a concentraciones crecientes e impregnadas con resinas epoxy. Las secciones ultrafinas fueron estudiadas y fotografiadas en un microscopio electrónico ZEISS EM10C.
|
|
|
|
1º En las biopsias realizadas inmediatamente tras el tratamiento destacaba al microscopio óptico la presencia de depósitos de partículas de pigmento negro brillante o verde según la tinta administrada que se disponían en acúmulos pequeños y múltiples, localizándose en el estrato córneo, en la epidermis y en los poros foliculares. No se observó pigmento en la dermis (Figura 1 y Figura 2).
El estudio al microscopio electrónico confirmó la presencia del pigmento de las tintas en el estrato córneo y espinoso, como pequeños acúmulos de partículas geométricas de contornos angulares, que destacaban de los gránulos de queratohialina por presentar mayor electrodensidad y una forma más redondeada u ovoide (Figura 3 y Figura 4).
2º El estudio al microscopio óptico de las biopsias, realizadas a las 24, 48, 96 horas y al mes de la administración de la tinta; demostró la presencia de partículas de tinta en las localizaciones anteriores (estrato córneo y queratinocitos epidérmicos) y en los queratinocitos de las porciones intradérmicas y en el citoplasma de los macrófagos, preferentemente alrededor de los vasos sanguíneos y entre los haces de fibras colágenas y músculos (Figura 5 y Figura 6).
El estudio al microscopio electrónico demostró la presencia de dichas partículas de en el citoplasma de los queratinocitos. Las múltiples secciones semifinas seriadas (Figura 7) y las ultrafinas permitieron visualizar las distintas fases del transporte de las partículas de tinta china desde los queratinocitos foliculares hasta la dermis. En algunas zonas visualizamos la apertura de canales o “poros” por separación total de las estructuras desmosómicas entre las dos células adyacentes, cuyos diámetros máximos oscilaban entre 0,84 µm-3,10 µm (media de 2,01 µm± 0,58), permitiendo así el paso directo de las partículas a la dermis (Figura 8). En otras zonas observamos la apertura parcial de dichos espacios intercelulares que afectaba a la porción interna de la unión entre células adyacentes, (Figura 9) y en las secciones ultrafinas siguientes, dicha separación intercelular llevaba a la formación de “poros” o espacios en la porción central de la unión de las células vecinas (Figura 10 y Figura 11). En otras secciones el “poro” se visualizaba en las porciones externas de la unión intercelular, comunicando con la dermis adyacente (Figura 12). Asimismo observamos la formación de varios espacios intercelulares intercomunicados entre sí, que comunicaban la zona de la médula del folículo piloso con la dermis adyacente, conteniendo a su vez varias partículas de pigmento de distintos tamaños, cuyos tamaños de estas partículas observadas en los espacios intercelulares oscilaban entre 0,047 y 3,097 µm, y una media de 0,276 µm (Figura 13).
También observamos partículas tanto en la dermis papilar como en la reticular, localizadas entre los haces de fibras colágenas (Figura 14), en la proximidad de las glándulas sebáceas, músculos y vasos sanguíneos, así como en el interior de los citoplasmas de los macrófagos (Figura 15). Éstas eran básicamente de configuración poligonal con bordes afilados y sus diámetros oscilaban entre 0,28 µm y 1,60 µm con un valor medio de 0,82 µm.
Las zonas cutáneas controles en las que administramos exclusivamente la suspensión de tinta china, sin que aplicáramos las ondas electromagnéticas, mostraban tanto al microscopio óptico como electrónico partículas de pigmento similares a las descritas anteriormente, pero localizadas exclusivamente en el estrato córneo; mientras que en los animales a los que únicamente administramos las ondas sin aplicar tinta china no presentaban partículas de pigmento en ninguna de las localizaciones anteriores (Figura 16).
Era de destacar que en ninguna de las muestras cutáneas tratadas y en las que aplicamos los colorantes, observamos alteraciones tisulares microscópicas ni ultraestructurales, características de la injuria celular (necrosis, tumefacción, vacuolización celular, nuclear o de los orgánulos, alteraciones de las membranas, ni de las mitocondrias etc.), tanto en el epitelio como en los anejos cutáneos ni en la dermis.
Las secciones histológicas de las áreas cutáneas a las que se aplicó la hematoxilina de Harris y las ondas electromagnéticas fueron teñidas posteriormente únicamente con eosina. Sin embargo, mostraban las características tintoriales típicas de la habitual tinción de Hematoxilina-Eosina,( Figura 17) es decir, el estrato córneo, los citoplasmas celulares, las fibras colágenas, elásticas y sustancia intercelular de color rosa, y los núcleos de color azul-violeta; imágenes similares mostraban las tratadas con Eosina y sólo teñidas con Hematoxilina (Figura 18). Las muestras que no fueron teñidas con ninguno de los colorantes, mostraban sólo tinción de los núcleos en las zonas correspondientes a las que se aplicó la Hematoxilina o bien se teñían únicamente de color rosa las restantes estructuras (Figura 19), sin que se tiñesen los núcleos en las que se administró la Eosina.
A las biopsias correspondientes al tratamiento con azul tripán y las ondas electromagnéticas, las secciones, histológicas mediante criostato, fueron estudiadas al M.O. sin realizar tinción, aunque se colorearon de azul oscuro (Figura 20).
|
|
|
|
La electroporación, es un método físico desarrollado durante las últimas decadas (10), que utiliza pulsos cortos de alto voltaje con el fin de hacer permeable la membrana celular a los iones (11), anticuerpos, RNA (12) y DNA, drogas, etc. y se utilizó para la transferencia de genes a células de ratón (13). En la década de los noventa se realizaron los primeros estudios clínicos sobre el uso de la electroporación en la quimioterapia de tumores y posteriormente se desarrollaron (14 15 16 17), etc.
El paso de las sustancias se ha relacionado con la formación de poros en la membrana celular tras la aplicación de los pulsos eléctricos (18 19) a nivel de la capa lipídica de la membrana celular e incluso a través del estrato córneo (20). Otros estudios han mostrado la evidencia indirecta de que pulsos de alto voltaje causan cambios en la estructura de la piel (21) y posiblemente llevan a la formación de caminos acuosos durante la aplicación del pulso eléctrico. Sin embargo, el mecanismo íntimo de tales fenómenos no está claramente demostrado, ya que los “poros” no han sido evidenciados con ninguna técnica microscópica, posiblemente debido a su pequeño tamaño y a su carácter transitorio y reversible (22). El mecanismo del paso de sustancias a través de la piel ha sido explicado por dos rutas; transcelular e intercelular, ( a través de la epidermis como por vía transfolicular 23), y relacionados con los distintos tipos de pulsos utilizados (24 25), de modo que con la aplicación de pulsos cortos de alto voltaje el transporte se realizaría fundamentalmente por vía transcelular; mientras que cuando se disminuye el voltaje o se aumenta la duración del pulso el transporte ocurre preferentemente por la vía intercelular o transfolicular (26 27). Sin embargo, en nuestro trabajo, utilizando exclusivamente OEM de pulsos cortos de alto voltaje observamos los dos mecanismos descritos de transporte, transcelular e intercelular, ya que en nuestro estudio morfológico-ultraestructural sistematizado observamos la presencia de partículas de tinta china tanto en el estrato córneo y en todas las capas de la epidermis y en la dermis papilar, lo que indica el paso transcelular hasta la dermis, pero también observamos dicho paso de forma detallada a través de los espacios intercelulares de los queratinocitos adyacentes en los folículos pilosos y la llegada de las partículas de tinta china a la dermis, sin precisar la utilización de sustancias queratolíticas como la urea o tiosulfato sódico, como han descrito previamente 28) para poder atravesar el estrato córneo mediante la creación de microconductos en la matriz queratínica que facilitaría la electroporación de los corneocitos y hacer pasar las sustancias a través del estrato córneo.
En los controles, donde aplicamos la tinta china sin la utilización de las ondas electromagnéticas, únicamente observábamos pequeños depósitos de pigmento, exclusivamente localizados en la capa más superficial del estrato córneo, pero nunca en las zonas epidérmicas profundas ni en la dermis.
Por otra parte, la aplicación de las ondas del equipo TDES® - Dercont Dell® no originó en nuestro modelo experimental alteraciones morfológicas (macroscópicas, microscópicas, ni ultraestructurales), en las muestras cutáneas de las zonas tratadas, ni tampoco en los controles a los que aplicamos exclusivamente las ondas electromagnéticas, observando además que el estrato córneo mantenía su típico aspecto normal en hojaldre. Por otra parte, también se ha demostrado la idoneidad del cobaya como modelo animal para este tipo de estudios, como había confirmado anteriormente (29).
|
|
|
|
En nuestro estudio ha demostrado la eficacia del método de electroporación por ondas electromagnéticas con el equipo TDES® - Dercont Dell® en la administración de sustancias a través de la vía cutánea y transfolicular, que puede constituir mediante la apertura de “poros “ o canales intercelulares una alternativa no invasiva de administración de macromoléculas sin originar alteraciones tisulares ni celulares.
|
|
|
|
A D. Victor Bolarín Lucas técnico de laboratorio del departamento de anatomía patológica de la facultad de Médicina de la Universidad de Murcia, a la Dra. Mª T. Castell del servicio de analisis de Imagen. Este trabajo ha sido financiado con el Proyecto de Investigación y Desarrollo (I + D) del Plan de Ciencia y Tecnología 2003-2006 de la Comunidad Autónoma de Murcia - España
Proyecto Nº 2104SU012
|
|
|
|
1 - Prausnitz MR, Bose VG, Langer R, Weaver JC. Electroporation of mammalian skin: a mechanism to enhance transdermal drug delivery. Proc Natl Acad Sci U S A 1993; 90(22):10504-10508. 2 - Panchagnula, R. Transdermal delivery of drugs. Ind J Pharmacol1997; 29: 140-156. 3 - Badkar AV, Betagen GV, Hofmann GA, Banga AK. Enhancement of transdermal iontophoretic delivery of a liposomal formulation of colchicines by electroporation. Drug Deliv 1999; 6: 111-115. 4 - Lan CY, Tan PH, Cheng JT, Lu HF, Lin MW, Hsiao PN et al. Immunoneutralization of c-Fos using intrathecal antibody electroporation attenuates chronic constrictive injury-induced hyperalgesia and regulates prepodynorphin expression in rats. Anesthesiology 2003; 99 (4):938-946. 5 - Dev SB. Electrochemotherapy for. Cancer Wt1996;5(2): 23-24. 6 - Glass LF, Pepine ML, Fenske Na Jaroszeski MJ, and Reintger DS. Bleomycin-mediated electrchemotherapy of metastatic melanoma. Arch Dermatol 1996; 132 (11): 1352-1357. 7 - Heller R, Jaroszeski MJ, Glass LF, Messina JL, Rapaport DP, DeConti RC et al. Phase I /II trial for the treatment of cutaneous and subcutaneous tumors using electrochemotherapy. Cancer 1996; 77(5):964-971. 8 - Hyacinthe M, Jaroszeski MJ, Dang VV, Coppola D, Karl RC, Gilbert RA et al. Electrically enhanced drug delivery for the treatment of soft tissue sarcoma. Cancer 1999 15; 85(2):409-417. 9 - Jaroszeski MJ, Dang V, Pottinger C, Hickey J, Gilbert R, Heller R. Toxicity of anticancer agents mediated by electroporation in vitro. Anticancer Drugs 2000; 11(3):201-208. 10 - Tsong TY. Electroporation of cell membranes. Biophys J 1991; 60(2):297-306. 11 - Mir LM, Banoun H, Paoletti C. Introduction of definite amounts of nonpermeant molecules into living cells after electropermeabilization: direct access to the cytosol. Exp Cell Res 1988; 175(1):15-25. 12 - Teruel MN, Blanpied TA, Shen K, Augustine GJ, Meyer T. A versatile microporation technique for the transfection of cultured CNS neurons. Neurosci Methods 1999; 93(1):37-48. 13 - Neumann E, Schaefer-Ridder M, Wang Y, Hofschneider PH. Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO J 1982; 1(7):841-5. 14 - Belehradek J Jr, Orlowski S, Poddevin B, Paoletti C, Mir LM. Electrochemotherapy of spontaneous mammary tumours in mice. Eur J Cancer 1991; 27(1):73-6. 15 - Mir LM, Glass LF, Sersa G, Teissie J, Domenge C, Miklavcic D et al. Effective treatment of cutaneous and subcutaneous malignant tumours by electrochemotherapy. Br J Cancer. 1998; 77(12):2336-42 16 - Gehl J, Geertsen PF. Efficient palliation of haemorrhaging malignant melanoma skin metastases by electrochemotherapy. Melanoma Res 2000; 10(6):585-9. 17 - Sersa G, Stabuc B, Cemazar M, Miklavcic D, Rudolf Z. Electrochemotherapy with cisplatin: the systemic antitumour effectiveness of cisplatin can be potentiated locally by the application of electric pulses in the treatment of malignant melanoma skin metastases. Melanoma Res 2000; 10(4):381-5. 18 - Treco DA, Selden RF. Non-viral gene therapy. Mol Med Today 1995; 1(7):314-21. 19 - Weaver JC. Electroporation theory: concepts and mechanisms. In: Nickoloff JA, ed. Molecular Biology: Methods. Totowa: Human Press; 1995: 3-28. 20 - Prausnitz MR, Gimm JA, Guy RH, Langer R, Weaver JC, Cullander C. Imaging regions of transport across human stratum corneum during high-voltage and low-voltage exposures. J Pharm Sci 1996b ; 85(12):1363-70. 21 - Edwards D.A. Prausnitz M.R. Langer R., Weaver J.C. Analysis of enhanced transdermal transport by skin electroporation. J Control Release 1995; 34: 211-221. 22 - Banga AK, Bose S, Ghosh TK. Iontophoresis and electroporation: comparisons and contrasts. Int J Pharm 1999 ; 179(1):1-19 23 - Banga AK, Prausnitz MR. Assessing the potential of skin electroporation for the delivery of protein- and gene-based drugs. Trends Biotechnol 1998; 16(10):408-12. 24 - Prausnitz MR, Gimm JA, Langer R, Weaver JC, Cullander C. Imaging Regions of transport across human stratum corneum during high-voltage exposures. J Pharm Sci 1996b;85(12):1363-70 25 - Pliquett UF, Zewert TE, Chen T, Langer R, Weaver JC. Imaging of fluorescent molecule and small ion transport through human stratum corneum during high voltage pulsing: localized transport regions are involved. Biophys Chem 1996; 58(1-2):185-204. 26 - Pliquett UF, Vanbever R, Preat V, Weaver JC. Local transport regions in human stratum corneum due to short and long high- voltage pulses. Bioelectrochem Bioenerg 1998; 47: 151-161. 27 - Vanbever R, Preat V. In vivo efficacy and safety of skin electroporation. Adv Drug Deliv Rev 1999 Jan 4; 35(1):77-88 28 - Ilic L, Gowrishankar TR, Vaughan TE, Herndon TO, Weaver JC. Spatially constrained skin electroporation with sodium thiosulfate and urea creates transdermal microconduits J Control Release 1999; 61(1-2):185-202. 29 - Panchangula R. Transdermal delivery of drugs. Ind J Pharm 1997;29:140-156.
|
|
|
|
- Emilio Mayayo Artal (06/10/2005 19:34:24)
- Manuel Diaz-Marta Puentes (17/01/2012 0:04:06)
- Manuel Diaz-Marta Puentes (17/01/2012 0:04:06)
- Manuel Diaz-Marta Puentes (17/01/2012 0:04:07)
- Manuel Diaz-Marta Puentes (22/01/2012 12:31:12)
- Manuel Diaz-Marta Puentes (22/01/2012 12:31:12)
- Manuel Diaz-Marta Puentes (22/01/2012 12:31:12)
|
|
|
|
|
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 14:10:50
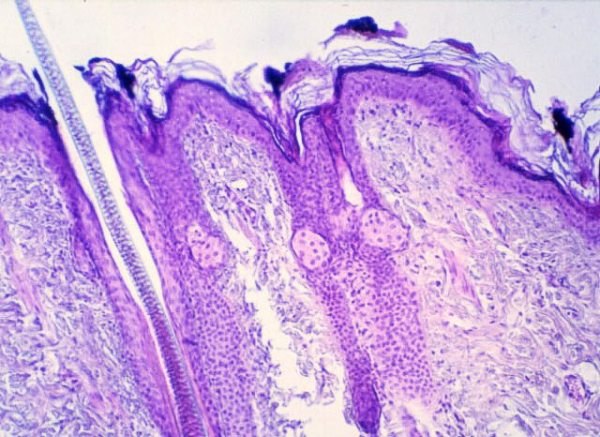 fiogf49gjkf0dFigura 1. Partículas de tinta china en capa córnea y folículo piloso (H.E. 125x).">
fiogf49gjkf0dFigura 1. Partículas de tinta china en capa córnea y folículo piloso (H.E. 125x).">
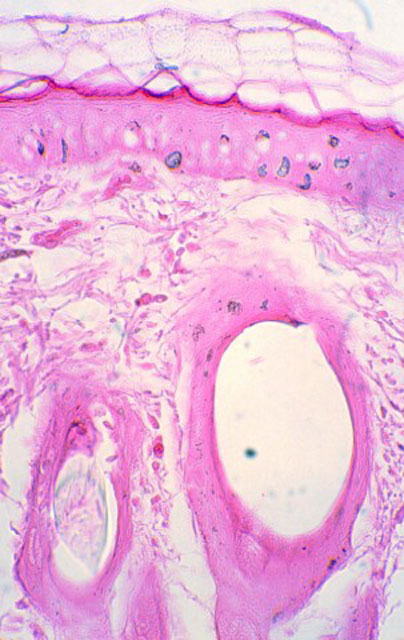 fiogf49gjkf0dFigura 2. Tinta marcadora verde en capa córnea, epidermis, dermis y folículo piloso (M.O. 312.5x).">
fiogf49gjkf0dFigura 2. Tinta marcadora verde en capa córnea, epidermis, dermis y folículo piloso (M.O. 312.5x).">
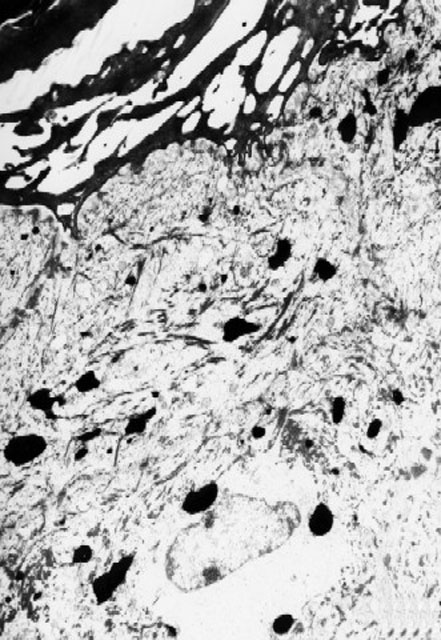 fiogf49gjkf0dFigura 3. Partículas de tinta china en estrato córneo y granuloso (M.E. 3850x).">
fiogf49gjkf0dFigura 3. Partículas de tinta china en estrato córneo y granuloso (M.E. 3850x).">
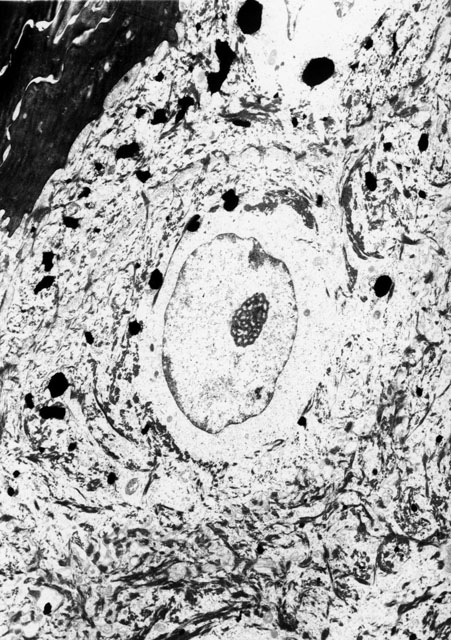 fiogf49gjkf0dFigura 4. Tinta china en queratinocito del estrato granuloso (M.E. 3850x).">
fiogf49gjkf0dFigura 4. Tinta china en queratinocito del estrato granuloso (M.E. 3850x).">
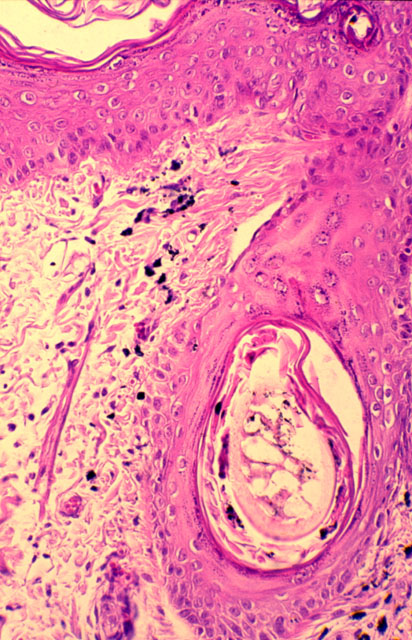 fiogf49gjkf0dFigura 5. Pigmento en folículo piloso y dermis y macrófagos dérmicos (H.E. 312.5x).">
fiogf49gjkf0dFigura 5. Pigmento en folículo piloso y dermis y macrófagos dérmicos (H.E. 312.5x).">
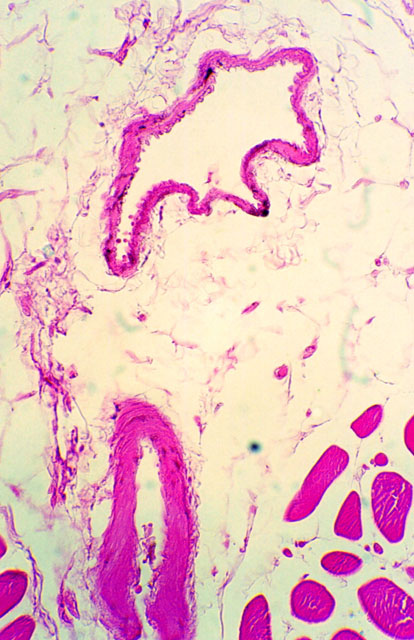 fiogf49gjkf0dFigura 6. Tinta china marcadora verde en dermis y vasos sanguíneos (M.O. 312.5x).">
fiogf49gjkf0dFigura 6. Tinta china marcadora verde en dermis y vasos sanguíneos (M.O. 312.5x).">
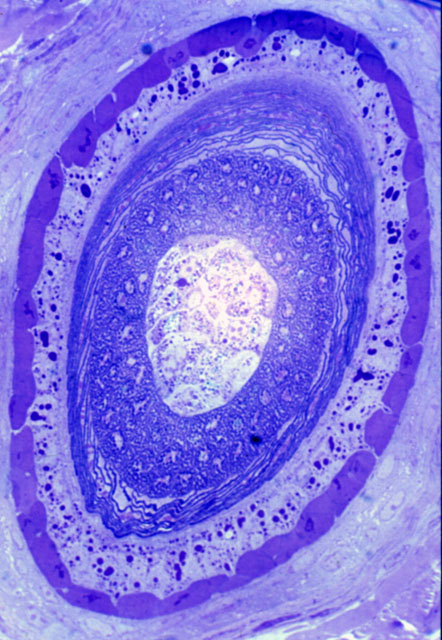 fiogf49gjkf0dFigura 7. Sección semifina. Partículas de tinta china y visualización de canales en folículo piloso (500x).">
fiogf49gjkf0dFigura 7. Sección semifina. Partículas de tinta china y visualización de canales en folículo piloso (500x).">
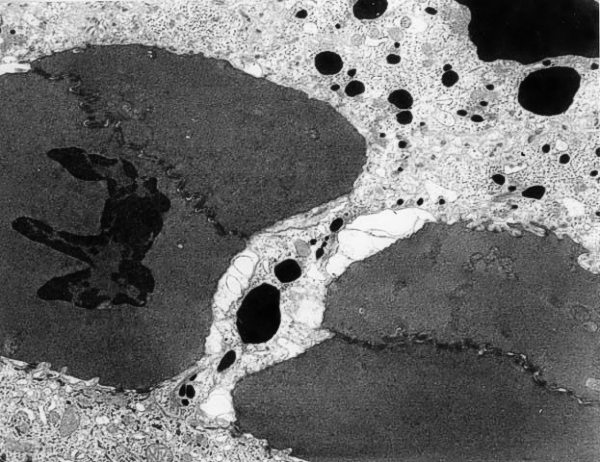 fiogf49gjkf0dFigura 8. Formación del poro intercelular en la zona del folículo piloso por ruptura de las uniones gap con paso masivo de tinta china (M.E. 5000x).">
fiogf49gjkf0dFigura 8. Formación del poro intercelular en la zona del folículo piloso por ruptura de las uniones gap con paso masivo de tinta china (M.E. 5000x).">
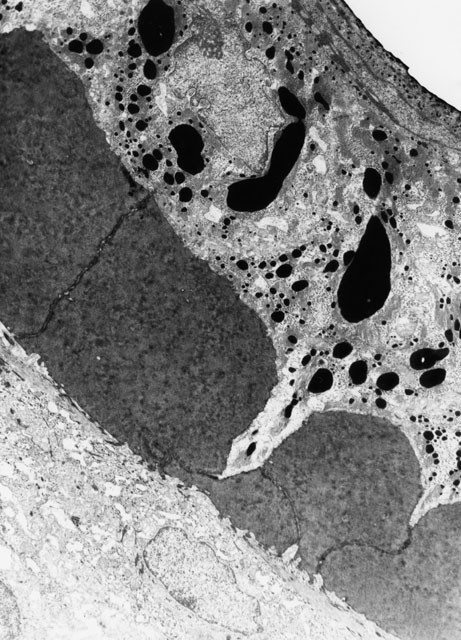 fiogf49gjkf0dFigura 9. Apertura del espacio intercelular (poro) en células del folículo piloso con paso de tinta china (M.E. 8000x).">
fiogf49gjkf0dFigura 9. Apertura del espacio intercelular (poro) en células del folículo piloso con paso de tinta china (M.E. 8000x).">
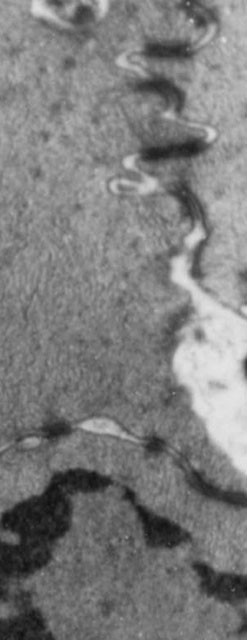 fiogf49gjkf0dFigura 10. Apertura parcial de las uniones gap (M.E. 8000x).">
fiogf49gjkf0dFigura 10. Apertura parcial de las uniones gap (M.E. 8000x).">
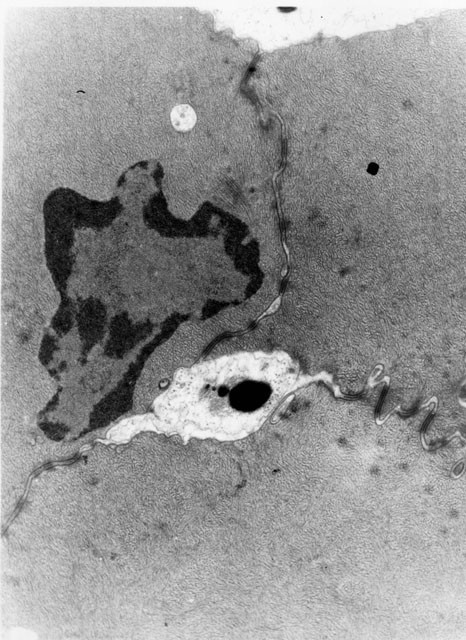 fiogf49gjkf0dFigura 11. Formación de poro intercelular en las células del folículo piloso por ruptura de las uniones gap con partículas de tinta china (M.E. 5000x).">
fiogf49gjkf0dFigura 11. Formación de poro intercelular en las células del folículo piloso por ruptura de las uniones gap con partículas de tinta china (M.E. 5000x).">
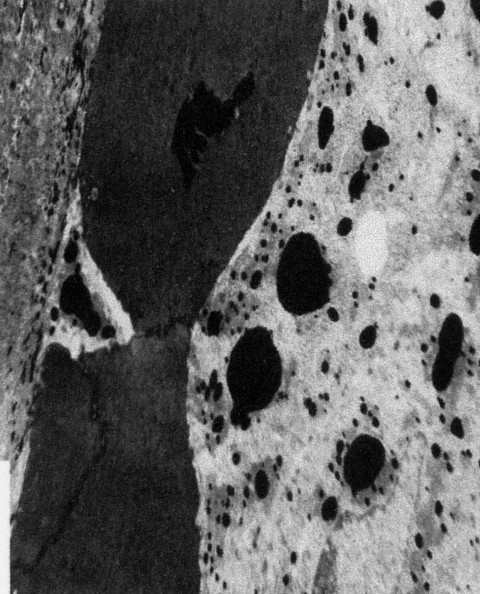 fiogf49gjkf0dFigura 12. Cierre parcial del canal con salida de partículas de tinta china (M.E. 5000x).">
fiogf49gjkf0dFigura 12. Cierre parcial del canal con salida de partículas de tinta china (M.E. 5000x).">
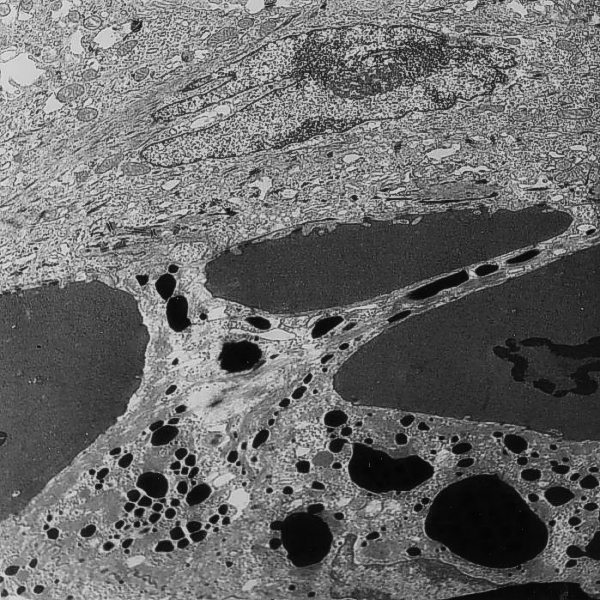 fiogf49gjkf0dFigura 13. Apertura de multicanales entre células epiteliales del folículo piloso con paso de partículas de tinta china (M.E. 6000x).">
fiogf49gjkf0dFigura 13. Apertura de multicanales entre células epiteliales del folículo piloso con paso de partículas de tinta china (M.E. 6000x).">
 fiogf49gjkf0dFigura 14. Partículas de tinta china en dermis entre fibras de colágeno (M.E. 9300x).">
fiogf49gjkf0dFigura 14. Partículas de tinta china en dermis entre fibras de colágeno (M.E. 9300x).">
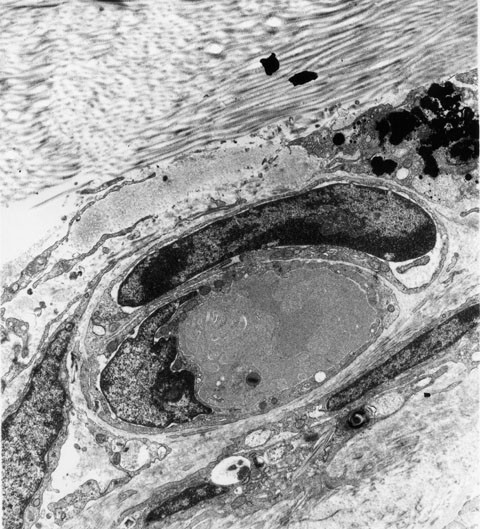 fiogf49gjkf0dFigura 15. Partículas de tinta china en macrófago junto a vaso sanguíneo (M.E. 9300x).">
fiogf49gjkf0dFigura 15. Partículas de tinta china en macrófago junto a vaso sanguíneo (M.E. 9300x).">
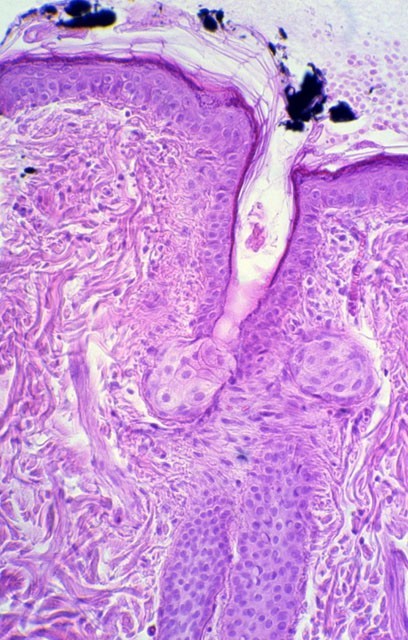 fiogf49gjkf0dFigura 16. Control (partículas de tinta china en superficie de capa córnea) (M.O. 312.5x).">
fiogf49gjkf0dFigura 16. Control (partículas de tinta china en superficie de capa córnea) (M.O. 312.5x).">
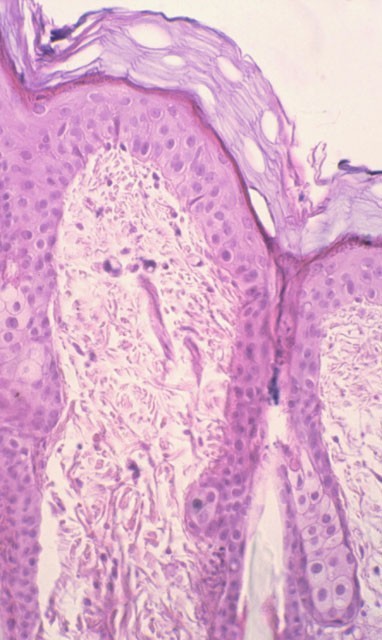 fiogf49gjkf0dFigura 17. Aplicación de hematoxilina de Harris con TDES® + tinción con eosina (M.O. 312.5x).">
fiogf49gjkf0dFigura 17. Aplicación de hematoxilina de Harris con TDES® + tinción con eosina (M.O. 312.5x).">
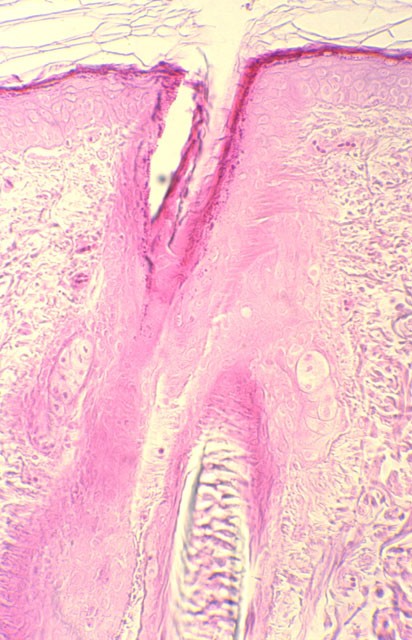 fiogf49gjkf0dFigura 18. Aplicación de eosina con TDES® (M.O. 312.5x).">
fiogf49gjkf0dFigura 18. Aplicación de eosina con TDES® (M.O. 312.5x).">
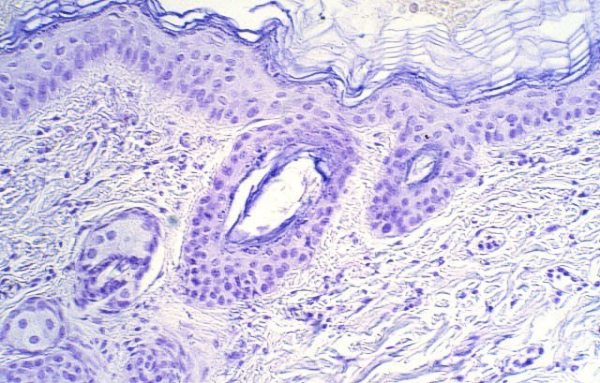 fiogf49gjkf0dFigura 19. Aplicación de hematoxilina de Harris con TDES® (M.O. 312.5x).">
fiogf49gjkf0dFigura 19. Aplicación de hematoxilina de Harris con TDES® (M.O. 312.5x).">
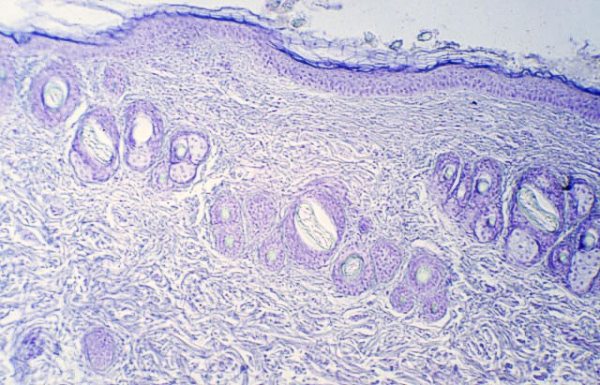 fiogf49gjkf0dFigura 20. Aplicación de azul tripán con TDES® (M.O. 312.5x).">
fiogf49gjkf0dFigura 20. Aplicación de azul tripán con TDES® (M.O. 312.5x).">