

|
Angiomixoma agresivo. Presentación clínico patológica de 2 casos. Julia Cruz Mojarrieta*, Samuel Navarro*, Alejandro Joan**, Israel Díaz***, Margarita Amigó**, Sonia Franco****, Ana Lidia Linares*****, Antonio Llombart Bosch* |
||||||||||||||||||||||||||||||||||||||||||||||
|
El angiomixoma agresivo es un tumor miofibroblastico de partes blandas con dependencia hormonal, que se dignostica con mayor frecuencia en mujeres en edad reproductiva en región de vulva, periné y pelvis. Desde que se describió en 1983 como entidad por Steeper y Rossai, como lesión benigna fibromixoide con escasas células mesenquimales fusocelulares o estrelladas y abundante número de vasos sanguíneos de diferentes diámetros con paredes gruesas, y crecimiento infiltrativo, en la literatura se han publicado aproximadamente 180 casos de los cuales en solo dos, se han descrito metástasis. A pesar de sus múltiples recurrencias por la dificultad de resección completa y su crecimiento infiltrativo, tienen un buen pronóstico. Nosotros presentamos dos casos de angiomixomas agresivos en mujeres de 30 años, con tumores en la pelvis que se han presentado como aumento de volumen a nivel de vulva y pliegue intergluteo con un diámetro mayor de 20 cms al realizarles la exéresis. El perfil inmunohistoquímico mostró expresión de vimentina, desmina, actina muscular lisa, receptores de estrógenos, progesterona y CDK4. Ambos casos fueron negativos a la proteína S100, Citoqueratina, CD44 y MDM2. Mostramos sus correlaciones morfológicas e inmunohistoquímicas y su diagnóstico diferencial con otros tumores mixoides de partes blandas. Financiado por beca de Fundación de Investigación del Hospital Clínico Universitario de Valencia. (2005)
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
Esta rara y controvertida lesión neoplásica se presenta en mujeres en etapa reproductiva en región de la vulva, perine y pelvis (1,2) como una masa única aunque se ha publicado un caso multifocal (3). También se han descrito casos en hombres (4). Histológicamente se caracteriza por un estroma mixoide, con la presencia de células fusiformes y estrelladas sin atipa, ni mitosis y un marcado componente vascular. Los diferentes estudios indican que esta lesión se deriva de una célula mesenquimal primitiva del aparato genital con capacidad de diferenciación miofibroblástica. Se ha demostrado su relación con receptores de estrógenos y progesterona en las mujeres y de andrógenos en el hombre (5), lo que favorece la utilización de una terapéutica hormonal adicional, al tratamiento quirúrgico de elección. Desde el punto de vista citogenética presenta anormalidades del cromosoma 12, en especial de la región 12q13-15 con reordenamiento en el gen HMCGI (6).
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
Historias clínicas: Caso 1: Paciente femenina de 30 años con tumor de la vulva y periné de un año de evolución. Llega a nuestro centro con el diagnóstico por biopsia por aspiración con aguja fina (BAAF) de tumor mesenquimal mixoide. Al examen físico se palpa una masa tumoral de consistencia dura elástica a nivel de la pared derecha de la vagina que se extiende por cara interna del muslo derecho. En los estudios de imágenes, se detecta en la ecografía pélvica: Tumoración (T) de 48x62 mm en proyección del tabique recto-vaginal. Y en la TAC: T del periné en intima relación con el suelo vesical, que crece hacia atrás y abajo, extendiéndose por la raíz del muslo en su parte interna que mide 16x8.7 cms y se extiende por la vagina (Fig. 1). Se le realiza biopsia excisional informándose como angiomiofibroma, con lo que se procede a realizar la exéresis completa, diagnosticándose un angiomixoma agresivo (AMA). En los 28 meses después de la cirugía la paciente no ha presentado recidivas. Hallazgos anatomopatológicos: Se recibe para estudio intraoperatorio una tumoración de 23x8x3 cms con aspecto gomoso, superficie lisa brillante, cubierta por serosa en sus 2/3 partes. Al corte, es un tejido de color blanquecino, homogéneo con pequeños focos hemorrágicos. El borde de sección quirúrgico inferior es irregular y no presenta cápsula, estando la tumoración incompletamente resecada. Caso 2: Mujer de 30 años que desde hace 3 años nota un ligero aumento de volumen duro entre vulva y glúteo derecho. El estudio ecográfico, se interpreto como una posible hipertrofia muscular. En los 2 años siguientes la lesión aumenta de tamaño y acude a nuestro Instituto. En la exploración se palpa masa dura en región vulvo-vaginal derecha que se extiende a cara interna del muslo. En la ecografía pélvica se aprecia masa sólida, ecogénica, que mide 2x65x80 cms, de bordes irregulares localizada por detrás y a la derecha de la vejiga y del útero. Produce desplazamiento del mismo hacia la izquierda y de la vejiga hacia delante. Se extiende hacia abajo, localizándose a la derecha del recto, el cual también está desplazado, hasta alcanzar la porción interna del pliegue inter-glúteo. La lesión no muestra calcificaciones. En la TAC de abdomen, se describe masa T sólida de 16x7x8 cms, que se inicia en la excavación pélvica en su lado derecho y se extiende hacia la región isquiopubica derecha alcanzando el plano interno de esta región vecina a la vagina. Y en el urograma descendente, el uréter derecho está comprimido. Se le realizó una BAAF, no siendo concluyente para diagnóstico. Se interviene quirúrgicamente realizándose la excéresis de la masa tumoral. Cuatro meses después la paciente no ha presentado ninguna alteración. Hallazgos anatomopatológicos: Pieza quirúrgica de 21x12x9 cms, revestida parcialmente por grasa y serosa (Fig. 2),con áreas hemorrágicas. En los cortes seriados la superficie es homogénea, blanco-grisácea, brillante, con consistencia elástica, áreas mixoides y focos de hemorragias (Fig. 3). Se tomaron muestras de tejido tumoral de ambos casos y se fijaron en formaldehído al 10%. Tras su inclusión en parafina, se realizaron cortes de secciones de 5 μ y se tiñeron con técnica de H&E, así como las siguientes técnicas de inmunohistoquímica (Tabla 1), empleando la técnica de la avidina-biotina-peroxidasa (ABC) con recuperación antigénica utilizando autoclave a 1.5 atmósferas durante 3min y solución tampón citrato Tabla 1: Panel de anticuerpos utilizados en los casos 
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
Histológicamente ambos tumores se caracteriza por la presencia de dos componentes principales: uno constituido por abundante estroma mixoide, compuesto por escasas células fusiformes y estrelladas sin atipas, con citoplasma mal definido, núcleos redondos u ovales con pequeños nucleolos localizados centralmente (Fig. 4), también se observan células inflamatorias linfoides alrededor de algunos vasos sobretodo en el caso 2. El segundo componente, está formado por numerosos vasos de diferente calibre (Fig. 5), muchos de ellos de tamaño medio con una pared muscular bastante prominente, algunos rodeados de condensación de fibras colágenas (Fig. 6). Hay escasa extravasación eritrocitaria. Inmunohistoquímicamente las células estromales de los dos casos resultaron positivas para vimentina, desmina (Fig. 7) y actina múscular lisa (AML), y sus núcleos presentaron positividad para receptores de estrógenos (Fig. 8), progesterona y CDK4 ((Fig. 9). En ambos casos fueron negativas para S100, citoqueratina, CD44 y MDM2. En el componente vascular se observó positividad del endotelio para CD 31 y CD 34 y en la pared de los vasos de mediano calibre para AML (Fig. 10) y desmina.
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
El angiomixoma agresivo desde su descripción en 1983 (7), se ha convertido en una lesión controvertida debido a la poca concordancia existente entre su blanda morfología (8), la forma de crecimiento y su posibilidad de dar metástasis, aunque solo hay 2 casos metastáticos publicados (9, 10); uno de ellos esta bien documentado, siendo la causa de muerte las metástasis pulmonares después de varias recidivas (10). Por ello creemos que debemos estar alerta, ante lesiones mixoides de bajo grado como estas, capaces de producir frecuentes recidivas locales y metástasis a pesar de su morfología histológica benigna como ocurre también en el sarcoma fibromixoide y el mixofibrosarcoma de bajo grado.
Los estudios citogenéticos realizados en estas lesiones, muestran que las alteraciones genéticas más significativas se localoizan en el brazo largo del cromosoma 12, en particular en la región 12q13-15. El gen localizado en esta región y que parece estar más implicado en la histogénesis del angiomixoma agresivo es el HMGIC (6). También se conoce que los genes CDK4 y MDM2 están amplificados en algunas neoplasias mesenquimales (11); el primero es una kinasa dependiente de ciclina que interviene en la progresión del ciclo celular y MDM2 es el mayor regulador del P53. Recientemente algunos investigadores detectaron expresión inmunohistoquímica positiva de CDK4 en sus casos y negatividad de MDM2 (12). Nuestros 2 casos presentaron positividad nuclear difusa para CDK4 y negatividad para MDM2, lo que refuerza la hipótesis de que la ciclina se encuentre implicada en la histogenesis del angiomixoma agresivo.
Recientemente se ha valorado la posibilidad de que CD44, una glicoproteina que es el principal receptor de membrana de la hialuronidasa, que interactúa con componentes de la matriz siendo responsable de la adhesión y migración celular, pudiera tener un rol en la progresión y forma de crecimiento infiltrativo del AMA (13). Nuestros 2 casos fueron negativos a este marcador y creemos se necesitan otros estudios para confirmar el valor diagnóstico de este anticuerpo.
Los diagnóstico diferenciales hay que realizarlos con otros tumores mixoides benignos de partes blandas, especialmente el angiomiofibroblastoma, el cual puede ser difícil de distinguir histológicamente del AMA (14) aunque presenta un menor tamaño (<5cm), esta bien delimitado, desarrolla un estroma mas celular, especialmente alrededor de los vasos, no recurre y sus células son negativas a la AML. Otros tumores malignos como el liposarcoma mixoide, en los que además de atipia celular y patrón vascular plexiforme se identifican lipoblastos que son positivos para la preoteína S100 y el mixofibrosarcoma mixoide que se compone de un patrón vascular con capilares curvilíneos que se conectan entre sí e inmunohistoquímicamente son positivos para marcadores histiocitarios.
Nuestro estudio ha corroborado una vez más la relación existente entre estos tumores y los receptores de estrógeno y progesterona (12,13,15), demostrando su dependencia hormonal y la posibilidad de aplicar tratamientos de bloqueo hormonal en casos de recurrencias.
Consideramos, que en los AMA, a pesar de presentan una morfología blanda y recidivar a los varios años de evolución, existe la posibilidad de metatizar, siendo esencial un largo seguimiento clínico y realizar estudios de patología molecular e inmunohistoquímica para conocer el significado biológico y la progresión de estos tumores infrecuentes.
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
1 -Behranwala KA, Latifaj B, Blake P, Barton DP, Shepherd JH, Thomas JM. Vulvar soft tissue tumors. Int J Gynecol Cancer 2004; 14:94-9. 2 -Fetsch JF, Laskin WB, Lefkowitz M, Kindblom LG, Meis-Kindblom JM. Aggressive angiomyxoma: a clinicopathologic study of 29 female patients. Cancer 1996; 78:79-90. 3 -Kaurs A, Makhija, PS, E vallikad, Padmashree, Indira HS. Multifofal aggressive angiomyxoma: a case report. J Clin Pathol 2000; 53:798-99. 4 -Lezzoni JC, Fechner RE, Wong LS, Rosai J. Aggressive angiomyxoma in males. A report of four cases. Am J Clin Pathol 1995; 104:391-96. 5 -Chijara J, Fujimoto K, Takada S, Hirayama A, Cho M, Yoshida K, Ozono S, Hirao Y. Aggressive angiomyxoma in the srotum expressing androgen and progesterone receptors. Int J Urol 2003; 10:672-5. 6 -Nucci MR, Weremowicz S, Neskey MD, Sornberge K, Tallini G, Morton Cc, Quade BG. Chromosomal translocation t(8;12) induces aberrant HMGIC expressionin aggressive angiomyxoma of the vulva. Genes Chromosomes Cancer 2001; 32:172-76. 7 -Steeper TA and Rosai J: Aggressive angiomyxoma of the female pelvis and peritoneum. Report of nine cases of a distinctive type of gynaecologic solf-tissue neoplasm. Am J Surg Pathol 1973; 7:463-75. 8 -McCluggage WG. A review and update of morphologically bland vulvovaginal mesenchymal lesions. Int J Gynecol Cancer 2005; 24:26-38. 9 -Siassi RM, Papadopoulos T, Matzel KE: Metastasizing aggressive angiomyxoma. N Eng J Med 1999; 341:1772. 10 -Blandamura S, Cruz J, Faure Vergara L, Machado Puerto I, Ninfo V. Aggressive angiomyxoma: a second case of metastasis with patient´s death. Hum Pathol. 2003; 34:1072- 74. 11 -Oliner JD, Kinzler KW, Meltzer PS, George DL, Vogeltein B. Amplification of a gene encoding a p53-associated protein in human sarcomas. Nature 1992; 358:15-6. 12 -Graadt van Roggen JF, M van Unnik JA, Briare-de Bruijn.IH, Hogendoorn PC. Aggressive angiomyxoma: a clinicopathological and immunohistochemical study of 11 cases with long-term follow-up. Virchows Arch 2005; 446:157-63. 13 -Amezcua CA, Begley SJ, Mata N, Felix JC, Ballard CA. Aggressive angiomyxoma of the female genital tract: a clinicopathologic and immunohistochemical study of 12 cases. Int J Gynecol Cancer 2005; 15:140-5. 14 -Fletcher CDM, Tsang WYW, Fisher C, Lee KC and Chan JKC. Angiofibroblastoma of the vulva. A benign neoplasm distinct from aggressive angiomyxoma. Am J Surg Pathol 1992; 16:373-382. 15 - McCluggage WG, Paterson A, P Maxwell. Aggressive angiomyxoma of pelvic parts exhibits estrogen and progesterone receptor positivity. J Clin pathol 2000; 53:603-5.
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
- Horacio Lezcano (05/10/2005 19:42:45)
- Walter Marcial Martínez Rodríguez (10/10/2005 1:02:17)
- Walter Marcial Martínez Rodríguez (10/10/2005 12:58:38)
- ELSIE BEATRIZ PICOTT RANGEL (14/10/2005 8:12:21)
- Juan Pablo Garcia de la Torre (17/10/2005 12:39:37)
- david orlando leon perez (22/10/2005 6:28:03)
- Juan Carlos Perez-Cardenas (25/10/2005 4:22:56)
- Margarita Amigo (29/10/2005 7:50:33)
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 14:10:50
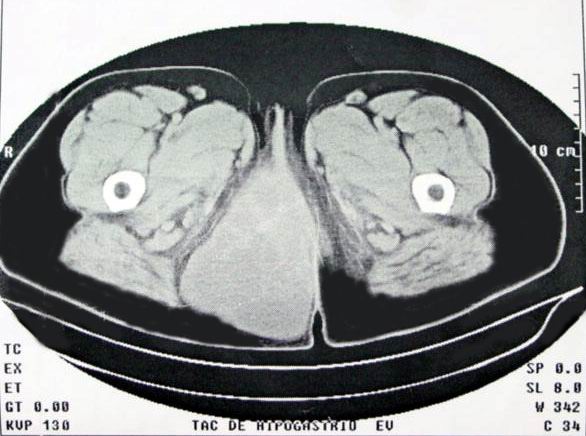 fiogf49gjkf0dFig. 1: TAC de tumoración de 16x8.7 cms del perine, que se extienden por la raíz del muslo (caso 1).">
fiogf49gjkf0dFig. 1: TAC de tumoración de 16x8.7 cms del perine, que se extienden por la raíz del muslo (caso 1).">
.jpg) fiogf49gjkf0dFig. 2: Aspecto macroscópico de tumoración revestida por serosa, tejido adiposo y músculo (caso 2).">
fiogf49gjkf0dFig. 2: Aspecto macroscópico de tumoración revestida por serosa, tejido adiposo y músculo (caso 2).">
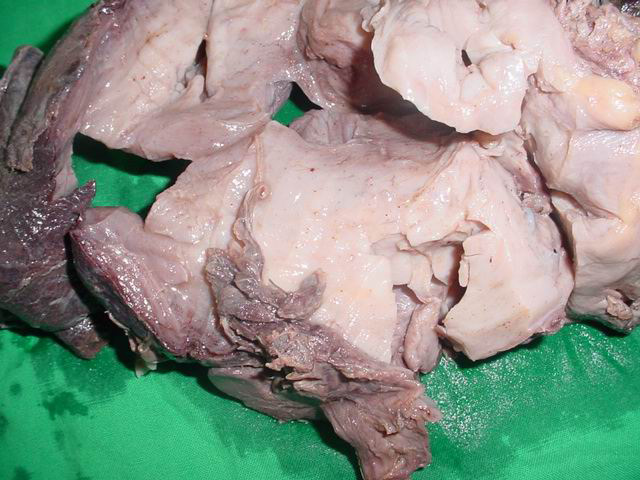 fiogf49gjkf0dFig. 3: Superficie de corte blanquecina de consistencia elástica con áreas mixoides y focos de hemorragia puntiformes. Acercamiento del caso anterior.">
fiogf49gjkf0dFig. 3: Superficie de corte blanquecina de consistencia elástica con áreas mixoides y focos de hemorragia puntiformes. Acercamiento del caso anterior.">
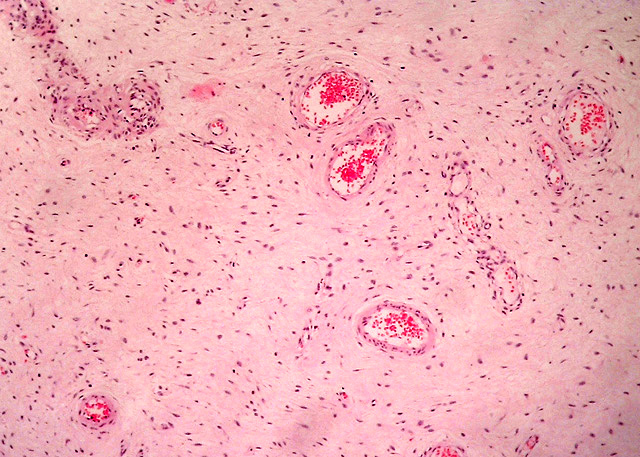 fiogf49gjkf0dFig.5: Presencia de vasos de diferentes diámetros en un estroma fibromixoide. H.E 10x.">
fiogf49gjkf0dFig.5: Presencia de vasos de diferentes diámetros en un estroma fibromixoide. H.E 10x.">
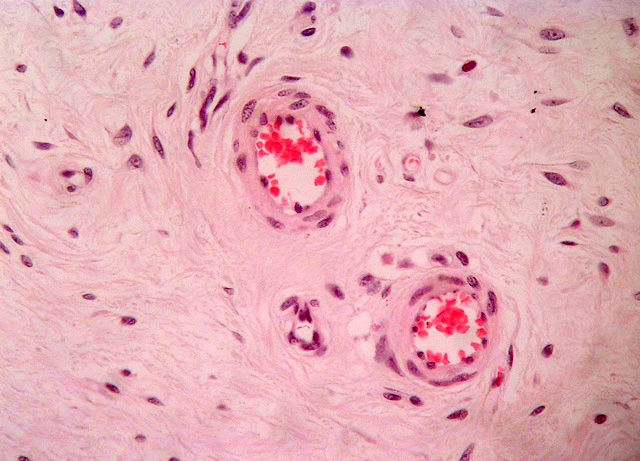 fiogf49gjkf0dFig. 6: Aspecto microscópico, donde se observa un engrosamiento de la pared muscular en los vasos de mediano calibre. H.E 60x.">
fiogf49gjkf0dFig. 6: Aspecto microscópico, donde se observa un engrosamiento de la pared muscular en los vasos de mediano calibre. H.E 60x.">
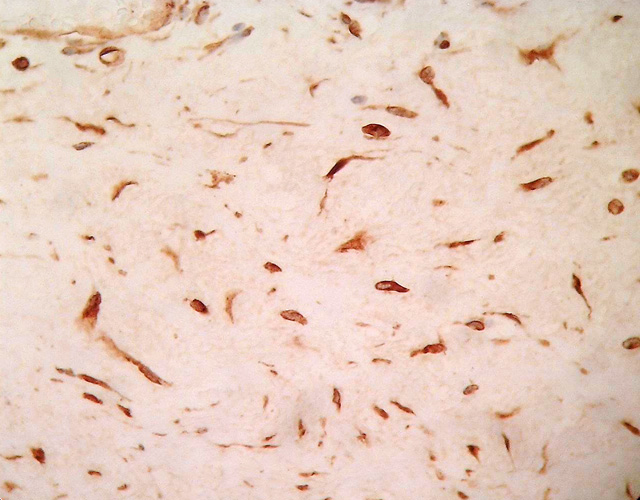 fiogf49gjkf0dFig. 7: Positividad moderada para desmina. ABC 40x.">
fiogf49gjkf0dFig. 7: Positividad moderada para desmina. ABC 40x.">
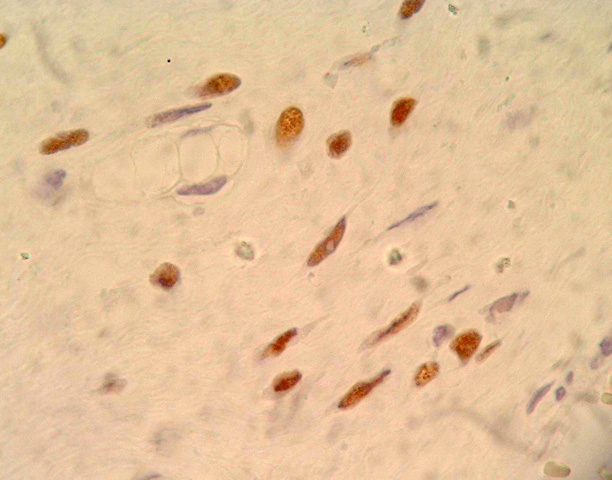 fiogf49gjkf0dFig. 8: Inmunopositividad nuclear moderada a receptores de estrógenos. ABC 100x.">
fiogf49gjkf0dFig. 8: Inmunopositividad nuclear moderada a receptores de estrógenos. ABC 100x.">
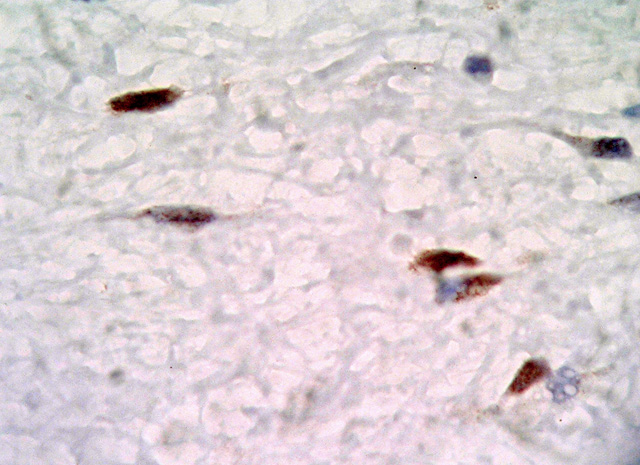 fiogf49gjkf0dFig. 9: Inmunorectividad nuclear intensa y difusa para CDK4. ABC X100.">
fiogf49gjkf0dFig. 9: Inmunorectividad nuclear intensa y difusa para CDK4. ABC X100.">
.jpg) fiogf49gjkf0dFig. 10: Positividad moderada para AML en la pared de los vasos de mediano calibre y células estromales. ABC 40x.
">
fiogf49gjkf0dFig. 10: Positividad moderada para AML en la pared de los vasos de mediano calibre y células estromales. ABC 40x.
">