

|
MUTACIONES DEL GEN K-RAS EN TUMORES PANCREATICO-BILIARES Juan Carlos Roa S*, Leonardo Anabalon R**, Oscar Tapia E**, Angélica Melo A**, Xabier de Aretxabala U***, Iván Roa E**** |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Introducción: La familia de genes ras (H-ras, N-ras y K-ras) son oncogenes frecuentemente mutados en neoplasias humanas, especialmente en tumores del complejo pancreático-biliar
Objetivo: Determinar la frecuencia de mutación del codón 12 del gen K-ras en tumores pancreático biliares.
Material y Método: Se analizan 69 casos de tumores malignos (35 de vesícula biliar (CVB), 15 de Ampolla de Vater (AV), 10 de vía biliar (BTC) y 9 de páncreas (CP). Del material incluido en parafina se microdisecó tejido tumoral. La detección de las mutaciones del codón 12 se realizó mediante técnica combinada de PCR y RFLP.
Resultados: El 46% de casos analizados presentaron mutaciones del gen K-ras. Las frecuencias de mutación fueron de 80%, 56%, 50% y 29%, para AV, CP, BTC, CVB respectivamente. Se encontró diferencias significativas de sobrevida global según el tipo histológico de los tumores, el grado de diferenciación, el órgano afectado y la ubicación del tumor (p<0,05). Los CVB presentaron significativa menor frecuencia de mutación de K-ras en comparación con el conjunto de los otros tumores pancreático-biliares estudiados (p<0,0001). Se observó una tendencia no significativa a mayor frecuencia de mutación en hombres (p=0,07)
Conclusiones: Se detectó mutación del K-ras en el codón 12 entre un 29 y 80% de los casos dependiendo del órgano estudiado. Las diferencias observadas ponen de manifiesto la importancia de esta vía carcinogénica especialmente en los tumores pancreático-biliares distintos al CVB.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
La genética molecular de los tumores del complejo pancreático biliar ha sido extensamente estudiada. Nuestra población presenta una alta incidencia de tumores de la vesícula biliar y menor frecuencia de tumores de páncreas, ampolla de Vater y de vías biliares, las razones de estas diferencias no están claras y requieren estudios adicionales(1).
La asociación de mutaciones del gen K-ras con este tipo de tumores y lesiones preneoplásicas específicamente adenomas ha sido documentada (2, 3, 4). Sin embargo, existen muy pocos estudios basados en nuestra población (5, 6).
El oncogen K-ras pertenece a la familia de genes ras (H-ras, N-ras y K-ras) (7). Se ubica sobre el cromosoma 12p12 y tiene aproximadamente 45 Kb en extensión (8). Las proteínas codificadas por estos genes adoptan un conformación estructural con un peso de 21 Kd, se localizan en la membrana plasmática y participan en la vía de transducción de señales y diferenciación celular(5, 7). La Mutación de este gen es el evento genético más común de la carcinogénesis humana(9). Más del 90% de las mutaciones se han encontrado en el codón 12 y con menor frecuencia en los codones 13 y 61(10, 11). Ha sido reportada en diferentes órganos con alta frecuencia en tumores de colon 50% (12), pulmón 50 % (13) y tiroides 0-60% (14). En el cáncer de páncreas se han comunicado frecuencias de mutación, que varían entre 70 y 100% de los casos (8, 9, 15). En el cáncer ampular entre 19-70%, para tumores de vía biliar(16-22) entre 0 y 55% (20, 23-27) y entre 0-100% para vesícula biliar (6, 20, 23, 25).
Existen diversos métodos para la detección de mutaciones de K-ras, sin embargo, uno de los mas usados corresponde a una técnica combinada de PCR (reacción en cadena de la polimerasa) y RFLP utilizando enzimas de restricción (polimorfismo en la longitud de los fragmentos de restricción) (5, 9, 28, 29).
El objetivo de este trabajo fue determinar la frecuencia de mutación en el codón 12 del gen K-ras, mediante PCR-RFLP, en tumores pancreático biliares en nuestra población y correlacionar con las características clínicas y morfológicas de los tumores
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Casos: Se seleccionaron 69 casos de cánceres pancreático biliares : 35 de cáncer de vesícula biliar (CVB), 15 de ampolla de Vater (AV), 10 de vía biliar (BTC) y 9 de cáncer pancreático (CP) de los archivos del Servicio de Anatomía Patológica del Hospital Hernán Henríquez Aravena y del Departamento de Patología de la Universidad de la Frontera. Extracción del ADN
Se utilizó tejido fijado en formalina e incluido en parafina. Se microdisecó manualmente 5 cortes histológicos con áreas representativas del tumor. El ADN fue extraído con el Kit Puregene DNA Isolation System (Gentra Systems, USA), de acuerdo a las instrucciones del fabricante. El ADN fue almacenado a –20º C hasta su análisis. En todos los casos se realizó amplificación del gen B-globina para confirmar la integridad y calidad del ADN.
Detección de mutación del codón 12 del gen K-ras. Se utilizó un PCR en seminido y RFLP, con iniciadores previamente reportados en la literatura (5). Estos iniciadores (“primers”) permiten amplificar un fragmento del gen K-ras que incluye un sitio de restricción para la enzima MvaI. Tanto los productos PCR (pPCR) de la primera como de la segunda amplificación fueron digeridos con la enzima MvaI (10 U para 20 ul pPCR) (9, 28, 29). El iniciador K-ras-A tiene una base cambiada con respecto a la secuencia del gen K-ras. Esto produce un sitio de restricción para la enzima MvaI cuando el codón 12 es normal. También el iniciador K-ras-B tiene una base cambiada lo que lo hace susceptible de digestión por la enzima MvaI y de esta manera no interfiere en la 2da amplificación.
Los pPCR de la segunda amplificación fueron corridos en un gel al 10% de Poliacrilamida (1:29), Buffer TBE 1X, Glicerol 5% a 150 Volt. por 2 horas y posteriormente teñidos con bromuro de etidio (Figura 1).
Controles: como control positivo, se empleó ADN de carcinomas de páncreas en los que previamente se había demostrado la mutación del K-Ras en el codón 12. Como control negativo se uso DNA genómico comercial (Promega) y como control blanco se sustituyó el ADN por agua deionizada. Análisis estadístico. La relación entre la mutación de K-ras con variables categóricas tales como sexo, raza, tipo histológico se estableció usando la prueba de chi cuadrado o la prueba exacta de Fisher. Para variables numéricas como edad se utilizó la prueba de t-student. Para el cálculo de sobrevida global se incluyó solo a los casos avanzados, la asociación con parámetros morfológicos y clínicos y la presencia de mutación se realizó mediante múltiples curvas de Kaplan Meier y fueron comparadas utilizando la prueba de log-rank y el modelo de Cox Hazard.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Las características generales del grupo de pacientes incluidos en el estudio, se detallan en la Tabla 1. La mayoría de los casos de carcinoma vesícula biliar correspondieron a mujeres (89%), en los otros tumores la relación fue similar o levemente superior para el sexo masculino (40%-56%). Del mismo modo correspondieron a pacientes no mapuches (71%). El rango de edad fluctuó entre los 25 y 92 años, con un promedio de 57.6 años.
El tipo histológico predominante correspondió al tubular (83%). El grado de infiltración de los tumores estudiados correspondió mayoritariamente a tumores avanzados (95.7%) y moderadamente diferenciados (57%). La totalidad de CP y AV fueron intervenidos mediante pancreatoduodenectomía mas disección ganglionar, 12 de los 17 casos de tumores vesiculares subserosos recibieron tratamiento quirúrgico complementario posterior a la colecistectomía mediante bisegmentectomía hepática y disección ganglionar. Ninguno de los pacientes con tumores de vía biliar fue sometido a resección quirúrgica con intención curativa. Se encontraron diferencias significativas en la sobrevida global según el origen del tumor, siendo el cáncer de vía biliar y el de vesícula biliar los de peor y mejor pronóstico respectivamente (p=0,004) (Tabla 1). También se observó diferencias en la sobrevida según tipo histológico de los tumores (peor pronóstico para adenocarcinomas tubulares) (p<0,05) y según grado de diferenciación histológica (mejor pronóstico para tumores bien diferenciados) (p<0,05).
En la totalidad de los casos fue posible amplificar adecuadamente los productos de PCR requeridos (Figura 1). En 32 de los 69 casos (46.4%) se detectó la mutación en el codón 12 del gen K-ras (Tabla 1). Según el órgano analizado, las frecuencias de mutación fueron de 29%, 50%, 56% y 80%, para CVB, BTC, CP y AV respectivamente. Cuando agrupamos a los tumores pancreático biliares no vesiculares y los comparamos con el CVB la frecuencia de mutación fue de 64,7% y 35.3% respectivamente (Tabla 2) (p<0,0001). El grupo de pacientes que presentaba tumores de ampolla de Vater con mutación del gen K-ras tuvo mejor sobrevida (p=0,05). Se observó una tendencia no significativa a mayor frecuencia de mutación en hombres (p=0,07). (Tabla 1)
Tabla 1. Características generales del grupo analizado y su relación con sobrevida y mutación del gen k-ras (n=69)
A Mutación de K-ras según sexo.
B Sobrevida según localización del tumor.
C Sobrevida según tipo histológico.
D Sobrevida según etapa
E Sobrevida según grado de diferenciación.
F Mutación de K-ras según localización del tumor
Tabla 2 Mutacion de K-ras en tumores vesiculares vs tumores no vesiculares.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
La asociación de mutaciones del gen K-ras con este tipo de tumores y lesiones preneoplásicas específicamente adenomas ha sido bien documentada. Sin embargo existen muy pocos estudios basados en nuestra población.
Nuestros resultados muestran que aproximadamente la mitad de los tumores pancreático-biliares, presentan mutación en el codón 12 del gen K-ras (46.4%). La frecuencia de mutación fue dependiente del tipo de tumor (p<0,05), estando presente en el 29% de los adenocarcinomas de la vesícula biliar, en el 56% y 50% para carcinomas de páncreas y vía biliar respectivamente y en el 80% de los carcinomas de la ampolla de Vater.
En la vesícula biliar se ha reportado frecuencias de mutación de K-ras que fluctúan entre 0-100% (4, 30). Algunos autores han postulado que aquellos tumores que se asocian a una unión bilio-pancreática anómala, condición mas frecuente en las series japonesas, presentarían mayor frecuencia de mutación de K-ras(31, 32). Sin embargo, otras series han encontrado que la frecuencia de esta mutación es comparable con series de pacientes que no muestran esta anormalidad (30, 33, 34). En nuestros casos se encontró una frecuencia de 29% de mutación, muy similar a una serie previamente reportada(5). Esto contrasta con el 2,4% de mutaciones reportadas en una serie de 73 pacientes chinos de CVB (4, 30), en los que el 70% se encontraban asociados a litiasis. En nuestra región más del 90% de los cánceres vesiculares se encuentran asociados a litiasis(1), lo cual podría explicar algunas de las diferencias genético-moleculares encontradas en diferentes poblaciones y áreas geográficas.
En el cáncer de páncreas se han publicado frecuencias de mutación de K-ras que fluctúan entre 70-100% (15), sin diferencias significativas para los diferentes estadios de la enfermedad (18). Parece ser que esta mutación estaría involucrada en la iniciación pero no en la progresión del cáncer pancreático. En nuestros 9 casos encontramos una frecuencia algo menor de mutación que alcanzó el 56% de los casos. Sin embargo, las diferencias encontradas no fueron significativas. No encontramos relación con características morfológicas o sobrevida con la presencia de mutación.
En los tumores de vía biliar se ha reportado frecuencias de mutación que varían entre 14,3% y 55% (4, 30, 35, 36) y para el cáncer de ampolla entre 19 y 70%. (16, 17). En nuestra serie encontramos frecuencias de mutación de K-ras de un 50 y 80% para tumores de vía biliar y de ampolla de Vater respectivamente.
Las marcadas diferencias reportadas en las frecuencias de mutación de K-ras pueden ser atribuibles al uso de diferentes técnicas o a diferencias raciales y geográficas. Ejemplo de esto es la alta la incidencia de Mutación de K-ras en colangiocarcinomas observadas en Tailandia y Japón (37)
Nuestros casos no mostraron relación entre la mutación de K-ras y las características morfológicas del tumor. En la literatura se ha reportado escasa asociación con características morfológicas. Howe et al comunicaron que la mutación se asociaba a tumores de ampolla mayores de 2 cm, sin embargo, no se encontró relación con sobrevida (22).
En nuestro estudio la mutación de K-ras en cáncer de ampolla de Vater resultó ser un factor de mejor pronóstico, contrariamente a lo previamente reportado (20, 26) sin embargo esta observación se encuentra basada en una muestra limitada. En los tumores pancreático-biliares estudiados, la mutación de K-ras no mostró valor pronóstico al igual que otras comunicaciones(22, 26), sin embargo, otros autores han encontrado que la presencia de K-ras se encuentra asociada a peor pronóstico(30, 35).
Nuestro estudio encontró diferencias significativas en la sobrevida dependiendo el órgano comprometido y también de características clínicas y morfológicas tales como sexo, tipo histológico y grado de diferenciación (p<0,05). Aun cuando solo se incluyó tumores avanzados en este análisis, no todos los pacientes fueron sometidos a resecciones quirúrgicos con intención curativa. La imposibilidad de estratificar a los diferentes tipos de tumores debido al tamaño de la muestra limita su análisis.
Concluimos que la frecuencia de mutación del codón 12 del gen K-ras en tumores biliopancreáticos es similar a la reportada en otras áreas geográficas y en otras etnias. Aun cuando en nuestra serie de tumores pancreático biliares solo mostró tener impacto pronóstico en los canceres de ampolla y estar asociado mas frecuente a la población femenina, lo cual corrobora la importancia de este gen, y que se encuentra mutado en casi el 50% de todos los casos estudiados.
De esta manera, podemos señalar que la mutación del codón 12 del gen K-ras es un evento que se observa en forma frecuente en los tumores pancreático-biliares de nuestra población. Al igual que en series internacionales reportadas existe una significativa diferencia entre la frecuencia de mutación entre los cánceres vesiculares y los no vesiculares, lo cual sugiere que a pesar de ser tumores anatómicamente relacionados tienen vías carcinogenéticas distintas, por lo cual las estrategias para su estudio a nivel genético-molecular deberán ser distintas.
El mejor entendimiento de la biología molecular de los tumores pancreático biliares no es de simple interés en investigación básica sino porque llegará a tener implicancia clínica en la evaluación de riesgo de desarrollar neoplasias, en el diagnóstico precoz, tratamiento y pronóstico
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Financiado por Proyecto Fondecyt 1010523 y 1050603
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
1 - Roa I, Araya JC, de Aretxabala X, Salinas C, Wistuba I. Patología de la vesícula biliar en Temuco, IX Región. Rev Med Chil 1989;117:889-94.
2 - Wistuba, II, Albores-Saavedra J. Genetic abnormalities involved in the pathogenesis of gallbladder carcinoma. J Hepatobiliary Pancreat Surg 1999;6:237-44. 3 - Wistuba, II, Miquel JF, Gazdar AF, Albores-Saavedra J. Gallbladder adenomas have molecular abnormalities different from those present in gallbladder carcinomas. Hum Pathol 1999;30:21-5. 4 - Rashid A. Cellular and molecular biology of biliary tract cancers. Surg Oncol Clin N Am 2002;11:995-1009. 5 - Roa JC, Roa I, de Aretxabala X, Melo A, Faria G, Tapia O. Mutacion del gen K-ras gene en el cáncer de la vesícula biliar. Rev Med Chil 2004;132:955-60. 6 - Wistuba, II, Sugio K, Hung J, Kishimoto Y, Virmani AK, Roa I, et al. Allele-specific mutations involved in the pathogenesis of endemic gallbladder carcinoma in Chile. Cancer Res 1995;55:2511-5. 7 - Walsh AB, Bar-Sagi D. Differential activation of the Rac pathway by Ha-Ras and K-Ras. J Biol Chem 2001;276:15609-15. Epub 2001 Feb 14. 8 - Mu DQ, Peng YS, Xu QJ. Values of mutations of K-ras oncogene at codon 12 in detection of pancreatic cancer: 15-year experience. World J Gastroenterol 2004;10:471-5. 9 - Ren YX, Xu GM, Li ZS, Song YG. Detection of point mutation in K-ras oncogene at codon 12 in pancreatic diseases. World J Gastroenterol 2004;10:881-4. 10 - Yoshida T, Ohnami S, Aoki K. Development of gene therapy to target pancreatic cancer. Cancer Sci 2004;95:283-9. 11 - Cerny WL, Mangold KA, Scarpelli DG. K-ras mutation is an early event in pancreatic duct carcinogenesis in the Syrian golden hamster. Cancer Res 1992;52:4507-13. 12 - Vogelstein. KKB. Colorectal tumors. In: Bert V, editor. The genetic basis of Human cancer. Second ed. New York: Mac Graw Hill; 2002. p. 583-612. 13 - Clements NC, Jr., Nelson MA, Wymer JA, Savage C, Aguirre M, Garewal H. Analysis of K-ras gene mutations in malignant and nonmalignant endobronchial tissue obtained by fiberoptic bronchoscopy. Am J Respir Crit Care Med 1995;152:1374-8. 14 - Esapa CT, Johnson SJ, Kendall-Taylor P, Lennard TW, Harris PE. Prevalence of Ras mutations in thyroid neoplasia. Clin Endocrinol (Oxf) 1999;50:529-35. 15 - Sakorafas GH, Tsiotou AG, Tsiotos GG. Molecular biology of pancreatic cancer; oncogenes, tumour suppressor genes, growth factors, and their receptors from a clinical perspective. Cancer Treat Rev 2000;26:29-52. 16 - Matsubayashi H, Watanabe H, Yamaguchi T, Ajioka Y, Nishikura K, Kijima H, et al. Differences in mucus and K-ras mutation in relation to phenotypes of tumors of the papilla of vater. Cancer 1999;86:596-607. 17 - Zhao B, Kimura W, Futakawa N, Muto T, Kubota K, Harihara Y, et al. p53 and p21/Waf1 protein expression and K-ras codon 12 mutation in carcinoma of the papilla of Vater. Am J Gastroenterol 1999;94:2128-34. 18 - Motojima K, Tsunoda T, Kanematsu T, Nagata Y, Urano T, Shiku H. Distinguishing pancreatic carcinoma from other periampullary carcinomas by analysis of mutations in the Kirsten-ras oncogene. Ann Surg 1991;214:657-62. 19 - Scarpa A, Capelli P, Zamboni G, Oda T, Mukai K, Bonetti F, et al. Neoplasia of the ampulla of Vater. Ki-ras and p53 mutations. Am J Pathol 1993;142:1163-72. 20 - Malats N, Porta M, Corominas JM, Pinol JL, Rifa J, Real FX. Ki-ras mutations in exocrine pancreatic cancer: association with clinico-pathological characteristics and with tobacco and alcohol consumption. PANK-ras I Project Investigators. Int J Cancer 1997;70:661-7. 21 - Chung CH, Wilentz RE, Polak MM, Ramsoekh TB, Noorduyn LA, Gouma DJ, et al. Clinical significance of K-ras oncogene activation in ampullary neoplasms. J Clin Pathol 1996;49:460-4. 22 - Howe JR, Klimstra DS, Cordon-Cardo C, Paty PB, Park PY, Brennan MF. K-ras mutation in adenomas and carcinomas of the ampulla of vater. Clin Cancer Res 1997;3:129-33. 23 - Tada M, Yokosuka O, Omata M, Ohto M, Isono K. Analysis of ras gene mutations in biliary and pancreatic tumors by polymerase chain reaction and direct sequencing. Cancer 1990;66:930-5. 24 - Levi S, Urbano-Ispizua A, Gill R, Thomas DM, Gilbertson J, Foster C, et al. Multiple K-ras codon 12 mutations in cholangiocarcinomas demonstrated with a sensitive polymerase chain reaction technique. Cancer Res 1991;51:3497-502. 25 - Imai M, Hoshi T, Ogawa K. K-ras codon 12 mutations in biliary tract tumors detected by polymerase chain reaction denaturing gradient gel electrophoresis. Cancer 1994;73:2727-33. 26 - Rijken AM, van Gulik TM, Polak MM, Sturm PD, Gouma DJ, Offerhaus GJ. Diagnostic and prognostic value of incidence of K-ras codon 12 mutations in resected distal bile duct carcinoma. J Surg Oncol 1998;68:187-92. 27 - Suto T, Habano W, Sugai T, Uesugi N, Funato O, Kanno S, et al. Aberrations of the K-ras, p53, and APC genes in extrahepatic bile duct cancer. J Surg Oncol 2000;73:158-63. 28 - Zhou M, Huang SG, Wan HY, Li B, Deng WW, Li M. Genetic polymorphism in matrix metalloproteinase-9 and the susceptibility to chronic obstructive pulmonary disease in Han population of south China. Chin Med J (Engl) 2004;117:1481-4. 29 - Uemura T, Hibi K, Kaneko T, Takeda S, Inoue S, Okochi O, et al. Detection of K-ras mutations in the plasma DNA of pancreatic cancer patients. J Gastroenterol 2004;39:56-60. 30 - Rashid A, Ueki T, Gao YT, Houlihan PS, Wallace C, Wang BS, et al. K-ras mutation, p53 overexpression, and microsatellite instability in biliary tract cancers: a population-based study in China. Clin Cancer Res 2002;8:3156-63. 31 - Hanada K, Itoh M, Fujii K, Tsuchida A, Ooishi H, Kajiyama G. K-ras and p53 mutations in stage I gallbladder carcinoma with an anomalous junction of the pancreaticobiliary duct. Cancer 1996;77:452-8. 32 - Hidaka E, Yanagisawa A, Seki M, Takano K, Setoguchi T, Kato Y. High frequency of K-ras mutations in biliary duct carcinomas of cases with a long common channel in the papilla of Vater. Cancer Res 2000;60:522-4. 33 - Kim SW, Her KH, Jang JY, Kim WH, Kim YT, Park YH. K-ras oncogene mutation in cancer and precancerous lesions of the gallbladder. J Surg Oncol 2000;75:246-51. 34 - Ajiki T, Fujimori T, Onoyama H, Yamamoto M, Kitazawa S, Maeda S, et al. K-ras gene mutation in gall bladder carcinomas and dysplasia. Gut 1996;38:426-9. 35 - Ahrendt SA, Rashid A, Chow JT, Eisenberger CF, Pitt HA, Sidransky D. p53 overexpression and K-ras gene mutations in primary sclerosing cholangitis-associated biliary tract cancer. J Hepatobiliary Pancreat Surg 2000;7:426-31. 36 - Watanabe H, Ha A, Hu YX, Ohtsubo K, Yamaguchi Y, Motoo Y, et al. K-ras mutations in duodenal aspirate without secretin stimulation for screening of pancreatic and biliary tract carcinoma. Cancer 1999;86:1441-8. 37 - Kiba T, Tsuda H, Pairojkul C, Inoue S, Sugimura T, Hirohashi S. Mutations of the p53 tumor suppressor gene and the ras gene family in intrahepatic cholangiocellular carcinomas in Japan and Thailand. Mol Carcinog 1993;8:312-8.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
- ELSIE BEATRIZ PICOTT RANGEL (15/10/2005 3:19:22)
- Cesáreo Corbacho Cuevas (25/10/2005 19:55:55)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 14:10:50
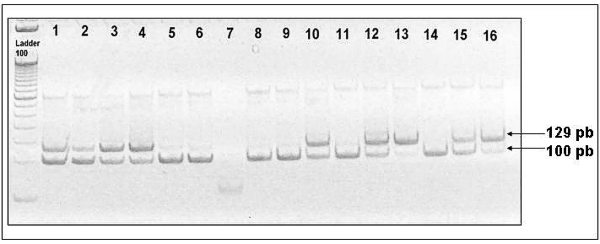 fiogf49gjkf0dFIGURA 1. Gel de poliacrilamida al 10% teñido con bromuro de etidio.
En el cual se observan los productos del método PCR-RFLP. El producto mutado es de 129 pb. La presencia de 2 bandas se explica por la presencia de ADN mutado y normal simultáneamente en la muestra analizada. (Cáncer de Ampolla de Vater Líneas 1-3 vesícula biliar líneas 4-6, vía biliar líneas 8-12, cáncer de páncreas líneas 13-15. las líneas 7 y 16 corresponden al blanco y control positivo respectivamente
">
fiogf49gjkf0dFIGURA 1. Gel de poliacrilamida al 10% teñido con bromuro de etidio.
En el cual se observan los productos del método PCR-RFLP. El producto mutado es de 129 pb. La presencia de 2 bandas se explica por la presencia de ADN mutado y normal simultáneamente en la muestra analizada. (Cáncer de Ampolla de Vater Líneas 1-3 vesícula biliar líneas 4-6, vía biliar líneas 8-12, cáncer de páncreas líneas 13-15. las líneas 7 y 16 corresponden al blanco y control positivo respectivamente
">