

|
Papel del Rofecoxib como inhibidor de la carcinogénesis en colon. Estudio experimental en ratas. Javier Ibarra de la Rosa*, F. José Noguera Aguilar**, Isabel Amengual Antich***, Ángel Plaza Martínez****, Julio Moyano Muñoz** |
|
|
Introducción: se ha comprobado a nivel clínico y experimental la existencia de sobreexpresión de la ciclooxigenasa-2 (COX-2) en los tumores de colon, por lo que los inhibidores de dicha enzima podrían tener un efecto preventivo.
El objetivo del estudio es investigar el efecto de la inhibición de la ciclooxigenasa empleando un modelo de carcinogénesis cólica, inducida farmacológicamente, en ratas. Material y métodos: estudio experimental en 65 ratas Sprague-Dawley macho, distribuidas en 4 grupos: grupo control (n=20), carcinogénesis con 1-2 dimetilhidrazina; grupo ácido acetilsalicílico (n=15), carcinogénesis y adición de AAS; grupo Inhibidores COX-2 baja dosis (n=15), carcinogénesis y adición de rofecoxib 1.2 mg/kg y grupo Inhibidores COX-2 alta dosis (n=15), carcinogénesis y rofecoxib 3 mg/kg. El principal parámetro evaluado es el porcentaje de tejido cólico neoplásico y la expresión de COX-2 en el colon normal y neoplásico.
Resultados: la expresión de COX-2 es superior en los adenocarcinomas frente a los adenomas. El rofecoxib a dosis altas reduce el porcentaje de colon ocupado por adenocarcinomas inducidos (p<0.01). El rofecoxib a dosis bajas presentó el mismo efecto sobre los adenomas (p<0.05), sin efecto sobre los adenocarcinomas. La expresión COX-2 es superior en los adenocarcinomas frente a los adenomas. El rofecoxib redujo la expresión COX-2 respecto al control y AAS (p<0.01), tanto en los adenomas como en los adenocarcinomas, no mostrando este efecto sobre el colon normal.
Conclusiones: nuestro estudio parece demostrar el papel del rofecoxib en la inhibición de la carcinogénesis cólica inducida en ratas, reduciendo la expresión COX-2 en los tumores y disminuyendo el porcentaje de colon neoplásico.
|
||
|
|
Existen dos estrategias para la prevención del cáncer colorectal (CCR): la detección precoz y la quimioprevención. Ambas pretenden reducir la incidencia y mortalidad del CCR(1-3). En la quimioprevención se emplean agentes químicos para prevenir el desarrollo del proceso de carcinogénesis. Entre ellos se encuentran los inhibidores de la enzima ciclooxigenasa-2 (COX-2). La ciclooxigenasa (COX) es la enzima que cataliza los primeros pasos en la síntesis de prostaglandinas. Existen dos isoformas: El objetivo de nuestro estudio fue averiguar si la inhibición selectiva de Existe una evidencia creciente de que el ácido actilsalicílico (AAS) y otros anti-inflamatorios no esteroideos (AINEs) reducen el riesgo de padecer cáncer colorectal. De ellos, el Rofecoxib posee el mayor efecto inhibitorio sobre
|
|
|
|
En el estudio se incluyeron 65 ratas Sprague-Dawley (OFA-SD-hr) macho (Criffa, España), con una media de peso de Fármacos empleados. Se administraron dieciocho inyecciones subcutáneas semanales de 1-2 DMH, a una dosis semanal de 25 mg/kg de peso. El rofecoxib y AAS fueron administrados por vía oral, mezclados con la dieta oral. Seguimiento y sacrificio. Los animales fueron sacrificados en la semana 20, con sobredosis anestésica. El colon fue extirpado en su totalidad y las piezas fueron fijadas en solución de formaldehido al 10%. Evaluación de los tumores cólicos. Se examinó el colon de cada animal determinando tres parámetros: número de tumores, superficie tumoral y porcentaje tumoral (superficie global del colon/superficie del colon ocupado por tumor). En el estudio histológico se determinaron el tipo histológico, el grado histológico, la invasión tumoral y la afectación ganglionar. Expresión cólica de ciclooxigenasa-2. Se determinó la expresión de COX-2 en los adenomas y adenocarcinomas cólicos, así como en la mucosa normal adyacente a cada neoplasia. Las tinciones inmunohistoquimicas se realizaron sobre cortes de tejidos de 5-mm, fijados en formol al 10% y embebidos en parafina: Se empleó Ac anti-COX-2 (Santa Cruz Biotech., USA). Se analizó la positividad o negatividad de dicha expresión. Análisis estadístico. Los datos se analizaron con los programas SPSS y G-Stat, y el análisis estadístico se realizó con modelos Anova unifactorial (Test de Scheffé) y prueba Chi-cuadrado (c2). Se consideraron estadísticamente significativos valores de p inferior a 0.05 .
|
|
|
|
Se analizan a continuación los resultados de los 65 animales incluidos en el estudio. Número de tumores: se hallaron 97 tumores cólicos, 72 adenocarcinomas y 25 adenomas. (Tabla 1). En el grupo control, la media de adenocarcinomas fue de 1.55 tumores malignos por animal, mientras que en los grupos con AAS y AD-ICOX-2 la media fue de 0.86, diferencias que fueron significativas (p<0.05, Scheffé). Superficie tumoral microscópica: en total 31.56 cm2 de superficie cólica tumoral, 31.44 cm2 correspondientes a adenocarcinomas. Las diferencias entre los grupos no fueron significativas. Porcentaje tumoral microscópico: el mayor porcentaje se obtiene en el grupo control: 4.56%;. en el grupo con rofecoxib a dosis bajas se reduce hasta el 3.52%; en el grupo con AAS baja al 2.94% y es inferior al 1% en el grupo con rofecoxib a dosis de altas. Las diferencias entre el último grupo y los grupos control y BD-ICOX-2 fueron significativas (p<0.01, Scheffé, figura 1). Expresión cólica de ciclooxigenasa-2: la expresión COX-2 fue más de 6 veces superior en los adenocarcinomas, (0.0043 adenomas y 0.27 adenocarcinomas), diferencia que fue significativa (p<0.01, c2). En los adenocarcinomas se redujo la expresión COX-2 en los grupos con rofecoxib a dosis bajas y altas, respecto al grupo con AAS y control (p<0.001, c2, tabla 2). Esta disminución (estadísticamente significativa) sólo se apreciaba en el epitelio y estroma de los adenocarcinomas y no en la mucosa normal. El 60% de la expresión COX-2 se halló en el epitelio cólico (figuras 2,3) y el 40% en el estroma cólico (figuras 4,5). Estudio histológico: los adenocarcinomas fueron bien diferenciados en el 33.33% de los casos, moderadamente diferenciados en 37.5% y pobremente diferenciados en el 29.16% (figuras 6,7). Se aislaron un total de 344 ganglios linfáticos, albergando metástasis 18 de ellos (5.23%). Ninguna de estas diferencias fue significativa.
|
|
|
|
La primera evidencia de la relación entre los AINEs y el cáncer de colon se deriva de un estudio epidemiológico realizado por Kune en 1988(12), observando la menor incidencia de CCR en pacientes con enfermedad inflamatoria intestinal consumidores crónicos de sulfasalazina. La primera evidencia de la eficacia de los inhibidores de Del mismo modo, la administración de rofecoxib produce efectos similares en estos ratones(15-18). Existen escasos trabajos con rofecoxib, dos veces más selectivo por Las dosis usadas en este estudio son mayores de las empleadas en artrosis y dolor agudo, pero la inhibición de Atendiendo al número de adenocarcinomas inducidos, se halló una reducción significativa cuando se administró AAS y rofecoxib a dosis altas, pero al analizar el porcentaje tumoral, sólo el inhibidor selectivo de
|
|
|
|
Con los resultados obtenidos se puede ver el efecto preventivo de la adición de dosis altas de ICOX-2 en la formación de adenocarcinomas cólicos inducidos en ratas. El ICOX- Estos resultados experimentales en el animal de laboratorio precisarán de estudios posteriores para investigar el efecto quimiopreventivo sobre el CCR de las dosis altas de inhibidores de
|
|
|
|
1 - Lieberman DA. Screening for colorectal cancer. Clin Cornerstone 2002;4:1-10. 2 - Benamouzig R, Chaussade S. La chimioprevéntion du cancer colorectal. Presse Med 2002;31:124-128. 3 - Sheehan KM, Sheahan K, O´Donoghue DP, MacSweeney F, Conroy RM, Fitzgerald DJ, et al. The relationship between cyclooxygenase-2 expression and colorectal cancer. JAMA 1999;282 (13):1254-1257. 4 - Vane JR, Bakle YS, 5 - Brooks P, Emery P, Evans JF, Fenner H, Hawkey CJ, Patrono C, et al. Interpreting the clinical significance of the differential inhibition of cyclo-oxygenase-1 and cyclo-oxygenase-2. Rheumatology 1999;38:779-788. 6 - Lipsky PE, Brooks P, Crofford LJ, DuBois R, Graham D, Simon LS, et al. Unressolved issues in the role of cyclooxygenase- 7 - Williams CS, Mann M, DuBois R. The role of cyclo-oxygenases in inflammation, cancer and development. Oncogene 1999;18:7908-7916. 8 - DuBois RN, Radhika A, Reddy BS, Entingh AJ. Increased cyclooxygenase-2 levels in carcinogen-induced rat colonic tumors. Gastroenterology 1996;110:1259-1252. 9 - Bamba H, Ota S, Kato A, Adachi A, Itoyama S, Matsuzaki F. High expression of cyclooxygenase- 10 - Reddy BS, Hirose Y, Lubet R, Steele V, Kelloff G, Paulson S, et al. Chemoprevention of colon cancer by specific cyclooxygenase-2 inhibitor, celecoxib, administered during different stages of carcinogenesis. Cancer Res 2000;60:293-297. 11 - Kargman SL, O´Neill GP, Vickers PJ, Evans JF, Mancini JA, Jothy S. Expression of prostaglandin G/H synthase -1 and –2 protein in human colon cancer. Cancer Res 1995;55:556-2559. 12 - 13 - Wargovich MJ, Chen CD, Harris C. Inhibition of aberrant crypt growth by nonsteroidal anti-inflammatory agents an differentiation agents in the rat colon. Int J Cancer 1995; 60: 515-519. 14 - Rao CV, Rivenson A, Simi B, Zang E, Kelloff G, Steele V, et al. Chemoprevention of colon carcinogenesis by sulindac, a nonsteroidal anti-inflammatory agent. Cancer Res 1995; 55: 1464-1472. 15 - Su LK, Kinzler KW, Vogelstein B, Preisinger AC, Moser AR, Luongo C, et al. Multiple intestinal neoplasia caused by a mutation in the murine homolog of the Apc gene. Science 1992; 256: 668-670. 16 - Jacoby RF, Seibert K, Cole CE, Kelloff G, Lubet RA. The cyclooxygenase-2 inhibitor celecoxib is a potent preventive and therapeutic agent in the min mouse model of adenomatous polyposis. Cancer Res 2000; 60: 5040-5044. 17 - Oshima m, Murai N, Kargman S, Arguello M, Luk P, Kwong E, et al. Chemoprevention of intestinal polyposis in the Apc Δ716 mouse by rofecoxib, a specific cyclooxygenase-2 inhibitor. Cancer Res 2001; 61: 1733-1740. 18 - Evans JF. Rofecoxib (vioxx), a specific cyclooxygenase-2 inhibitor, is chemopreventive in a mouse model of colon cancer. 19 - Depre M, Ehrich E, Van Hecken A, De Lepeleire I, Dallob A, Wong P, et al. Pharmacokinetics, COX-2 specificity, and tolerability of supratherapeutic doses of rofecoxib in humans. Eur J Clin Pharmacol 2000; 56(2): 167-174.
|
|
|
|
- Emilio Mayayo Artal (01/11/2005 23:50:54)
- Manuel Diaz-Marta Puentes (09/11/2011 11:18:26)
- Manuel Diaz-Marta Puentes (09/11/2011 11:18:26)
- Manuel Diaz-Marta Puentes (09/11/2011 11:18:27)
|
|
|
|
|
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 14:10:50
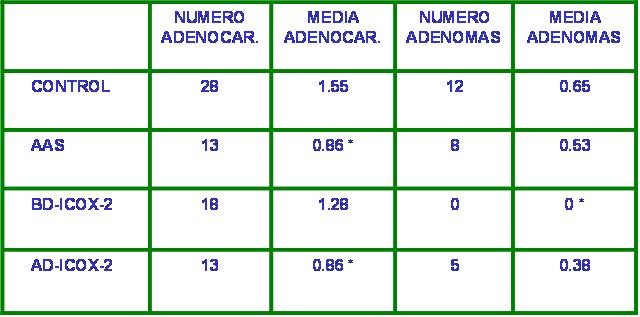 fiogf49gjkf0dTabla 1. Valores totales y medios de adenomas y adenocarcinomas (*diferencia significativa respecto al control).">
fiogf49gjkf0dTabla 1. Valores totales y medios de adenomas y adenocarcinomas (*diferencia significativa respecto al control).">
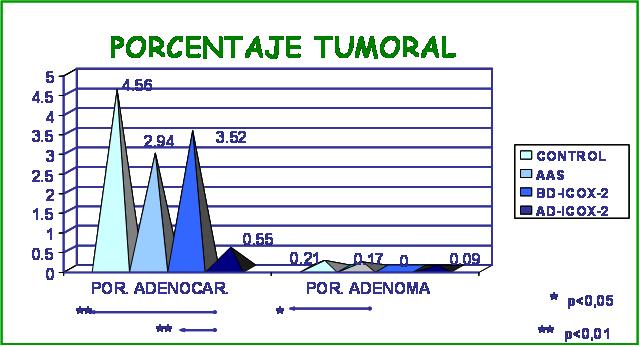 fiogf49gjkf0dFigura 1. Porcentaje tumoral de adenomas y adenocarcinomas en los grupos de estudio.">
fiogf49gjkf0dFigura 1. Porcentaje tumoral de adenomas y adenocarcinomas en los grupos de estudio.">
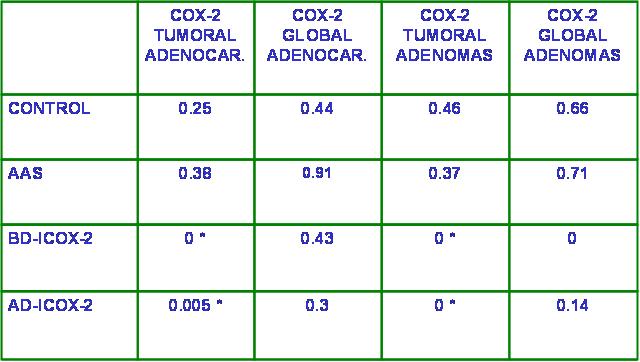 fiogf49gjkf0dTabla 2. Expresión de COX-2 en los adenomas y adenocarcinomas cólicos y en el global del colon (mucosa sana y tumoral).">
fiogf49gjkf0dTabla 2. Expresión de COX-2 en los adenomas y adenocarcinomas cólicos y en el global del colon (mucosa sana y tumoral).">
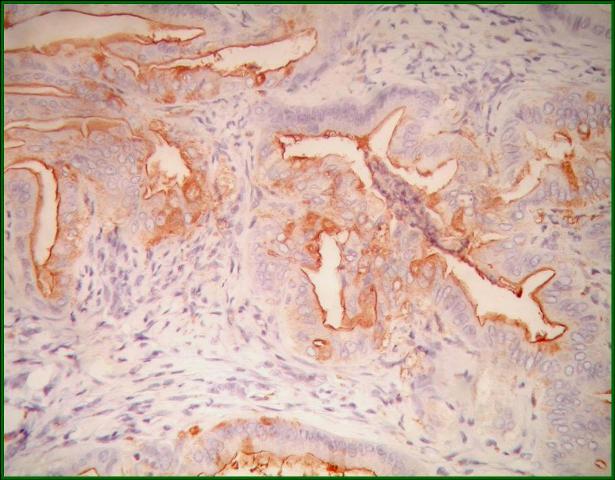 fiogf49gjkf0dFigura 2. Positividad para COX-2 en componente epitelial tumoral. AC anti-COX-2 (x 200)">
fiogf49gjkf0dFigura 2. Positividad para COX-2 en componente epitelial tumoral. AC anti-COX-2 (x 200)">
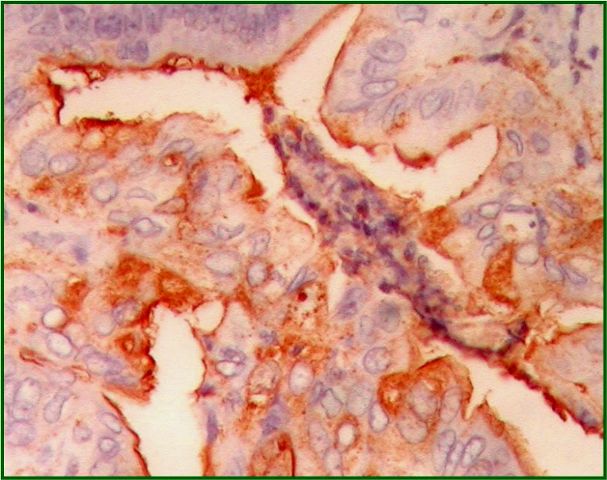 fiogf49gjkf0dFigura 3. Positividad para COX-2 en componente epitelial tumoral. AC anti-COX-2 (x 400)">
fiogf49gjkf0dFigura 3. Positividad para COX-2 en componente epitelial tumoral. AC anti-COX-2 (x 400)">
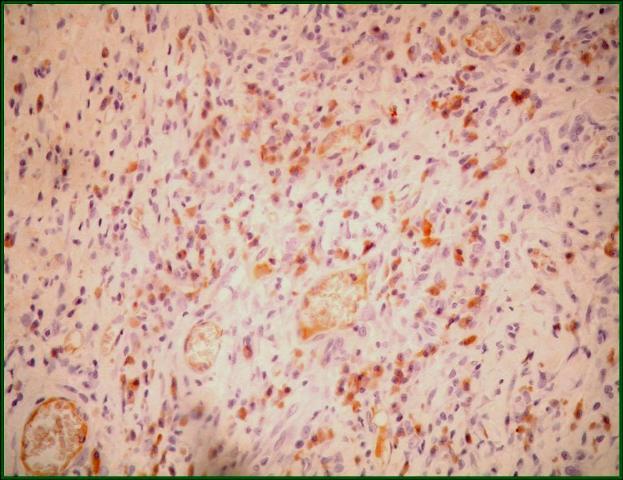 fiogf49gjkf0dFigura 4. Positividad para COX-2 en componente estromal. AC anti-COX-2 (x 200)">
fiogf49gjkf0dFigura 4. Positividad para COX-2 en componente estromal. AC anti-COX-2 (x 200)">
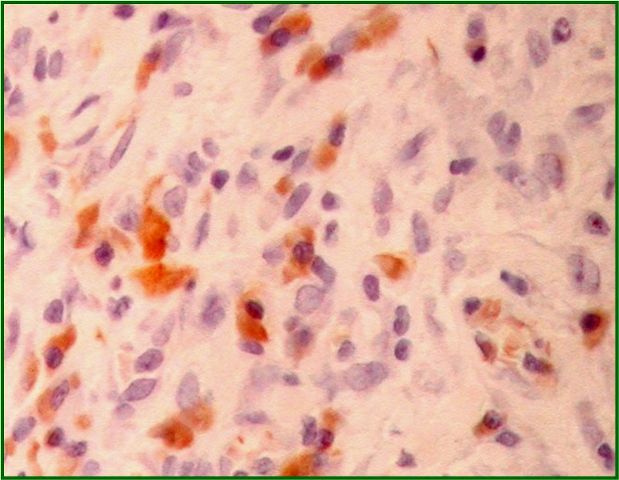 fiogf49gjkf0dFigura 5. Positividad para COX-2 en componente estromal. AC anti-COX-2 (x 400)">
fiogf49gjkf0dFigura 5. Positividad para COX-2 en componente estromal. AC anti-COX-2 (x 400)">
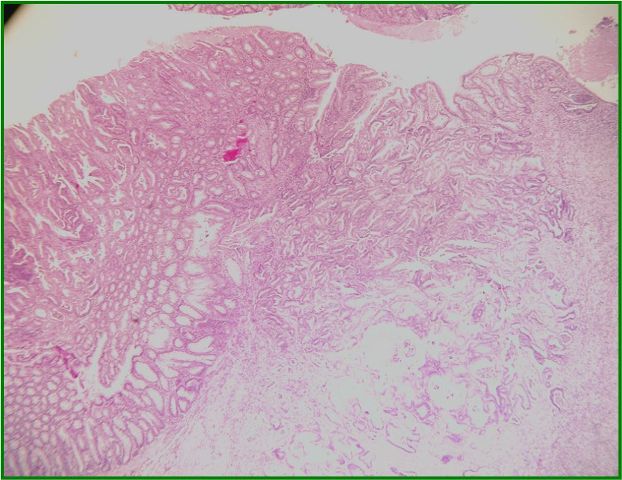 fiogf49gjkf0dFigura 6. Mucosa colónica con cambio adenomatoso en continuidad con adenocarcinoma infiltrante moderadamente diferenciado. HE (x40)">
fiogf49gjkf0dFigura 6. Mucosa colónica con cambio adenomatoso en continuidad con adenocarcinoma infiltrante moderadamente diferenciado. HE (x40)">
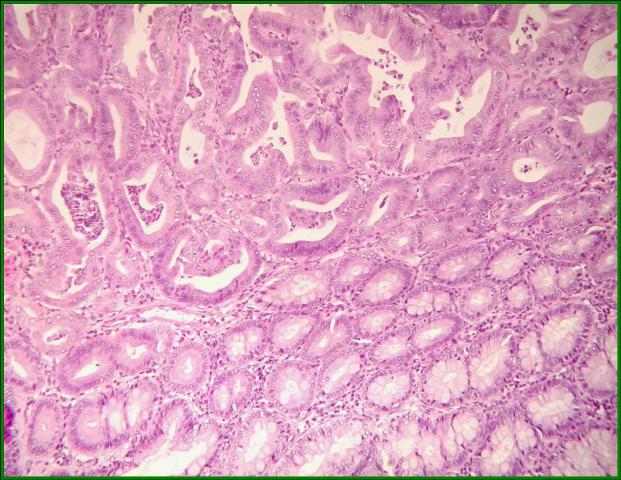 fiogf49gjkf0dFigura 7. Mucosa colónica con cambio adenomatoso (displasia moderada-severa). HE (x200)">
fiogf49gjkf0dFigura 7. Mucosa colónica con cambio adenomatoso (displasia moderada-severa). HE (x200)">