Direccion de contacto
fiogf49gjkf0d Rocío Martín.
Hospital Nuestra Señora de Sonsoles.
Unidad de Anatomía Patológica.
Avda. de Juan Carlos I, s/n.
05001 Avila. ESPAÑA.
Tlfº: 920.358047
email: rmartin@hnss.sacyl.es
|
|
Sarcoma de células claras de tendones y aponeurosis (Melanoma maligno de partes blandas). Presentación de un caso.
Rocío Martín*, Aranzazu Duque**, David Gutiérrez***, Enrique de Alava****, Javier Hernández*****, Luis Santamaría******
* Unidad de Anatomía Patológica
Hospital Nstra. Sra. de Sonsoles. Avila ESPAÑA
** Unidad de Medicina de Familia.
Hospital Nstra. Sra. de Sonsoles. Avila. ESPAÑA
*** Unidad de Oncología.
Hospital Nstra.de Sonsoles. Avila. ESPAÑA
**** Centro de Investigación del Cáncer (CIC). Universidad de Salamanca-CSIC. Salamanca. ESPAÑA
***** Servicio de Cirugía General.
Hospital Nstra. Sra. de Sonsoles. Avila. ESPAÑA
****** Dpto. de Morfología (Histología).
Facultad de Medicina. UAM. Madrid. ESPAÑA
|
|
|
Resumen
fiogf49gjkf0d INTRODUCCIÓN: El sarcoma de células claras de tendones y aponeurosis (SCCTA) o melanoma maligno de partes blandas (MMPB), representa el 1% de todos los sarcomas de partes blandas. Es una neoplasia agresiva, de origen neuroectodérmico, que frecuentemente produce melanina y plantea un diagnóstico diferencial prioritario con metástasis de un melanoma.
MATERIAL Y MÉTODOS: Se presenta un caso de una mujer de 61 años, con múltiples masas nodulares en la extremidad inferior izquierda (EII). Se extirpan 8 lesiones nodulares subcutáneas, para estudio histológico, inmunohistoquímico y FISH.
RESULTADOS: Los nódulos, de entre 2 y 9 cm, estaban constituidos mayoritariamente por nidos de células epitelioides o fusiformes, con núcleo excéntrico y nucleolo prominente, con zonas periféricas de células de menor tamaño y núcleos hipercromáticos. La neoplasia presentaba extensas áreas de necrosis y contacto frecuente con los bordes quirúrgicos de resección. El estudio de inmunohistoquímica demostró intensa positividad para S100, HMB45, vimentina y enolasa neuronoespecífica, con negatividad para desmina y citoqueratina. Destaca la intensa positividad citoplasmática para c-Kit. El índice de proliferación nuclear medido con Ki-67 era del 20 %.
El estudio de FISH sobre material de parafina, detectó reordenamiento del gen EWS, confirmando el diagnóstico de SCCTA (MMPB).
A los dos meses de la intervención se objetivaron metástasis cerebrales, pulmonares y retroperitoneales. Se inicia tratamiento con imatinib (Gleevec) que se suspendió a los 20 días por la aparición de complicaciones metastásicas -episodios tromboembólicos y hematoma cerebral-. La paciente falleció a los 4 meses de la intervención.
DISCUSIÓN: El SCCTA (MMPB) es una neoplasia rara y agresiva, derivada de cresta neural. Es más frecuente en EEII de mujeres jóvenes, aunque se han descrito otras localizaciones, incluso viscerales, y casos pediátricos. Generalmente produce melanina. Los rasgos histológicos e inmunohistoquímicos son superponibles a un melanoma metastásico. Destaca la intensa positividad citoplasmática del caso presentado para c-Kit, que se ha descrito también en otros sarcomas de partes blandas.
El SCCTA (MMPB) se caracteriza citogenéticamente por la translocación cromosómica t(12:22) (q13;q12), que resulta en la fusión del gen de EWS-ATF1 y en la expresión de MIFT. El tratamiento es quirúrgico, con radioterapia para controlar la persistencia de neoplasia microscópica residual post-cirugía. La quimioterapia es ineficaz. En esta paciente, la aparición de metástasis condujo al tratamiento con Gleevec. Son factores de mal pronóstico: el tamaño tumoral y la existencia de necrosis.
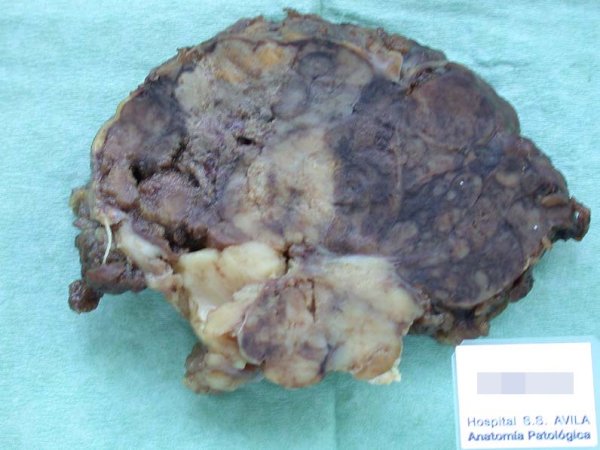 fiogf49gjkf0dFigura 1. Una de las ocho lesiones nodulares extirpadas, de contorno irregular, con extensas áreas negruzcas."> fiogf49gjkf0dFigura 1. Una de las ocho lesiones nodulares extirpadas, de contorno irregular, con extensas áreas negruzcas.">
Figura 1. - fiogf49gjkf0d Figura 1. Una de las ocho lesiones nodulares extirpadas, de contorno irregular, con extensas áreas negruzcas.
.jpg) fiogf49gjkf0dFigura 2. Cinco de las lesiones, de aspecto nodular, de contorno irregular y coloración variada, con áreas amarillentas y otras negruzcas.
"> fiogf49gjkf0dFigura 2. Cinco de las lesiones, de aspecto nodular, de contorno irregular y coloración variada, con áreas amarillentas y otras negruzcas.
">
Figura 2. - fiogf49gjkf0d Figura 2. Cinco de las lesiones, de aspecto nodular, de contorno irregular y coloración variada, con áreas amarillentas y otras negruzcas.
|
|
|
Introduccion
fiogf49gjkf0d
INTRODUCCIÓN:
El sarcoma de células claras de tendones y aponeurosis (SCCTA), también llamado melanoma maligno de partes blandas (MMPB,) es un tumor de partes blandas raro, agresivo, que frecuentemente produce melanina. Representa el 1 % de todos los sarcomas de partes blandas. Fue descrito por primera vez, como entidad clínicopatológica independiente por Enzinger en 1965.
Se presenta en forma de masas, localizadas generalmente en partes blandas de extremidades inferiores de mujeres jóvenes.
Tiene una diferenciación neuroectodérmica y plantea un diagnóstico diferencial prioritario con metástasis de un melanoma, por la coincidencia de imágenes histológicas y resultados de inmunohistoquímica en ambas neoplasias. (1,2)
|
|
|
Material y Métodos
fiogf49gjkf0d Se presenta un caso de una mujer de 61 años con múltiples masas nodulares en EII. Se extirparon en bloque ocho de estos nódulos, con biopsia intraoperatoria de uno de ellos.
El estudio de IH y los estudios especiales de FISH conducen al diagnóstico definitivo.
Se discute el diagnóstico diferencial y las opciones de tratamiento ante las peculiaridades de los resultados de IH con c-Kit.
|
|
|
Resultados
fiogf49gjkf0d
RESULTADOS:
Clínica:
Mujer de 61 años con lesiones subcutáneas múltiples en EII, de 10 meses de evolución. Realiza consulta en el servicio de cirugía por el rápido crecimiento de las mismas.
Cirugía:
Se realiza biopsia intraoperatoria de uno de los nódulos. Se diagnostica como "tumor mesenquimal con áreas de necrosis, sugestivo de malignidad". En el mismo acto quirúrgico se extirpan en bloque otros siete nódulos subcutáneos, con sospecha clínica de fibrohistiocitoma maligno.
Descripción macroscópica:
Las ocho lesiones extirpadas correspondían a piezas nodulares con bordes irregulares y unos diámetros entre 2.5 y 9 cm. Algunos incluían ojal cutáneo. Presentaban una consistencia elástica, a veces blanda, de aspecto necrótico-hemorrágico, con coloración variada, con áreas pardo oscuras y otras rosadas o blanquecinas amarillentas, con ribete periférico amarillento.
Descripción microscópica:
Los agregados de células neoplásicas estaban compartimentalizados por bandas de tejido fibroconectivo de distinto grosor, con nidos de células epitelioides o fusiformes, con núcleo grande, ocasionalmente en posición excéntrica, nucleolo y frecuentes figuras de mitosis, junto a otras áreas de células pequeñas de núcleos hipercromáticos. Especialmente en las áreas epitelioides, se reconocen núcleos ovoides, pleomórficos, con ocasionales formas multinucleadas y nucleolo prominente, así como frecuentes inclusiones intranucleares claras. En la periferia de los nódulos pueden verse células tumorales que presentan pigmentación pardusca intracitoplasmática.
Se evidencian extensas áreas de necrosis intratumoral. Las lesiones neoplásicas muestran contacto frecuente con los márgenes quirúrgicos.
Estudio inmunohistoquímico:
Los resultados de inmunohistoquímica mostraron intensa positividad para S100, HMB45, vimentina y enolasa neuronoespecífica, con negatividad para desmina y citoqueratina. El índice de proliferación nuclear medido con Ki-67 es del 20 %. El c-Kit presentó intensa positividad difusa intracitoplasmática.
Estudios especiales:
Se realizó estudio de FISH sobre el material incluido en parafina para detectar reordenamiento del gen EWS, mediante un juego de sondas que detectan la rotura de dicho gen. Se detectaron numerosas células con dicho reordenamiento.
Evolución:
La paciente es remitida al Servicio de Oncología con debilidad progresiva de la mano derecha, con crisis parciales focalizadas en el brazo derecho. A los dos meses de la intervención se evidencian en TAC imágenes nodulares pequeñas en la base del pulmón izquierdo y tres imágenes hiperdensas en lóbulo parietal izquierdo cerebral, con edema perilesional, sugerentes de metástasis. Se describe otra imagen en retroperitoneo, de 2 cm, sugestiva de adenopatía metastásica.
Recibió radioterapia holocraneal e inició tratamiento con imatinib (Gleevec) 400 mg/día. A los 20 días se suspendió el tratamiento por la aparición de un hematoma cerebral, con crisis epilépticas secundarias y trombosis venosa profunda femoral izquierda. Se implantó un filtro de cava y se trasladó a la Unidad de Cuidados paliativos. La paciente falleció a los cuatro meses de la intervención quirúrgica.
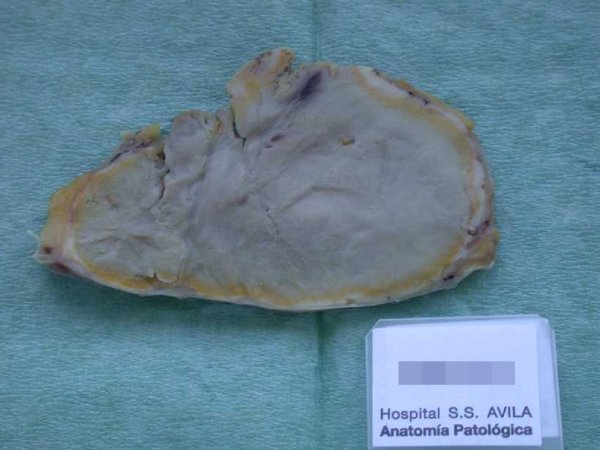 fiogf49gjkf0dFigura 3. Una de las lesiones nodulares extirpadas. Al corte mostraba un aspecto sólido, con un área central extensa blanda, grisácea, de aspecto necrótico, con una zona periférica amarillenta."> fiogf49gjkf0dFigura 3. Una de las lesiones nodulares extirpadas. Al corte mostraba un aspecto sólido, con un área central extensa blanda, grisácea, de aspecto necrótico, con una zona periférica amarillenta.">
Figura 3 - fiogf49gjkf0d Figura 3. Una de las lesiones nodulares extirpadas. Al corte mostraba un aspecto sólido, con un área central extensa blanda, grisácea, de aspecto necrótico, con una zona periférica amarillenta.
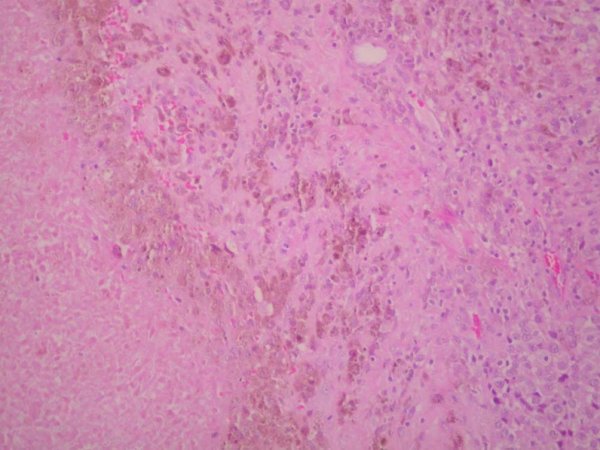 fiogf49gjkf0dFigura 4. A la izquierda de la imagen se observa un área extensa de necrosis tumoral. A la derecha, celularidad neoplásica epitelioide con frecuente pigmento intracitoplasmático. HE 10 X.
"> fiogf49gjkf0dFigura 4. A la izquierda de la imagen se observa un área extensa de necrosis tumoral. A la derecha, celularidad neoplásica epitelioide con frecuente pigmento intracitoplasmático. HE 10 X.
">
Figura 4 - fiogf49gjkf0d Figura 4. A la izquierda de la imagen se observa un área extensa de necrosis tumoral. A la derecha, celularidad neoplásica epitelioide con frecuente pigmento intracitoplasmático. HE 10 X.
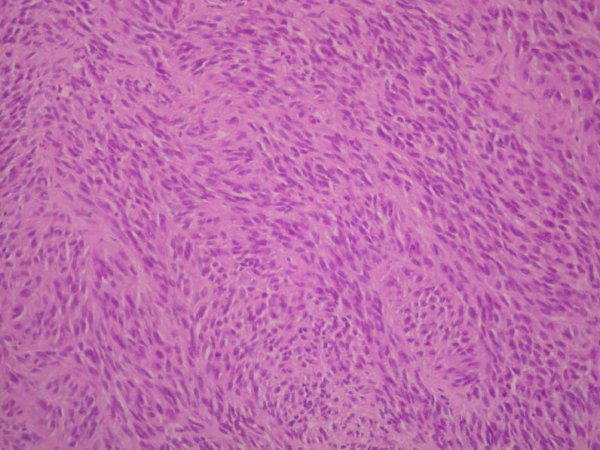 fiogf49gjkf0dFigura 5. Patrón fusiforme en la celularidad neoplásica. HE 10 X."> fiogf49gjkf0dFigura 5. Patrón fusiforme en la celularidad neoplásica. HE 10 X.">
Figura 5 - fiogf49gjkf0d Figura 5. Patrón fusiforme en la celularidad neoplásica. HE 10 X.
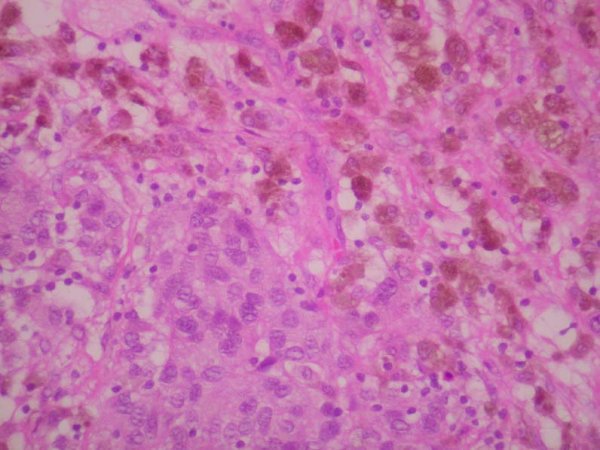 fiogf49gjkf0dFigura 6. Células de morfología epiteliode, con frecuentes citoplasmas amplios y claros y presencia de pigmento pardo intracitoplasmático. HE 20 X."> fiogf49gjkf0dFigura 6. Células de morfología epiteliode, con frecuentes citoplasmas amplios y claros y presencia de pigmento pardo intracitoplasmático. HE 20 X.">
Figura 6 - fiogf49gjkf0d Figura 6. Células de morfología epiteliode, con frecuentes citoplasmas amplios y claros y presencia de pigmento pardo intracitoplasmático. HE 20 X.
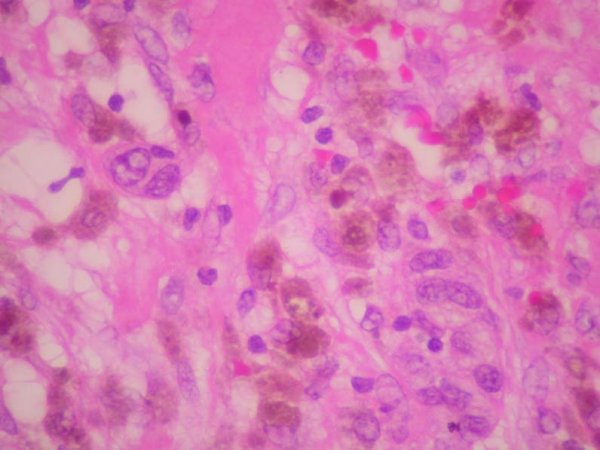 fiogf49gjkf0dFigura 7. Células neoplásicas con citoplasmas amplios y claros, con frecuente pigmento intracitoplasmático, núcleos ovoides, pleomórficos, con nucleolo prominente, cromatina irregular e inclusiones intranucleares. HE 40 X."> fiogf49gjkf0dFigura 7. Células neoplásicas con citoplasmas amplios y claros, con frecuente pigmento intracitoplasmático, núcleos ovoides, pleomórficos, con nucleolo prominente, cromatina irregular e inclusiones intranucleares. HE 40 X.">
Figura 7 - fiogf49gjkf0d Figura 7. Células neoplásicas con citoplasmas amplios y claros, con frecuente pigmento intracitoplasmático, núcleos ovoides, pleomórficos, con nucleolo prominente, cromatina irregular e inclusiones intranucleares. HE 40 X.
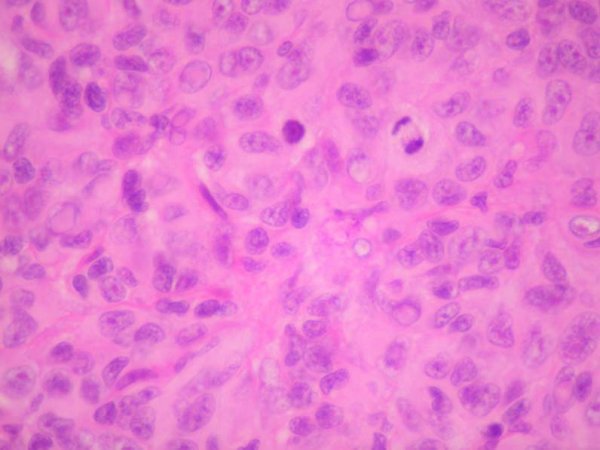 fiogf49gjkf0dFigura 8. Mayor detalle de las caracteríscitcas citológicas. Pueden verse figuras de mitosis. HE 40 X."> fiogf49gjkf0dFigura 8. Mayor detalle de las caracteríscitcas citológicas. Pueden verse figuras de mitosis. HE 40 X.">
Figura 8 - fiogf49gjkf0d Figura 8. Mayor detalle de las caracteríscitcas citológicas. Pueden verse figuras de mitosis. HE 40 X.
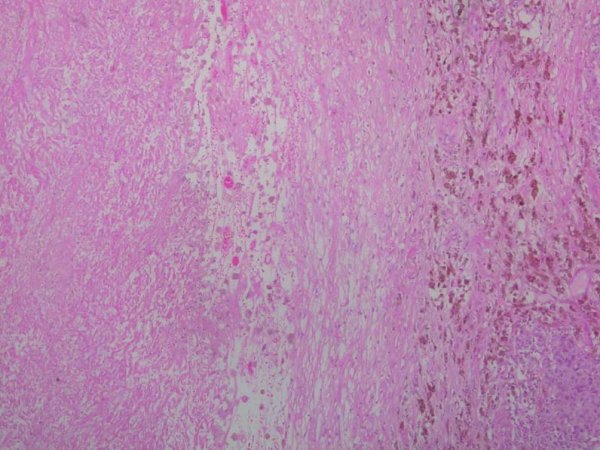 fiogf49gjkf0dFigura 9. Extensas áreas de necrosis tumoral. HE 4 X."> fiogf49gjkf0dFigura 9. Extensas áreas de necrosis tumoral. HE 4 X.">
Figura 9 - fiogf49gjkf0d Figura 9. Extensas áreas de necrosis tumoral. HE 4 X.
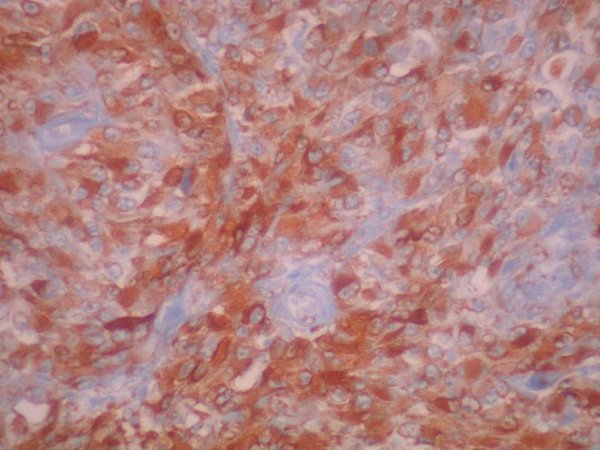 fiogf49gjkf0dFigura 10. Intensa inmunoexpresión intracitoplasmática para HMB45. 40 X."> fiogf49gjkf0dFigura 10. Intensa inmunoexpresión intracitoplasmática para HMB45. 40 X.">
Figura 10 - fiogf49gjkf0d Figura 10. Intensa inmunoexpresión intracitoplasmática para HMB45. 40 X.
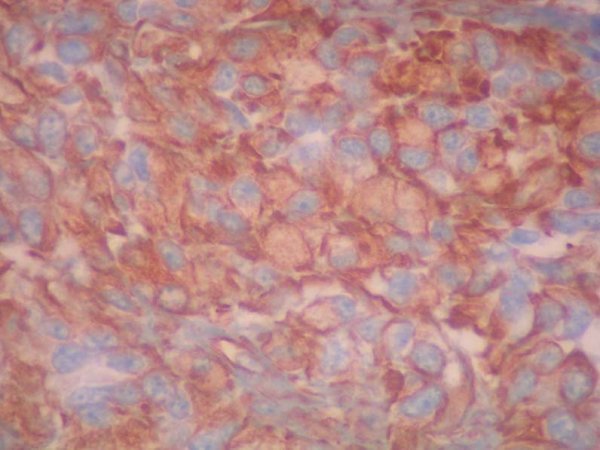 fiogf49gjkf0dFigura 11. Positividad intracitoplasmática para Vimentina. 40 X."> fiogf49gjkf0dFigura 11. Positividad intracitoplasmática para Vimentina. 40 X.">
Figura 11 - fiogf49gjkf0d Figura 11. Positividad intracitoplasmática para Vimentina. 40 X.
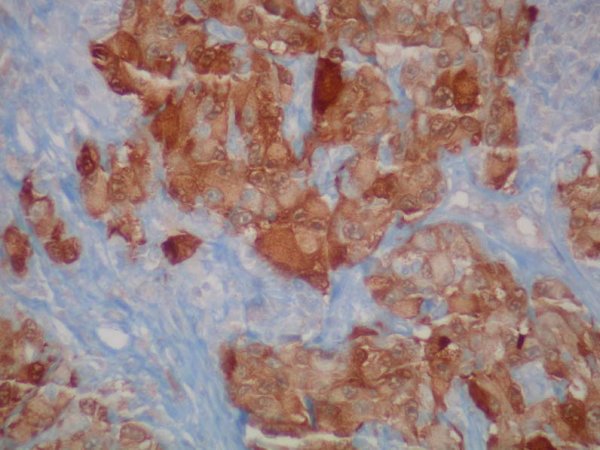 fiogf49gjkf0dFIgura 12. Intensa inmunoexpresión para NSE en el citoplasma de las células neoplásicas. 20 X."> fiogf49gjkf0dFIgura 12. Intensa inmunoexpresión para NSE en el citoplasma de las células neoplásicas. 20 X.">
Figura 12 - fiogf49gjkf0d FIgura 12. Intensa inmunoexpresión para NSE en el citoplasma de las células neoplásicas. 20 X.
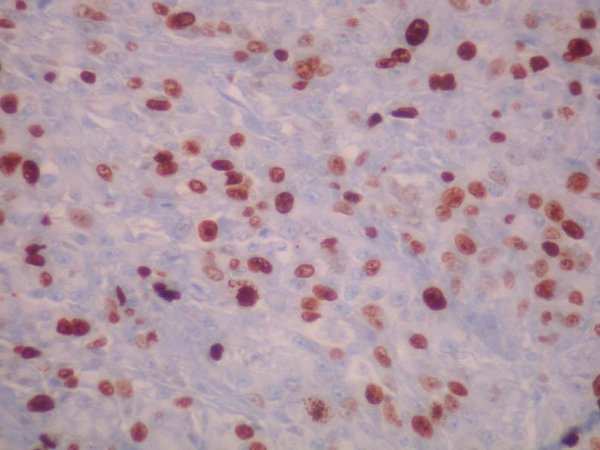 fiogf49gjkf0dFigura 13. Indice de proliferación nuclear del 20 %, medido con Ki-67. 20 X."> fiogf49gjkf0dFigura 13. Indice de proliferación nuclear del 20 %, medido con Ki-67. 20 X.">
Figura 13 - fiogf49gjkf0d Figura 13. Indice de proliferación nuclear del 20 %, medido con Ki-67. 20 X.
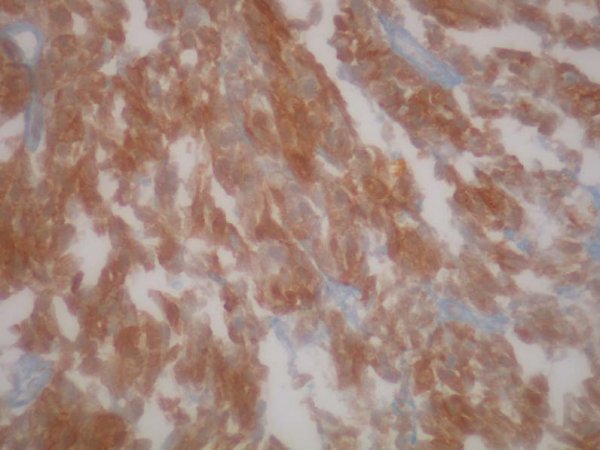 fiogf49gjkf0dFigura 14. Positicivad citoplasmática difusa, intensa, para c-kit. 20 X."> fiogf49gjkf0dFigura 14. Positicivad citoplasmática difusa, intensa, para c-kit. 20 X.">
Figura 14 - fiogf49gjkf0d Figura 14. Positicivad citoplasmática difusa, intensa, para c-kit. 20 X.
|
|
|
Discusión
fiogf49gjkf0d
DISCUSIÓN:
El SCCTA es una neoplasia maligna rara que aparece principalmente en las extremidades de adultos jóvenes y que supone el 1 % de todos los sarcomas de partes blandas. La presentación más habitual es en forma de masas en tejidos blandos, en extremidades de mujeres jóvenes. El caso presentado corresponde a una mujer de 61 años con múltiples lesiones nodulares en partes blandas de la EII. Aunque raros, también se existen casos pediátricos (2).
Fue descrita como entidad clínicopatológica por Enzinger en 1965. Sus rasgos histológicos se solapan con los de un melanoma (origen común en cresta neural, síntesis de melanina, expresión de proteína S100 y de HMB45, así como evidencia ultraestructural de melanosomas) y fue originalmente considerada como un melanoma originado en partes blandas, con la denominación de "melanoma maligno de partes blandas". La paciente estudiada no presentaba ninguna lesión pigmentada cutánea, ocular, ni en mucosas, ni tampoco antecedentes de extirpaciones sospechosas de melanoma.
Se ha demostrado una diferenciación neuroectodérmica, similar a la de la cresta neural con demostración de melanosomas y presencia de actividad colinesterasa y tirosinasa, tanto en tumores primarios como en metastásicos y en transplantados en ratones (1).
La localización más habitual, como en el caso presentado, es en partes blandas en EEII, mayoritariamente en el pie, aunque también se ha descrito en otros lugares, incluso en el pene y en el tracto gastrointestinal (3).
Los resultados de inmunohistoquímica fueron superponibles a los que pueden verse en un melanoma con intensa positividad para S100 y HMB45, vimentina y enolasa neuronoespecífica, con negatividad para desmina y citoqueratina. El índice de proliferación nuclear medido con Ki-67 fue del 20 %.
Destaca la intensa positividad difusa intracitoplasmática para c-Kit (CD117) que también se ha descrito en otros sarcomas y neoplasias melánicas (4).
Se han publicado casos diagnosticados en paaf, aunque se trata de un diagnóstico complejo que puede conducir a errores (5).
En los últimos años se ha demostrado, en el 60-75 % de los casos de SCCTA, la translocación cromosómica específica t(12:22)(q13;q12) que afecta a los factores de transcripción ATF-1 en el cromosoma 12 y en el gen EWS en el cromosoma 22 (6). Esta translocación está ausente en el melanoma o en líneas celulares de melanoma y lleva a la conclusión de que ambas entidades suponen dos entidades nosológicas diferentes, a pesar de su inmunohistoquímica similar y el origen histogenético común. En el caso presentado se realizó FISH sobre material incluido en parafina, observándose numerosas células con reordenamiento del gen EWS, lo que confirma el diagnóstico.
Recientemente se ha señalado una alta incidencia de mutaciones en activación del dominio de la tirosin kinasa del gen BRAF en el MM cutáneo, que no se han detectado en el MMPB (7) .
Por tanto, la denominación más adecuada para esta entidad es la de SCCTA, aunque, como se ha señalado, puede describirse en otras localizaciones.
Se plantea diagnóstico diferencial con el resto de tumores primarios melanocíticos de la dermis y tejidos blandos, entidades reconocidas, aunque infrecuentes, como el melanoma primario dérmico, el nevus azul celular, el melanocitoma pigmentado epitelioide y el schwanoma melanocítico. Estas lesiones tienen características histológicas diferenciales y, en algunos casos se asocian a hallazgos clínicos que permiten su reconocimiento.
Recientemente se han denominado como tumores primarios melanocíticos dérmicos tipo-paraganglioma aquellos que no encajan en ninguna de las categorías diagnósticas previamente citadas. La asociación con el paraganglioma es sólo descriptiva (8).
Se ha descrito también un caso de metástasis de melanoma en tendón (9), posibilidad que debe valorarse ante un SCCTA, así como un carcinoma de células renales metastásico, un sarcoma sinovial, Schwannoma maligno epitelioide, melanoma de células fusiformes, melanoma de células dendríticas e interdigitantes, tumor de vaina nerviosa periférica, liposarcoma, fibrosarcoma, etc. (10). La inmunohistoquímica y ahora la comprobación de la existencia de la translocación específica, contribuirán al diagnóstico de SCCTA.
Existe una variante histológica descrita recientemente, el sarcoma mixoide de células claras, con quistes de tamaño variable, con depósito de mucina en el estroma y en la luz de los quistes. El estudio con FISH demostró que se trataba citogenéticamente de un SCC (11).
El curso clínico se caracteriza por evolución lenta e imparable, con frecuentes recurrencias locales y posibilidad de metástasis ganglionares y a distancia (1,2). La paciente presentó al diagnóstico, metástasis ganglionares en retroperitoneo, pulmonares y cerebrales, posteriormente asociadas a complicaciones tromboembólicas.
La necrosis y el gran tamaño tumoral, se consideran indicadores de mal pronóstico (1), como ocurrió en el caso presentado.
La resección quirúrgica completa se plantea incluso como tratamiento exclusivo en tumores pequeños. Determinados autores plantean la linfadenectomía regional e incluso el ganglio centinela (12).
La radioterapia puede controlar la enfermedad microscópica residual post-cirugía. La quimioterapia es ineficaz y el pronóstico es desfavorable en tumores grandes (2).
Nuestra paciente presentaba intensa inmunorreactividad tumoral para c-Kit. Ante el cuadro metastásico avanzado se decidió tratarle con imatinib (Gleevec), a pesar de desconocer la existencia de mutación específica. Este tratamiento fue interrumpido ante la aparición de complicaciones tromboembólicas de las metástasis. Estas expectativas terapéuticas deben ser evaluadas en una casuística más amplia, aunque la utilidad terapéutica de imatinib en un sarcoma sin mutaciones de c-kit es muy dudosa.
|
|
|
Conclusiones
fiogf49gjkf0d
CONCLUSIONES:
- El SCCPB es una neoplasia maligna con un fenotipo similar al de la cresta neural, con características histológicas e inmunohistoquímicas superponibles a un melanoma, pero con rasgos citogenéticos diferentes.
- Por tanto, la denominación más adecuada es la de sarcoma de células claras.
- Esta entidad debe incluirse en el diagnóstico diferencial de lesiones nodulares y/o lesiones melánicas en partes blandas de las extremidades, o en la proximidad de tendones y aponeurosis, sin descartar otras posibles localizaciones.
- En el caso presentado destaca la inmunorreactividad de las células neoplásicas para c-Kit, con expectativas terapéuticas que deben ser evaluadas en una casuística más amplia.
|
|
|
Bibliografía
BIBLIOGRAFÍA
- 1. Dewan M, Malatani TS, Ansari MA. Lessons to be learned: a case study approach. Malignant melanoma of the soft tissue. JR Soc Health 2005 Jan; 125(1): 42-6.
- 2. Ferrari A., Casanova M, Bisogno G et al. Clear cell sarcoma of tendons and aponeuroses in pediatric patients. A report from Italian and German soft tissue Sarcoma Cooperative group. Cancer 2002, Jun 94(12): 3269-3276.
- 3. Ekfors TO, Kujari H, Isomaeki M. Clear cell sarcoma of tendons and aponeuroses (malignant melanoma of soft parts) in the duodenum: the first visceral case. Histopathology 1993, 22 (3): 255-9.
- 4. Hartman JT, Patel S. New drug developments for patients with metastatic soft tissue sarcoma. Curr Oncol Rep. 2005 Jul; 7(4):300-6.
- 5. Tong TR, Chow TC, Chan OW. et al. Clear-cell sarcoma diagnosis by fine-needle aspiration: cytologic, histologic, and ultrastructural features; potential pitfalls and literature review. Diagn Cytopathol. 2002 Mar; 26(3): 174-80.
- 6. Langezaal SM, Graadt van Roggen JF, Cleton Jansen AM. et al. Malignant melanoma is genetically distinct from clear cell sarcoma of tendons and aponeuroses (malignant melanoma of soft parts). Br J Cancer 2001, Feb 84(4): 535-8.
- 7. Panagopoulos I, Mertens F, Isaksson M, Mandahl N. Absence of mutations of the BRAF gene in malignant melanoma of soft parts (clear cell sarcoma of tendons and aponeuroses). Cancer Genet Cytogenet. 2005 Jan 1; 156(1): 74-6.
- 8. Deyrup AT, Althof P, Zhon M. et al. Paraganglioma-like dermal melanocyte tumor: a unique entity distinc from cellular blue nevus, clear cell sarcoma and cutaneous melanoma. Am J Surg Pathol 2004 Dec; 28 (12): 1579-86.
- 9. Silvestri E, Bertolotto M, Perrone R. et al. Case report: US detection of tendinous metastasis from malignant melanoma. Clinical Radiology 1994, 49(4): 288-9.
- 10. Laky D, Voicu DC. Clear cell sarcoma of tendons and aponeuroses (malignant melanoma of soft tissue). A case report. Morphologie et embriologie, 1990, 36 (2): 121-4.
- 11. Kim YC, Vandersteen DP, Jung HG. Myxoid clear cell sarcoma. Am J Dermatopathol. 2005 Feb; 27(1): 51-5.
- 12. Piccioto F, Zaccagna A, Derosa G. et al. Clear cell sarcoma (malignant melanoma of soft parts) and centinel lymph node biopsy. Eur J Dermatol. 2005 Jan.Feb; 15 (1): 46-8.
|
|
|
Comentarios
- Oscar Marin (07/10/2005 18:27:03)
Interesante caso, infrecuente y bien documentado. En nuestro hospital solo registramos 2 casos, con una evolución con recidivas recurrentes. Coincido con Sarcoma de Células Claras como término mas adecuado ya que además -al menos en nuestro medio- el término Melanoma Maligno de Partes Blandas, con su palabra inicial a creado algunos malos entendidos.
- Walter Marcial Martínez Rodríguez (09/10/2005 9:21:58)
Estoy de acuerdo con los autores y con Oscar Marín; hay poca duda de que el sarcoma de células claras es un tumor de origen en ls cresta neural, posiblemente se origine en melanocitos que migraron a los tendones o aponeurosis, la morfología es variable y Tsuneyoshi (1978), distingue entre sarcoma de células claras "sinovial" y sarcoma de células claras tipo "melanótico"; por otra parte la ultraestructura parece apoyar también la histogénesis en melanocitos pues melanosomas en diferentes estadios de desarrollo estan presentes en algunos tumores, así también como que otros presentan la típica estructura lamelar, estriada de los premelanosomas, pero...de ahi a llamarle Melanoma Maligno de Partes Blandas, con la confusión que puede traer???
Saludos y muchas graias por la iconografía
- Manuel Diaz-Marta Puentes (27/07/2011 11:33:39)
1
- Manuel Diaz-Marta Puentes (27/07/2011 11:33:40)
1
- Manuel Diaz-Marta Puentes (27/07/2011 11:33:41)
1
- Manuel Diaz-Marta Puentes (27/07/2011 11:35:50)
1
- Manuel Diaz-Marta Puentes (27/07/2011 11:35:51)
1
- Manuel Diaz-Marta Puentes (27/07/2011 11:35:52)
1
- Manuel Diaz-Marta Puentes (04/01/2012 2:28:37)
1
- Manuel Diaz-Marta Puentes (04/01/2012 2:28:38)
1
- Manuel Diaz-Marta Puentes (04/01/2012 2:28:38)
1
- Manuel Diaz-Marta Puentes (22/01/2012 12:22:38)
1
- Manuel Diaz-Marta Puentes (22/01/2012 12:22:38)
1
- Manuel Diaz-Marta Puentes (22/01/2012 12:22:39)
1
|
|
|
|
|


