
 Comunciación libre
Comunciación libre
|
Expresión de apolipoproteína D en carcinoma de próstata resecable Luis Ovidio González*, Maria Daniela Corte Torres**, Javer Sanchez***, Juan Carlos Rodriguez*, Ivan Pidal*, David Pidal*, Sara Junquera*, Francisco Vizoso* |
|
|
La apolipoproteína D (Apo D) es una lipoproteína componente del sistema de transporte de lípidos en el plasma humano. Se ha demostrado que en líneas celulares de cáncer de mama y próstata su expresión esta regulada por andrógenos. Objetivo: Evaluar la expresión de ApoD en cáncer de próstata resecable así como su posible relación con parámetros clínico-patológicos de los pacientes y sus tumores, además de su posible importancia pronóstica. Materiales y métodos: La expresión de Apo D fue analizada por inmunohistoquímica en muestras de tejido embebido en parafina de un grupo de 132 pacientes tratados con cirugía radical de próstata, por cáncer de próstata localizado clínicamente. Resultados: Un total de 18 tumores (13,6%) no expresaron Apo D, 74 carcinomas (56,1%) fueron débilmente positivos y 25 (18,9%) se tiñeron de forma moderada, mientras que el resto de los tumores 15 (11,4) mostraron una fuerte tinción con el anticuerpo especifico. No se observó ninguna correlación estadísticamente significativa entre la inmunotinción para Apo D y el estadio tumoral, grado de Gleason, niveles de antígeno prostático especifico (PSA) sérico, o márgenes quirúrgicos. Además, los niveles de expresión de Apo D no mostraron una correlación significativa con la probabilidad de recurrencia bioquímica (elevación de los niveles de PSA séricos postoperatorios). Conclusiones: Existe una variabilidad en la expresión de Apo D en carcinomas de próstata localizados. Sin embargo, son necesarios futuros estudios para determinar su posible uso clínico en estos tumores.
|
||
|
|
La apolipoproteína D (Apo D) es una proteína perteneciente al sistema de transporte de lípidos en el plasma humano, de la que existen varias isoformas las cuales muestran como función común la capacidad de unirse y transportar pequeños ligandos hidrofóbicos en el plasma (1). Se ha descrito la expresión de esta apolipoproteína en una amplia variedad de tejidos así como, su capacidad de unirse y transportar distintos ligandos tales como compuestos relacionados con el grupo Hem, progesterona (2) y ácido araquidónico-8, lo que sugiere la participación de esta proteína en distintos procesos biológicos. Tras el hallazgo de esta apolipoproteína en el fluido quistico de mujeres con enfermedad fibroquistica de la mama, así como en secreciones de mama obtenidas de mujeres no lactantes (3, 4), nosotros también hemos reportado la expresión de Apo D en un porcentaje significativo de carcinomas de mama, tanto de mujeres como de varones (5, 6). Además, se ha descrito en otros tumores, como carcinomas de próstata, (7, 8) ovario (9), endometrio (10) o retinoblastomas (11). Por otra parte, estudios “in vitro” demostraron que la secreción de Apo D en líneas celulares de cáncer de mama y próstata es regulada por andrógenos, y está inversamente correlacionada con la proliferación celular (12-14). La expresión tumoral de Apo-D ha sido asociada con un pronóstico favorable en pacientes con cáncer de próstata con enfermedad metastásica y bajo terapia antiandrogénica, lo que sugiere el posible uso de esta lipoproteína como marcador para predecir la respuesta a terapia antiandrogénica en cáncer de próstata avanzado (8). Además, recientemente se ha descrito la presencia de elevados niveles de Apo D en neoplasia intraepitelial prostática de alto grado, la cual es una lesión precursora del cáncer de próstata. Ello sugiere la posibilidad de que la expresión de Apo D pueda representar un marcador de transformación maligna de la próstata (15).
El objetivo de este trabajo fue el de investigar la expresión y posible significación clínica de la expresión tumoral de Apo D en una serie de pacientes tratados con cirugía radical por cáncer de próstata clínicamente localizado
|
|
|
|
Se recogieron muestras tisulares de 132 pacientes de 55-91 años quienes fueron sometidos a prostatectomía retropúbica radical por adenocarcinoma de próstata. Ningún paciente recibió algún tratamiento antes de la cirugía. Las características de los pacientes y sus tumores son mostradas en la tabla 1. Los tumores fueron estadiados de acuerdo a los criterios de la AJCC (16). El grado histológico de los tumores fue establecido según los criterios de Gleason. Los niveles séricos del antígeno prostático especifico (PSA) pre-operatorios y post-operatorios fueron determinados utilizando el “Elecys” (Roche Diagnostic GMBH, Mannheim, Germany).
Tinción inmunohistoquímica
Las tinciones inmunohistoquímicas se realizaron sobre cortes de tejidos de 5-mm, fijados en formol al 10% y embebidos en parafina, utilizando el Kit de detección EnVisionTM, peroxidasa/DAB, DAKO. El anticuerpo contra Apolipoproteína D (diluido 1:100 en Antibody Diluent; Dako) se incubo a temperatura ambiente durante 30 min. Posteriormente, las preparaciones fueron incubadas con EnVision; Dako por 30 minutos a temperatura ambiente, y la reacción fue revelada con solución de diaminobenzidina concentrada (DAB) en buffer sustrato, que contiene peróxido de hidrógeno.
Análisis estadístico Las diferencias entre en la expresión de Apo D entre los grupos fueron realizadas mediante los test de Man-Whitney o Kruskall-Wallis según fuese el caso. Las diferencias fueron consideradas como significativas para una p<0,05.
|
|
|
|
Un total de 114 (86,3%) de los tumores fueron positivos para ApoD, aunque existió una amplia variabilidad en la intensidad y porcentajes de positividad. La tinción positiva para ApoD se localizó en el citoplasma de las células malignas, ejemplos representativos de secciones tisulares con tinción positiva y negativa pueden observarse en la figura 1A y 1B. El análisis semicuantitativo de las secciones de tejido tumoral teñidas fueron llevadas a cabo utilizando un sistema de “HSCORE”, el cual considera tanto la intensidad como el porcentaje de células teñidas. Como muestra la tabla 1. Los valores de hscore variaron de 0 a 270, con un valor medio de 60. En el grupo de 114 tumores positivos, un total de 74 mostraban una tinción débil, 25 moderada y los 15 restantes resultaron fuertemente positivos. Además, pudimos observar una fuerte inmunotinción para la ApoD en estructuras neurales de la cápsula prostática y en el tejido periprostático (figura 2).Al evaluar la posible relación entre la tinción positiva para ApoD y las características de los pacientes y sus tumores (edad, estadio tumoral, hscore de Gleason, niveles de PSA séricos preoperatorios, así como, los márgenes quirúrgicos), pudimos comprobar que no se relacionaron de forma significativa con ninguna de estas características clínico patológicas
|
|
|
|
Existe una amplia variabilidad en la expresión de ApoD en los carcinomas de próstata localizados. Si embargo son necesarios futuros trabajos para determinar su utilidad clínica en estos tumores
|
|
|
|
1. Drayna D, Fielding C, McLean J, Baer B, Castro G, Chen E, et al. Cloning and expression of human apolipoprotein D cDNA. J Biol Chem 1986, 261, 16535-16539. 2. Balbin M, Freije JM, Fueyo A, Sanchez LM, Lopez-Otin C. Apolipoprotein D is the major protein component in cyst fluid from women with human breast gross cystic disease. Biochem J 1990, 271, 803-807. 3. Sanchez LM, Vizoso F, Diez-Itza I, Lopez-Otin C. Identification of the major protein components in breast secretions from women with benign and malignant breast diseases. Cancer Res 1992, 52, 95-100. 4. Vizoso F, Sanchez LM, Diez-Itza I, Luz Lamelas M, Lopez-Otin C. Factors affecting protein composition of breast secretions from nonlactating women. Breast Cancer Res Treat 1992, 23, 251-258. 5. Diez-Itza I, Vizoso F, Merino AM, Sanchez LM, Tolivia J, Fernandez J, et al. Expression and prognostic significance of apolipoprotein D in breast cancer. Am J Pathol 1994, 144, 310-320. 6. Serra C, Vizoso F, Lamelas ML, Rodriguez JC, Gonzalez LO, Merino AM, et al. Comparative study of two androgen-induced markers (apolipoprotein D and pepsinogen C) in female and male breast carcinoma. Int J Surg Investig 2000, 2, 183-192. 7. Aspinall JO, Bentel JM, Horsfall DJ, Haagensen DE, Marshall VR, Tilley WD. Differential expression of apolipoprotein-D and prostate specific antigen in benign and malignant prostate tissues. J Urol 1995, 154, 622-628. 8. Rodriguez JC, Diaz M, Gonzalez LO, Sanchez J, Sanchez MT, Merino AM, et al. Apolipoprotein D expression in benign and malignant prostate tissues. Int J Surg Investig 2000, 2, 319-326. 9. Vazquez J, Gonzalez L, Merino A, Vizoso F. Expression and clinical significance of apolipoprotein D in epithelial ovarian carcinomas. Gynecol Oncol 2000, 76, 340-347. 10. Rojo JV, Gonzalez LO, Lamelas ML, Merino A, Vizoso F. Apolipoprotein D expression in endometrial carcinomas. Acta Obstet Gynecol Scand 2001, 80, 158-161. 11. Alvarez ML, Barbon JJ, Gonzalez LO, Lamelas ML, Vazquez J, Vizoso FJ. Expression of two androgen-induced proteins (pepsinogen C and apolipoprotein d) in epithelial skin cancers of the eyelids. Ophthalmologica 2004, 218, 115-119. 12. Simard J, Dauvois S, Haagensen DE, Levesque C, Merand Y, Labrie F. Regulation of progesterone-binding breast cyst protein GCDFP-24 secretion by estrogens and androgens in human breast cancer cells: a new marker of steroid action in breast cancer. Endocrinology 1990, 126, 3223-3231. 13. Simard J, de Launoit Y, Haagensen DE, Labrie F. Additive stimulatory action of glucocorticoids and androgens on basal and estrogen-repressed apolipoprotein-D messenger ribonucleic acid levels and secretion in human breast cancer cells. Endocrinology 1992, 130, 1115-1121. 14. Sugimoto K, Simard J, Haagensen DE, Labrie F. Inverse relationships between cell proliferation and basal or androgen-stimulated apolipoprotein D secretion in LNCaP human prostate cancer cells. J Steroid Biochem Mol Biol 1994, 51, 167-174. 15. Hall RE, Horsfall DJ, Stahl J, Vivekanandan S, Ricciardelli C, Stapleton AM, et al. Apolipoprotein-D: a novel cellular marker for HGPIN and prostate cancer. Prostate 2004, 58, 103-108. 16. Thompson JA. The revised American Joint Committee on Cancer staging system for melanoma. Semin Oncol 2002, 29, 361-369.
|
|
|
|
- ELSIE BEATRIZ PICOTT RANGEL (14/10/2005 8:02:56)
- Cesáreo Corbacho Cuevas (18/10/2005 20:08:18)
- Nelson Bustamante Sigarroa (29/10/2005 20:45:18)
- Luis Ovidio gonzalez (10/11/2005 11:00:33)
|
|
|
|
|
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 15:10:50
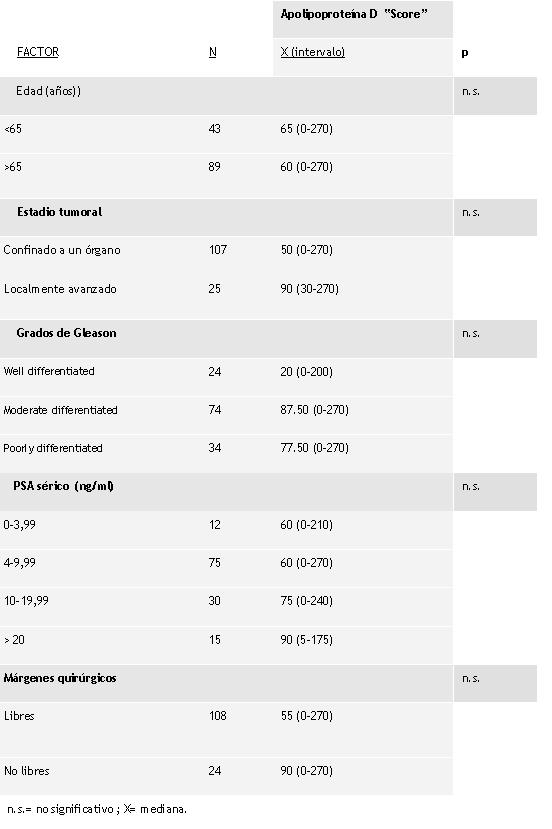 fiogf49gjkf0dDistribución de los”Hscore” de tinción de la ApoD en relación con las características de las pacientes y sus tumores.">
fiogf49gjkf0dDistribución de los”Hscore” de tinción de la ApoD en relación con las características de las pacientes y sus tumores.">