
 Comunciación libre
Comunciación libre
|
Resultados neuropatológicos en pacientes sometidos a cirugía de la epilepsia en el CIREN. Dra. Bárbara Estupiñán Díaz*, Dra. María Caridad De Armas Fernández**, Dr. Carlos Alfonso Sabatier**, Dr. Joaquín Galarraga***, Dr. Héctor Gómez***, Dr. Juan Carlos Rosillo Martí****, Dra. C. Lilia María Morales Chacón*****, Dra. C. Lourdes Lorigados Pedre****, Lic. Lisis Gabriela Martínez Martí****, Dr. Iván García Maeso**** |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
INTRODUCCIÓN. La epilepsia del lóbulo temporal medial, prototipo de síndrome remediable quirúrgicamente posee un sustrato neuropatológico: la esclerosis del hipocampo, detectada por RMN entre el 87-89 % de los pacientes. Se reporta en estos casos que entre el 5 – 30 % la neocorteza temporal u otras estructuras pueden estar afectadas. OBJETIVO. Presentar los resultados anatomopatológicos obtenidos de los primeros pacientes operados en el CIREN con diagnóstico clínico de epilepsia del lóbulo temporal medial refractaria a tratamiento médico. MATERIAL Y MÉTODOS. De Mayo del 2002 a Marzo del 2005 se operaron 10 pacientes, todos con diagnóstico imagenológico de esclerosis hipocampal. La edad promedio fue de 36 años. Se estudió por parafina la neocorteza temporal de los 10 pacientes, en uno de ellos además un pequeño fragmento de hipocampo. Los fragmentos analizados fueron teñidos con H/E y Kluver-Barrera. RESULTADOS. En los 10 pacientes se evidenció daño neuronal crónico. En 6 casos se observó trastornos de la migración, 1 asociado a displasia cortical, 4 a cambios espongióticos, 2 a cuerpos amiláceos y 2 a espacios vasculares amplios. Cambios espongióticos relacionado a daño neuronal crónico en 4 pacientes, uno de estos con quiste aracnoideo y otro con espacios vasculares amplios. CONCLUSIÓN. La epilepsia del lóbulo temporal medial se asocia a cambios neuropatológicos en la neocorteza, en nuestra muestra el 70 % de los casos mostraron patología dual.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
La epilepsia del lóbulo temporal medial (ELTM) es la de mayor incidencia en el adulto y prototipo de síndrome remediable quirúrgicamente cuyo sustrato neuropatológico más frecuente es la esclerosis del hipocampo (EH) o esclerosis mesial del temporal (EMT) (1, 2), detectada por Resonancia Magnética Nuclear (RMN) entre el 87 - 89 % de los pacientes (3). La cirugía de la epilepsia constituye una alternativa terapéutica en estos pacientes por lo que resulta imprescindible una evaluación prequirúrgica multidisciplinaria que permita seleccionar correctamente aquellos casos que serán sometidos a intervención quirúrgica. Nuestro centro consta con un proyecto de cirugía de la epilepsia en la que participan los servicios de Neurología, Neurofisiología, Neuropsicología, Neuroinmunología, Neurorradiología, Medicina nuclear y Neuropatología. Es objetivo de nuestro trabajo presentar los resultados anatomopatológicos obtenidos en los primeros 10 pacientes operados en el CIREN con diagnóstico clínico de ELTM refractaria a tratamiento médico.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
De Mayo del 2002 a Abril del 2005, fueron intervenidos quirúrgicamente 10 pacientes por ELTM refractaria al tratamiento médico en el Centro Internacional de Restauración Neurológica (CIREN). Todos los pacientes fueron sometidos a una evaluación prequirúrgica protocolizada que incluye: 1.- Evaluación clínica y neurológica, detallando la historia de las crisis; 2.- Monitoreo Video – EEG; 3.- Evaluación neuropsicológica; 4.- Estudio de Imágenes, estructurales: RMN y funcionales: Espectroscopia por Resonancia Magnética (ERM) y Tomografía Computarizada con Emisión de Fotón Simple (SPECT) con los cuales se definió la zona epilectogénica. Se realizó en todos lobectomía temporal ajustada por electrocorticografía, que presuponía la resección en bloque de la neocorteza temporal y la aspiración de estructuras mesiales. El tejido resecado en bloque (neocorteza) fue inmediatamente fijado en formaldehído al 10%, cortados en fragmentos más pequeños (3 mm) e incluidos en parafina, cortados a 5 m de grosor y teñidos con hematoxilina / eosina y Kluver-Barrera (luxol fast blue y cresyl violeta).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
La tabla 1 sintetiza los datos clínicos de los 10 pacientes, 5 correspondieron al sexo masculino y 5 al femenino. La edad al momento de la cirugía osciló entre 25 y 52 años con una media de 36. La duración de la epilepsia previo a la intervención fluctuó entre 10 y 34 años con una media de 25.1. El tipo de crisis en todos los pacientes fue de parciales complejas, en 6 de ellos se hizo secundariamente generalizadas y 6 pacientes presentaron antecedentes patológicos personales relacionados con las crisis epilépticas. Mediante la técnica Video – EEG se confirmó el origen de las crisis: región medial de lóbulo temporal, lado izquierdo 6 casos, en el derecho 4. El SPECT demostró hipoperfusión interictal en 9 casos, en 3 de ellos se logró realizar SPECT en estado ictal corroborándose el origen de las crisis. En solo un caso no se realizó este estudio (paciente 5). La ERM evidenció disminución del N acetil Aspartato (NAA) ipsilateral a la zona epileptogénica en el 92 % de los pacientes. La Tabla 2 evidencia que en el 100 % de los casos se confirmó por RMN la EH, diagnóstico que no tuvo confirmación histopatológica por la técnica quirúrgica utilizada. En esta tabla se detallan los hallazgos neuropatológicos obtenidos tras el análisis histológico de la neocorteza de los pacientes. En el total de los pacientes se evidenció daño neuronal crónico (DNC): presencia de neuronas retraídas con núcleo picnótico, en 6 casos se observó trastornos de la migración (TMN): neuronas aisladas o en grupos en la sustancia blanca (Figura 3), 1 asociado a displasia cortical focal (DCF) (Figura 2), 4 a cambios espongióticos (CE) (Figura 5), 2 a cuerpos amiláceos (CA) (Figura 4) y 2 a espacios vasculares amplios. CE relacionado a DNC en 4 pacientes uno de estos con quiste aracnoideo y otro a espacios vasculares amplios. Los hallazgos histológicos de DNC, CE y espacios vasculares amplios los incluimos en el apartado de no específicos. En la tabla 2 se presenta además la evolución postquirúrgica, donde se muestra que el 88.8 % (9 de 10) de los casos se encontraban en la escala I y II de Engel a los dos años de operados, lo que corrobora que la zona epileptogénica, definida prequirúrgicamente fue resecada en toda su extensión. En el anexo 1 se exponen los criterios de la escala de Engel modificada seguidos por el grupo multidisciplinario para la evolución postquirúrgica. Solo dos pacientes presentaron complicaciones temporales posterior a la cirugía: paresia del III y IV par craneal (paciente 1) y una meningitis hemosiderótica (paciente 3) que resolvió con tratamiento médico. No fallecidos en nuestra serie. Tabla 1. Resumen clínico de los pacientes intervenidos.
Leyenda: CPC: Crisis parciales complejas. HTA: Hipertensión arterial. 2 G: Secundariamente generalizadas. Tabla 2. Resultados obtenidos con la RMN y el SPECT. Evolución postquirúrgica según Escala modificada de Engel.
Leyenda: SG: sustancia gris. SB: sustancia blanca. Anexo 1. Escala de Engel modificada para el seguimiento postquirúrgico de las crisis epilépticas.
Se excluyen las crisis postquirúrgicas tempranas (primera semana). Anexo 2. Clasificación histológica de la DCF.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
En nuestra muestra el diagnóstico de EMT se realizó a través de la RMN. En el 100 % de los pacientes las imágenes de RMN evidenciaron atrofia del hipocampo, en tanto el 70 % presentó anomalías en la neocorteza, demostradas histológicamente por lo que afirmamos la presencia de patología dual (coexistencia de EMT con lesiones extrahipocampales). Se reporta que aproximadamente el 30 % de los pacientes con ELTM pueden presentar esta condición (4, 5, 6) lo que contrasta con el elevado por ciento presente en nuestra casuística, la que no puede ser comparada con estas series por el número reducido de casos estudiados por nosotros. Un hallazgo neuropatológico de significación fue la presencia de TMN en 6 pacientes, uno de ellos asociado a DCF, ampliamente descrito en las series quirúrgicas de centros dedicados a la cirugía de la epilepsia (7, 8, 9). El término de displasia cortical se emplea para designar una amplia variedad de trastornos del Sistema Nervioso Central que oscilan desde las lesiones más ligeras, como las alteraciones citológicas sin disrupción de la corteza (displasia cortical ligera o microdisgenesis) hasta las más graves, dado por una disrupción total de la laminación cortical con neuronas dismórficas, con o sin células balonadas (DCF de Taylor), así como heterotopias y giros anormales (8, 10). Tassi y colaboradores han propuesto una clasificación sencilla para las DCF donde se reconocen tres subtipos histológicos: displasia arquitectural, displasia citoarquitectural y DCF de Taylor. El Anexo 2 muestra en detalles las categorías incluidas en cada subtipo (11). Se plantea que las DCF implica una migración neuronal anormal durante el desarrollo intrauterino antes de la 16 semanas de gestación, o que algunas de estas displasias corticales estén relacionadas con irregularidades en la migración de la matriz neuronal hacia la corteza, la que se continua hasta aproximadamente el año de edad. Por otra parte, una diferenciación neuronal anormal posterior al desarrollo y/o proliferación pudieran estar involucrados en la patogénesis de las displasias (12). Otro hallazgo importante lo fue el depósito abundante de cuerpos amiláceos (estructuras redondeadas basófilas) en la superficie meníngea, alrededor de los vasos sanguíneos y en la sustancia blanca de dos pacientes (casos 3 y 8). Es bien conocido que los CA se presentan en una amplia variedad de enfermedades neurodegenerativas y en el cerebro de personas envejecidas (13). Su presencia se ha observado también en el hipocampo de pacientes con ELTM, así como en el tejido extrahipocampal con determinado favoritismo por la sustancia blanca del lóbulo temporal (14, 15). Chung y coautores reportaron la presencia de CA en el 58 % (22 de 38) de hipocampos con esclerosis, en el trabajo de Van Paesschen el 63 % (26 de 41) con EH percibieron CA (16). Loiseau y colaboradores plantean que la abundancia de CA en pacientes con EH pudiera ser una forma localizada de enfermedad por almacenamiento de glucógeno (15). Por otra parte, la correlación inversa entre la densidad de CA y la densidad neuronal hipotetiza, que los CA pueden ser el resultado de la pérdida neuronal según Van Paesschen y coautores planteando además, que los CA son un epifenómeno en los procesos patogénicos que ocurren en la EH, al no encontrar diferencias clínicas en pacientes con diagnóstico de EH con o sin CA (16). En tanto, Cherian y colaboradores en su reporte no hallaron diferencias significativas en cuanto a la evolución de las convulsiones entre los 58 pacientes con EMT, con CA (33 pacientes) y sin CA (25 pacientes) en dos años de seguimiento (17). Los hallazgos histológicos de DNC, CE y espacios vasculares amplios los incluimos en el apartado de no específicos, relacionados con la cronicidad de la epilepsia. En nuestra serie la duración de la epilepsia previo a la cirugía osciló entre los 10 y 34 años, con una media de 25.1, similar a los reportado por otros autores (18, 19). No esta dilucidado en la actualidad la relación entre el tiempo de duración de la epilepsia, y el grado de afectación y atrofia de las estructuras mesiales del temporal (20, 21, 22).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Nuestros resultados confirman que la ELTM se asocia con alteraciones estructurales en la neocorteza en la mayoría de los pacientes.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
1 - Babb TL, Brown WJ. Pathological findings in epilepsy. In: Engel J, ed. Surgical treatment of the epilepsies. New York: Raven Press, 1987:511-540.
2 - Bruton CJ. The neuropathology of temporal lobe epilepsy. New York: oxford University Press, 1988.
3 - Ryvlin P, Coste S, Hermier M, Mauguiere F. Temporal pole MRI abnormalities in TLE. Epilpetic Disord 2002; 4 Suppl 1:533-9.
4 - Levesque MF, Nakasato N, Vinters HV, Babb TL. Surgical treatment of limbic epilepsy associated with extrahippocampal lesions: the problem of dual pathology. J Neurosurg 1991; 75: 364-70.
5 - Cendes F, Cook MJ, Watson C, Andermann F, Fish DR, Shorvon SD, et al. Frequency and characteristics of dual pathology in patients with lesional epilepsy. Neurology 1995; 45:2058-2064.
6 - Cascino GD, Jack CR Jr, Parisi JE, Sharbrough FW, Schreiber CP, kelly PJ, et al. Operative strategy in patients with MRI . identified dual pathology and temporal lobe epilepsy. Epilepsy Res 1993; 14:175-182.
7 - Colombo N, Tassi L, Galli C, Citterio A, Lo Russo G, Scialfa G, et al. Focal cortical dysplasias: MR imaging, histopathologic, and clinical correlations in surgically treated patients with epilepsy. Am J Neuroradiol 2003; 24:724 – 733.
8 - Bautista JF, Foldvary-Schaefer N, Bingaman WE, Luders HO. Focal cortical dysplasia and intractable epilepsy in adults: clinical, EEG, imaging, and surgical features. Epilepsy Res 2003; 55:131-6.
9 - Fauser S, Schulze-Bonhage A, Honegger J, Carmona H, Huppertz HJ, Pantazis G, et al. Focal cortical dysplasias: surgical outcome in 67 patients in relation to histological subtypes and dual pathology. Brain 2004; 127:2406-18.
10 - Palmini A, Andermann F, Oliver A, Tampieri D, Robitaille Y, Andermann E, et al. Focal neuronal migration disorders and intractable partial epilepsy: a study of 30 patient, Ann Neurol 1991; 30:741-9.
11 - Tassi L, Colombo N, Garbelli R, Francione S, Lo Russo G, Mai R, et al. Focal cortical dysplasia: neuropathological subtypes, EEG, neuroimaging and surgical outcome. Brain 2002; 125:1719 – 1732.
12 - Sarnat HS. Disturbance of late neuronal migration in the perinatal period. Am J Dis Child 1987; 141:969 – 80.
13 - Singhrao SK, Neal JW, Newman GR. Corpora amylacea could be an indicator of neurodegeneration. Neuropathol Appl Neurobiol 1993; 19:269-76.
14 - Chung MH, Horoupian DS. Corpora amylacea: a marker for mesial temporal sclerosis. J Neuropatol Exp Neurol 1996; 55:403-8.
15 - Loiseau H, Marchal C, Vital A, Vital C, Rougier A, Loiseau P. Ocurrence of polyglucosan bodies in temporal lobe epilepsy. J Neurol Neurosurg Psychiatry 1992; 55:1092-3.
16 - Van Paesschen W, Revesz T, Duncan JS. Corpora amylacea in hippocampal sclerosis. J Neurol Neurosurg Psychiatry 1997; 63:513-515.
17 - Cherian PJ, Radhakrishnan V, Radhakrishnan K. The significance ofcorpora amylacea in mesial temporal lobe epilepsy. Neurol India 2003; 51:277-279.
18 - Folvary N, Nashold B, Mascha E, Thompson EA, Lee N, McNamara JO, et al. Seizure outcome after temporal lobectomy for temporal lobe epilepsy: a Kaplan – Meier survival analysis. Neurology 2000; 54:630-4.
19 - Elices E, Rumiá J, Cañizares – Alejos S, Boget-Lluciá T, Setoáin-Perego J, Pintor-Pérez L, et al. Cirugía de la epilepsia en un centro de referencia. Rev Neurol 2002; 35:635-9.
20 - Cendes F, Andermann F, Gloor P, Lopes-Cendes I, Andermann E, Melanson D, et al. Atrophy of mesial structures in patients with temporal lobe epilepsy: cause or consequence of repeated seizures? Ann Neurol 1993; 34:795-801.
21 - Trenerry MR, Jack CR Jr, Sharbrough FW, Cascino GD, Hirshorn KA, Marsh WR, et al. Quantitative MRI hippocampal volumes: association with onset and duration of epilepsy, and febrile convulsions in temporal lobectomy patients. Epilpesy Res 1993; 15:247-252.
22 - Liu Z, Nagao T, Desjardins GC, Gloor P, Avoli M. Quantitative evaluation of neuronal loss in the dorsal hippocampus in rats with long-term pilocarpine seizures. Epilepsy Res 1994; 17:237 – 247.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 15:10:50
.jpg) fiogf49gjkf0dFigura 1. Imagen de RMN (FLAIR) que muestra atrofia hipocampal derecha en paciente con ELTM derecha (Caso 7).">
fiogf49gjkf0dFigura 1. Imagen de RMN (FLAIR) que muestra atrofia hipocampal derecha en paciente con ELTM derecha (Caso 7).">
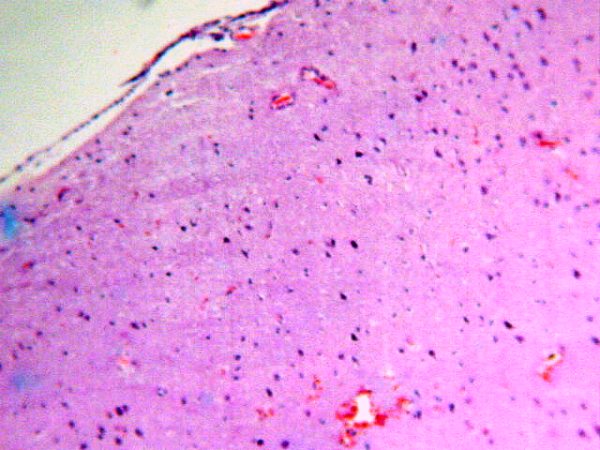 fiogf49gjkf0dFigura 2. DCF. Desorganización de la laminación cortical. H/E.">
fiogf49gjkf0dFigura 2. DCF. Desorganización de la laminación cortical. H/E.">
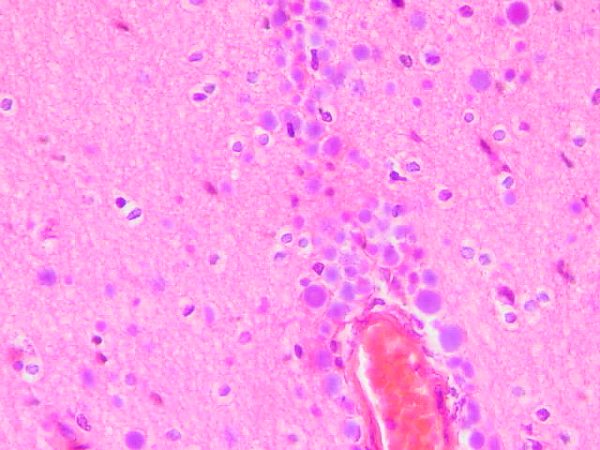 fiogf49gjkf0dFigura 4. Presencia de numerosos CA en SB y perivascular. H/E.">
fiogf49gjkf0dFigura 4. Presencia de numerosos CA en SB y perivascular. H/E.">
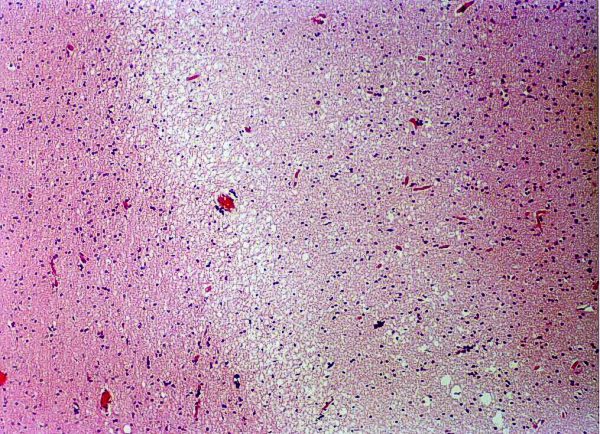 fiogf49gjkf0dFigura 5. Cambios espongióticos en SB. H/E.">
fiogf49gjkf0dFigura 5. Cambios espongióticos en SB. H/E.">