
 Comunciación libre
Comunciación libre
|
LINFOMAS GASTROINTESTINALES EN JUJUY, NOROESTE DE ARGENTINA: Y revisión de la literatura. Oscar Marin* |
|
|
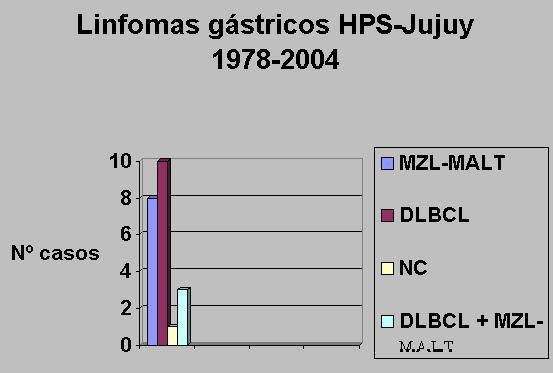
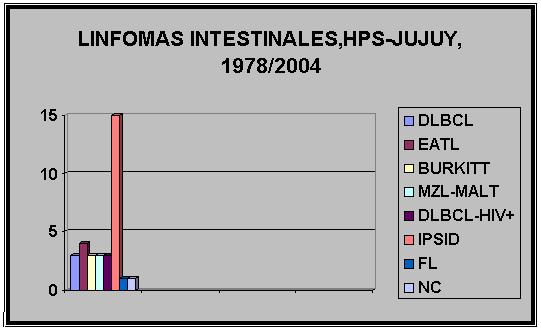
INTRODUCCION: La provincia de Jujuy, localizada en el Noroeste de Argentina presenta elevada incidencia de afecciones linfoproliferativas, entre ellas un elevado número de linfomas no Hodgkin de tipo extraganglionar es registrado. Entre estos los del aparato gastrointestinal, tracto aerodigestivo superior y piel son los mas frecuentes. Sin embargo la incidencia de linfomas del tracto gastrointestinal no ha sido estudiada. MATERIAL Y METODOS: 56 casos de linfomas gastrointestinales registrados en el Servicio de Anatomía Patológica del Hospital "Pablo Soria" de Jujuy, han sido estudiados. El material ha sido obtenido tanto de biopsias endocópicas, como de piezas quirúrgicas. Estudios de rutina con Hematoxilina-Eosina, PAS y Giemsa han sido realizados. Inmunohistoquímica para CD20, CD3, CD30, CD8, CD79a, Ciclina D1, cadenas livianas de inmunoglobulinas kappa, cadenas livianas de inmunoglobulinas Lambda, CD10, ki-67, Bcl-2 y CD5. Diagnósticos de acuerdo a la clasificación de la OMS (2001) RESULTADOS: Se registran: 1) linfomas gástricos (22 c): DLBCL (Diffusse Large B-cell Lymphoma) 10c, MZL-MALT (Marginal Zone Lymphoma of the MALT type) 8c, DLBCL asociado a MZL-MALT 3c, no clasificado 1c. Epigastralgia, pérdida de peso y hemorragia digestiva, fueron los síntomas más comunes. 2) linfomas intestinales (32c): IPSID (Immunoproliferative Small Intestinal Disease) 15c, DLBCL 3c, DLBCL-HIV+ 3c, MZL-MALT 3c, EATL (Enteropathy Associated T-cell Lymphoma) 4c, Linfoma de Burkitt 2c, Burkitt-HIV+ 1c, Linfoma Folicular 1c, no clasificados 1c. Pérdida de peso, vómitos y sub-oclusión intestinal han sido los síntomas más frecuentes. Diarrea en 100 % de casos IPSID. 3) Linfoma sincronicamente afectando estómago e intestino: Linfoma del Manto 1c, MZL-MALT 1c. CONCLUSIONES: Llamativamente el número de linfomas intestinales, es superior al de casos gástricos, contrariamente a lo descrípto en la literatura. La presencia de casos de IPSID 26 % (el mas numeroso de esta serie) parece ser la explicación de ello. Execpto por un caso los restantes IPSID fueron encontrados en estadio C. En 2 casos se observo la entidad Poliposis Intestinal Múltiple, uno de ellos correspondió a un linfoma del Manto y el restante a un linfoma folicular. Caos de EATL con evolución agresiva y 2 de ellos asociados a otros tumores. Cáncer de Mama y gástrico respectivemente. El número de DLBCL gástricos es importante con mala evolución clínica. Entre los casos MZL-MALT los últimos 4 han sido tratados con terapia para erradicación de helicobacter pylori. Control mensual endocópico, con toma de biopsias han sido realizados, con desaparición del linfoma entre 4 y 5 meses luego de instaurada la terapia. Uno de los casos recidivó en Seno piriforme primeramente y luego en zona Amigdalina. El hallazgo de casos de IPSID constituye el aspecto mas sorprendente y llamativo de nuestro estudio.
|
||
|
|
En la provincia de Jujuy (Nor-Oeste de Argentina), las enfermedades linfoproliferativas, especialmente linfomas no-Hodgkin, se encuentran entre las principales neoplasias malignas. Se registra además un elevado índice de linfomas extraganglionares, entre los cuales el aparato gastrointestinal, el tracto aéreo digestivo superior y la piel son las ubicaciones topográficas más frecuentes. 1, 2, 3 Los linfomas extraganglionares, presentan una pronunciada variabilidad geográfica en su incidencia. Ocurren entre 20-50 % de los linfomas no Hodgkin y los linfomas gastrointestinales, se consideran los más frecuentes, en países occidentales. 4 Tradicionalmente se aplicaron al diagnostico de los linfomas gastrointestinales, los criterios de linfomas ganglionares, al considerarse que representaban la contrapartida de estos, en sitio extraganglionar. Isaacson y col. notaron que algunos linfomas gástricos presentan particularidades, que los diferencian de aquellos nacidos en ganglio linfático, denominándolos linfomas del MALT. Estos recapitulan, los rasgos histológicos del tejido linfoide asociado mucosa (MALT-Mucosa Associated Lymphoid Tissue) y se postuló, que los linfomas nacidos en tejido del MALT, representan un tipo distintivo de linfoma. Indicando que la diferencia entre algunos linfomas ganglionares y extraganglionares, no es un simple hecho de localización topográfica, sino que presentan además diferencias biológicas. 4, 5, 6, 7 Isaacson y col. primeramente clasificaron a estos, como linfomas del MALT de bajo y alto grado. Los primeramente nombrados ahora se denominan: Linfoma de la Zona Marginal de tipo MALT (MZL-MALT) y constituyen una entidad clínico-patológica con definidos rasgos clínicos, histológicos e inmunofenotipicos y patogénicos. 8 Se reconocen dos tipos de tejido MALT; uno nativo del intestino constituyendo las placas de Peyer. El restante "adquirido"; presente en diferentes órganos, desarrollándose en respuesta a condiciones inflamatorias, como la gastritis asociada a Helicobacter pylori. Procesos autoinmunes como la tiroiditis de Hashimoto y la Sialoadenitis Mioepitelial (MESA) en el Síndrome de Sjögren, también desarrollan tejido MALT "adquirido". 9, 10 La prolongada estimulación linfoide en estos procesos, lleva con el tiempo al nacimiento de clones linfoides patológicos, que reemplazan a la población linfoide reactiva, originando un linfoma del MALT. Por ello linfoma del MALT no es sinónimo de linfoma gástrico, ya que puede nacer en cualquier tejido mucoso del organismo, encontrándose estos linfomas (con similar estructura histopatológica) en Aparato Digestivo, Pulmón, Piel, Fosas Nasales, Timo etc. Si bien el linfoma gástrico se considera prototípico y es la ubicación topográfica más frecuente de este linfoma. 6, 11 El linfoma de MALT de alto grado, se denomina ahora Linfoma Difuso de Grandes Células B (DLBCL). Es consenso no clasificarlo como linfoma del MALT, aún cuando nace en sitio MALT. 8 En el estómago la presencia de DLBCL, puede en ciertos casos, resultar de la evolución clonal de de un linfoma MZL-MALT previo. Pero también puede surgir "de novo" teniendo similar histología; pero diferentes vías patogénicas. La presencia de linfomas de células T en estómago, es excepcional. En intestino los linfomas constituyen un grupo más heterogéneo, constituido por neoplasias de células B (formas indolentes y agresivas), linfomas de células T y linfomas de células Natural Killer. Muchos de ellos presentan similitud histológica con sus contrapartidas ganglionares, como los linfomas del manto (MCL), linfoma folicular (FL), DLBCL, linfoma de Burkitt etc. Otros no tienen equivalencia con linfomas ganglionares, como los casos de MZL-MALT, IPSID (Immunoproliferative Small Intestinal Disease) y EATL (Enteropathy Associated T-cell Lymphoma). 4, 12 Hasta la llegada de la clasificación de consenso de la OMS-WHO 8, existía una confusión terminológica, basada en la existencia de numerosas clasificaciones, que no permitía un claro entendimiento de esta patología. En diferentes países; se utilizaban disímiles clasificaciones, con distinta nomenclatura y concepto: por ejemplo Rappaport, Lukes y Collins, Bennet, Kiel, REAL. 13-19 En ocasiones en un mismo país o ciudad, se utilizaban distintas clasificaciones. No permitiendo esto, comparaciones válidas entre las diferentes series de linfomas, tanto ganglionares como extraganglionares. Actualmente la clasificación de neoplasias hemolinfoides de la OMS, incorpora avances en el conocimiento de la biología tumoral, inmunofenotipo y genética molecular. Presentando entonces progresos conceptuales en la sistematización de linfomas, incorporando nuevas entidades, redefiniendo otras y agregando estas a entidades "históricas", dentro del espectro de los linfomas malignos. Esta clasificación define ahora a las diferentes neoplasias linfoides, como entidades anatomopatológicas. Es una clasificación de consenso entre especialistas de diferentes partes del mundo, y ha sido propuesta para su uso internacional en el año 2001. 8 La patología hemolinfoide en Jujuy, presenta aspectos particulares. Entre ellos por ejemplo, la incidencia de linfomas presenta similitud con las estadísticas de países asiáticos, mas que de países occidentales. En razón de registrarse elevado número de linfomas de células T/Natural Killer (de elevada prevalencia en China y Corea) y existiendo además casos de Linfomas ATLL (Adult T-cell Lymphoma) asociados a virus de HTLV-1 (Human T-cell Lymphoma/leukemia virus, Type I) que son endémicos en Japón. 20, 21, 22 El objetivo de este trabajo, es el de estudiar la incidencia de linfomas del aparato gastrointestinal, utilizando la nueva clasificación linfomas de la OMS, para conocer las particularidades anatomoclínicas de los linfomas gastrointestinales en nuestro medio.
|
|
|
|
El servicio de Anatomía Patológica del Hospital “Pablo Soria” de Jujuy, recibe (a excepción de un solo hospital) la casi totalidad de biopsias de la esfera estatal, lo que presenta la oportunidad de tener una visión global de las diferentes patologías. Se registran en su archivo 526 linfomas malignos (entre 1978 y 2004) de los cuales 86 casos (16,3 %) corresponden a Enfermedad de Hodgkin y 440 casos (83,6 %) a Linfomas no Hodgkin. Entre los linfomas no Hodgkin el número de casos extraganglionares es de 242 (55 %), registrándose 56 casos (23 %) de linfomas en el aparato gastrointestinal, que corresponden en 32 casos a linfomas intestinales (que representan el 16,9 % del total de linfomas extraganglionares) y en 22 casos (9 %) a linfomas gástricos. Además, en dos casos la neoplasia afectaba simultáneamente estómago e intestino (0,8 %). Se separó para este estudio al grupo de linfomas gastro-intestinales y se los reclasificó histológicamente de acuerdo a la nueva clasificación de consenso propuesta por la OMS/WHO (2001) 8 . También se revisaron los datos de los pacientes en las historias clínicas para conocer de esta manera las características anatomo-clínicas de esta patología en nuestro medio. El material de biopsias procede de biopsias endoscópicas en los casos gástricos, estudiándose además las piezas de gastrectomía en los casos anteriores a 1995. Entre 2000 y 2001 se realizaron estudios de biopsias gástricas sistematizadas de acuerdo al método descripto por Kimura y col. 22b durante Mientras que los casos intestinales fueron estudiados en piezas quirúrgicas intestinales y biopsias rectales. El material fue incluido en parafina, realizándose cortes de 3 micras de espesor y coloreándose de rutina con Hematoxilina-Eosina, Giemsa, PAS y Reticulina según Gomori, además de coloraciones con técnica de Warthin-Starry. Estudios de immunohistoquímica fueron realizados mediante los siguientes marcadores: CD20 (L26), CD79a, Bcl-2, CD3, CD4, CD8, CD5, CD30, Ciclina D-1, Inmunoglobulina A (IgA) y cadenas livianas de inmunoglobulinas Kappa y Lambda. (DAKO).
|
|
|
|
El servicio de Anatomía Patológica del Hospital “Pablo Soria” de Jujuy, recibe (a excepción de un solo hospital) la casi totalidad de biopsias de la esfera estatal, lo que presenta la oportunidad de tener una visión global de las diferentes patologías. Se registran en su archivo 526 linfomas malignos (entre 1978 y 2004) de los cuales 86 casos (16,3 %) corresponden a Enfermedad de Hodgkin y 440 casos (83,6 %) a Linfomas no Hodgkin. Entre los linfomas no Hodgkin el número de casos extraganglionares es de 242 (55 %), registrándose 56 casos (23 %) de linfomas en el aparato gastrointestinal, que corresponden en 32 casos a linfomas intestinales (que representan el 16,9 % del total de linfomas extraganglionares) y en 22 casos (9 %) a linfomas gástricos. Además, en dos casos la neoplasia afectaba simultáneamente estómago e intestino (0,8 %). Se separó para este estudio al grupo de linfomas gastro-intestinales y se los reclasificó histológicamente de acuerdo a la nueva clasificación de consenso propuesta por la OMS/WHO (2001) 8 . También se revisaron los datos de los pacientes en las historias clínicas para conocer de esta manera las características anatomo-clínicas de esta patología en nuestro medio. El material de biopsias procede de biopsias endoscópicas en los casos gástricos, estudiándose además las piezas de gastrectomía en los casos anteriores a 1995. Entre 2000 y 2001 se realizaron estudios de biopsias gástricas sistematizadas de acuerdo al método descripto por Kimura y col. 22b durante Mientras que los casos intestinales fueron estudiados en piezas quirúrgicas intestinales y biopsias rectales. El material fue incluido en parafina, realizándose cortes de 3 micras de espesor y coloreándose de rutina con Hematoxilina-Eosina, Giemsa, PAS y Reticulina según Gomori, además de coloraciones con técnica de Warthin-Starry. Estudios de immunohistoquímica fueron realizados mediante los siguientes marcadores: CD20 (L26), CD79a, Bcl-2, CD3, CD4, CD8, CD5, CD30, Ciclina D-1, Inmunoglobulina A (IgA) y cadenas livianas de inmunoglobulinas Kappa y Lambda. (DAKO).
|
|
|
|
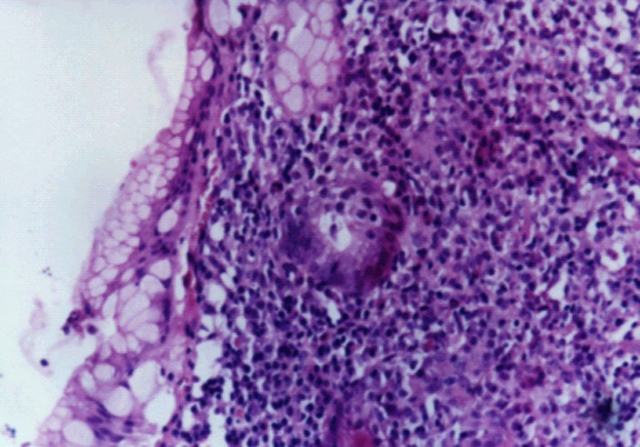
Nuestro estudio ha identificado la incidencia de linfomas del aparato gastrointestinal en nuestra provincia, de acuerdo a las diferentes entidades anatomoclínicas, descriptas en la recientemente propuesta clasificación de linfomas de la OMS/WHO. 8 Los linfomas gastrointestinales representan el 23 % de los linfomas extraganglionares de nuestra serie. A diferencia de lo habitualmente expresado en la literatura, en nuestra serie, los linfomas intestinales superan en incidencia a los linfomas gástricos. Correspondiéndoles a los linfomas primarios gástricos el 39 % de los casos de la serie y a los linfomas intestinales el 57 % de casos. Entre los linfomas primarios gástricos, aquellos de tipo MZL-MALT, constituyen el 36 % de los casos. En el 70 % de estos, se identificó Helicobater pylori. Conocido es el hecho de que linfomas de tipo MZL-MALT; están relacionados etiologicamente con esta bacteria. Y tienen la particularidad, a diferencia de aquellos nacidos en ganglio, de permanecer limitados al órgano de origen por largos períodos de tiempo. Esto es debido a propiedades de rutas específicas de recirculación linfocitaria, como a propiedades de “homing” características, principalmente debido a propiedades conferidas por “adressines” (moléculas “direccionantes” endoteliales) y a la dependencia de los linfocitos B neoplásicos, que requieren para su crecimiento de células T (helper). Según estudios actuales, estos poseen sus propiedades citotóxicas disminuidas y las propiedades “helper” incrementadas. Un ejemplo de las diferencias con linfomas convencionales, es que la invasión de la médula ósea (evento frecuente en linfomas de bajo grado ganglionares), es una rareza en linfoma MZL-MALT. 23, 24, 25, 26, 27, 28, 29 Este tipo de linfoma tiene la particularidad, de nacer en un órgano como el estómago, que no presenta en su estructura original tejido linfoide. Este es adquirido como consecuencia de respuesta al estímulo de Helicobacter pylori y recapitula la estructura histológica de las placas de Peyer, denominándose MALT adquirido 30, 31. Estas observaciones llevaron a la consideración de que estos linfomas, presentan propiedades que los diferencian, especialmente de aquellos nacidos en ganglio linfático. Como consecuencia de esto han surgido nuevas formas de terapia órgano-conservativas, que se han orientado a la erradicación de Helicobacter pylori (asociado etiologicamente a gran porcentaje de estos linfomas) y la erradicación de este lleva a la desaparición de las lesiones linfoides en un 70-80 % de los casos. 32, 33, 34, 35 En los 4 últimos casos de MZL-MALT de nuestra serie se ha llevado a cabo terapia para erradicación de helicobacter pylori, resultando en la desaparición de las lesiones linfomatosas en todos los pacientes, entre 4 y cinco meses después de instaurada la terapia. En estos pacientes se ha realizado un seguimiento mensual con tomas de biopsias para evaluar histológicamente las lesiones, observándose la desaparición gradual del infiltrado linfoide, para finalmente observarse una amplia fibrosis estromal, con desaparición tanto del infiltrado linfoide, como de las glándulas del tejido gástrico. Estos casos son los primeros en los cuales se aplica este tratamiento en nuestra serie. (Fig.1, 2, 3). Los casos anteriores en razón del carácter retrospectivo de este estudio han sido tratados principalmente mediante cirugía, en combinación con quimioterapia y con elevada mortalidad y morbilidad. Sin embargo uno de los casos tratados con terapia para erradicación de Helicobacter pylori, presentó particularidades, como ser la desaparición del infiltrado linfoide linfomatoso a los 6 meses del diagnóstico, con tratamiento antibiótico. Sin embargo, pese a la desaparición del linfoma, se observó permanencia de la bacteria en biopsias sucesivas, con histología de gastritis y presencia de H.Pylori, aún a los 9 meses del diagnóstico original de linfoma. Finalmente no se identificó H. Pylori, a los 17 meses del diagnóstico original. A los 4 años del diagnóstico original, se observó re-aparición de infiltrado linfomatoso, con similares caracteres a los observados en las biopsias gástricas previas, localizados esta vez en biopsia del pliegue gloso-epiglótico y actualmente a 5 años del diagnóstico original de linfoma gástrico de tipo MZL-MALT, este ha recidivado en orofarínge, invadiendo amígdala . Desconociendo si se trata de un linfoma multifocal, con falla en la estadificación del paciente, o si se trata de un linfoma rebelde a la terapia de erradicación de H. Pylori. Pudiendo en este último caso relacionarse con aquellos casos asociados a translocaciones genéticas, que se describen como no respondedores a la terapia de erradicación de helicobacter pylori. Existe un 30 % de casos que no responden a la terapia para Helicobacter Pylori. En estos se ha detectado, la ausencia de helicobacter pylori, como la presencia de translocaciones cromosómicas características o ambas. La translocación cromosómica mas frecuente y mejor estudiada es t(11;18) q21;q21). Esta translocación produce la fusión del gen inhibidor de la apoptosis-2 (API-2), localizado en el cromosoma 11, con un gen denominado MALT1 en el cromosoma 18, resultando en productos quiméricos AP12-MALT1. Está significativamente asociada a infección por CagA “strains” de Helicobacter pylori, sugiriendo que esta translocación esta relacionada con daño directo del ADN, debido a procesos oxidativos ocasionados por neutrófilos, que caracterizan la reacción a CagA. 36 En los casos que responden a terapia para erradicación de Helicobacter pylori esta translocación no se presenta. El estudio de esta alteración genética, permitiría identificar, aquellos casos que no responden a esta terapia. Esta translocacion cromosómica ligada a la expresión intranuclear de Bcl-10 en las células neoplásicas, puede ser identificada por inmunohistoquímica. Actualmente la expresión de BCL10 o de factor nuclear kappa B (NF-κB), se consideran útiles para identificar casos avanzados y casos resistentes a la terapia de erradicación de H. Pylori. 37, 38, 39, 40, 41, 42,43 Otras translocaciones cromosómicas identificadas en MZL-MALT son: t(1;14)(p22;q32) y t(14;18)(q32;q21) y también están asociadas a expresión intranuclear de BCL10, si bien no se encuentran en casos gastrointestinales. 44, 45, 46, 47 Estos hallazgos cambian algunos conceptos y sugieren que existe una llamativa complejidad patogénica en los linfomas gástricos, la cual aún no esta completamente definida. Los casos de MZL-MALT están asociados a 3 translocaciones específicas t(11;18)(q21;q21), t(1;14)(p22;q32) y t(14;18)(q32;q21), que involucran genes, que parecen tener propiedades oncogénicas comunes involucrando una vía oncogénica molecular común, relacionada a NF-κB. 47, 48, 49, 50 Los casos AP12-MALT1 positivos se considera ahora, que están asociados específicamente a MZL-MALT que no responden a terapia para erradicar esta bacteria 47, 49 pero tampoco tienen la capacidad para desarrollar linfomas de tipo DLBCL. Mientras que linfomas MZL-MALT sin esta translocación, responden a terapia para erradicación de Helicobacter pylori. Estos últimos presentan además numerosas alteraciones genéticas, ya sea numéricas, como ganancia en cromosoma 3 y 12, pérdida en 13q, observándose asimismo otras alteraciones, como amplificación del proto-oncogen REL, que pueden llevar mediante progresión clonal a un DLBCL. Esto es apoyado por el hallazgo de idénticos reordenamientos en el gen de inmunoglobulinas pesadas tanto en el componente de pequeñas células, como en el de grandes células, en casos en que estos componentes se asocian. También se han documentado casos con ganancia de 8q24, incluyendo amplificación del proto-oncogen MYC y pérdidas en 2q. Estas alteraciones no están presentes en linfomas de tipo DLBCL, no asociados a componente MZL-MALT, surgiendo “de novo” a través de una diferente vía patogénica. 51, 52 Los linfomas de tipo DLBCL en nuestra serie, representan un elevado porcentaje entre los linfomas gástricos (Fig.3). Este tipo de linfoma tuvo malos índices de sobreviva, comportándose en forma agresiva, pese a la terapéutica quirúrgica y de quimioterapia realizadas. En 3 casos se pudo documentar mediante el estudio de biopsias previas, la transformación desde casos de linfomas de tipo MZL a DLBCL. En estos casos los pacientes tuvieron entre 2 y tres biopsias previas sucesivas, cuyos diagnósticos no consideraban la posibilidad de linfoma. Los informes de anatomía patológica tenían diagnósticos tales como “gastritis linfocitaria”, “gastritis inespecífica” y “Pseudo-linfoma”. Estos pacientes no recibieron terapéutica para linfoma y en un período de entre 2 y tres años desarrollaron un linfoma de tipo DLBCL. Ahora el estudio retrospectivo de estas biopsias ha constatado, que en todos los casos se trataba de lesiones con los caracteres histológicos de linfomas de tipo MZL-MALT y que debido a la época del diagnostico, habían sido mal interpretadas no reconociéndose el linfoma. (Fig. 4 y 5). Los casos de linfomas gástricos en nuestra serie han aumentado su número desde 13 casos registrados en el período de tiempo entre 1984-2000 a 20 casos en marzo del 2002. Es decir los casos registrados en poco más de un año significaron el 35 % de esta serie. No está claro si esto representa un aumento de la incidencia de linfomas gástricos o si es una mejora en la detección de los mismos, debido a la instrumentación de una diferente metodología del estudio endoscópico, que se llevo a cabo en nuestro hospital, durante el año 2000 y 2003, la cual dejo de utilizarse y decayendo también el número de linfomas gástricos diagnosticados. Entre nuestros casos de linfomas intestinales el rasgo más inesperado para nosotros fue el determinar la existencia de casos de linfomas tipo IPSID, que además se han constituido en uno de las principales neoplasias linfoides malignas de nuestra serie (solo superado por la suma de DLBCL gástricos e intestinales) y el más numeroso de los casos intestinales. Un aspecto llamativo al comenzar este estudio, era el hecho de que los linfomas intestinales representaran el mayor número de casos entre los linfomas gastro-intestinales (57 % contra 39 %). Esto en contradicción con lo habitualmente expresado en la literatura, describiéndose al linfoma gástrico, como el principal linfoma gastrointestinal. La dispersión de diagnósticos realizados por diferentes observadores utilizando distintas clasificaciones, no permitió anteriormente identificar a este linfoma, que se encontraba de esta manera enmascarado en nuestro archivo, bajo diferentes diagnósticos como linfomas inmunoblasticos, centroblasticos, plasmablasticos e inclusive linfoma “histiocitico”. La aplicación estricta de las definiciones de linfomas de la clasificación OMS/WHO ha permitido la identificación de IPSID en nuestro medio. (Fig. 6, 7 y 8). Linfomas de tipo IPSID (Immune proliferative small intestinal disease) anteriormente denominados Linfoma Mediterráneo o Enfermedad de cadenas alfa, fueron denominados por la OMS en 1976 como IPSID y reconocidos ahora como una variante del linfoma MZL-MALT. 53 Afecta el intestino delgado, principalmente en regiones cercanas a la válvula ileocecal. Este linfoma se consideraba limitado a países de Oriente Medio, pero luego documentado en la India, Pakistán y México, considerándose ahora un linfoma del tercer mundo 54, Este tipo de linfomas se registra en ciertas localizaciones geográficas en poblaciones de bajo status socioeconómico, con pobres condiciones de higiene y elevado índice de infecciones intestinales infantiles e infestación parasitaria. IPSID se describe asociado a tres estadios de acuerdo a la profundidad de la invasión en la pared gástrica. Los dos primeros (A y B) no se extienden mas allá de la sub-mucosa, son considerados como de bajo grado de malignidad y responden a tratamiento con antibióticos como tetraciclinas. El estadio final es denominado C, con invasión de la pared intestinal en el cual es necesario realizar quimioterapia. A excepción de uno, todos nuestros casos de IPSID han sido diagnosticados en estadio C. Todos fueron hallazgos inesperados en piezas quirúrgicas obtenidas por oclusión o sub-oclusión intestinal, en los que se sospechaba afección tumoral, pero no linfoma. Solo un caso se diagnosticó en biopsia endoscópica, realizada fuera de nuestro hospital y permanece en tratamiento con antibióticos. En todos los casos se trato de tumores voluminosos (Fig. 6). La clínica de estos se caracterizó por antecedentes de diarrea crónica a repetición, síndrome de mala absorción, pérdida de peso y dolor abdominal. Otros aspectos característicos de este linfoma son la producción de inmunoglobulina A (IgA) y el grupo etáreo afectado de adultos jóvenes de entre 18-35 años. Los criterios histológicos utilizados para el diagnóstico de estos en nuestro estudio, además de los definidos por la OMS 8 se basan en otros trabajos sobre IPSID 53, 54, 55, 56, 57, 58, 59 Los criterios histológicos observados por nosotros son: ensanchamiento y/o atrofia de las vellosidades intestinales (Fig.7,8), celularidad linfoide con marcada diferenciación plasmática o plasmocitoide; que en los niveles profundos de infiltración parietal muestran todo el espectro de esta diferenciación, con formas blasticas de tipo inmunoblastos, plasmoblastos e inclusive células multinucleadas de morfología bizarra. Presencia de algunos folículos linfoides residuales de aspecto atrófico. La diferenciación plasmática fue tan intensa y característica, que nosotros inclusive encontramos en los ganglios linfáticos regionales estudiados, una intensa Plasmocitosis intrasinusoidal En los últimos pacientes de nuestra serie se realizó estudio sérico de Inmunoglobulinas detectándose IgA elevada y tanto en estos en forma prospectiva, como en casos anteriores a modo retrospectivo, se realizó estudio de inmunohistoquímica para IgA, siendo positivo en todos los casos. Nosotros encontramos discutible el hecho de que este linfoma se clasifique junto a linfomas de tipo MZL-MALT. Ya que además de presentar diferencias en la presentación epidemiología, clínica, grupo etáreo y etiología (no asociado a H. Pylori); inmunofenotípicamente fueron diferentes con CD20- y CD79a+, además de ser IgA positivos. En algunos casos la población linfoide de células pequeñas resultó CD20+, CD79a-, mientras que la población plasmocitaria, plasmoblastica o de células bizarras resultó CD20-, CD79a+ (también CD138+ en los casos estudiados), mostrando una población dual, no observada en casos de MZL-MALT. Si bien existe similitud histológica en las formas tempranas. Las condiciones socioeconómicas imperantes en nuestra provincia, tras décadas de deterioro y devastación económica de amplios sectores de la población, parecen estar creando las bases para la aparición cada vez mas frecuente de IPSID. La evolución de linfomas IPSID en nuestra serie fue mala por lo tardío del diagnóstico, que excepto el último caso, corresponden a estadios C, con voluminosa masa tumoral e histología agresiva inclusive con formación de células bizarras. (Fig. 9). En 11 casos se documentó la presencia de Ascaris lumbricoides en las piezas quirúrgicas y las historias clínicas de estos pacientes, reflejan antecedentes de diarrea crónica e infecciones bacterianas intestinales a repetición. Algunos pacientes interrogados, pese a vivir en zonas urbanas y con buenas condiciones sanitarias, manifiestan haber vivido en áreas rurales en edad temprana y haber tomado asiduamente agua de acequias, refiriendo antecedentes de diarreas frecuentes en la niñez y presentando síndrome de malabsorción previo al diagnóstico de linfoma. Es referido por algunos autores, que algunos años luego de epidemias de cólera se desarrollan casos de linfomas de Tipo IPSID. Nuestra provincia en la década de los 80 sufrió una epidemia de cólera, lo cual puede brindar una alternativa al pobre status económico imperante como causa de la presencia de IPSID, o sumarse como factor en la presencia de este linfoma en nuestra provincia. 58 Otro linfoma interesante de nuestra serie esta representado por 4 casos de linfomas de tipo EATL (Enteropathy Associated T-cell Lymphoma). Se considera a este un linfoma raro pero de incidencia aumentada en zonas donde se registran casos de enfermedad celíaca. Este linfoma se halla descrito como relacionado a enteropatía, pero el consenso de diagnóstico de este es diagnosticarlo con independencia de la presentación de esta o no. Debido a que existen formas subclínicas de enfermedad y a períodos de latencia de la Enfermedad Celíaca y que no todos los casos se asocian a Enfermedad Celíaca. Por ello la denominación actual de estos es Linfoma Intestinal T (ITL-Intestinal T-cell Lymphoma), que reemplaza al anterior nombre de Linfoma T asociado a Enteropatia (EATL) . 8. Uno de nuestros casos de EATL se presentó en un paciente al que un año antes se le había diagnosticado un carcinoma gástrico del cual se negó a realizar tratamiento y otro en paciente de sexo femenino asociado a carcinoma Lobulillar de mama. Siendo este el único linfoma de nuestra serie, que se asoció a otra neoplasia maligna. Tres de nuestros casos tenían diagnóstico anterior como Histiocitosis maligna. En todos los casos se trató de urgencia abdominal con perforación intestinal y características úlceras circunferenciales dispuestas acompañando el sentido de los pliegues intestinales. La evolución de los pacientes fue mala. Dado el carácter retrospectivo del estudio, no se estudió la presencia de celiaquía en estos casos, ni se realizaron estudios de anticuerpos. Pero en razón de ser piezas quirúrgicas, la revisión de estas demuestra en zonas alejadas al tumor, alteraciones histológicas concordantes con el diagnóstico de celiaquía, observándose pérdida de relación vellosidad/ cripta con atrofia vellositaria, hiperplasia críptica y elevado número de linfocitos intraepiteliales >40/100 enterocitos. Otros linfomas de nuestra serie se presentan en forma ocasional como linfomas de Burkitt en niños y en un paciente con SIDA (Fig. 9) y linfomas de células del manto (MCL) no incidiendo mayormente, en la caracterización de nuestra serie. Se registra un caso de linfoma folicular. Interesantemente la imagen endoscópica de este, con caracteres de Poliposis Linfomatoide, como asimismo el cuadro histológico sugerían la presencia de un linfoma del Manto (MCL), quien es responsable mayormente de estos cuadros. Sin embargo la expresión inmunohistoquímica demostró que se trataba de un linfoma folicular, con expresión de Bcl-2 en los centros germinales y negatividad para ciclina-D1 (que caracterizan al linfoma del Manto) y expresión de CD20, además de ser CD3, CD5 negativo. En conclusión los linfomas del tracto gastro-intestinal presentan la mayor incidencia entre nuestros casos extraganglionares, sin embargo en porcentajes menores a los descriptos en países occidentales. El elevado número de linfomas nasales y del tracto aero-digestivo superior (considerados raros en países occidentales) en una incidencia bastante similar, es la razón para estos porcentajes disminuidos en forma relativa. El linfoma de tipo MZL-MALT es el más frecuente de nuestra serie sumadas las formas de tipo occidental (8 casos gástricos y 3 intestinales) y las formas tipo IPSID que en conjunto representan el 46 % de nuestros casos. El último de estos constituye, a nuestro entender, el aspecto más llamativo de nuestra serie y si lo consideramos separado ya que encontramos discutible su inclusión entre los Linfomas MZL-MALT, es el segundo linfoma de nuestro estudio y el primero de los casos intestinales. Linfomas de tipo DLBCL constituyen un subtipo importante en nuestro estudio, presentando agresiva evolución clínica con mala tasa de sobrevida. Los linfomas de tipo EATL sugieren la posibilidad de elevada incidencia de Enfermedad Celíaca en Jujuy. Otros linfomas tienen presentación solo ocasional en nuestra serie. Queda a determinar si linfomas gástricos de tipo MZL-MALT, presentan un aumento en su incidencia actual o es resultado de mejor metodología de detección. La nueva clasificación de consenso de la OMS/WHO es aplicable al estudio de linfomas del aparato gastrointestinal y útil al definir categorías anatomo-clínicas bien definidas.
|
|
|
|
Entre los linfomas extraganglionares los del aparato digestivo son los más numerosos en nuestra serie. Llamativamente los casos intestinales superan a los casos gástricos, a diferencia de lo habitualmente expresado en la literatura occidental. Sin embargo en oriente medio los casos intestinales presentan incidencia superior a los casos gástricos. Esto es atribuido especialmente a la presencia de IPSID linfoma considerado endémico y descrípto primeramente en áreas mediterráneas, luego informado en otros países como la India, México y Pakistán y considerado ahora un linfoma del 3ºer mundo y presente en nuestra serie de linfomas gastrointestinales, lo que justifica el elevado número de casos intestinales de nuestra serie. Característicamente estos mostraron población bi-celular linfo-plasmocitaria, con predominio de diferenciación plasmática CD79a+, especialmente a la nivel de la mucosa, mientras que células de tipo inmunoblastico-plasmoblastico son observadas en sub-mucosa y células bizarras a niveles mas profundos de infiltración. La expresión inmunohistoquímica con CD20 mayormente negativo y CD79a+ e IgA+ es característica.
Con excepción del linfoma IPSID, el resto de linfomas en nuestra serie es similar a lo observado en la literatura, con mayor número de casos de DLBCL en estómago, presencia de MZL-MALT y regresión de estos con terapia anti-Helicobacer pylori y presencia de casos que combinan DLBCL y MZL-MALT, como ausencia de casos de estirpe celuLar T, raramente encontrados en la literatura y pese a la elevada incidencia de linfomas T/NK en nuestra serie. En intestino todas las formas histológicas fueron observadas con predominio de casos de IPSID.
|
|
|
|
1) Marín O. Neoplasias malignas en Jujuy: Estudio retrospectivo (1978-1997) del material de archivo del Hospital Pablo Soria. Medicrinia Nº 1997 Dic; nº 6: 31-58. 2) Marín O. Patología tumoral maligna en la provincia de Jujuy. 37ª Congreso Argentino de patología, Buenos Aires 22-25 de noviembre de 2000. 3) Marin O. Incidencia de linfomas extraganglionares en Jujuy. 38º Congreso Argentino de Patología, Córdoba, Argentina, 7-10 Noviembre de 2001. 4) Isaacson P G, Norton A J. Malignant lymphomas of the gastrointestinal tract. En Extranodal Lymphomas. Churchill-Livingstone, 1994. 5) Isaacson P, Wrigth D H. Malignant lymphoma of mucosa-associated lymphoid tissue. A distinctive type of B-cell Lymphoma. Cancer 1983; 52:1410-1416. 6) Isaacson P, Wrigth D H. Extranodal Malignant lymphoma arising from Mucosa-associated lymphoid tissue. Cancer 1984; 53: 2515-2514. 7) Isaacson P G, Spencer J. Malignant Lymphoma of Mucosa-associated lymphoid tissue. Histopathology, 1989; 11: 445-462. 8) Jaffe ES, Harris NL, Stein H, Vardinan J. Tumors of the haematopoietic and lymphoid tissues. The World Health Organization Classification of Tumors. 2001, IARC Press.
9) Isaacson P G, Norton A J, Mucosa-associated Lymphoid Tissue (MALT) and the MALT-lymphoma concept. En Extranodal Lymphomas. Churchill-livingstone, 1994; chapter 3. Pp5-15.
10) Raderer M, Isaacson PG. Extranodal lymphoma of the MALT-type: Perspective at the beginning of the 21st century. Expert Rev.Anticancer Ther, 2001; 1(1):53-64. 11) Zucca E, Bertoni F, Roggero E, Cavalli F. The gastric marginal zone B-cell Lymphoma of MALT type. Blood, 2000; 96 (2): 410-419. 12) 13) Rappaport H. Tumors of the hematopoietic system. 1966; AFIP, pp91-204. 14) Anon. National Cancer Institute sponsored study of classifications of non Hodgkin’s lymphoma Pathologic classification project. 1982, Cancer; 49: 2112-2135. 15) Lukes R, Collins R. Immunologic characterization of human malignant lymphomas. Cancer 1974; 34:1488-1503. 16) Lennert K, Mohri N, Stein H, Kaiserling E. The histopathology of non Hodgkin’s lymphoma. 1975; Br J Haematol; 31 (Suppl): 193-203. 17) Isaacson PG, Recent Advances in the Biology of Lymphomas. Eur J Cancer, 1991 vol 27, nº 6 : pp795-802. 18) Lennert K, Feller A. Histopathology of Non Hodgkin’s Lymphoma. 1992; 2nd edn. New York: Springer-Verlag. 19). Harris NL, Jaffe ES, Stein H et al. A revised European-American classification of lymphoid neoplasm: a proposal from the International Lymphoma Group. 1994, Blood; 84: 1361-1392. 20) Marín O, Hasui K, Sato E, et al. Adult T-cell lymphomas, in Jujuy-Argentina. Abstracts of the 9th International conference on human retrovirology 21) Marín O, Hasui K, Remondegui C, Tajima K et al. Adult T-cell leukemia / lymphoma and T/NK-cell lymphomas in native south-Americans in North West 22) Marín O, Hasui K, Sato E et al. Adult T-cell leukaemia / lymphoma (ATLL) in 22b) Kimura K, Satoh K, Hiratsuka H, Concept of specification for biopsy sites, Digestive Endoscopy; 2000, 12:217-220. 23) Wootherspoon AC, Ortiz-Hidalgo C, Falson MR et al. Helicobacter Pylori-associated gastritis and primary B-cell gastric lymphoma. Lancet 1991, 338:1175-1176. 24) Nakamura S, Yao T, Aoyagai K et al. Helicobacter pylori and primary gastric lymphoma. A histopathologic and immunohistochemical analysis of 237 patients. Cancer 1997, 79:3-11. 25) Doglioni C, Wotherspoon AC, Moschini A. et al. High Incidence of primary gastric lymphoma in 26) Parsonnet J, Hansen S, Rodriguez L et al. Helicobacter pylori infection and gastric lymphoma. N.Engl.J.Med. 1994; 330:1267-1271. 27) Huseel T, Isaacson PG, Crabtree JE et al. The response of cells from low-grade B-cell gastric lymphoma of mucosa-associated lymphoid tissue to helicobacter pylori. Lancet 1993; 342:571-574.
28) The route of re-circulation of lymphocytes in the rat. Pro R Soc Lond (Biol) 1994; 159; 257-258. 29) D´elios M, Amedi A, Costa F et al, Impaired T-cell regulation of B-cell growth in Helicobacter Pylori-related gastric low-grade MALT lymphoma. Gastroenterology, 1999, vol 117, nº5: 1105-1112. 30). Wyatt J I, Rathbone B J. Immune response of the gastric mucosa to campylobacter pylori. Scan J Gastroenterol 1988, supp 142:44-49. 31) Stolte M, Eidt S. Lymphoid follicles in astral mucosa: immune response to Campylobacter Pylori? J.Clin. Pathol 1989; 42:1269-1271. 32) Wotherspoon AC, Doglioni C, Dis TC et al. Regression of primary low-grade B-cell gastric lymphoma of the mucosa-associated lymphoid tissue type after eradication of helicobacter pylori. Lancet 1993, 342:575-577. 33) Stolte M, Etdt S. Healing gastric MALT-lymphomas by eradicating H Pylori? Lancet 1993; 342:568. 33) Fischbach W, Kolve M, Engemann R, etc al. Unexpected success of Helicobacter Pylori (Hp) eradication in low grade MALT-lymphoma. Gastroenterology 1996; 100 (Abstract). 34) Roggero E, Zuca E, Pinotti G et al. Eradication of Helicobacter Pylori infection in primary low-grade gastric lymphoma of mucosa-associated lymphoid tissue. Ann Intern. Med 1995; 122:767-769. 35) Ye H, Liu H, Attygalle A, Wotherspoon A, Nicholson A, Charlotte F, Leblond V, Speight P, Goodlad J, Lavergne-Slove A, Martin-Subero I, Siebert R, Dogan A, Isaacson P, Du M-Q. Variable frequencies of t(11;18)(q21,q21) in MALT lymphomas of different sites: significant association with CagA strains of H pylori in gastric MALT lymphoma. Blood;102:1012-1018. 36) Bayerdörffer E, Neubauer A, Rudolph B et al. Regression of primary gastric lymphoma of mucosa-associated lymphoid tissue after cure of Helicobacter Pylori infection. Lancet; 1995; 345:1591-1594. 37) Alpen B, Neubauer A, Dierlamm J et al. Translocation t ( 38) Liu H, Ruskone-Fourmestraux A, Lavergne-Slove A et al. Resistance of t ( 39) Nakamura T, Nakamura S, Yokoi T, Ohashi K, Seto M. Clinicopathologic Comparison between the API2.MALT1 Chimeric Transcript-positive and –negative gastric low-grade B-cell lymphoma of Mucosa-associated Lymphoid Tissue. Jpn. J Cancer Res, 2002, 93:677-684. 40) Ye H, Liu H, Radarer M, Chott A, Ruskone-Fourmestraux A, Wotherspoon A, Dyer M, Chuang S, Dogan A, Isaacson P, Du M. High Incidence of t(11;18)(q21;q21) in Helicobacter pylori-negative gastric MALT lymphoma. Blood, 2003; 101 (7): 2547-2550. 41) Nakamura T, Nakamura S, Yonezumi M, Suzuki T, Matsura A, Yatabe Y, Yokoi T, Ohashi K, Seto M. Helicobacter pylori and the t(11;18)(q21;q21) translocation in gastric low-grade B-cell lymphoma of Mucosa-associated Lymphoid Tissue. Jpn J. Cancer Res. 2000; 91:301-309. 42) Inagaki H, Okabe M, Seto M, Nakamura S, Ueda R, Eimoto T. API2-MALT1 Fusion transcripts involved in Mucosa-Associated Lymphoid Tissue Lymphoma. Am J Pathol 2001,158: 699-706 43) Nakamura S, Matsumoto T, Nakamura S, Jo Y, Fujiwasa K, Suekane H, Yao T, Tsuneyoshi M, Lida M. Chromosomal translocation t(11;18)(q21;q21) in gastrointestinal mucosa associated lymphoid tissue lymphoma. J Clin Pathol 2003;56:36-42. 44) Wotherspoon A, Pan L, Diss T, Isaacson P. Cytogenetic study of B-cell lymphomas of mucosa associated lymphoid tissue. Cancer Genetics and Cytogenetics. 1992; 58:35-38. 45) Streubel B, Lamprecht A, Dierlamm J y col. T(14;18)(q32;q21) involving IGH and MALT1 is a frequent chromosomal aberration in MALT lymphoma. Blood;101:2335-2339. 46) Willis T, Jadayel M, Du M, y col. BCL10 is involved in t(1;14)(q22;q32) of MALT B-cell lymphoma and mutated in multiple tumor types. Cell 1999;96:35-45. 47) Isaacson PG. Update on MALT Lymphomas. Best Practice & Research Clinical Haematology. 2005; 18 (1):57-68. 48) T(11;18)(q21;q21) is associated with advanced mucosa-associated lymphoid tissue lymphoma that expressed nuclear BCL10 49) Liu H, Ye H, Ruskone-Fourmestraux et al. T(11;18) is a marker for all stage gastric MALT lymphomas that will not respond to H.Pylori eradication. Gastroenterology 2002; 122:1286-1294. 50) Yeh K-H, Kuo S-H, Mao T-L, Doong S-L, Wu M-S, Hsu C-H, Tzeng T-S, Chen C-L, Lin J-T, Cheng A-L. Nuclear expression of BCL10 or nuclear factor kappa B help predict Helicobacter pylori-independent status of low-grade gastric mucosa-associated lymphoid tissue lymphomas with or without t(11;18)(q21;q21). Blood 2005; April 21; DOI 10.1182/ Prepublished online 51) Starostik P, Patzner J, Grenier A, Schwarz S, Kalla J, Ott G, Müller-Hermelink H. Gastric Marginal zone B-cell lymphomas of MALT type develop along 2 distinct pathogenic pathways. Blood 2002,99:3-9. 52) Barth T, Brentz M, Lethäuser F, Stilgenbauer S, Siebert R, Schlotter M, Schlenk R, Döhner H, Möller P. Pathogenic complexity of gastric B-cell lymphoma. Blood, 2002; 100 (3): 1095-1096. 53) Alpha-Chain disease and related small-intestinal lymphoma: a memorandum. Bull World Health Organ. 1976, Vol 54: 615-624. 54) Khojasteh A, Haghshenass M, Haghighi P. Immunoproliferative small intestinal disease. A “third world lesion”. N.Eng.J. Med. Vol 1983. 308, nº23: 1401-1405. 55) Asselah F, Slavin G, Sowter G. Immunoproliferative small intestinal disease in Algerians. Cancer, 1983; 52:227-237. 56) Fenoglio-Preiser C, Noffsinger A, Stemmermann G, Lantz P, et alia. Gastrointestinal Pathology. An atlas and text. Second edition. 1999, chapter 24, pp1129-1168. 57) Lecuit M, Abachin E, Martin A, et al. Immunoproliferative Small Intestinal Disease Associated wit Campylobacter Jejuni. New Engl J Med 2004; 350: 239-248. 58) Parsonnet J, Isaacson PG. Bacterial Infection and MALT lymphoma. New Engl J Med 2004; 350: 3:213-215. 59) Al-Salem T, Al-Mondhiry. Immunoproliferative small intestinal disease (IPSID): a model for mature B-cell neoplasms. Blood, 2005;105:2274-2280.
|
|
|
|
- Irma Garcia de Palazzo (06/10/2005 19:22:36)
- Irma Garcia de Palazzo (06/10/2005 19:39:10)
- Irma Garcia de Palazzo (06/10/2005 19:40:17)
- Oscar Marin (07/10/2005 5:27:10)
- Diana Maite Hernandez Fernandez (12/10/2005 18:40:15)
|
|
|
|
|
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 15:10:50
 fiogf49gjkf0d">
fiogf49gjkf0d">
 fiogf49gjkf0d">
fiogf49gjkf0d">
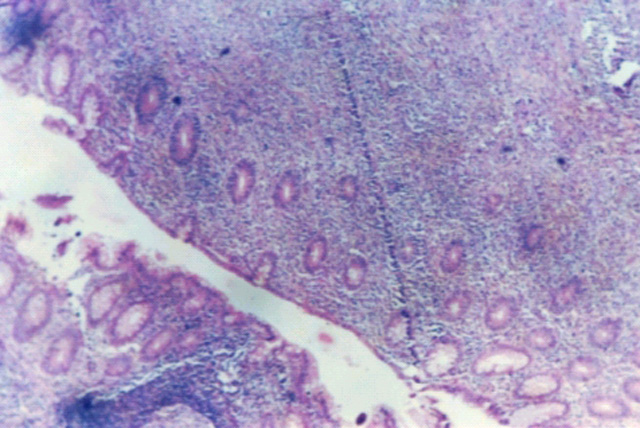 fiogf49gjkf0dSe observa celularidad centrocitoide monótona, desaparición de estructuras glandulares y presencia de lesiones linfoepiteliales y de un folículo linfoide con centro germinal.">
fiogf49gjkf0dSe observa celularidad centrocitoide monótona, desaparición de estructuras glandulares y presencia de lesiones linfoepiteliales y de un folículo linfoide con centro germinal.">
 fiogf49gjkf0d">
fiogf49gjkf0d">
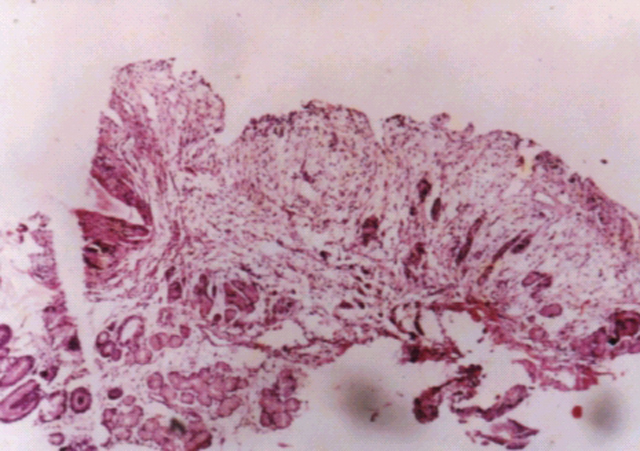 fiogf49gjkf0dImágen histológica de un caso de linfoma de la zona marginal de tipo MALT, 4 meses luego de terapia anti-helicobater pylori. Desaparición del infiltrado linfomatoso y reemplazado del sector glandular dañado por el linfoma, por tejido fibroso.">
fiogf49gjkf0dImágen histológica de un caso de linfoma de la zona marginal de tipo MALT, 4 meses luego de terapia anti-helicobater pylori. Desaparición del infiltrado linfomatoso y reemplazado del sector glandular dañado por el linfoma, por tejido fibroso.">
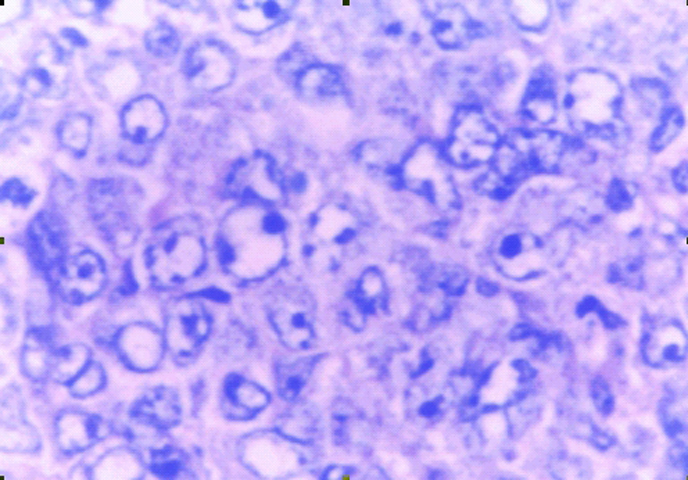 fiogf49gjkf0dLinfoma gástrico de tipo Difuso de Grandes Células B, con característica citología de centroblastos e inmunoblastos.">
fiogf49gjkf0dLinfoma gástrico de tipo Difuso de Grandes Células B, con característica citología de centroblastos e inmunoblastos.">
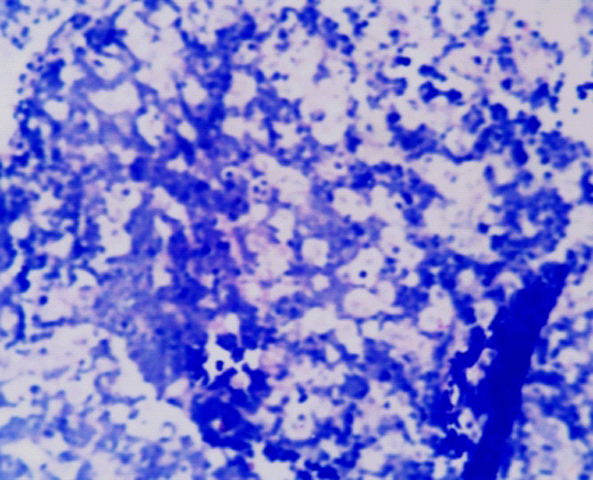 fiogf49gjkf0dCaso pediátrico de 03 años de edad, con afección intestinal por linfoma de Burkitt, con el característico aspecto de "cielo estrellado".">
fiogf49gjkf0dCaso pediátrico de 03 años de edad, con afección intestinal por linfoma de Burkitt, con el característico aspecto de "cielo estrellado".">
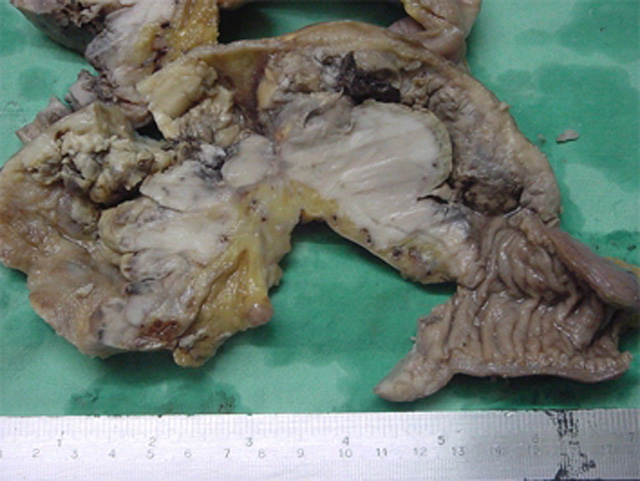 fiogf49gjkf0dPieza qurúrgica: Pseudo-obstrucción intestinal en caso de IPSID (Immunoproliferative Small Intestinal Disease).">
fiogf49gjkf0dPieza qurúrgica: Pseudo-obstrucción intestinal en caso de IPSID (Immunoproliferative Small Intestinal Disease).">
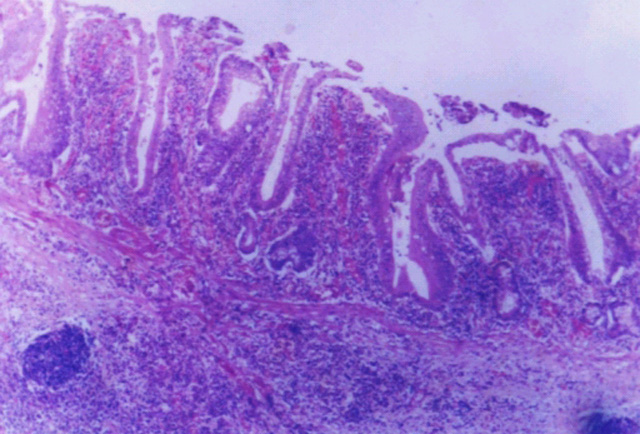 fiogf49gjkf0dSe observa ensanchamiento vellositario en caso de linfoma de tipo IPSID. La celularidad de lámina propia es mayoritariamente con diferenciación de tipo plasmática. Se observa un folículo linfoide residual en sub-mucosa.">
fiogf49gjkf0dSe observa ensanchamiento vellositario en caso de linfoma de tipo IPSID. La celularidad de lámina propia es mayoritariamente con diferenciación de tipo plasmática. Se observa un folículo linfoide residual en sub-mucosa.">
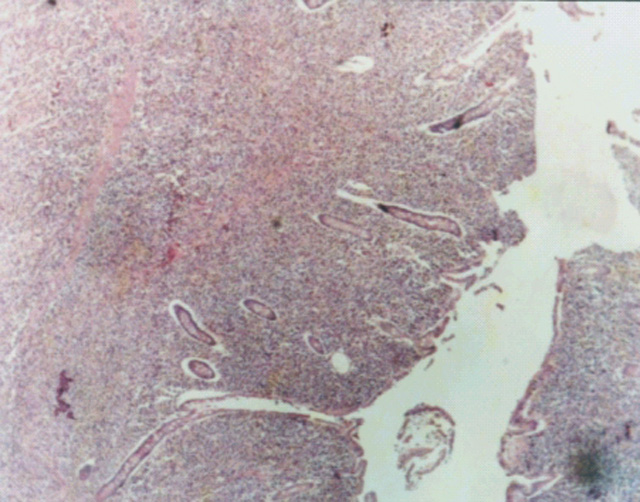 fiogf49gjkf0dSe observa atrofia vellositaria marcada en caso de IPSID.">
fiogf49gjkf0dSe observa atrofia vellositaria marcada en caso de IPSID.">
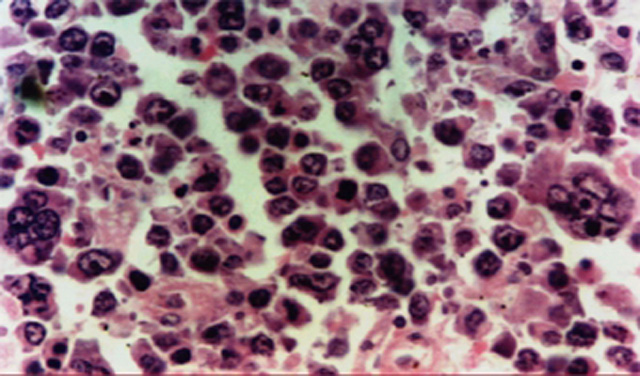 fiogf49gjkf0dA nivel de infiltración profundo, se detectan células con morfología bizarra, a diferencia de la celularidad plasmática predominante en mucosa y submucosa.">
fiogf49gjkf0dA nivel de infiltración profundo, se detectan células con morfología bizarra, a diferencia de la celularidad plasmática predominante en mucosa y submucosa.">