

|
Cambios histológicos en la cóclea en un modelo de ototoxicidad. 1. Microscopía óptica Rosa María Coro Antich*, Sandra Rodríguez**, Odelsa Ancheta**, Tania Valdés**, Yahima Harvey**, Armando Alvaré**, Valia Rodríguez***, Pavel Prado*** |
|
|
Introducción. El daño inducido por drogas terapéuticas ototóxicas está entre las principales causas de pérdidas auditivas. En estudios encaminados a mejorar la eficiencia de los implantes cocleares es conveniente caracterizar morfológicamente las lesiones inducidas por drogas ototóxicas. Objetivo. Analizar la influencia de un tratamiento con kanamicina y furosemida sobre la citoarquitectura del órgano de Corti y del ganglio espiral de cócleas de ratas adultas. Métodos. Al microscopio óptico se estudiaron cortes de cócleas de ratas sanas y sordas, sacrificadas al inicio y al final del experimento. Se llevó a cabo un estudio morfométrico mediante el sistema cubano Digipat. Resultados: 1) A partir de la segunda semana de sordera se observaron cambios degenerativos en el órgano de Corti. 2) A partir de la octava semana hubo reducción significativa de la densidad neuronal del ganglio espiral, acompañada por pérdida de las dendritas que inervan el órgano de Corti, 3) La disminución de la densidad neuronal siguió un gradiente morfológico con mayor pérdida en la base que en el ápice. Conclusión. La degeneración de las dendritas que se proyectan hacia el órgano de Corti, junto con la pérdida gradual de las células ganglionares puede influir sobre la aplicación de los implantes cocleares porque las neuronas del ganglio espiral son sus células diana. En este trabajo se ha delimitado una posible “ventana terapéutica” (hasta la octava semana después de inducida la sordera) correspondiente con un período crítico durante el cual se pueda garantizar el éxito del implante coclear.
|
||
|
|
Las drogas terapéuticas ototóxicas son una de las principales causas de daño en el sistema auditivo (1). En pacientes con sordera inducida por ototoxicidad, los implantes cocleares representan una importante vía de recuperar la audición (2). Para mejorar la eficiencia de los implantes cocleares es conveniente caracterizar morfológicamente, en modelos animales, las lesiones inducidas por drogas ototóxicas en la cóclea. La recuperación de la audición depende en gran medida del tiempo que media entre la aparición de la sordera y el momento en que se realiza el implante coclear. Durante este período de deprivación comienzan a producirse una serie de cambios degenerativos que empeoran con el tiempo y culminan en la muerte celular de los receptores auditivos (células ciliadas del órgano de Corti –OC-) y de las células del ganglio espiral –GE- (primeras neuronas de la vía) (3). La reducción de la población neuronal del GE afecta notablemente la eficiencia de los implantes, pues el funcionamiento de estos dispositivos está basado en la estimulación de los axones de esas neuronas (4). El objetivo de este trabajo fue analizar la influencia en el tiempo de un tratamiento ototóxico con kanamicina y furosemida sobre la citoarquitectura del OC y del GE de ratas adultas.
|
|
|
|
Animales: Se utilizaron 27 ratas machos Wistar adultas entre 250 y 300g de peso. Al inicio del experimento se comprobó la normalidad funcional de la vía auditiva de todos los animales mediante potenciales evocados transientes de tallo encefálico (PEATC) y potenciales evocados de estado estable (PEAEE). Los animales se dividieron en seis grupos de 4 -5 animales cada uno: dos grupos de ratas no tratadas sacrificadas a las 2 y 16 semanas de iniciado el experimento (grupos controles), y cuatro grupos de ratas tratadas con ototóxicos sacrificadas a las 2, 4, 8 y 16 semanas de sordera. Inducción de la sordera: Al inicio del experimento se administró una dosis de kanamicina (400 mg/kg) y furosemida (150 mg/kg) simultáneamente, por vía intraperitoneal, a los 4 grupos tratados. Una semana después se comprobó la instauración de la sordera mediante PEATC y PEAEE. Se consideraron sordos los animales que presentaron umbrales sensoriales superiores a 105 dB nHL. Procesamiento histológico: Los animales se fijaron por perfusión vascular en formalina al 10%. Se extrajeron las cócleas (una de cada animal) e inmediatamente se fijaron por perfusión perilinfática en paraformaldehído al 2% y glutaraldehído al 2% (en buffer fosfato de sodio 0,1 M, pH 7,4). Las cócleas se descalcificaron en EDTA al 8.3%, se pos-fijaron en tetróxido de osmio al 1% (en el mismo buffer fosfato), se deshidrataron en acetona, se incluyeron en bloques de resina spurr y se cortaron en un ultramicrótomo Ultrotome III (LKB). Se obtuvieron cortes semifinos seriados según el plano horizontal de la cóclea, que se tiñeron con Azul de Stevenel (5) y se montaron en láminas de vidrio (6). En las regiones: basal, media inferior, media superior y apical de la cóclea (Fig. 1) se estudiaron de 5 a 10 cortes por cóclea, separados entre sí por 5 cortes. Estudio cualitativo: Al microscopio óptico se estudió el estado del OC, de los procesos periféricos que lo inervan (dendritas de las neuronas del GE que se proyectan radialmente desde los cuerpos celulares hasta el OC) y de las neuronas del GE dentro del canal de Rosenthal (Fig. 2). Estudio cuantitativo: Se empleó el sistema cubano para morfometría de imágenes Digipat (7). En cada imagen se determinó el área del canal de Rosenthal y se contaron las neuronas dentro del canal (Fig. 2). Se calculó la densidad neuronal (DN), expresada como neuronas por mm2, dividiendo el número de células entre el área del canal de Rosenthal. Se analizaron todos los valores de DN correspondientes a las vueltas: basal, media y apical de la cóclea de cada animal. Para la vuelta media se tomaron todos los valores de las regiones media inferior y media superior. Para cada grupo se compararon las DN entre vueltas. Para cada vuelta se compararon las DN entre grupos. Se comparó además la DN coclear promedio de las tres vueltas entre grupos. Procesamiento estadístico: En todos los casos se determinaron los valores de media y desviación estándar mediante estadística descriptiva. Las comparaciones se realizaron utilizando la prueba no paramétrica de Kruskal Wallis y la prueba de comparaciones múltiples de Dunn.
|
|
|
|
RESULTADOS CUALITATIVOS
Animales controles: Organo de Corti: Morfología normal en las 3 vueltas de la cóclea: 3 filas de células ciliadas externas, de forma cilíndrica, con el extremo apical aplanado y el núcleo redondeado, localizado en la porción basal del cilindro. Las células ciliadas internas presentaron forma de pera con un núcleo redondeado central (Fig. 3A). Ganglio espiral: Las neuronas, muy próximas unas de otras, ocuparon todo el espacio del canal de Rosenthal en las vuelta apical (Fig. 4A) y media (Fig. 4B) observándose cierta escasez de neuronas hacia la vuelta basal (Fig. 4C). Los procesos periféricos, en las 3 vueltas cocleares, se presentaron en forma de haces de fibras apretadas en la lámina espiral ósea (Fig. 4A-C). Animales sordos: Organo de Corti: En las 3 vueltas de la cóclea, a partir de la segunda semana, se observaron signos de degeneración, desde pérdida del patrón celular normal (epitelio en mosaico) (Fig. 3B), hasta la sustitución del órgano de Corti por una capa de células aplanadas (Fig. 3C). Ganglio espiral: En las 3 vueltas de la cóclea, a partir de la cuarta semana de inducida la sordera, se observó cierta separación entre los cuerpos neuronales y vaciamiento de la lámina espiral ósea por pérdida de fibras. (Fig. 4D-I). RESULTADOS CUANTITATIVOS
En las 3 vueltas cocleares, hasta las 8 semanas de sordera no hubo diferencias significativas de la DN con respecto al control y a partir de ese momento se produjo una disminución progresiva y significativa de la DN siguiendo un gradiente del ápice a la base (Fig. 5). A partir de las 4 semanas de sordera se produjo una disminución progresiva de la DN coclear promedio, que sólo fue significativa estadísticamente a las 8 y 16 semanas de sordera, con disminuciones de 36% a las 8 semanas y de 79% a las 16 semanas, con respecto al grupo control (Figs. 5-6).
|
|
|
|
La mayoría de las ototoxinas, incluyendo los agentes quimioterapéuticos y antibióticos aminoglicósidos, tienen como blanco primario a las células ciliadas, pero afectan también a las neuronas del ganglio espiral (8, 9, 10). El aminoglicósido kanamicina induce una sordera sensorineural al provocar pérdida de células ciliadas y posteriormente degeneración de las neuronas del GE, lo que ha sido comprobado en varios modelos animales (11-15). La furosemida induce daño ototóxico temporal de poca relevancia clínica (16), pero, igual que otros diuréticos, potencia la acción ototóxica de los aminoglicósidos (17). La efectividad del modelo de sordera empleado en esta investigación se ha comprobado en trabajos anteriores (18, 19). En humanos, la mayoría de las sorderas son de origen sensorineural (20), y se plantea que el daño neuronal del GE se debe a la pérdida del efecto trófico que ejercen las células ciliadas sobre esas neuronas (21). La escasez de los procesos periféricos que inervan el OC, conjuntamente con la pérdida de somas neuronales del GE en animales sordos, se ha descrito como signo de degeneración en varios modelos animales (22) y también se observó en este trabajo. La pérdida de las dendritas hace que el sitio de generación de potenciales de acción tenga que trasladarse hacia el soma de las neuronas del GE o al axón central, lo que tiene implicaciones para la aplicación de los implantes cocleares (23). En este estudio se observó una disminución significativa de la DN hacia la vuelta basal en todos los animales controles. Se ha observado un comportamiento similar a éste en ratones, que se ha atribuido al envejecimiento (24, 25). En los animales sordos ocurrió una disminución significativa de la DN hacia la vuelta basal que sí se corresponde con la pérdida de audición demostrada por los PEATC y PEAEE. La base de la cóclea es la región donde se transducen las altas frecuencias; las bajas frecuencias se transducen en el ápice. El rango de frecuencias se distribuye tonotópicamente a lo largo del conducto coclear, desde la base hasta el ápice. El daño inducido por ototóxicos sigue un gradiente morfológico coclear que se expresa como mayor sensibilidad (pérdida de células ciliadas y neuronas) en la base que en el ápice (26). También se ha planteado que el gradiente de base a ápice observado en el daño inducido por aminoglicósidos puede ser resultado de una susceptibilidad diferencial de las células ciliadas externas a las especies reactivas del oxígeno que genera el agente ototóxico (27). En los grupos de animales sordos la disminución de la DN respecto al control fue mayor en la vuelta media que en las vueltas apical y basal. Un fenómeno similar ocurre durante la ototoxicidad inducida por el antibiótico aminoglicósido neomicina (28). La reducción significativa de la DN promedio observada en este trabajo a partir de la octava semana, coincide exactamente con lo obtenido por Hellier y colaboradores (15) al provocar daño ototóxico a curieles mediante el tratamiento con kanamicina y diurético. Para mejorar la supervivencia neuronal del ganglio espiral se podrían emplear otros tratamientos tales como el uso de ciertos factores neurotróficos y/o agentes antioxidantes para la prevención de la degeneración neuronal, así como la regeneración de las neuronas auditivas dañadas. Esto ha sido demostrado in vitro (29), en animales de experimentación (30) y en pacientes (20). Estos enfoques para resolver la sordera demuestran la importancia que tiene la comprensión de los cambios morfológicos que están ocurriendo en la cóclea. En este trabajo se ha delimitado una posible “ventana terapéutica” (hasta la octava semana después de inducida la sordera) correspondiente con un período crítico durante el cual se pueda garantizar el éxito del implante coclear. La marcada similitud de los cambios patológicos del oído interno entre roedores y humanos (31) permitiría aplicar los conocimientos obtenidos en ensayos clínicos con pacientes afectados por drogas ototóxicas.
|
|
|
|
1 - Zheng JL, Gao WQ. Differential damage to auditory neurons and hair cells by ototoxins and neuroprotection by specific neurotrophins in rat cochlear organotypic cultures. Eur J Neurosci 1996; 8: 1897-905.
2 - Seligman PM, Shepherd RK. Chapter 6.3. Cochlear implants. En Horch KW & Dhillon GS, eds. Neuroprosthetics: Theory and Practice. Singapur: World Scientific Publishing; 2002. p.1-27.
3 - Leake PA, Snyder RL, Rebscher SJ, Hradek GT, Moore CM, Vollmer M, Sato M. Chapter 3. Long-Term Effects of Deafness and Chronic Electrical Stimulation of the Cochlea. En Waltzman and Cohen, eds. Cochear Implants. New York: Thieme Medical Publishers Inc.; 2000. p. 31-41.
4 - Shepherd RK, Hardie NA. Deafness-Induced Changes in the Auditory Pathway: Implications for Cochlear Implants. Audiol Neuro-Otol 2001; 6: 305-18.
5 - Del Cerro M, Cogen J, Del Cerro C. Stevenel´s Blue, an excellent stain for optical microscopical study of plastic embedded tissue. Microsc Acta 1980; 83: 117.
6 - Rodríguez S, Valdés T, Harvey Y, Ancheta O, Rodríguez V, Alvaré A, Coro RM, Prado P, Gutiérrez F, Valmaña C, Feston M. Preparación histológica de cócleas de ratas y su aplicación a estudios de sordera. Rev CENIC Ciencias Biol 2004; 35 (Supl): en prensa.
7 - Coro RM, Borrajero I. DIGIPAT: Un sistema cubano para morfometría de imágenes. Rev Patol 1996; 34: 9 -10.
8 - Bichler E, Spoendlin H, Rauchegger H. Degeneration of cochlear neurons after amikacin intoxication in the rat. Arch. Otorhinolaryngol 1983; 237 (3): 201-8.
9 - Gabaizadeh R, Staecker H, Liu W, Kopke R, Malgrange B, Lefebvre PP, Van der Water TR. Protection of both auditory hair cells and auditory neurons from cisplatin induced damage. Acta Otolaryngol 1997; 117 (2): 232-8.
10 -McFadden SL, Ding D, Jiang H, Salvi RJ. Time course of efferent fiber and spiral ganglion cell degeneration following complete hair cell loss in the chinchilla. Brain Res 2004; 997: 40-51.
11 - Lim DJ. Ultratstructural cochlear changes following acoustic hyperstimulation and ototoxicity. Ann Otol Rhinol Laryngol 1976; 35 (6PT.1): 740-51.
12 - Xu SA, Shepherd RK, Chen Y, Clark GM. Profound hearing loss in the cat following the single co-administration of kanamycin and ethacrynic acid. Hear Res 1993; 70: 205-15.
13 - Wu WJ, Sha SH, McLaren, JD, Kawamoto K, Raphael Y, Schacht J Aminoglycoside ototoxicity in adult CBA, C57BL and BALB mice and the Sprague Dawley rat. Hear Res 2001; 158: 165-78.
14 - Illinskaya EV, Atamanova NV. Ultrastructural study of the organ of Corti in animals given kanamycin and ceruloplasmin. Vestn Otorinolaringol 1997; 4: 24-6.
15 - Hellier WPL, Wagstaff SA, O’Leary SJ, Shepherd RK. Functional and morphological response of the stria vascularis following a sensorineural hearing loss. Hear Res 2002; 172: 127-36.
16 - Bourke B. Frusemide, Bumetanide and Ototoxicity. The Lancet 1976; 307: 917-8.
17 - Yamane H, Nakai Y, Konishi K. Furosemide-induced alteration of drug pathway to cochlea. Acta Otolaryngol 1988; 447 (Suppl. 447): 28-35.
18 - Prado P, Alvaré A, Rodríguez V. Efecto de la sordera sensorineural sobre el ganglio espiral de ratas adultas: Desarrollo de un biomodelo. Rev. CENIC Ciencias Biológicas 2004; 35 (Supl): en prensa.
19 - Rodríguez S, Valdés T, Harvey Y, Ancheta O, Coro RM, Rodríguez V. Effects of an induced deafness in the spiral ganglion cells’ density: a morphometric study. Restor Neurol Neurosci 2003; 21: 300.
20 - Lefebvre PP, Staecker H, Van de Water T, Moonen G, Malgrange B. Pharmacologic treatment of inner ear: from basic science to the patient. Acta Otorhinolaryngol Belg 2002; 56: 45-9.
21 - Kopke R, Staecker H, Lefebvre P, Malgrange B, Moonen G, Ruben RJ, Van de Water TR Effect of neurotrophic factors on the inner ear: clinical implications. Acta Otolaryngol 1996; 116: 248-52.
22 - Leake P, Hradek GT, Snyder RL. Chronic electrical stimulation by a cochlear implant promotes survival of spiral ganglion neurons after neonatal deafness. J Comp Neurol 1999; 412: 543-62.
23 - Shepherd RK, Baxi JH, Hardie NA. Electrical stimulation of the auditory nerve: single neuron strength –duration functions in deafened animals. Ann Biomed Eng 2001; 29: 195-01.
24 - Dazert S, Feldman ML, Keithley EM. Cochlear spiral ganglion cell degeneration in wild-caught mice as a function of age. Hear Res 1996; 100: 101-6.
25 - Keithley EM, Canto C, Zheng QY, Fischel –Ghodsian N, Johnson KR. Age-related hearing loss and the ahl locus in mice. Hear Res 2004; 188: 21-8.
26 - Raphael Y, Altschuler RA. Structure and innervation of the cochlea. Brain Res Bull 2003; 60: 397-22.
27 - Sha SH, Taylor R, Forge A, Schacht J. Differential vulnerability of basal and apical hair cells is based on intrinsic susceptibility to free radicals. Hear Res 2001; 155: 1-8.
30 - Staecker H, Gavilonic-Schwartz V, Liu W, Lefebvre P, Kopke R, Malgrange B, Moonen G, Van der Water TR. The role of neurotrophins in maturation and maintenance of postnatal auditory innervation. Am J Otol 1996; 17: 486-92.
31 - Staecker H, Kopke R, Malgrange B, Lefebvre P, Van der Water TR. NT-3 and/or BDNF therapy prevents loss of auditory neurons following loss of hair cells. Neuroreport 1996; 7: 889-94.
|
|
|
|
- ELSIE BEATRIZ PICOTT RANGEL (14/10/2005 8:04:10)
- Mª TERESA CORCUERA PINDADO (14/10/2005 13:52:47)
- Rosa María Coro Antich (16/10/2005 6:39:25)
- Manuel Diaz-Marta Puentes (05/01/2012 4:22:47)
- Manuel Diaz-Marta Puentes (05/01/2012 4:22:48)
- Manuel Diaz-Marta Puentes (05/01/2012 4:22:48)
|
|
|
|
|
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 14:10:50
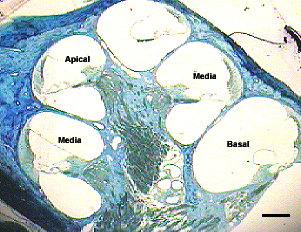 fiogf49gjkf0dFigura 1: Vista panorámica de la cóclea en el plano horizontal. Animal control. Regiones cocleares estudiadas: Apical (A), Media (M), y Basal (B). Barra = 200 micras.">
fiogf49gjkf0dFigura 1: Vista panorámica de la cóclea en el plano horizontal. Animal control. Regiones cocleares estudiadas: Apical (A), Media (M), y Basal (B). Barra = 200 micras.">
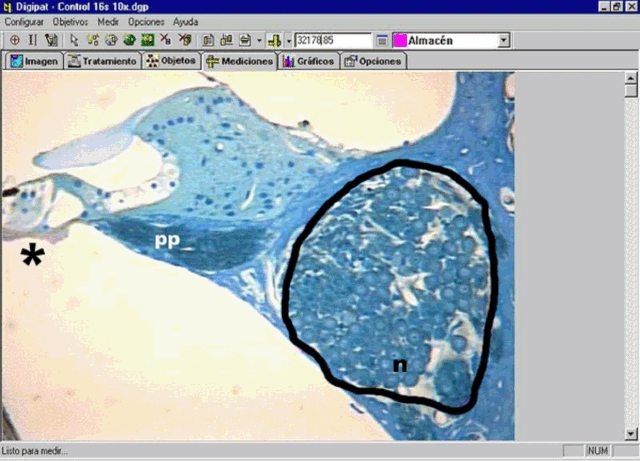 fiogf49gjkf0dFigura 2: Pantalla del sistema Digipat mostrando la delimitación del canal de Rosenthal. Neuronas (n), procesos periféricos que inervan el órgano de Corti (pp) y porción del órgano de Corti (*).">
fiogf49gjkf0dFigura 2: Pantalla del sistema Digipat mostrando la delimitación del canal de Rosenthal. Neuronas (n), procesos periféricos que inervan el órgano de Corti (pp) y porción del órgano de Corti (*).">
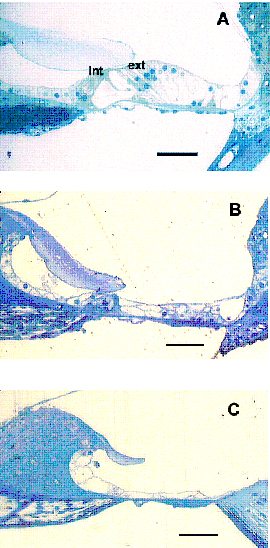 fiogf49gjkf0dFigura 3: Organo de Corti. Células ciliadas internas (int), células ciliadas externas (ext). A: Control, B y C: Sordera 4 semanas. Barras = 50 micras.">
fiogf49gjkf0dFigura 3: Organo de Corti. Células ciliadas internas (int), células ciliadas externas (ext). A: Control, B y C: Sordera 4 semanas. Barras = 50 micras.">
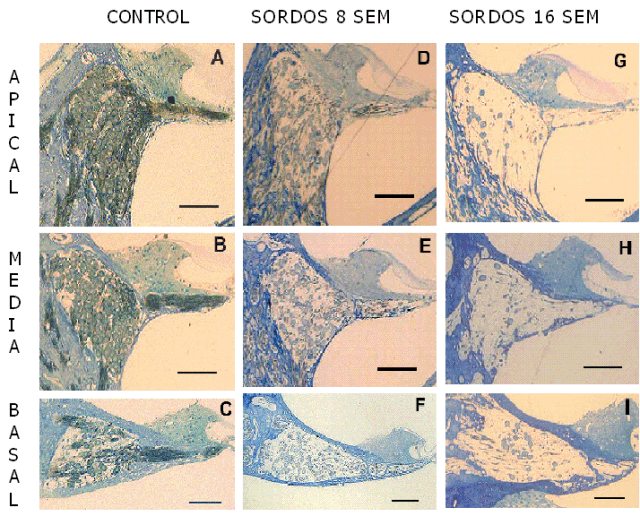 fiogf49gjkf0dFigura 4: Cortes semifinos de cócleas de ratas en las vueltas apical, media y basal. Barras = 100 micras.">
fiogf49gjkf0dFigura 4: Cortes semifinos de cócleas de ratas en las vueltas apical, media y basal. Barras = 100 micras.">
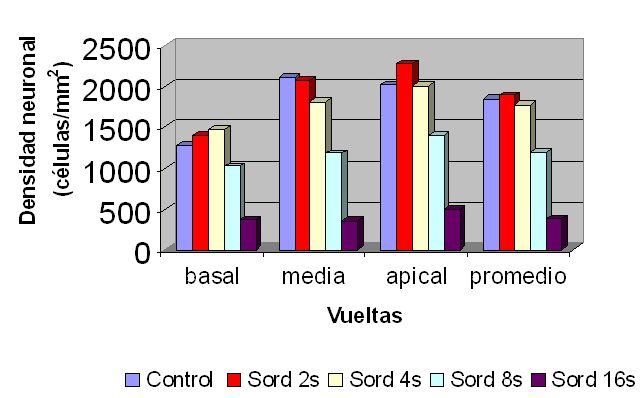 fiogf49gjkf0dFigura 5: Densidad neuronal por vuelta coclear y promedio.">
fiogf49gjkf0dFigura 5: Densidad neuronal por vuelta coclear y promedio.">
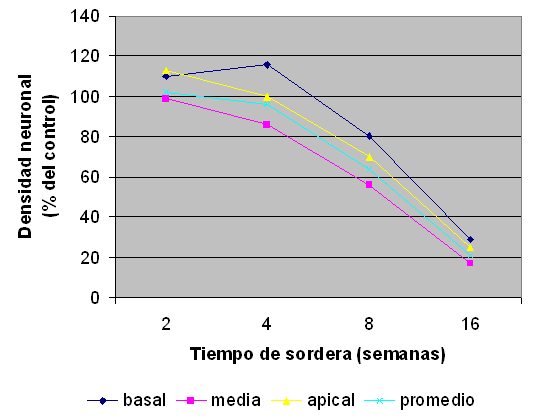 fiogf49gjkf0dFigura 6: Densidad neuronal según el tiempo de sordera.">
fiogf49gjkf0dFigura 6: Densidad neuronal según el tiempo de sordera.">