

|
Hallazgos morfológicos, clínicos y electroneuromiográficos en pacientes con Neuritis leprosa pura Héctor Gómez Suárez*, Joaquín Galarraga Inza*, Rosa María Coro Antich*, María Xiomara Gil Gil* |
|
|
Introducción: La enfermedad de Hansen constituye un problema de salud mundial porque anualmente se reportan de 10 a 20 millones de casos. La tasa de incidencia de la Lepra en Cuba es de 2,2 x 100,000 habitantes (año 2004), lo que representa entre 250 y 300 casos nuevos al año. Las manifestaciones neurológicas de la Lepra son importantes porque algunos pacientes desarrollan neuropatías antes del diagnóstico de la enfermedad de Hansen, con los consecuentes riesgos que implica este retardo. Otros pacientes, en cambio, manifiestan las neuropatías después de iniciado el tratamiento antileproso. Objetivos: Presentar los hallazgos clínicos, electroneuromiográficos e histopatológicos en una serie de casos diagnosticados como neuritis leprosa pura. Pacientes y métodos: Se revisaron expedientes clínicos de 13 pacientes atendidos en el Instituto de Neurología y Neurocirugía. Se estudiaron los cortes de los nervios biopsiados. Las tinciones realizadas fueron: Fiti- Faraco, Weigert-Pal, Hematoxilina-Eosina y Tricrómica de Masson. Resultados: Las alteraciones sensitivas fueron el hallazgo más frecuente en el examen clínico. Casi la mitad de los casos presentaron Mononeuritis múltiple o Polineuropatía mixta. Las alteraciones electroneuromiográficas más frecuentes fueron la desmielinización y la lesión axonal. El estudio al microscopio óptico mostró fundamentalmente infiltrado inflamatorio mononuclear, macrófagos con bacilos y bacilos libres en el tejido. Otros hallazgos histopatológicos fueron la fibrosis, infiltrado inflamatorio con granulomas epiteliodes, pérdida de vainas mielínicas y remielinización.Conclusiones: Ante determinados síntomas, es necesario tener presente que la lepra puede ser el diagnóstico. Se recomienda tener a punto la técnica de Fiti-Faraco, identificadora del M. leprae.
|
||
|
|
La enfermedad de Hansen no es un problema de salud en los países desarrollados. En cambio, esta enfermedad resulta de interés como un problema de salud mundial pues cada año se reportan de 10 a 20 millones de casos nuevos (1).
En Cuba, en el año 2003 la tasa de incidencia de las diferentes variedades de lepra fue de 2,2 x 100,000 habitantes. Los reportes de años anteriores refieren: 330 casos en 1970, 339 en 1975, 306 en1980, 310 en 1990, 278 en 2000, 267 en 2001, 316 en 2002 y 251 en 2003 (2).
Está bien aceptada la afinidad del Mycobacterium leprae por las células de Schwann y la propiedad de crecer en sitios de baja temperatura del cuerpo. Estas cualidades del bacilo hacen que ciertos segmentos de determinados troncos nerviosos sean más vulnerables a su infestación (3).
Algunos pacientes desarrollan diferentes formas clínicas de neuropatías antes del diagnóstico de la enfermedad de Hansen (4).
Estos pacientes acuden a nuestra institución con una serie de resultados negativos que no revelan manifestaciones leprosas. Es el estudio histopatológico de la biopsia de nervio el que determina la etiología de la neuropatía en estudio.
Objetivos
· Mostrar los resultados clínicos, electrofisiológicos e histopatológicos de una serie de 13 casos diagnosticados como neuritis leprosa pura en el Instituto de Neurología y Neurocirugía de La Habana (INN).
· Presentar una revisión bibliográfica sobre los mecanismos patogénicos implicados en las alteraciones patológicas de los nervios periféricos en la lepra.
|
|
|
|
Se revisaron los expedientes clínicos de los 13 pacientes de esta serie, atendidos en el INN entre 1980 y 1990.
Se estudiaron los cortes de los nervios biopsiados, seleccionados de acuerdo a los estudios clínicos y electrofisiológicos.
Las tinciones realizadas fueron: Fiti- Faraco, Weigert-Pal, Hematoxilina-Eosina y Tricrómica de Masson.
|
|
|
|
Examen clínico
Alteraciones electroneuromiográficas
Estudio histopatológico
* No se documenta el % de lesiones axonales en el estudio histopatológico porque la técnica de Gless Marland no se realizó en todos los casos.
|
|
|
|
Mecanismos patogénicos implicados en las alteraciones patológicas de los nervios periféricos en la lepra
Los nervios periféricos juegan un papel central en la patología de la lepra, teniendo el M. leprae una predilección particular por los mismos (5).
A pesar de existir nuevas y más eficientes formas de tratamiento para la lepra, el daño de los nervios periféricos continuará siendo un problema importante para su control y rehabilitación (6).
El daño neural provocado por el M. leprae se puede incrementar por la elevación de la presión intraneural, así como por la formación de túneles fibrosos en los nervios periféricos (7,8,9,10).
La lepra resulta un modelo único donde la incidiosa infectación del M. leprae y su predilección por las células de Schwann coexisten con las funciones del sistema inmune durante los estadios iniciales de la infección (6).
A continuación se describen las dos etapas de las alteraciones del nervio periférico, como consecuencia de la infección por el M. leprae.
Fase inicial del daño nervioso La fase inicial es común para la lepra tuberculoide (LT) y para la lepra lepromatosa (LLP) y ocurre en ausencia de células inflamatorias (11,12,13).
Modelos experimentales en ratones han mostrado que el progreso inicial del daño nervioso inducido por el M. leprae permanece sin variación en animales timectomizados, así como en ratones knockout, lo que refuerza que estos eventos iniciales no son mediados por la actividad inmunológica (14,15).
Las alteraciones iniciales en los axones de los nervios resultan de las modificaciones metabólicas que genera la presencia de M. leprae en las células de Schwann (16,17).
El daño nervioso observado en esta fase de la LLP se caracteriza por la ausencia de células inflamatorias (11,12).
Varios autores han sugerido que la entrada del M. leprae está mediada por las células endoteliales (19,20,21) y otros han documentado su presencia dentro de las mismas (22,23,24).
La entrada del M. leprae a las células de Schwann, es el evento más importante para la inducción del daño nervioso (6).
Estudios recientes sugieren que la a2 laminina y los dextroglicanos, ambos componentes de la lámina basal de las fibras nerviosas mielínicas y amielínicas, son los responsables de la predilección del M. leprae por las células de Schwann (25).
Una vez que el M. leprae ha colonizado las células de Schwann, la expresión del receptor de factor de crecimiento nervioso (NGF-R) y la secreción de fibronectina disminuyen. La caída del NGF-R trae como resultado una disminución en la utilización del factor de crecimiento nervioso (NGF) que conduce a una atrofia axonal. La disminución en la secreción de fibronectina pudiera impedir la regeneración (11,18).
Esta respuesta probablemente provoca la señal para que aparezcan poblaciones diferentes de células inflamatorias que caracterizan la LT o la LLP (26).
Fase tardía del daño nervioso Las alteraciones neurales se acentúan en esta fase por la migración de células mononucleares con predominio de linfocitos en los pacientes con LT y macrófagos en los pacientes con LLP (27). La presencia de estas células es el sello característico de esta fase (9,10,11,28,29).
Que señal produce la invasión de las células inflamatorias y cómo se regula?
Una de las primeras teorías implicaba la competencia del sistema inmune para brindar una respuesta inflamatoria, especialmente en los pacientes con LT (30).
Se ha reportado la presencia de auto–anticuerpos contra varios componentes nerviosos en pacientes con LLP (31).
Los nervios humanos y la piel poseen determinantes antigénicos comunes con el M. leprae (32,33); muchos de estos epitopes son proteínas de schock (34,35).
La presencia y multiplicación del M leprae en las células de Schwann, así como el depósito de determinantes antigénicos, pueden generar la repuesta inmune dependiendo de la competencia del sistema inmune en los pacientes con LT o LLP(34).
Una hipótesis atractiva es que células mononucleares cruzan la barrera epineural en el curso normal de la vigilancia inmunológica, encontrando antígenos. Las células mononucleares se activan y generan nuevas células (36).
La célula de Schwann muestra antígenos micobacterianos sobre su membrana, probablemente como resultado de la interacción de los antígenos micobacterianos con los componentes de la membrana de dichas células durante la entrada del M. leprae (37).
Los linfocitos, estimulados por la presencia de dichos antígenos, activan a los macrófagos que eliminan a los M. leprae situados dentro de las células de Schwann (38). Por otra parte, la presencia de macrófagos incrementa el proceso regenerativo (38).
Simultáneamente con estos efectos beneficiosos, la liberación de proteasas produce ruptura del colágeno, con la formación de granulomas. Los radicales reactivos del oxígeno, producidos por los macrófagos y las células de Schwann como resultado del proceso inflamatorio, provocan daño neural en el sitio de los granulomas (38).
|
|
|
|
1 - Bennington JL. Infectious Disorders:Leprous Neuritis. In: Pathology of Peripheral Nerve, Vol 9. Series: Major Problems in Pathology. Philadelphia, London, Toronto: W.B. Saunders Company, 1978:184-189.
22 - Anuario estadístico. Ministerio de Salud Pública de Cuba, año 2004.
3 - Job CK. Pathology and pathogenesis of leprous neuritis; a preventable and treatable complication. Int J Lepr Other Mycobact Dis 2001;69 Suppl 2:19-29.
4 - Ramadan W, Mourad B, Bad el W, Ghoraba E. Clinical, electrophysiological and immunopathological study of peripheral nerves in Hansen´s disease. Lepr Rev 2001;72(1):35-49.
5 - Iyer CGS. Predilection of Mycobacterium leprae for nerves, neurohistophatological observations. Int J Lepr 1965;33:634-45.
6 - Birdi TJ. Antia HH. Mechanisms involved in peripheral nerve damage in leprosy with special reference to insights mouse model. Int J Lepr Other Mycobact Dis 2003;71(4):345-53.
7 - Antia NH. Surgery of nerves. In: Surgical Rehabilitation in Leprosy. Baltimore:William and Wilkins Company. 1971:31-51.
8 - Dastur DK. Pathology and pathogenesis of predilective sites of nerve damage in leprous neuritis nerves in the arm and face. Neurosurg Rev 1983;6:139-52.
9 - Dastur DK, Pandya SS, Antia NH. Nerves in the arm in leprosy. II. Pathology, pathogenesis and clinical correlations. Int J Lepr 1970;38:30-48.
10 - Palande DD. Preventive nerve surgery in leprosy. Lepr India 1980;52:276-97.
11 - Shetty VP, Mehta LN, Irani PF, Antia NH. Study of the evolution of nerve damage in leprosy. Part I. Lesion of the index branch of the radial cutaneous nerve in early leprosy. Lepr Ind 1980;52:5-18.
12 - Shetty VP, Mehta LN, Irani PF, Antia NH. Study of the evolution of nerve damage in leprosy: Part II. Observation on the index branch of the radial cutaneous nerve in contacts of leprosy. Lepr Ind 1980;52:19-25.
13 - Shetty VP, Vidyasagar PB. Study of the evolution of nerve damage in leprosy. Part III. Sciatic nerve lesion in mice inoculated with M. leprae with nerve conduction velocity correlates. Lepr Ind 1980;52:426-72.
14 - Rambukkana A, Zanazzi G, Tapinos N, Salzer JL. Contac-dependent demyelination by M. leprae in the absence of immune cells. Science 2002;296: 927-31.
15 - Shetty VP, Mistry NF, Birdi TJ, Antia NH. Effect of T-cells depletion on bacterial multiplication and pattern of nerve damage in M. leprae infected mice. Int J Lepr 1995 ;67 :363-73.
16 - Mistry NF, Shetty V, Shetty VP, Antia NH. The role of nerve tissue culture in the study of the interrelationship of Schwann cells with M. leprae. In: The peripheral nerve in leprosy and other neuropathies. Dehli. Oxford University Press, 1997:171-184.
17 - Mukherjee R, Manadevan PR, Antia NH. Organized nerve cultures. II. DNA synthesis in Schwann cell in the presence of M. leprae. Int J Lepr Other Mycobact Dis 1980;48:189-92.
18 - Shetty VP, Jacobs JM, Antia NH. The pathology of early leprous neuropathy. J Neurol Sci 1988;88:115-31.
19 - Mehta LN. Blood vessels in leprosy and other peripheral nerve disorders. In: The peripheral nerves in leprosy an other neuropathies. Dehli: Oxford University Press, 1997:151-70.
20 - Dastur DK, Rammohan Y, Shah JS. Ultrastructure of lepromatous nerves. Neural pathogenesis in leprosy. Int J Lepr Other Mycobact Dis 1973;41:47-80.
21 - Dastur DK, Rammohan Y, Shah JS. Ultrastructure of the nerves in tuberculoid leprosy. Neural Ind Proc 1972;Suppl 1:89-99.
22 - Boddingius J. Ultrastructural changes in blood vessels of peripheral nerves in leprosy neuropathy. Tuberculoid and borderline tuberculoid leprosy patients. Acta Neuropathol (Berlin) 1996;35:159-81.
23 - Boddingius J. Ultrastructural changes in blood vessels of peripheral nerves in leprosy neuropathy. Borderline lepromatous and lepromatous leprosy patients. Acta Neuropathol (Berlin) 1977;40:21-39.
24 - Scollard DM. Endothelial cell and the pathogenesis of lepromatous neuritis: Insights from the armadillo model microbes. Infect 2000;2:1835-43.
25 - Rambukkana A, Yamada M, Zanazzi G, Mathus T, Salzer JL, Yurchenco PD, et al. The role of dextroglycan as a Schwann cell receptor of Mycobacterium leprae. Science 1988;282:2076-79.
26 - Malone JD, Richards M, Jeffrey JJ. Recruitment of peripheral mononuclear cells by mammlian collagenase digest of type I collagen. Matrix 1991;11:289-95.
27 - Pearson JAH, Ross WF. Nerve involment in leprosy-pathology. Differential diagnosis, and principles of management. Lepr Rev 1975;46:199-212.
28 - Job CK. Nerve lesions in leprosy: An ultrastructural study. Lepr Ind 1972; 44:29-35.
29 - Job CK. Pathology of peripheral nerves. Lesion in lepromatous leprosy: A light and electron microscope study. Ind Lepr 1971;39:251-68.
30 - Lumsden CE. Leprosy and the Schwann cell in vivo and in vitro. In: Leprosy in Theory and Practice. Bristol:John Wright and Sons. 1964:221-50.
31 - Eustis-Turf EP, Benjamin JA, Lefford MJ. Characterization of the anti-neural antibodies in the sera of leprosy patients. J Neuroimmunol 1986;10: 313-30.
32 - Naafs B, Kolk AHJ, Chin A, Lien RAM. Anti-Mycobacterium leprae monoclonal antibodies cross-reactive with human skin. An alternative explanation for the immune responses in leprosy. J Invest Dermatol 1990;94: 685-88.
33 - Rambukkana A, Burggraaf ID, Faber WR. et al. The Mycobacterial secreted antigen 85 complex possesses epitopes that are differently expressed in human leprosy lesions and Mycobacterium leprae infected armadillo tissues. Infect Imnun 1993;61:1835-45.
34 - Khanolkar-Young S, Yoong DB, Colston MJ. Nerve and skin damage in leprosy is associated with increased intralesional heat shock proteins. Clin Exp Immunol 1994;96:208-13.
35 - Ottenhoff TH, Kale ABB, Van Embden JD et al. The recombinant 65 Kd heatshock protein of Mycobacterium bovis Bacillus Calmette Guerin/M tuberculosis is a major target molecule for CD4+ cytotoxic lymphocytes that lyce human monocytes. J Exp Med 1998;168:1947-52.
36 - Lassa Manu H. Basic mechanisms of brain inflammation J Neural Transm 1997;Suppl 50:183-90.
37 - Birdi TJ, D' Souza S, Antia NH. Expression of Mycobacterial antigens on murine dissociated Schwann cells infected with viable M. leprae. Microbial Pathogenesis 1996;22:181-5.
38 - Perry HV, Brown MC. Macrophages and nerve regeneration. Curr Opin Neurobiol 1992;2:679-82.
|
|
|
|
||
|
|
|
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 14:10:50
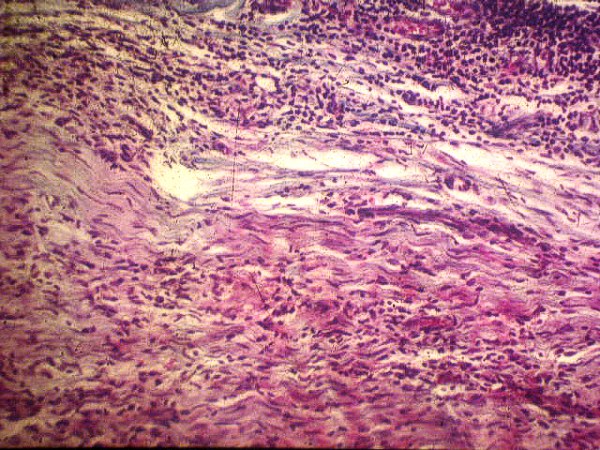 fiogf49gjkf0dFigura 1.">
fiogf49gjkf0dFigura 1.">
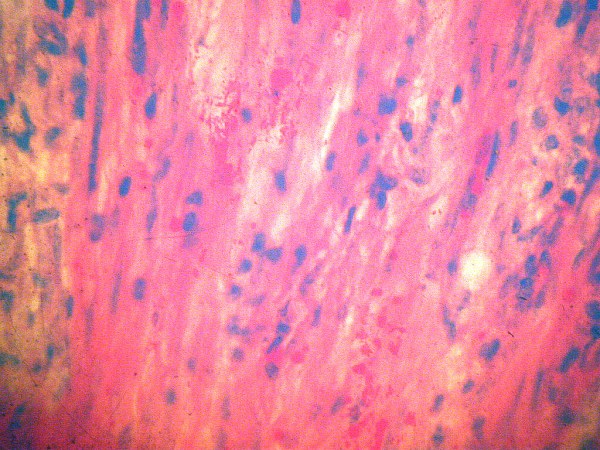 fiogf49gjkf0dFigura 2">
fiogf49gjkf0dFigura 2">
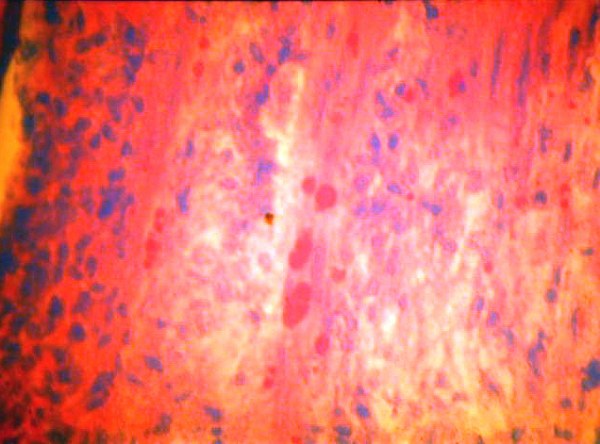 fiogf49gjkf0dFigura 3">
fiogf49gjkf0dFigura 3">
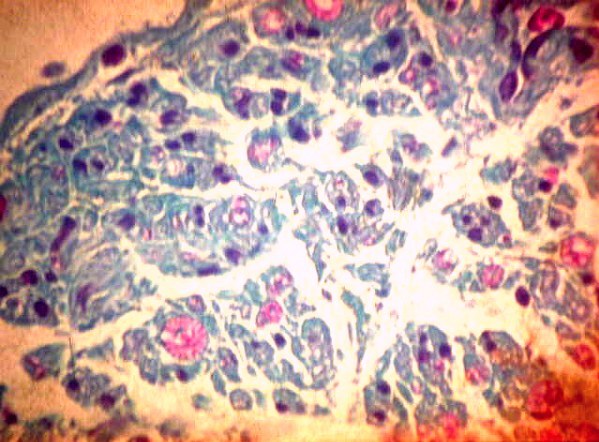 fiogf49gjkf0dFigura 4">
fiogf49gjkf0dFigura 4">
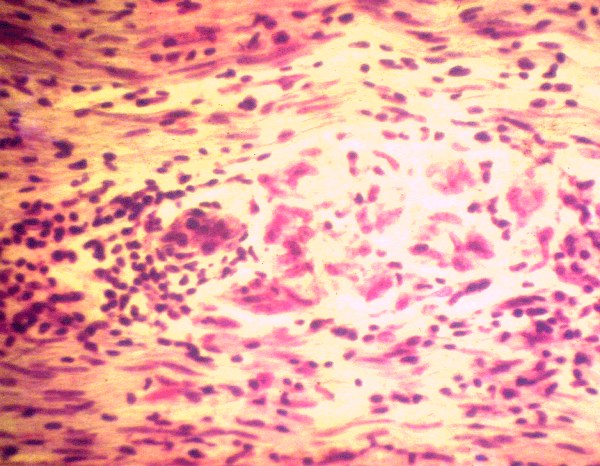 fiogf49gjkf0dFigura 5">
fiogf49gjkf0dFigura 5">
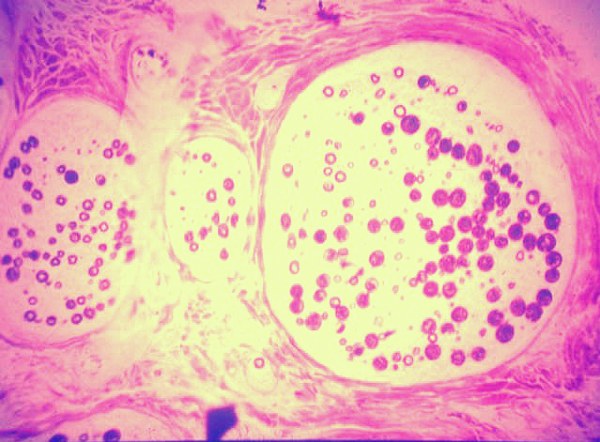 fiogf49gjkf0dFigura 6">
fiogf49gjkf0dFigura 6">
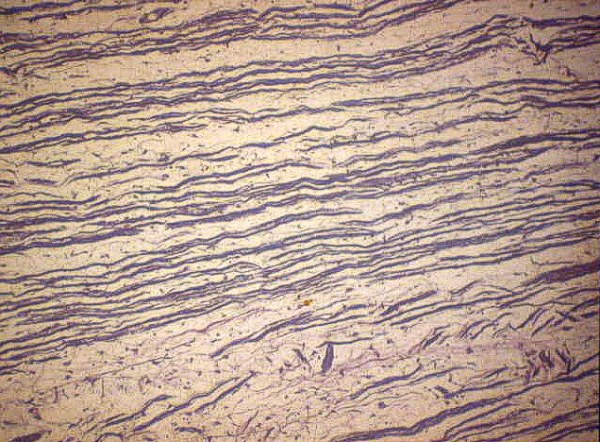 fiogf49gjkf0dFigura 7">
fiogf49gjkf0dFigura 7">