
 Comunciación libre
Comunciación libre
|
Sobrexpresión de p16INK4a en carcinoma epidermoide de cuello uterino Morelva Toro de Méndez*, Antonio Llombart-Bosch* |
||||||||||||||||||||||||||||||||
|
SOBREXPRESION DE p16INK4a EN CARCINOMA EPIDERMOIDE DE CUELLO UTERINO. Morelva Toro de Méndez*, Antonio Llombart-Bosch. Departamento de Patología, Facultad de Medicina. Universidad de Valencia-España. *Doctorando becario de RESUMEN. Se llevó a cabo un estudio inmunohistoquímico en 50 casos de carcinoma epidermoide de cuello uterino, diagnosticados entre los años 1940 y 1980, para examinar el patrón de expresión de la proteína p16INK4a en nuestro medio. Seleccionamos aleatoriamente 50 biopsias de cuello uterino de los archivos del departamento de Patología, Facultad de Medicina de Palabras clave. Carcinoma epidermoide de cervix, p16INK4a – E6H4 , inmunohistoquímica.
|
||||||||||||||||||||||||||||||||
|
|
La expresión celular de la proteína reguladora p16INK4a se ha evaluado mediante técnicas inmunohistoquímicas, para determinar su valor como marcador de lesión neoplásica del cuello uterino, tanto en muestras con morfología compatible con neoplasia intraepitelial cervical, carcinoma epidermoide así como en casos de adenocarcinoma endocervical y sus precursores, utilizando biopsias de tejido y citologías cervicovaginales. Estas observaciones han permitido concluir a los diferentes investigadores que la inmunodetección de la p16INK4a podría ser un marcador sensible y específico de lesiones cervicales clínicamente significativas asociadas a infección por virus papiloma humano de alto riesgo oncogénico / VPHAR (Sano et al, 1998b; Keating et al, 2001; Klaes et al, 2001; Bibbo et al, 2002; Schorge et al, 2004; Tringler et al, 2004; Trunk et al, 2004). La p16INK4a es una fosfoproteína, producto del gen supresor de tumor CDKN2 que se encarga de, al igual que otras proteínas, regular la progresión del ciclo celular al actuar como un inhibidor de kinasas dependientes de ciclinas, estas últimas tienen como función principal fosforilar a la proteína supresora de tumor Rb la cual a su vez en estado hipofosforilado cuando es requerido, se mantiene unida al factor de proliferación E2F, impidiendo de esta forma que el ciclo celular progrese desde la fase G1 a la fase S. Esta proteína puede verse inactivada funcionalmente cuando a la lesión neoplásica se encuentra asociado un VPHAR que se ensambla a ella y la bloquea mediante la expresión específica del oncogen viral VPHAR-E7, desatándose una proliferación celular prolongada y descontrolada, que conlleva al desarrollo de la lesión neoplásica, como se muestra en la figura Nº 1 (Serrano et al, 1993; Serrano, 1997; von Knebel Doeberitz, 2001). Existe entonces una relación inversa entre la expresión de p16INK4a y la presencia de pRb normal como por ejemplo ocurre en líneas celulares seleccionadas; la p16INK4a se detecta cuando la pRb está mutada, delecionada o inactivada, y se reduce o está ausente en células que contienen pRb con actividad normal. Además, la acumulación intracelular significativamente elevada de la p16INK4a ocurre como respuesta a los también niveles elevados de E2F libre, en ausencia de una pRb funcional (Kleif et al, 1996). Este estudio se llevó a cabo para examinar el patrón de expresión inmunohistoquímica de la proteína inhibidora de kinasa dependiente de ciclina p16INK4a, en muestras de tejido de cuello uterino con diagnóstico de carcinoma epidermoide, en nuestro medio.
|
|||||||||||||||||||||||||||||||
|
|
Material. El material de estudio consistió en la selección aleatoria de 50 biopsias de cuello uterino de los archivos del departamento de Patología, Facultad de Medicina de Metodología. Para la determinación de la proteína p16INK4a, utilizamos el anticuerpo monoclonal primario de ratón anti-p16INK4a clon E6H4 (MTM Laboratorios, Heidelberg, Germany), que permite su detección tanto en muestras de tejido fijadas con formalina buferada al 10% e incluidas en parafina así como en citologías cervicovaginales previamente teñidas con Papanicolaou (Bibbo, et al, 2002; Trunk et al, 2004). Las muestras se incubaron toda la noche en la estufa a Interpretación de los resultados de la inmunotinción para p16INK4a. Se realizó un contaje celular abarcando aproximadamente 1000 células (15 campos microscópicos). La reacción se consideró positiva cuando la célula mostró una coloración marrón a nivel nuclear y/o citoplasmático y la distribución de estas se realizó mediante una escala semicuantitativa descrita por Klaes et al 2001:
En la figura Nº 2 se muestra un caso de carcinoma epidermoide de cérvix de nuestro estudio inmunopositivo para p16INK4a. Los datos así obtenidos fueron introducidos en la base de datos de Excel Microsof XP y agrupados en tablas y gráficos.
|
|||||||||||||||||||||||||||||||
|
|
El estudio histopatológico de las 50 biopsias cervicales confirmó el diagnóstico previo de carcinoma epidermoide de cuello uterino, considerando los criterios histopatológicos estandar establecidos por Wright et al 1994; las muestras presentaron buen estado de conservación, a excepción de 3 casos cuyas muestras de tejido eran diminutas y se encontraban artefactadas. Los 50 carcinomas epidermoides se agruparon de acuerdo al grado de diferenciación tumoral y así obtuvimos 10 carcinomas epidermoides maduros y bien diferenciados, 10 moderamente diferenciados, 10 inmaduros (pobremente diferenciados), 10 inmaduros e indiferenciados (muy mal diferenciados) y finalmente un grupo de 10 carcinomas denominados misceláneos que incluyó 7 casos de carcinoma epidermoide anaplásico (con ausencia total de diferenciación) y 3 carcinomas de células pequeñas. La figura Nº 3 muestra la sobrexpresión inmunohistoquímica de p16INK4a en los casos de carcinoma epidermoide estudiados. El 74% (37/50) de los carcinoma epidermoides cervicales fueron positivos para la tinción inmunohistoquímica de p16INK4a, con carácter difuso o focal tanto a nivel nuclear como citoplasmático. Las zonas de epitelio escamoso y/o endocervical normal adyacentes a aquellas con proliferación celular neoplásica no mostraron tinción nuclear ni citoplasmática ante el anticuerpo p16INK4a. En las 2 citológicas cervicovaginales incluidas, las células escamosas intermedias y superficiales no mostraron reacción alguna ante el anticuerpo monoclonal específico para p16INK4a utilizado, ni en el núcleo ni en el citoplasma, corroborando lo formulado por Trunk et al, 2004. De igual forma, el control negativo tampoco fue reactivo. La tabla Nº I presenta la sobrexpresión de p16INK4a en carcinoma epidermoide de cuello uterino de acuerdo al grado de diferenciación tumoral. El 100% de los carcinomas epidermoides cervicales inmaduros e indiferenciados fueron positivos para p16INK4a (focal 2 y 8 difusa), seguidos de los misceláneos (80%) y de los carcinoma inmaduros (80%, 4 focal y 4 difusa); los carcinomas epidermoides maduros fueron los menos expresivos (40%). Hubo 2 casos de carcinoma epidermoide cervical que presentaron una lesión displásica (carcinoma in situ y/o atípia coilocitótica) asociada y en la que no se observó expresión de p16INK4a (no se muestran estos datos). Tabla Nº I. Sobrexpresión inmunohistoquímica de p16INK4a en los casos de carcinoma epidermoide de cuello uterino de acuerdo al grado de diferenciación tumoral.
Total 13 1 9 27
|
|||||||||||||||||||||||||||||||
|
|
El estudio que presentamos se llevó a cabo para examinar el patrón de sobrexpresión inmunohistoquímica de la proteína inhibidora de kinasa dependiente de ciclina p16INK4a en carcinoma epidermoide de cuello uterino. El papel causal de la infección persistente por papilomavirus humano de alto riesgo oncogénico en el desarrollo de cáncer de cuello uterino está actualmente bien establecido (Bosch et al 1995; Walboomers et al, 1999; Bosch et al, 2002; Muñoz et al 2003). Por otra parte, se ha reportado una fuerte sobrexpresión de p16INK4a en diferentes tumores uterinos y específicamente en aquel que se desarrolla a expensas de la mucosa cervical con infección por VPHAR asociada (Sano et al, 1998b; Nakashima et al, 1999; Agoff et al, 2003; Klaes et al, 2001; Negri et al, 2003). En el presente estudio, se encontró que el 74% de los carcinoma epidermoides de cuello uterino de diferentes grados de maduración y diferenciación, mostraron células con una inmunotinción nuclear y citoplasmática entre difusa y focal para p16INK4a. Estos resultados son semejantes a algunos hallados en la literatura revisada. En 1998b, Sano y colaboradores estudiaron en 139 biopsias cervicales y genitales la expresión inmunohistoquímica de p16INK4a, observando sobrexpresión marcada de esta proteína en todas las lesiones preneoplásicas y también en todos los carcinomas invasivos cervicales, asociadas a infección por VPHAR; sin embargo en condilomas acuminados y lesiones intraepiteliales de bajo grado con VHP de bajo riesgo asociado, la inmunoreacción fue leve. En un estudio similar realizado por Klaes et al en el 2001, el 98% de los carcinomas cervicales invasivos mostraron sobrexpresión marcada de p16INK4a. Agoff y colaboradores en el 2003, informaron que el 91% de los carcinomas cervicales de su estudio presentaron una fuerte tinción para p16INK4a con la presencia de tipos virales de alto riesgo, específicamente del tipo VHP 16, lo que les permitió inferir que la p16INK4a tiene potencial como marcador de pesquisa para neoplasia cervical. Por el contrario, en un estudio realizado por Jin et al (2000) quienes estudiaron la sobrexpresión de p16INK4a y pRb en carcinomas cervicales, reportaron que 25/58 (43,1%) fueron positivos para p16INK4a y estaba disminuida en las neoplasias intraepiteliales de bajo grado y casos clínicos muy avanzados; Sano et al 1998a también obtiene resultados similares en las lesiones intraepiteliales de bajo grado que incluyó en su estudio. A pesar de ello, los autores concluyen en que la expresión anormal de la p16INK4a está relacionada con el desarrollo del cáncer de cuello uterino. En este estudio, el 26% de los carcinomas epidermoides, sobretodo maduros y también moderadamente diferenciados, fueron inmunotinción negativa para p16INK4a. Kim et al 1998, además de otras lesiones cervicales, incluyeron en su estudio 46 pacientes con carcinoma cervical y curiosamente, estos mostraron una expresión disminuida de p16INK4a. Estos resultados negativos pueden tener diferentes orígenes, entre ellos: la presencia de excesiva necrosis como ocurre en estadios muy avanzados de la enfermedad, excesiva dilución del anticuerpo primario y tipo de clon utilizado, fijación defectuosa del material de biopsia, antigüedad de la muestra y, muy importante el tipo de VHP involucrado, ya que como ocurre en el caso de las lesiones intraepiteliales escamosas de bajo grado, la tinción para la p16INK4a podría ser negativa cuando está presente un VPH de bajo riesgo (Sano et al, 1998b; Keating et al, 2001). Es probable que en los carcinomas epidermoides que aún conservan su diferenciación como en los casos de nuestro estudio, ocurran eventos moleculares o intervienen otros factores desconocidos o, que el estado de inmunidad celular deficiente prevalezca sobre el tipo de VPH implicado. Finalmente, 2 de los casos estudiados (1 carcinoma de células pequeñas y 1 carcinoma epidermoide anaplásico) se consideraron negativos por mostrar menos de 5% de células teñidas para p16INK4a, probablemente la correcta evaluación visual de la reactividad se vio afectada por la presencia de necrosis y que además estas muestras estaban artefactadas y eran muy pequeñas. Con respecto a las citologías cervicovaginales, será necesario realizar investigaciones futuras para reafirmar la utilidad de la detección inmunohistoquímica de p16INK4a en el diagnóstico precoz del cáncer de cuello uterino.
|
|||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||
|
|
AGOFF, S ; LIN, P ; MORIHARA, J ; MAO, C ; KIVIAT, N ; KOTSKY, L. 2003. p16INK4a expression correlates with degree of cervical neoplasia: a comparison with Ki-67 expression and detection of high-risk HPV types. Mod Pathol., 16(7):665-673. BIBBO M, KLUMP W, DECECCO J, KOVATICH A. 2002. Procedurefor inmunocytochemical detection of p16INK4a antigen in Thin-Layer liquid-based specimens. Act Cytol., 46 25-29. BOSCH, XF; MANOS, M; MUÑOZ, N; SHERMAN, M; JANSEN, A; PETO,J; SCHIFFMAN, M; MORENO, V; KURMAN, R; SHAH K. 1995. Prevalence of human papillomavirus in cervical cancer: a worldwide perspective. J Natl cancer Inst., 87:796-802. BOSCH, XF; LORINCZ, A; MUÑOZ, N; MEIJER, CJLM; SHAH, KV. 2002. The causal relation between human papillomavirus and cervical cancer. J Clin Pathol., 55:244-265. JIN, SL; ZHANG, ZS; YANG, YH. 2000. The expression of p16 and Rb protein in the tissue of cervical squamous carcinoma. KEATING, JT; CVIKO, A; RIETHDORF, S; RIETHDORF, L; QUADE, B; SUN, D; DUENSING, S; SHEETS, E; MUNGER, K; CRUM, C. 2001. Ki-67, Cyclin E and p16INK4 are complementary surrogate biomarkers for human papilloma virus-related cervical neoplasia. Am J Surg Pathol, 25(7): 884-891. KHLEIF SN, DEGREGORY J, YEE C, OTTERSON G, KAYE F, NEVINS J, HOWLEY P. 1996. Inhibition of cyclin D-CDK4/CDK6 activity is associated with an E2F-mediated induction of cyclin kinasa inhibitor. Proc. Natl. Acad. Sci. USA. 93:4350-4354. KLAES, R; FRIEDRICH, T; SPITKOVSKY, D; RIDDER, R; RUDY, W; PETRY, U; DALLENBACH-HELLWEG, G; SCHMIDT, D; KNEBEL DOEBERITZ, M. 2001. Overexpression on p16INK4A as a specific marker for dysplastic and neoplastic epithelial cells of the cervix uterine. Int J Cancer, 92:276-284. MASUMOTO, N; FUJII, T; ISHIKAWA, M; SAITO, M; IWATA, T; FUKUCHI, T; SUSUMU, N; MUKAI, M; KUBUSHIRO, K; TSUKAZAKI, M; KUBUSHIRO, K; TSUKAZAKI, K; NOZAWA, S. 2003. p16INK4a overexpression and human papillomavirus infection in small cell carcinoma of the uterine cervix. Human Pathol., 34:778-783. MUÑOZ, N; BOSCH, XF; DE SANJOSÉ, S; HERRERO, R; CASTELLSAGUÉ, X; SHAH, K; SNIJDERS, P; MEIJER,C. 2003. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med 348:518-527. NAKASHIMA, R; FUJITA, M; ENOMOTO, T; HABA, T; YOSHINO, K; WADA, H; KURACHI, H; SASAKI, M; WAKASA, K; INOUE, M; BUZARD, G; MURATA, Y. 1999. Aletration of p16 and p15 genes in human uterine tumors. British j Cancer, 80:458-467. NEGRI, G; EGARTER-VIGL, E; ROMANO, F; HAITEL, A; SANO, T; OYAMA, T; KASHIWABARA, K; FUKUDA, T; NAKAJIMA, T. 1998a. Immnohistochemical overexpression of p16 protein associated with intact retinoblastoma protein expression in cervical cancer and cervical intraepithelial neoplasia. Pathol Int., 48(8):580-585. SANO, T; OYAMA, T; KASHIWABARA, K; FUKUDA, T; NAKAJIMA, T. 1998b. Expression status of p 16 protein is associated with human papillomavirus oncogenic potential in cervical and genital lesions. Am j Pathol., 153:1741-1748. SCHORGE, J; LEA, J; ELIAS, K; RAJANBABU, R; COLEMAN, R; MILLER, D; ASHFAG, R. 2004. p16 as a molecular biomarker of cervical adenocarcinoma. Am J Obstet and Gynecol., 190:668-673. SERRANO,M; HANNON, G; BEACH, D. SERRANO, M. 1997. The tumor suppressor protein p16INK4a. Experimental cell research, 237:7-13. SOLOMON D, NAYAR R. Editors. The TRINGLER B, GUP C, SINGH M, GROSHONG S, SHROYER L, HEINZ D, SHROYER K. 2004. Evaluation of p16INK4a and pRb expression in cervical squamous and glandular neoplasia. Hum Pathol., 35:689-696. TRUNK M, DALLENBACH-HELLWEG G, RIDDER R, ULRICH K, IKENBERG H, SCHNEIDERV, VON KNEBEL DOEBERITZ M. 2004. Morphologic characteristics of p16INK4a-positive cells in cervical cytology samples. Act Cytol., 48:771-782. VON KNEBEL DOEBERITZ, M. 2001. Aspects of molecular pathogenesis of cervical cancer in establishing new tumor markers for early detection and diagnosis. Zentralbl Gynakol., 123(4):186-191. WALBOOMERS, J; JACOBS, M; MANOS, M; BOSCH, XF; KUMMER, A; SHAH, K; SNIJDERS, P; PETO, J; MEIJER, CH; MUÑOZ, N. 1999. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol., 189:12-19. YAZIJI, H; GOWN, AM. 2001. Inmunohistochemical analysis of gynaecologic tumors. Int J Gynecol Pathol., 20(1):64-78.
|
|||||||||||||||||||||||||||||||
|
|
- Cesáreo Corbacho Cuevas (27/10/2005 20:33:05)
- Silvia Holgado (30/10/2005 2:20:01)
- MORELVA TORO DE MÉNDEZ (10/11/2005 8:55:41)
|
|||||||||||||||||||||||||||||||
|
|
|
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 15:10:50
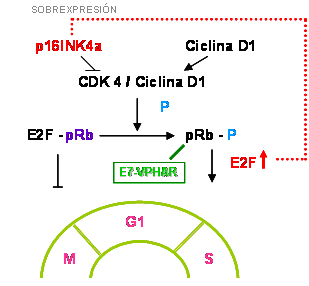 fiogf49gjkf0dFigura 1. Esquema de regulación del ciclo celular mediante la vía p16INK4a / ciclina D1 / pRb y efecto de la expresión del encogen E7 de los VPHAR. Tomado y modificado de Serrano, 1997.">
fiogf49gjkf0dFigura 1. Esquema de regulación del ciclo celular mediante la vía p16INK4a / ciclina D1 / pRb y efecto de la expresión del encogen E7 de los VPHAR. Tomado y modificado de Serrano, 1997.">
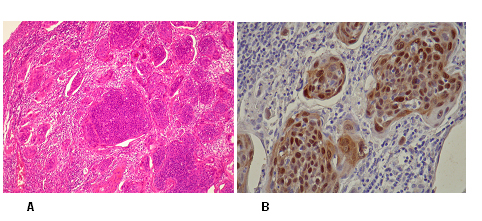 fiogf49gjkf0dFigura Nº 2. Caso 78b-36671. A. Carcinoma epidermoide anaplásico de cuello uterino (HE) 100X. B. El mismo caso mostrando inmunotinción difusa fuertemente positiva para p16INK4a (tinción marrón nuclear y citoplasmática) 400x.">
fiogf49gjkf0dFigura Nº 2. Caso 78b-36671. A. Carcinoma epidermoide anaplásico de cuello uterino (HE) 100X. B. El mismo caso mostrando inmunotinción difusa fuertemente positiva para p16INK4a (tinción marrón nuclear y citoplasmática) 400x.">
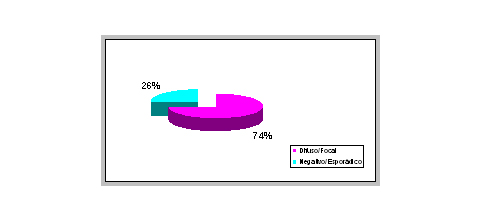 fiogf49gjkf0dFigura Nº 3. Sobrexpresión inmunohistoquímica de p16INK4a en los casos de carcinoma epidermoide de cuello uterino estudiados.">
fiogf49gjkf0dFigura Nº 3. Sobrexpresión inmunohistoquímica de p16INK4a en los casos de carcinoma epidermoide de cuello uterino estudiados.">