

|
Estudio Inmunohistoquímico y Estereológico de Fibras Peptidérgicas en la Próstata de la Rata Rosario Rodríguez Ramos*, José Manuel Pozuelo González*, Riánsares Arriazu Navarro*, Ildefonso Ingelmo Ingelmo**, Rocío Martín López***, Luis Santamaría Solís**** |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
INTRODUCCIÓN: El sistema nervioso autónomo se distribuye ampliamente en el tejido prostático. En los últimos años se han descubierto ciertos neuropéptidos, que al igual que los clásicos neurotransmisores noradrenalina y acetilcolina podrían modular la acción de los andrógenos. De esta forma, la función prostática estaría sujeta a control nervioso y no exclusivamente endocrino. Las últimas investigaciones, también relacionan este nuevo grupo de moléculas con el desarrollo de las principales patologías prostáticas como son la hiperplasia benigna de próstata (HBP) y el cáncer. El objetivo de este trabajo consiste en describir y cuantificar la presencia y distribución de fibras peptidérgicas en la próstata de la rata durante el desarrollo postanatal. MATERIAL Y MÉTODOS: 40 ratas Wistar macho distribuidas en cuatro grupos: prepuberales, puberales, adultos jóvenes y adultos viejos. Como marcadores inmunohistoquímicos de fibras se utilizaron PGP 9.5, NPY y VIP. La cuantificación de las fibras para los tres marcadores se realizó mediante técnicas estereológicas. RESULTADOS: Las fibras observadas en todas las regiones prostáticas y en todas las etapas del desarrollo fueron inmunorreactivas para los tres marcadores empleados. Desde un punto de vista cuantitativo la mayor densidad de fibras nerviosas aparece alrededor de los conductos prostáticos periuretrales. DISCUSIÓN Y CONCLUSIONES: La longitud de fibra nerviosa inmunorreactiva para PGP 9.5 no varía a lo largo del desarrollo postnatal en ninguna de las regiones prostáticas. Se observaron cambios significativos en las subpoblaciones de fibras peptidérgicas. La abundante inervación alrededor de los conductos prostáticos periuretrales podría estar relacionada con la contracción muscular necesaria durante la excreción del fluido prostático hacia la uretra durante la eyaculación, y con el control del tono muscular para evitar el vaciamiento espontáneo. La abundante inervación peptidérgica periglandular que destaca especialmente en el grupo de animales puberales (en el caso del NPY) y en los dos grupos de adultos (en el caso del VIP). Estos neuropéptidos pueden estar relacionados con las interacciones neuroepiteliales en la fisiopatología prostática.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
En la próstata de la rata existe un rico y abundante plexo nervioso a expensas del sistema nervioso autónomo. El sistema nervioso autónomo es fundamental en el mantenimiento de la integridad estructural y funcional de la próstata (1,2). La denervación prostática provoca una extensiva atrofia de la glándula en la rata (3,4).
En los últimos años, se han identificado una amplia variedad de fibras nerviosas tanto en próstata humana como de rata y hamster, que contienen sustancias de naturaleza peptídica. Estas moléculas también se comportan como neurotransmisores al igual que los clásicos noradrenalina y acetilcolina. Entre los neuropéptidos más conocidos destacan: neuropéptido Y (NPY), péptido intestinal vasoactivo (VIP), sustancia P (SP) y el péptido relacionado con el gen de la calcitonina (CGRP) (5-11).
Los neuropéptidos presentes en las terminaciones nerviosas autónomas podrían intervenir en la secreción prostática (12) y en el desarrollo y crecimiento de los acinos (13). De esta forma, su intervención podría modular la acción de los andrógenos. Los estudios más recientes relacionan a este grupo de moléculas con la fisiopatología prostática (14-18).
La rata se ha empleado ampliamente como modelo experimental para estudiar la biología y patología de la próstata (19-21).
Mediante el empleo de métodos inmunohistoquímicos y estereológicos se ha estudiado y cuantificado de modo insesgado la distribución de fibras peptidérgicas en todas las regiones de la próstata de la rata a lo largo del desarrollo postnatal.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Animales
En el estudio se han empleado 40 ratas macho de raza Wistar. Los animales se agruparon en 4 grupos (10 ratas por grupo) de acuerdo a 4 estadios de desarrollo postnatal: prepuberales (15 días), puberales (30 días), adultos jóvenes (90 días) y adultos viejos (540 días). Las ratas se sacrificaron mediante narcosis profunda con CO2 . De cada uno delos animales se extrajo el complejo prostático y se seccionó en rodajas de 2 mm de espesor perpendiculares al eje sagital de la glándula. Todas las muestras se fijaron en paraformaldehído al 10% en tampón fosfato salino (PBS), pH 7.4 durante 24 horas y se deshidrataron en serie creciente de alcoholes e incluyeron en parafina.
Procedimiento de muestreo
Todas las rodajas de la próstata de cada animal se incluyeron en un único bloque. Cada uno de los bloques se cortó en secciones de 5 y 10 micras de espesor de forma seriada. Las secciones de 5 micras se emplearon para las tinciones de rutina con hematoxilina-eosina y las técnicas inmunohistoquímicas. Las secciones de 10 micras fueron utilizadas para la realización de las técnicas estereológicas. Las secciones empleadas se seleccionaron mediante muestreo sistemático al azar (22, 23).
Inmunohistoquímica
Para visualizar fibras nerviosas se emplearon 3 marcadores. El PGP 9.5 se utilizó como marcador general de tejido nervioso. Para detectar los tipos específicos de inervación se utilizaron el NPY y el VIP. El estudio se realizó sobre todas las regiones prostáticas: dorsal, ventral, ampular y región de los conductos prostáticos periuretrales. En el caso de los animales prepuberales fue imposible individualizar las regiones dorsal, ventral y ampular, por lo que estas regiones se estudiaron en conjunto frente a los conductos fácilmente identificales incluso en esta etapa de desarrollo. Las fibras nerviosas inmunorreactivas para todos los marcadores empleados fueron evaluadas en el compartimiento periglandular en las regiones dorsal, ventral y ampular. Se estimó zona periglandular como un espacio de 10 micras alrededor de los acinos. Para evaluar las fibras periductales se consideró un espacio de 20 micras en torno a los conductos excretores. En este espacio se incluye el músculo liso periductal.
Las técnicas inmunohistoquímicas se efectuaron sobre 3 secciones por próstata y por antígeno (PGP 9.5, NPY, VIP).
Las secciones se desparafinaron y rehidrataron. A continuación se bloqueó la peroxidasa endógena exponiendo las muestras a una solución de peroxido de hidrógeno al 0.3 %. Para visualizar PGP 9.5 las secciones se incubaron con un anticuerpo monoclonal anti-PGP 9.5 (Biomeda, Foster City, Calif) diluido 1:25. Para detectar NPY y VIP, las secciones se incubaron respectivamente con un anticuerpo policlonal anti-NPY (Hammersmith Hospital, London, UK) diluido 1:1000 y, un anticuerpo policlonal anti-VIP (Biomeda) diluido 1:2. Todas las diluciones de los 3 anticuerpos primarios se realizaron en PBS (buffer fosfato salino) pH 7.4 que contenía BSA (albúmina sérica bovina) al 1% más ázida sódica al 0.1%. Las incubaciones con los anticuerpos primarios duraron toda la noche a 4º C.
En el caso de anticuerpos primarios monoclonales, se utilizó un anticuerpo secundario biotinilado anti-ratón obtenido en cabra (Biomeda). Para los anticuerpos primarios policlonales, se utilizó un anticuerpo secundario biotinilado anti-conejo obtenido en cabra (Biomeda). En ambos casos la dilución fue 1:400 en PBS que contenía una solución de BSA al 1% en azida sódica. El tiempo de incubación con los anticuerpos secundarios fue de 30 minutos a temperatura ambiente. Por último, las secciones fueron tratadas con el complejo avidina-biotina-peroxidasa (Biomeda) durante 30 minutos a temperatura ambiente. El revelado se efectuó con una solución que contenía 0,1 g de diamino bencidina (DAB) (3,3’,4,4’- tetraminobiphenyl, Sigma, St Louis, USA), más 20 microlitros de peróxido de hidrógeno al 30%. El contraste nuclear se consiguió con verde de metilo. Por último, los cristales se deshidrataron a través de una serie creciente de alcoholes, y se montaron con una resina sintética (Depex, Serva, Heidelberg, Germany).
La especificidad de las reacciones inmunohistoquímicas se comprobó mediante la incubación de las secciones con suero no inmune en sustitución del anticuerpo primario.
Métodos estereológicos
La estimación estereológica más adecuada para medir elementos lineales es la densidad de longitud (longitud de fibra por unidad de volumen del espacio de referencia) o longitud relativa (LV), que expresa la longitud del elemento lineal por unidad de volumen contenido en un espacio de referencia conocido (22). Un perfil nervioso se definió como una porción de un segmento nervioso independiente de su talla y longitud. En este estudio se asumió que la distribución de fibras nerviosas era isotrópica (23). En cada una de las regiones prostáticas de todos los grupos de desarrollo se evaluó la LV para cada uno de los marcadores utilizados. Como espacio de referencia se consideraron los componentes estromal y epitelial juntos.
De todas las secciones inmunoteñidas para PGP 9.5, NPY y VIP por próstata (por animal), se escogieron tres – de cada uno de los marcadores - mediante muestreo sistemático al azar. Sobre cada una de las secciones muestreadas, se aplicó la técnica del disector. Todas las medidas se realizaron con un microscopio Olympus, utilizando un objetivo x 100 (apertura numérica 1.4) y una magnificación final de 1200 x). El microscopio contaba con una platina motorizada conectada a un ordenador y además estaba conectado a una videocámara. El software utilizado (Stereologic software package, CAST-GRID; Interactivision, Silkeborg, Denmark) (24) controlaba el movimiento a lo largo de los ejes X e Y. El programa generaba disectores (aproximadamente unos 100 por cada región prostática) mediante muestreo sistemático al azar, que eran superpuestos sobre la imagen microscopia capturada por la videocámara y proyectada sobre el monitor. Los perfiles nerviosos elegidos para ser contados eran los que cumplían la regla de Sterio, es decir los que caían dentro del espacio del disector, los que sin caer dentro del disector tocaban algún borde permitido. No se contaban aquellos perfiles que tocaban los bordes prohibidos (23). Los perfiles elegidos para contaje se designaron como Q- .
La LV fue calculada mediante la siguiente fórmula:
LV = (2 x SQ-)/SA
donde Q- = número de perfiles nerviosos inmunopositivos y SA = área total muestreada, que es, área del disector (1312 mm2) multiplicada por el número total de disectores empleados.
Evaluación estadística
Los datos se transformaron logarítmicamente con el fin de que las variables se ajustaran a una distribución normal de la población. Se calcularon las medias y las desviaciones standard (SD). Las diferencias entre las distintas regiones prostáticas en todos los estadios de desarrollo en los compartimientos periglandular y periductal se evaluaron mediante ANOVA (análisis de la varianza). Para la comparación entre medias se utilizó el test de Student Newman-Keuls. El nivel de significación (P) fue inferior a 0.05.
Animales
En el estudio se han empleado 40 ratas macho de raza Wistar. Los animales se agruparon en 4 grupos (10 ratas por grupo) de acuerdo a 4 estadios de desarrollo postnatal: prepuberales (15 días), puberales (30 días), adultos jóvenes (90 días) y adultos viejos (540 días). Las ratas se sacrificaron mediante narcosis profunda con CO2 . De cada uno delos animales se extrajo el complejo prostático y se seccionó en rodajas de 2 mm de espesor perpendiculares al eje sagital de la glándula. Todas las muestras se fijaron en paraformaldehído al 10% en tampón fosfato salino (PBS), pH 7.4 durante 24 horas y se deshidrataron en serie creciente de alcoholes e incluyeron en parafina.
Procedimiento de muestreo
Todas las rodajas de la próstata de cada animal se incluyeron en un único bloque. Cada uno de los bloques se cortó en secciones de 5 y 10 micras de espesor de forma seriada. Las secciones de 5 micras se emplearon para las tinciones de rutina con hematoxilina-eosina y las técnicas inmunohistoquímicas. Las secciones de 10 micras fueron utilizadas para la realización de las técnicas estereológicas. Las secciones empleadas se seleccionaron mediante muestreo sistemático al azar (22, 23).
Inmunohistoquímica
Para visualizar fibras nerviosas se emplearon 3 marcadores. El PGP 9.5 se utilizó como marcador general de tejido nervioso. Para detectar los tipos específicos de inervación se utilizaron el NPY y el VIP. El estudio se realizó sobre todas las regiones prostáticas: dorsal, ventral, ampular y región de los conductos prostáticos periuretrales. En el caso de los animales prepuberales fue imposible individualizar las regiones dorsal, ventral y ampular, por lo que estas regiones se estudiaron en conjunto frente a los conductos fácilmente identificales incluso en esta etapa de desarrollo. Las fibras nerviosas inmunorreactivas para todos los marcadores empleados fueron evaluadas en el compartimiento periglandular en las regiones dorsal, ventral y ampular. Se estimó zona periglandular como un espacio de 10 micras alrededor de los acinos. Para evaluar las fibras periductales se consideró un espacio de 20 micras en torno a los conductos excretores. En este espacio se incluye el músculo liso periductal.
Las técnicas inmunohistoquímicas se efectuaron sobre 3 secciones por próstata y por antígeno (PGP 9.5, NPY, VIP).
Las secciones se desparafinaron y rehidrataron. A continuación se bloqueó la peroxidasa endógena exponiendo las muestras a una solución de peroxido de hidrógeno al 0.3 %. Para visualizar PGP 9.5 las secciones se incubaron con un anticuerpo monoclonal anti-PGP 9.5 (Biomeda, Foster City, Calif) diluido 1:25. Para detectar NPY y VIP, las secciones se incubaron respectivamente con un anticuerpo policlonal anti-NPY (Hammersmith Hospital, London, UK) diluido 1:1000 y, un anticuerpo policlonal anti-VIP (Biomeda) diluido 1:2. Todas las diluciones de los 3 anticuerpos primarios se realizaron en PBS (buffer fosfato salino) pH 7.4 que contenía BSA (albúmina sérica bovina) al 1% más ázida sódica al 0.1%. Las incubaciones con los anticuerpos primarios duraron toda la noche a 4º C.
En el caso de anticuerpos primarios monoclonales, se utilizó un anticuerpo secundario biotinilado anti-ratón obtenido en cabra (Biomeda). Para los anticuerpos primarios policlonales, se utilizó un anticuerpo secundario biotinilado anti-conejo obtenido en cabra (Biomeda). En ambos casos la dilución fue 1:400 en PBS que contenía una solución de BSA al 1% en azida sódica. El tiempo de incubación con los anticuerpos secundarios fue de 30 minutos a temperatura ambiente. Por último, las secciones fueron tratadas con el complejo avidina-biotina-peroxidasa (Biomeda) durante 30 minutos a temperatura ambiente. El revelado se efectuó con una solución que contenía 0,1 g de diamino bencidina (DAB) (3,3’,4,4’- tetraminobiphenyl, Sigma, St Louis, USA), más 20 microlitros de peróxido de hidrógeno al 30%. El contraste nuclear se consiguió con verde de metilo. Por último, los cristales se deshidrataron a través de una serie creciente de alcoholes, y se montaron con una resina sintética (Depex, Serva, Heidelberg, Germany).
La especificidad de las reacciones inmunohistoquímicas se comprobó mediante la incubación de las secciones con suero no inmune en sustitución del anticuerpo primario.
Métodos estereológicos
La estimación estereológica más adecuada para medir elementos lineales es la densidad de longitud (longitud de fibra por unidad de volumen del espacio de referencia) o longitud relativa (LV), que expresa la longitud del elemento lineal por unidad de volumen contenido en un espacio de referencia conocido (22). Un perfil nervioso se definió como una porción de un segmento nervioso independiente de su talla y longitud. En este estudio se asumió que la distribución de fibras nerviosas era isotrópica (23). En cada una de las regiones prostáticas de todos los grupos de desarrollo se evaluó la LV para cada uno de los marcadores utilizados. Como espacio de referencia se consideraron los componentes estromal y epitelial juntos.
De todas las secciones inmunoteñidas para PGP 9.5, NPY y VIP por próstata (por animal), se escogieron tres – de cada uno de los marcadores - mediante muestreo sistemático al azar. Sobre cada una de las secciones muestreadas, se aplicó la técnica del disector. Todas las medidas se realizaron con un microscopio Olympus, utilizando un objetivo x 100 (apertura numérica 1.4) y una magnificación final de 1200 x). El microscopio contaba con una platina motorizada conectada a un ordenador y además estaba conectado a una videocámara. El software utilizado (Stereologic software package, CAST-GRID; Interactivision, Silkeborg, Denmark) (24) controlaba el movimiento a lo largo de los ejes X e Y. El programa generaba disectores (aproximadamente unos 100 por cada región prostática) mediante muestreo sistemático al azar, que eran superpuestos sobre la imagen microscopia capturada por la videocámara y proyectada sobre el monitor. Los perfiles nerviosos elegidos para ser contados eran los que cumplían la regla de Sterio, es decir los que caían dentro del espacio del disector, los que sin caer dentro del disector tocaban algún borde permitido. No se contaban aquellos perfiles que tocaban los bordes prohibidos (23). Los perfiles elegidos para contaje se designaron como Q- .
La LV fue calculada mediante la siguiente fórmula:
LV = (2 x SQ-)/SA
donde Q- = número de perfiles nerviosos inmunopositivos y SA = área total muestreada, que es, área del disector (1312 mm2) multiplicada por el número total de disectores empleados.
Evaluación estadística
Los datos se transformaron logarítmicamente con el fin de que las variables se ajustaran a una distribución normal de la población. Se calcularon las medias y las desviaciones standard (SD). Las diferencias entre las distintas regiones prostáticas en todos los estadios de desarrollo en los compartimientos periglandular y periductal se evaluaron mediante ANOVA (análisis de la varianza). Para la comparación entre medias se utilizó el test de Student Newman-Keuls. El nivel de significación (P) fue inferior a 0.05.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Hallazgos inmunohiostoquímicos
Las fibras nerviosas inmunorreactivas para PGP 9.5 estaban presentes en los compartimientos periglandulares, periductales así como en el estroma interglandular de todas las regiones prostáticas y en todos los estadios del desarrollo (Figs.1-4). Igualmente, las neuronas de los ganglios periprostáticos expresaban PGP 9.5 (Fig.5).
Durante todo el desarrollo postnatal aparecieron fibras periglandulares así como periductales e interglandulares que expresaban NPY. Las fibras periductales inmunorreactivas para NPY eran notablemente más abundantes en el estadio puberal y en los dos de adultos (Figs. 6-8).
Las fibras vipérgicas de localización periglandular, periductal e interglandular también se observaron en todas las regiones prostáticas y en todos los estadios del desarrollo (Figs. 9-11). Cabe destacar la inmunorreactividad del VIP en neuronas, fascículos y fibras de localización subepitelial en los animales adultos (Fig. 12).
Hallazgos estereológicos
Comparación de las estimaciones de longitud relativa (LV) entre grupos de desarrollo
En la LV PGP 9.5 no se apreciaron diferencias significativas en los compartimientos periglandular y periductal en los cuatro grupos de desarrollo (Tabla I).
A nivel periglandular la LV NPY disminuyó significativamente en los adultos (Tabla II) mientras que la LV VIP aumentó significativamente en el grupo de adultos viejos (Tabla III).
La LV NPY periductal aumentó significativamente en la pubertad y se mantuvo sin cambios durante la madurez sexual (Tabla II). La LV de fibra vipérgica de localización periductal se incrementó significativamente en los estadios más avanzados del desarrollo (Tabla III).
Comparación de las estimaciones de longitud relativa (LV) entre regiones prostáticas
Las LV PGP 9.5 y LV NPY de localización periglandular en el grupo de los animales puberales no mostraron diferencias significativas entre regiones (Tablas IV y V). Sin embargo, en ambos grupos de adultos jóvenes y viejos, las LV PGP 9.5 y LV NPY fueron significativamente superiores en la localización periductal con respecto al compartimiento subepitelial de las regiones ampular, dorsal y ventral (Tablas IV y V).
En relación con la LV VIP perigandular, en los animales puberales se observó un incremento significativo en las regiones ampular y de conductos respecto a las regiones dorsal y ventral (Tabla VI). En los dos grupos de ratas adultas la LV VIP apareció significativamente incrementada en la región de los conductos (Tabla VI).
TABLA I. Longitud relativa de fibras nerviosas LN (LV ) para PGP 9.5 en las diferentes regiones prostáticas y en los diversos estadios de desarrollo
Los valores marcados con distintos superíndices presentan diferencias significativas
(p < 0.05): las letras establecen las comparaciones entre los distintos estadios de desarrollo
LN(LV): logaritmo de la densidad de longitud de fibra nerviosa LV (x 10-5 mm-²). (P): estroma periglandular; (Pd): estroma periductal
TABLA II. Longitud relativa de fibras nerviosas LN (LV) para NPY en las diferentes regiones prostáticas y en los diversos estadios de desarrollo
Los valores marcados con distintos superíndices presentan diferencias significativas
(p < 0.05): las letras establecen las comparaciones entre los distintos estadios de desarrollo
LN(LV): logaritmo de la densidad de longitud de fibra nerviosa LV (x 10-5 mm-²). (P): estroma periglandular; (Pd): estroma periductal
TABLA III. Longitud relativa de fibras nerviosas LN(LV) para VIP en las diferentes regiones prostáticas y en los diversos estadios de desarrollo
Los valores marcados con distintos superíndices presentan diferencias significativas
(p < 0.05): las letras establecen las comparaciones entre los distintos estadios de desarrollo
LN (LV): Logaritmo de la densidad de longitud de fibra nerviosa (x 10-5 mm-²). (P): estroma periglandular; (Pd): estroma periductal
TABLA IV. Longitud relativa de fibras nerviosas LN (LV ) para PGP 9.5 en las diferentes regiones prostáticas y en los diversos estadios de desarrollo
Los valores marcados con distintos superíndices presentan diferencias significativas
(p < 0.05): las letras establecen las comparaciones entre las distintas regiones prostáticas
LN(LV): logaritmo de la densidad de longitud de fibra nerviosa LV (x 10-5 mm-²). (P): estroma periglandular; (Pd): estroma periductal
TABLA V. Longitud relativa de fibras nerviosas LN (LV) para NPY en las diferentes regiones prostáticas y en los diversos estadios de desarrollo
Los valores marcados con distintos superíndices presentan diferencias significativas
(p < 0.05): las letras establecen las comparaciones entre las distintas regiones prostáticas
LN(LV): logaritmo de la densidad de longitud de fibra nerviosa LV (x 10-5 mm-²). (P): estroma periglandular; (Pd): estroma periductal
TABLA VI. Longitud relativa de fibras nerviosas LN(LV) para VIP en las diferentes regiones prostáticas y en los diversos estadios de desarrollo
Los valores marcados con distintos superíndices presentan diferencias significativas
(p < 0.05): las letras establecen las comparaciones entre las distintas regiones prostáticas
LN (LV): Logaritmo de la densidad de longitud de fibra nerviosa (x 10-5 mm-²). (P): estroma periglandular; (Pd): estroma periductal
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
La LV PGP 9.5 permanece invariable durante el desarrollo postnatal. Por lo tanto, en la próstata de la rata; la cantidad relativa de fibras nerviosas permanece constante durante toda la vida, sin embargo, en próstata humana se produce una reducción de la inervación autonómica en relación con la edad (25). En las distintas regiones prostáticas, y otras glándulas sexuales accesorias masculinas de hamster dorado, un grupo de autores (10), tampoco encuentran cambios en la densidad de fibras nerviosas inmunorreactivas para PGP 9.5 en relación con la edad. Sin embargo, existe un trabajo realizado en próstata de rata en el que la cantidad de fibras inmunorreactivas para PGP 9.5 se incrementa con la edad (9). Estos resultados discordantes con lo observado en el presente estudio, podrían deberse a los distintos métodos de cuantificación que se han utilizado en ambos trabajos, morfométricos y estereológicos respectivamente.
Cuando se compara entre regiones destaca una mayor concentración de fibras nerviosas en la región de los conductos, como revelan los resultados obtenidos mediante el marcador general de tejido nervioso PGP 9.5 especialmente en los dos grupos de adultos.
Con respecto a la inervación peptidérgica, se observa esencialmente, el incremento de LV NPY y LV VIP en la región de los conductos prostáticos periuretrales en adultos jóvenes y viejos. Este incremento de inervación peptidérgica podría ser debido a un aumento en la síntesis neuropeptídica en relación con las diferentes situaciones de la función andrógenica, durante las distintas etapas sexuales. Es probable que ambos neurópéptidos modulen la contracción muscular durante el vaciamiento prostático hacia la uretra e intervengan en el mantenimiento del tono muscular para evitar el vaciamiento prostático espontáneo (15, 26). Nuestros hallazgos en este caso, concuerdan con los datos expuestos en los trabajos de Properzi et al., y Chow et al. (9, 10).
Además, la abundante inervación autonómica periductal podría estar asociada con la presencia de células neuroendocrinas serotoninérgicas, situadas exclusivamente entre las células columnares epiteliales de los conductos periuretrales prostáticos. El conjunto de célula neuroendocrina e inervación está posiblemente implicado en la regulación de la excreción del fluido prostático hacia la uretra (11). El paralelismo entre el incremento de las células neuroendocrinas en la pubertad y la inmunorreactividad para NPY y VIP alrededor o después de la pubertad, sugiere un influjo androgénico en la inervación peptidérgica durante el desarrollo prostático.
La presencia de abundantes fibras peptidérgicas de localización subepitelial en los acinos ampulares, ventrales y dorsales; implica tanto al NPY como al VIP en la función del epitelio prostático. Además, es destacable la máxima concentración de NPY y VIP en torno a la pubertad y la madurez sexual, lo cual concuerda con las hipótesis que avalan la teoría de que el control de la función prostática no es exclusivamente endocrina. Los neurotransmisores de naturaleza peptídica como son el NPY, el VIP y otros podrían modular la acción de los andrógenos (12, 15). La unión del VIP a los receptores vipérgicos presentes en las células epiteliales de los acinos prostáticos ventrales desencadena la actuación de sistemas de segundos mensajeros. De esta forma se modificaría la unión de los andrógenos a sus receptores celulares, por lo que se modularía su acción sobre la secreción y por tanto sobre la función prostática (27-29).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
1- La cantidad relativa de fibras nerviosas presentes en la próstata de la rata, detectadas mediante PGP 9.5 no varía durante el desarrollo postnatal.
2- Las subpoblaciones de fibras que expresan NPY y VIP en torno a los conductos periuretrales se incrementan a partir del estadio puberal.
3- La abundante inervación periductal puede estar relacionada con la modulación de la función contráctil de la pared de los conductos prostáticos.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
1. Hedlund P, Ekstrom P, Larsson B, Alm P, Andersson KE. Heme oxygenase and NO-synthase in the human prostate-relation to adrenergic, cholinergic and peptide-containing nerves. J Auton Nerv Syst 1997; 63:115-126.
2. Hedlund P, Larsson B, Alm P, Andersson KE. Nitric oxide synthase-containing nerves and ganglia in the dog prostate: a comparison with other transmitters. Histochem J 1996; 28:635-642.
3. Wang JM, Mc Vary KT, Chung L. Requirement of innervation for maintenance of structural and functional integrity in the rat prostate. Biol Reprod 1991; 44: 1171-1176.
4. Luján M, Páez A, Llanes L, Angulo J, Berenguer A. Role of autonomic innervation in rat prostatic structure maintenance: a morfometric análisis. J Urol 1998; 160: 1919-1923.
5. Adrian TE, Gu J, Allen JM, Tatemoto K, Polak JM, Bloom SR. Neuropeptide Y in the human male genital tract. Life Sci 1984; 35: 2643-2648.
6. Vaalasti A, Tainio H, Pelto HM, Hervonen A. Light and electron microscope demonstration of VIP- and enkephalin-immunoreactive nerves in the human male genitourinary tract. Anat Rec 1986; 215: 21-27.
7. Lange W, Unger J. Peptidergic innervation within the prostate gland and seminal vesicle. Urol Res 1990; 18: 337-340.
8. Crowe R, Milner P, Lincoln J, Burnstock G. Histochemical and biohistochemical investigation of adrenergic, cholinergic and peptidergic innervation of the rat ventral prostate 8 weeks after streptozotocin-induced diabetes. J Auton Nerve Syst 1987; 20: 103-112.
9. Properzi G, Cordeschi G, Francavilla S. Postnatal development and distribution of peptide-containing nerves in the genital system of the male rat. An immunohistochemical sudy. Histochemistry 1992; 97: 61-68
10. Chow PH, Dockery P, Cheung A. Innervation of accesory sex glands in the adult male golden hamster and quantitative changes of nerve densities with age. Andrologia 1997; 29: 331-342.
11. Rodríguez R, Pozuelo JM, Martín R, Arriazu R, Santamaría L. Stereological quantification of nerve fibers immunoreactive to PGP 9.5, NPY, and VIP in rat prostate during postnatal development. J Androl 2005; 26: 197-204.
12. Gknos PJ, Kongrad A, Roos BA. Neuroendocrine peptides in the prostate. Urol Res 1995; 23: 81-87.
13. Chapple CR, Crowe R, Gilpin SA, Gosling J, Burnstock G. The innervation of the human prostate gland – the changes associated with benign enlargement. J Urol 1991; 146: 1637-1644.
14. Dixon JS, Jen PY, Gosling JA. The distribution of vesicular acetylcholine transporter in the human male genitourinary organs and its co-localization with neuropeptide Y and nitric oxide synthase. Neurourol Urodyn 2000; 19: 185-194.
15. Ventura S, Pennefather J, Mitchelson F. Cholinergic innervation and function in the prostate gland. Pharmacol Ther 2002; 94: 93-112.
16. Juarranz MG, Bodega G, Prieto JC, Guijarro LG. Vasoactive intestinal peptide (VIP) stimulates rat prostatic epithelial cell proliferation. Prostate 2001; 47: 285-292.
17. Martín R, Fraile B, Peinado F, Arenas MI, Elices M, Alonso L, Paniagua R, Martín JJ, Santamaría L. Immunohistochemical localization of protein gene product 9.5, ubiquitin, and neuropeptide Y immunoreactivies in epithelial and neuroendocrine cells from normal and hyperplastic human prostate. J Histochem Cytochem 2000; 48: 1121-1130.
18. Cornell RJ, Rowley D, Wheeler T, Ali N, Ayala G. Neuroepithelial interaction in prostate cancer are enhanced in the presence of prostatic stroma. Urology 2003; 4: 870-875.
19. Price D. Biology and the prostate and related tissues. NCI Monogr 1963; 12: 1-28.
20. Angelsen A, Falkmer S, Sandvik AK, Waldhum HL. Pre- and postnatal testosterone administration induces proliferative epithelial lesions with neuroendocrine differentiation in the dorsal lobe of the rat prostate. Prostate 1999; 40: 65-75.
21. Martín JJ, Martín R, Codesal J, Fraile B, Paniagua R, Santamaría L. Cadmiun chloride-induced dysplastic changes in the ventral rat prostate: An immunohistochemical and quantitative study. Prostate 2000; 45: 1-10.
22. Mayhew TM. The new stereological methods for interpreting functional morphology from slices of cells and organs. Exp Physiol 1991; 76: 663-665.
23. Howard CV, Reed MG. Length estimation. In: Howard CV, Reed MG, eds. Unbiassed Stereology. Three-Dimensional Measurement in Microscopy. Oxford, United Kingdom: Bios Scientific Publishers; 1998: 125-128.
24. Martin R, Nieto S, Santamaria L. Stereologic estimates of volume-weighted mean nuclear volume in colorectal adenocarcinoma: correlation with histologic grading, Duke’s staging cell proliferation activity and p 53 protein gene expression. Gen Diagn Pathol 1997; 143: 29-38.
25. Casas AP. The innervation of the human prostate. Z Mikrosk Anat Forsch 1958; 64: 608-633.
26. Pennefaher JN, Lau WA, Mitchelson F, Ventura S. The autonomic and sensory innervation of the smooth muscle of the prostate gland: a review of pharmacological and histological studies. J Auton Pharmacol 2000; 20: 193-206.
27. Carmena MJ, Prieto JC. Cyclic AMP response to vasoactive intestinal peptide and beta-adrenergic or cholinergic agonists in isolated epithelial cells of rat ventral prostate. Biosci Rep 1985; 5: 791-797.
28. Carmena MJ, Sancho JI, Prieto JC. Additive effect of VIP or isoproterenol on forskolin-stimulated cyclic AMP accumulation in rat prostatic epithelial cells. Biochem Int 1986a; 13:479-485.
29. Carmena MJ, Sancho JI, Prieto JC. Effects of age and androgens upon functional vasoactive intestinal peptide receptors in rat prostatic epithelial cells. Biochim Biophys Acta 1986b; 888: 338-343.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
- Maykel Pérez Machín (03/10/2005 14:20:13)
- Rosario Rodríguez Ramos (04/10/2005 16:37:39)
- Javier Muñoz Moreno (22/10/2005 14:06:13)
- Javier Muñoz Moreno (28/10/2005 12:46:45)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 14:10:50
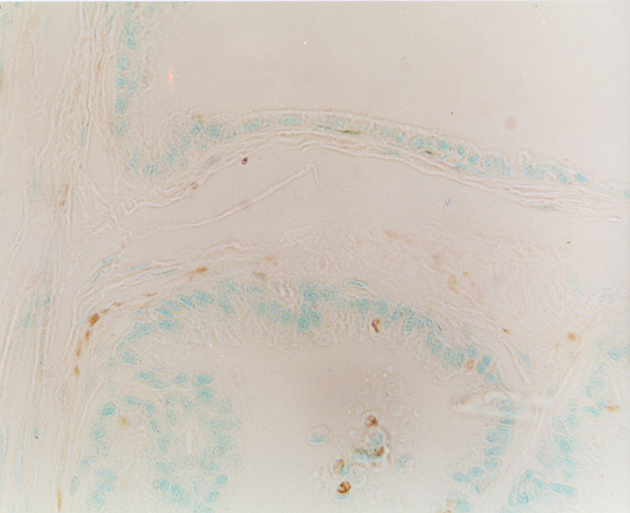 fiogf49gjkf0dPróstata de rata puberal. Se detecta inervación periglandular PGP 9.5 inmunorreactiva en la base del epitelio acinar. 400X">
fiogf49gjkf0dPróstata de rata puberal. Se detecta inervación periglandular PGP 9.5 inmunorreactiva en la base del epitelio acinar. 400X">
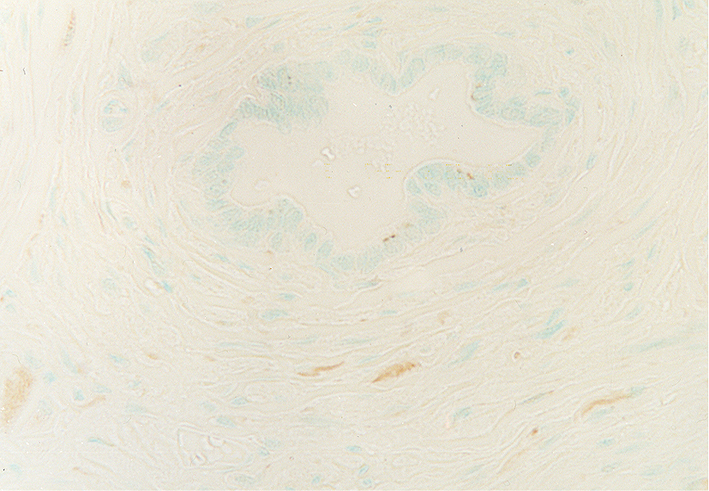 fiogf49gjkf0dPróstata de rata puberal. Alrededor de los conductos periuretrales aparecen fibras inmunorreactivas para PGP 9.5. 400X">
fiogf49gjkf0dPróstata de rata puberal. Alrededor de los conductos periuretrales aparecen fibras inmunorreactivas para PGP 9.5. 400X">
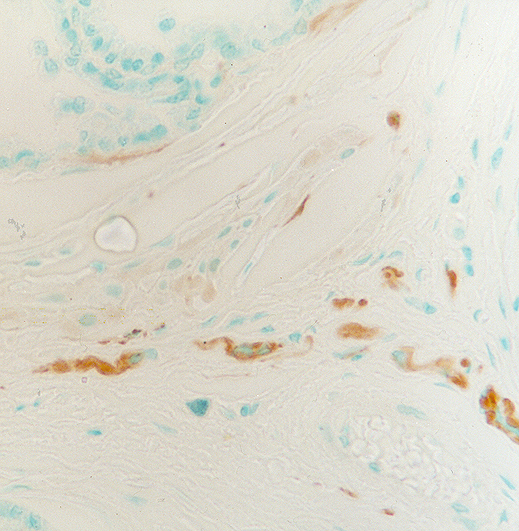 fiogf49gjkf0dPróstata de rata adulta joven. Fibras nerviosas periglandulares que expresan PGP 9.5. 400X">
fiogf49gjkf0dPróstata de rata adulta joven. Fibras nerviosas periglandulares que expresan PGP 9.5. 400X">
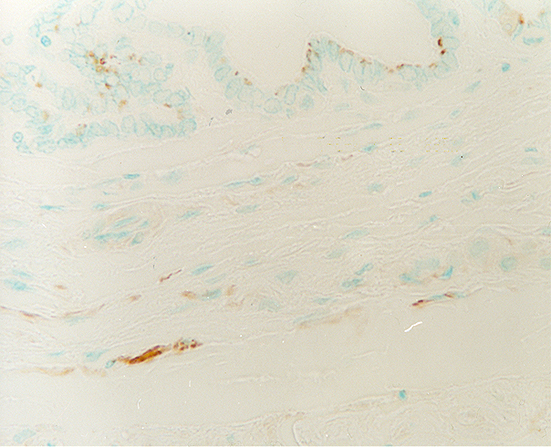 fiogf49gjkf0dPróstata de rata adulta vieja. Se observan terminaciones nerviosas inmunopositivas para PGP 9.5 en el estroma fibromuscular que rodea a los conductos. 400X">
fiogf49gjkf0dPróstata de rata adulta vieja. Se observan terminaciones nerviosas inmunopositivas para PGP 9.5 en el estroma fibromuscular que rodea a los conductos. 400X">
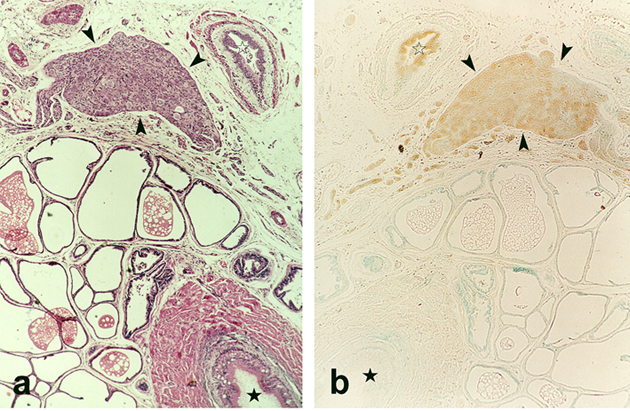 fiogf49gjkf0dGanglio periprostático. (a) Destaca la presencia de somas neuronales en el interior del ganglio (cabezas de flecha). 40X, HE. (b) Los cuerpos de las neuronas expresan PGP 9.5 (cabezas de flecha). 40X">
fiogf49gjkf0dGanglio periprostático. (a) Destaca la presencia de somas neuronales en el interior del ganglio (cabezas de flecha). 40X, HE. (b) Los cuerpos de las neuronas expresan PGP 9.5 (cabezas de flecha). 40X">
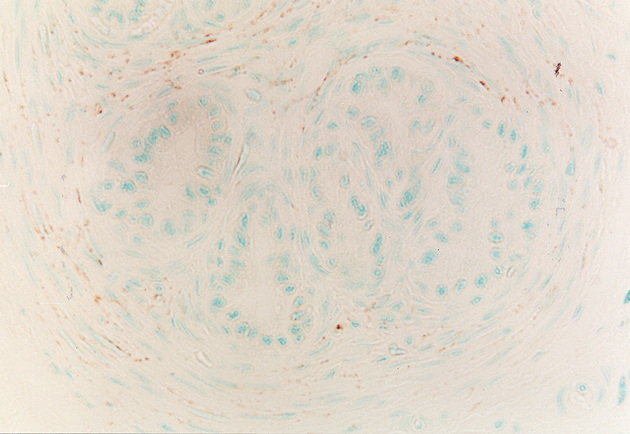 fiogf49gjkf0dPróstata de rata puberal. En torno a los conductos periuretrales se detectan finas y abundantes fibras inmunoteñidas para NPY. 400X">
fiogf49gjkf0dPróstata de rata puberal. En torno a los conductos periuretrales se detectan finas y abundantes fibras inmunoteñidas para NPY. 400X">
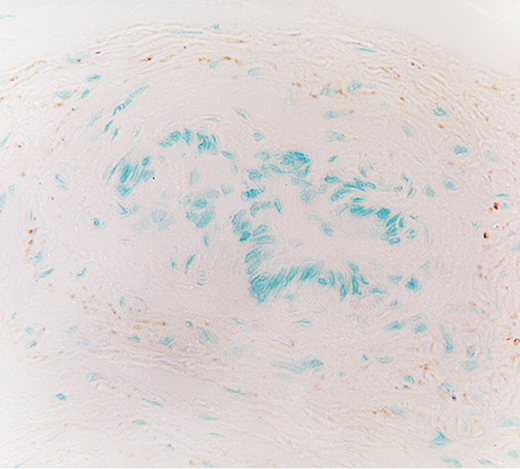 fiogf49gjkf0dPróstata de rata adulta joven. Se aprecia intensa inervación periductal que expresa NPY. 400X">
fiogf49gjkf0dPróstata de rata adulta joven. Se aprecia intensa inervación periductal que expresa NPY. 400X">
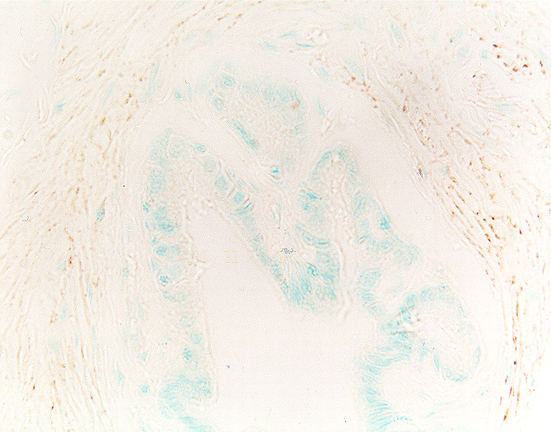 fiogf49gjkf0dPróstata de rata adulta vieja. Se observa abundancia de fibras periductales inmunorreactivas para NPY. 400X">
fiogf49gjkf0dPróstata de rata adulta vieja. Se observa abundancia de fibras periductales inmunorreactivas para NPY. 400X">
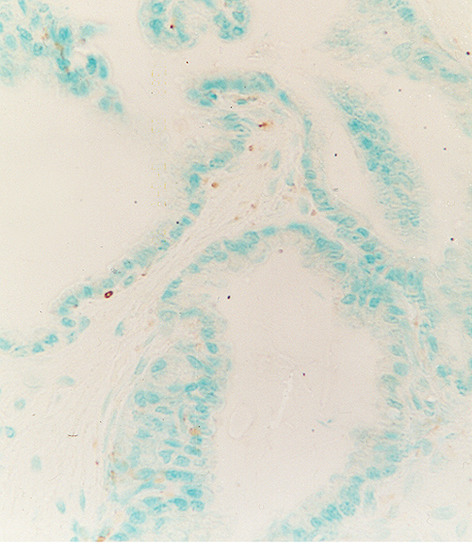 fiogf49gjkf0dPróstata de rata adulta joven. Fibras inmunopositivas para VIP, de localización subepitelial. 400X">
fiogf49gjkf0dPróstata de rata adulta joven. Fibras inmunopositivas para VIP, de localización subepitelial. 400X">
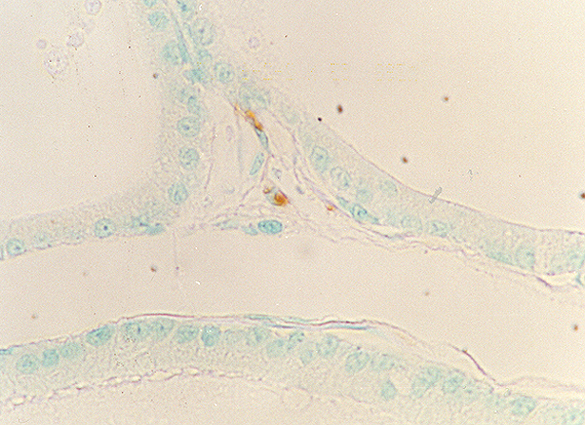 fiogf49gjkf0dPróstata de rata adulta vieja. Bajo el epitelio acinar se observan finas fibras inmunoteñidas para VIP. 400X">
fiogf49gjkf0dPróstata de rata adulta vieja. Bajo el epitelio acinar se observan finas fibras inmunoteñidas para VIP. 400X">
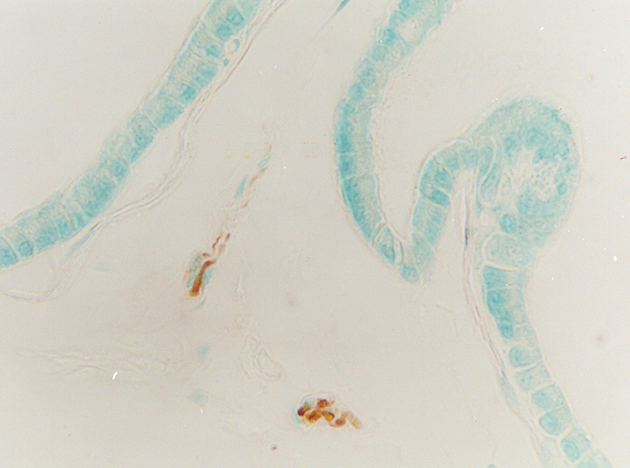 fiogf49gjkf0dPróstata de rata adulta vieja. Se detecta un facículo interglandular inmunorreactivo para VIP. 400X">
fiogf49gjkf0dPróstata de rata adulta vieja. Se detecta un facículo interglandular inmunorreactivo para VIP. 400X">
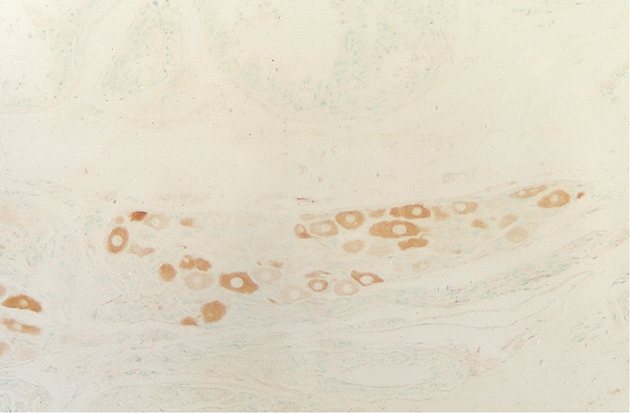 fiogf49gjkf0dGanglio periprostático. En el interior del ganglio se observan somas neuronales que expresan VIP. 400X">
fiogf49gjkf0dGanglio periprostático. En el interior del ganglio se observan somas neuronales que expresan VIP. 400X">