|
LIMITACIONES DE LA PUNCIÓN ASPIRACIÓN CON AGUJA FINA EN LAS LESIONES DE MAMA. La “Zona Gris”
Mercedes Santamaría Martínez*, Pedro de Llano Varela*, María Asunción Arrechea Irigoyen**
* Hospital de Navarra. Pamplona
ESPAÑA
** Hospital de Navarra ESPAÑA
|
|
Resumen
fiogf49gjkf0d Espectro de la Zona Gris
En la citología de mama existe un amplio espectro de hallazgos citológicos que son difíciles de interpretar y que plantean problemas diagnósticos y de diagnóstico diferencial. Es importante el conocer estas circuntancias para evitar falsos diagnósticos positivos y negativos.
- ¿ Son lesiones pre-cancerosas ?.
- ¿ Son lesiones benignas que parecen malignas?
O al contrario
- ¿ Son lesiones malignas que no reúnen todos los requisitos necesarios para diagnosticarlas como tales ?: Corresponden a:
- Lesiones de difícil interpretación en cuanto a su benignidad-malignidad.
- Lesiones en las que se corre el riesgo de hacer un sobrediagnóstico o un infradiagnóstico.
Frecuencia según autores
|
Autores |
|
Biopsia benigna
Nº de casos
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Causas de la “zona gris”
- Técnicas (fig 1)
- Inexperiencia
- Superposición de lesiones benignas y malignas
- En estas ocasiones, no puede hacerse un diagnóstico definitivo por FALTA DE CRITERIOS O SUPERPOSICIÓN DE LOS MISMOS
La "zona gris" se da con frecuencia en:
- A-Fibroadenoma
- B-Neoplasias papilares
- C-Enfermedad fibroquística con hiperplasia
- D-Carcinoma apocrino de bajo grado
El propósito de esta exposición es revisar los hallazgos citológicos y dificultades diagnósticas de estas lesiones
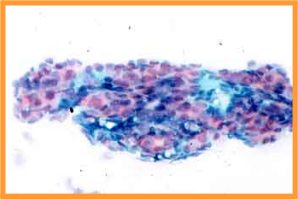 fiogf49gjkf0dFig 1-Artefacto que impide la correcta valoración citológica"> fiogf49gjkf0dFig 1-Artefacto que impide la correcta valoración citológica">
Causas - fiogf49gjkf0d Fig 1-Artefacto que impide la correcta valoración citológica
|
|
A- Fibroadenoma
fiogf49gjkf0d Fibroadenoma
- Frecuente
- Entre 20 y 35 años
- Generalmente nódulos únicos
- 20 % múltiples
- No más de 3 cms. de diámetro
- Macroscópicamente característico (Fig 2)
- El origen del carcinoma sobre FA es muy poco frecuente (0,1%). Se asocia a carcinoma lobular infiltrante y carcinoma in situ
Fibroadenoma
- Patrones microscópicos(Fig 3)
- Pericanalicular
- Intracanalicular
- Pero existen frecuentes variaciones morfológicas como son la calcificación, hialinización, transformación mixoide del estroma, la elevada densidad celular estroma y a veces la infartación hemorrágica
Fibroadenoma. Citología (Figs 4 y 5)
- Celularidad moderada
- Grupos de células epiteliales con buena cohesión
- Ramificaciones y proyecciones celulares
- Núcleos desnudos
- Fragmentos de estroma
- Escasas células espumosas y apocrinas
Fibroadenoma con atipia. Lo expresamos así cuando encontramos:
- Pérdida de cohesión celular
- Grupos papilares
- Atipia celular
- No hay necrosis
Vamos a considerar estas circunstancias en el diagnóstico diferencial:
- Atipia en fibroadenoma
- Citología semejante a EFQ
- Sospecha de CARCINOMA
1- Atipia en fibroadenoma (Fig 6)
- Núcleos aumentados
- Nucléolos aumentados
- Citoplasma basófilo aumentado
2. FA con EFQ (fig 7)
- Menor celularidad
- Pocos núcleos desnudos
- No estroma
- se trata en realidad de lesiones superpuestas
3. Sospecha de carcinoma (fig 8)
- Grupos de pocas células con poca cohesión
- Escasos núcleos desnudos
- Poca celularidad
- Defecto de técnica
Diagnóstico diferencial del fibroadenoma con atipia
- Papiloma y carcinoma papilar
- Papilomatosis en EFQ (no hay estroma)
- Phyllodes
- Adenoma (estroma acelular)
- Carcinoma ductal invasor de bajo grado o tubular(Fig 9)
- Carcinoma mucinoso
Posibles Mecanismos Patogénicos
- Respuesta a estimulación hormonal
- Actividad secretora focal
- Respuesta a la inflamación
- Cambios metaplásicos
- Multifactorial
Referencias
- Al-Kaisi N: The spectrum of the “gray zone” in breast cytology. A review of 186 cases of atypical and suspicious cytology.The spectrum of the “gray” Acta Cytol 1994, 38:898-908
- Stanley MW, Tani EM, Skoog L.: Fine-needle aspiration of fibroadenomas of the breast with atypia: a spectrum including cases that cytologically mimic carcinoma. Diagn Cytopathol. 1990;6(6):375-82.
- Ozkara SK, Ustun MO, Paksoy N. The gray zone in breast fine needle aspiration cytology. How to report on it? Acta Cytol. 2002 May-Jun;46(3):513-8.
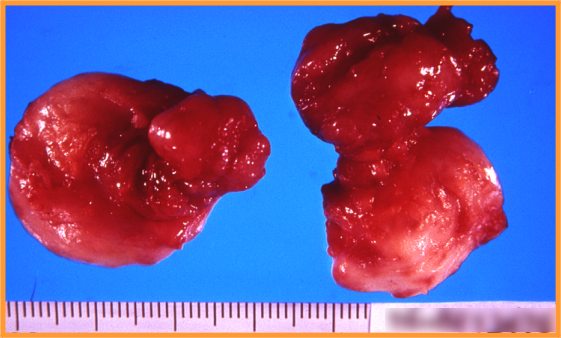 fiogf49gjkf0dFig 2-Fibroadenoma"> fiogf49gjkf0dFig 2-Fibroadenoma">
Fibroadenoma - fiogf49gjkf0d Fig 2-Fibroadenoma
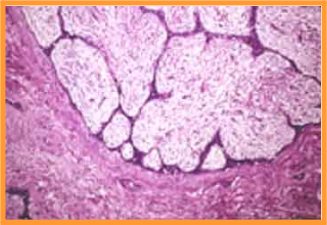 fiogf49gjkf0dFig 3.Fibroadenoma. Imagen microscópica"> fiogf49gjkf0dFig 3.Fibroadenoma. Imagen microscópica">
microscópicos - fiogf49gjkf0d Fig 3.Fibroadenoma. Imagen microscópica
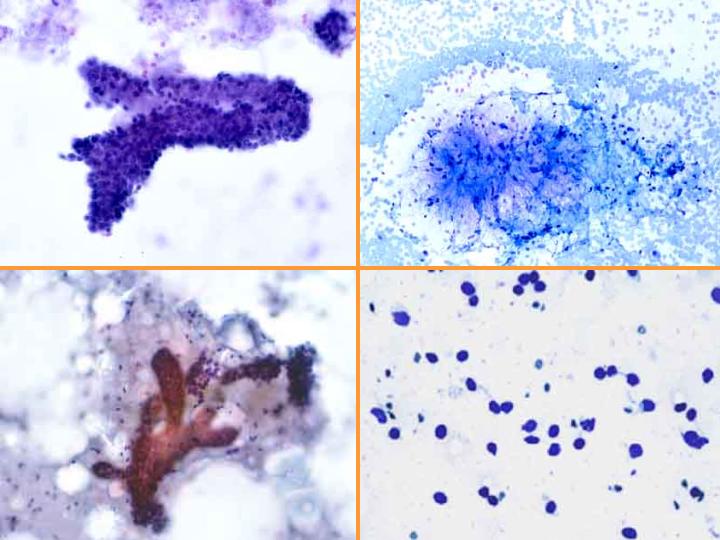 fiogf49gjkf0dFig 4.Fibroadenoma. Citología"> fiogf49gjkf0dFig 4.Fibroadenoma. Citología">
Fibroadenoma. Citología - fiogf49gjkf0d Fig 4.Fibroadenoma. Citología
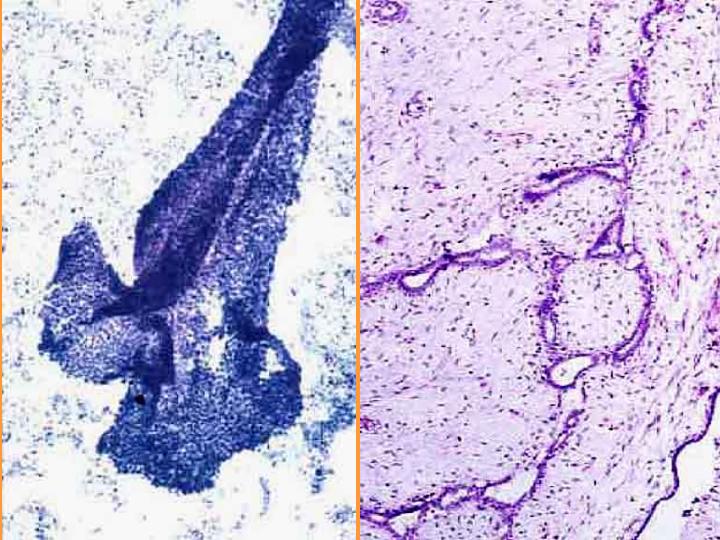 fiogf49gjkf0dFig 5.Fibroadenoma. Citología e histología"> fiogf49gjkf0dFig 5.Fibroadenoma. Citología e histología">
Fibroadenoma. Citología-2 - fiogf49gjkf0d Fig 5.Fibroadenoma. Citología e histología
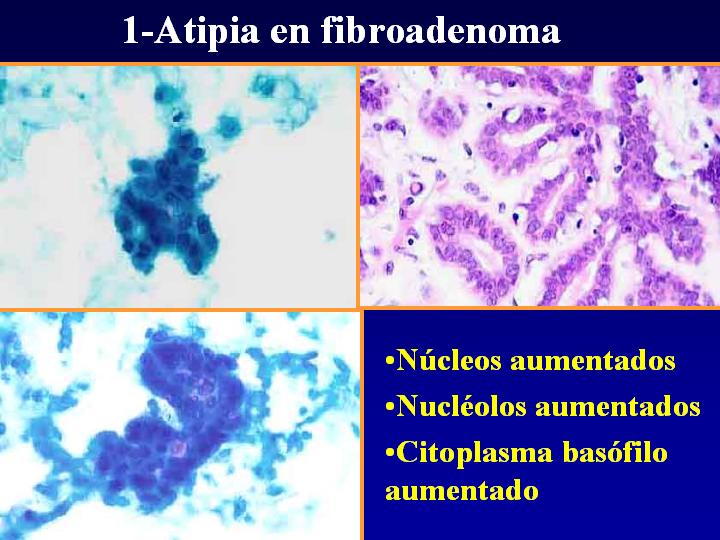 fiogf49gjkf0dFig 6.Atipia en fibroadenoma"> fiogf49gjkf0dFig 6.Atipia en fibroadenoma">
Atipia - fiogf49gjkf0d Fig 6.Atipia en fibroadenoma
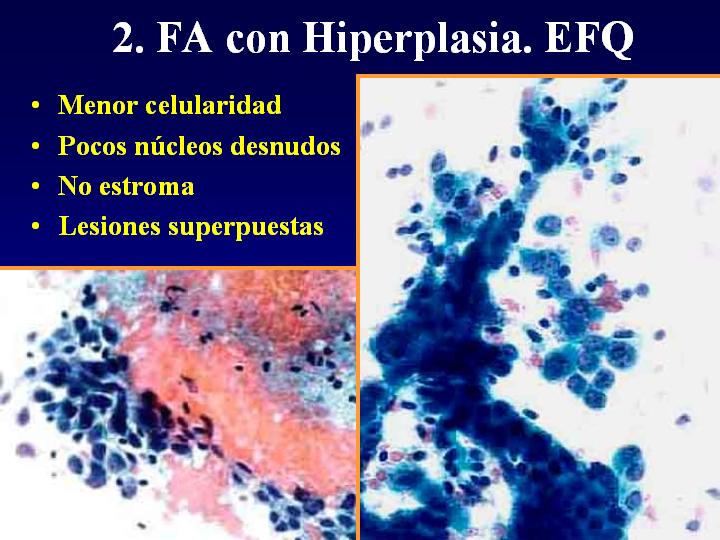 fiogf49gjkf0dFig 7.Fibroadenoma con Hiperplasia."> fiogf49gjkf0dFig 7.Fibroadenoma con Hiperplasia.">
con Hiperplasia - fiogf49gjkf0d Fig 7.Fibroadenoma con Hiperplasia.
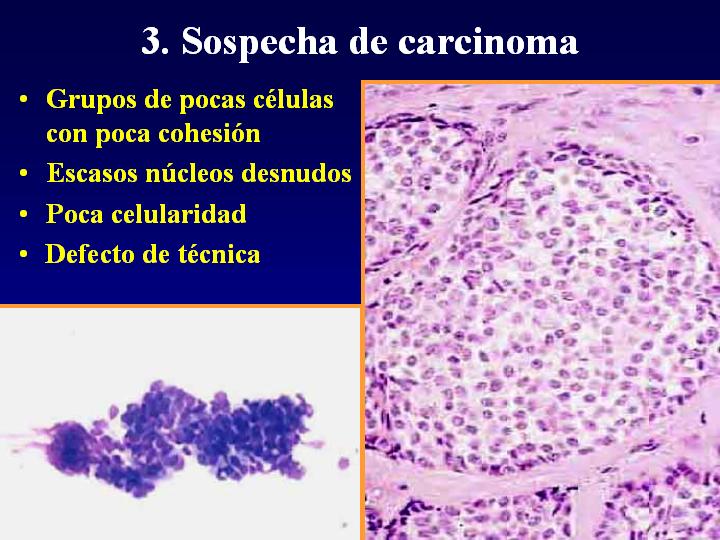 fiogf49gjkf0dFig 8.Sospecha de carcinoma"> fiogf49gjkf0dFig 8.Sospecha de carcinoma">
Sospecha - fiogf49gjkf0d Fig 8.Sospecha de carcinoma
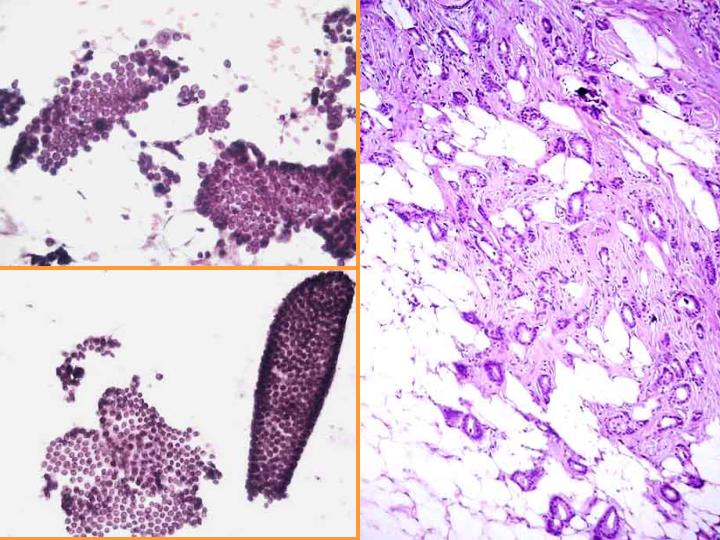 fiogf49gjkf0dFig 9. Sospecha de carcinoma"> fiogf49gjkf0dFig 9. Sospecha de carcinoma">
diapositiva17 - fiogf49gjkf0d Fig 9. Sospecha de carcinoma
|
|
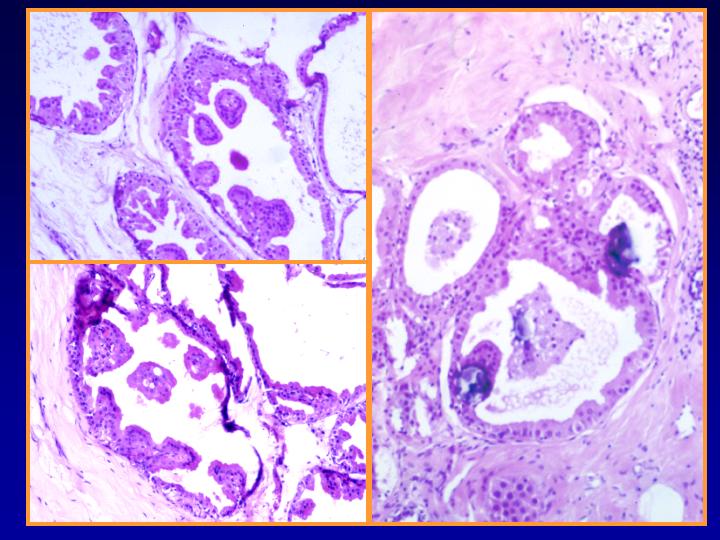
B- Neoplasias papilares
fiogf49gjkf0d Neoplasia papilar. La muestra puede obtenerse por:
- Secreción por el pezón
- Punción de lesión quística
- Punción aspiración de nódulo
- En general el patrón citológico muestra disposición tridimensional sin marcadas atipias ni mitosis.
- El diagnóstico será siempre descriptivo y de neoplasia papilar y por lo tanto no implica benignidad ni malignidad (Figs 10,11,12 y 13)
Papiloma (Figs 14,15 y 16)
- Puede interpretarse como maligno
- Menos células que en maligno
- Escasa células aisladas
- Células mioepiteliales
- Células apocrinas y espumosas
- Macrófagos con hemosiderina
Carcinoma Papilar (Figs 17 y 18)
- Diátesis hemorrágica
- Marcada celularidad
- Fragmentos papilares
- Numerosas células cuboidales aisladas
- Atipia escasa
- Macrófagos
- Núcleos bipolares
- Ausencia de células apocrinas
Diagnóstico diferencial en los siguientes casos
A- Papilomatosis en EFQ
B- Fibroadenoma
C- Carcinoma
A-EFQ-hiperplasia-papilomatosis (Fig 19)
- Diátesis hemorrágica
- Poca celularidad
- Fragmentos papilares
- Atipia escasa
- Células aisladas con citoplasma cuboidal
- Células espumosas apocrinas y núcleos bipolares
B-Fibroadenoma (Fig 20)
- Células epiteliales en disposición semejante a papilas
- No hay células columnares
- Núcleos desnudos
C-Carcinoma ductal (Fig 21)
- Componente micropapilar
- Depende del lugar de la punción
- Valorar criterios de malignidad
Referencias
- Jeffrey PB, Ljung BM.:Benign and malignant papillary lesions of the breast. A cytomorphologic study. Am J Clin Pathol. 1994.101(4):500-7.
- Simsir A, Waisman J, Thorner K, Cangiarella J.M: Mammary lesions diagnosed as "papillary" by aspiration biopsy: 70 cases with follow-up. Cancer. 2003; 25;99(3):156-65.
- Dawson AE, Mulford DK.: Benign versus malignant papillary neoplasms of the breast. Diagnostic clues in fine needle aspiration cytology. Acta Cytol. 1994;38(1):23-8
- Michael CW, Buschmann B.:Can true papillary neoplasms of breast and their mimickers be accurately classified by cytology? Cancer. 2002.25;96(2):92-100.
 fiogf49gjkf0dFig 10.Neoplasia papilar"> fiogf49gjkf0dFig 10.Neoplasia papilar">
papilar - fiogf49gjkf0d Fig 10.Neoplasia papilar
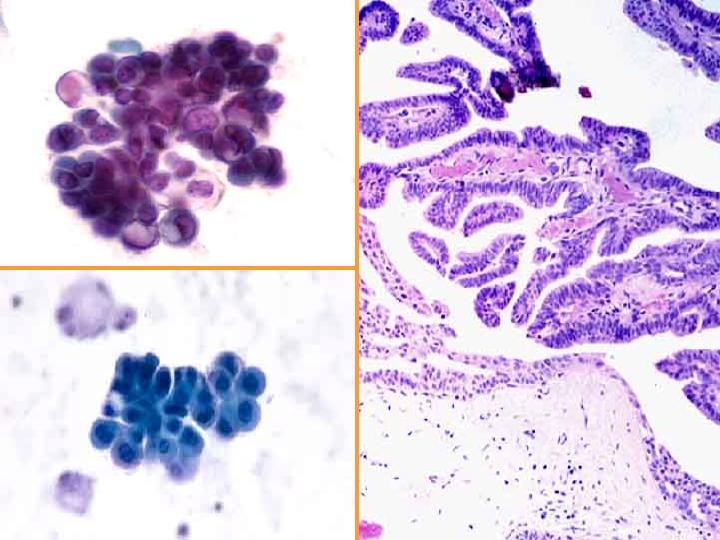 fiogf49gjkf0dFig 11.Neoplasia papilar"> fiogf49gjkf0dFig 11.Neoplasia papilar">
diapositiva23 - fiogf49gjkf0d Fig 11.Neoplasia papilar
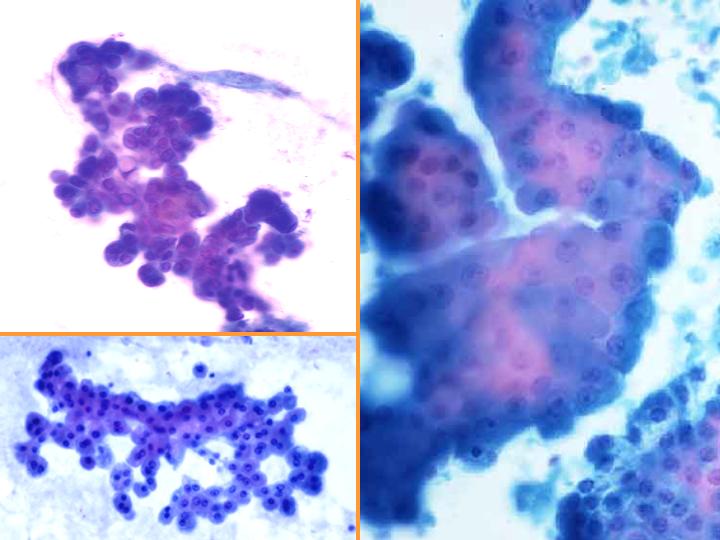 fiogf49gjkf0dFig 12.Neoplasia papilar"> fiogf49gjkf0dFig 12.Neoplasia papilar">
diapositiva24 - fiogf49gjkf0d Fig 12.Neoplasia papilar
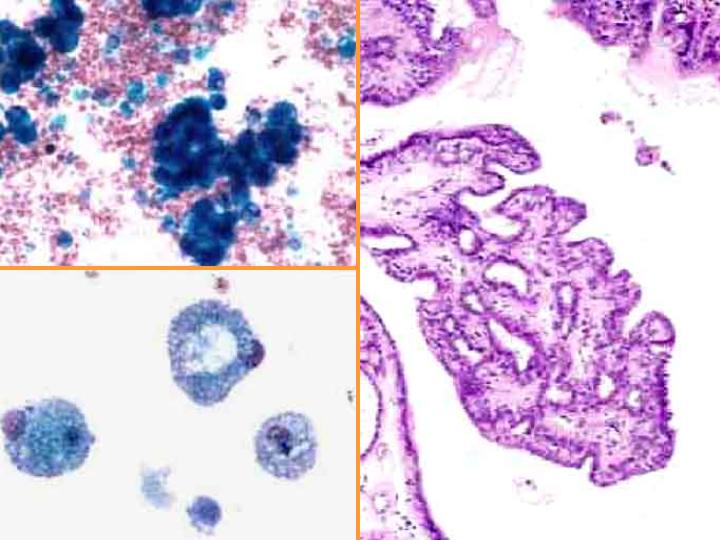 fiogf49gjkf0dFig 13.Neoplasia papilar"> fiogf49gjkf0dFig 13.Neoplasia papilar">
diapositiva25 - fiogf49gjkf0d Fig 13.Neoplasia papilar
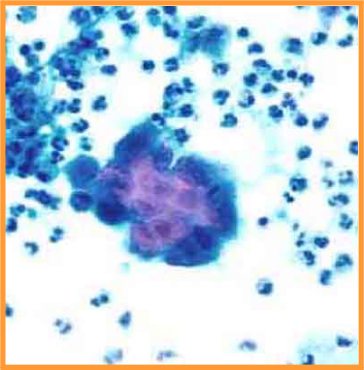 fiogf49gjkf0dFig 14.Papiloma"> fiogf49gjkf0dFig 14.Papiloma">
Papiloma - fiogf49gjkf0d Fig 14.Papiloma
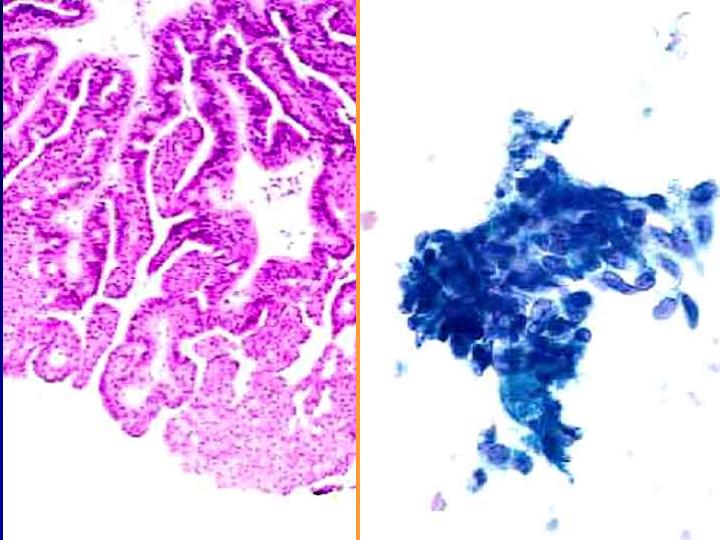 fiogf49gjkf0dFig 15.Papiloma"> fiogf49gjkf0dFig 15.Papiloma">
diapositiva27 - fiogf49gjkf0d Fig 15.Papiloma
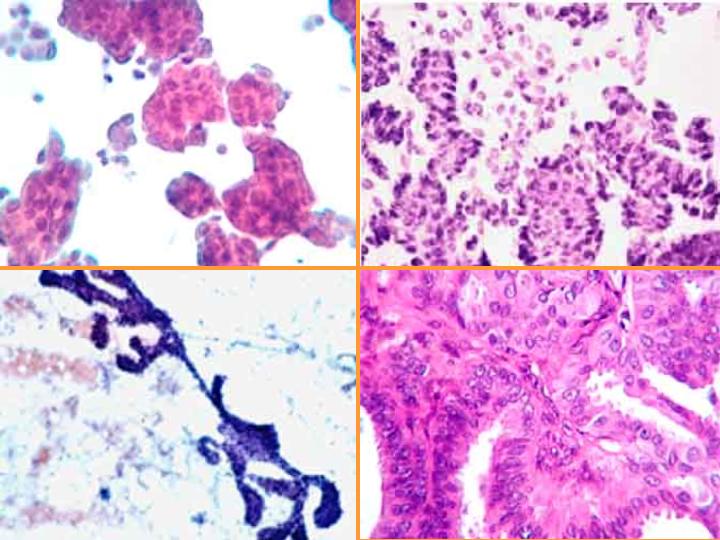 fiogf49gjkf0dFig 16.Papiloma"> fiogf49gjkf0dFig 16.Papiloma">
diapositiva28 - fiogf49gjkf0d Fig 16.Papiloma
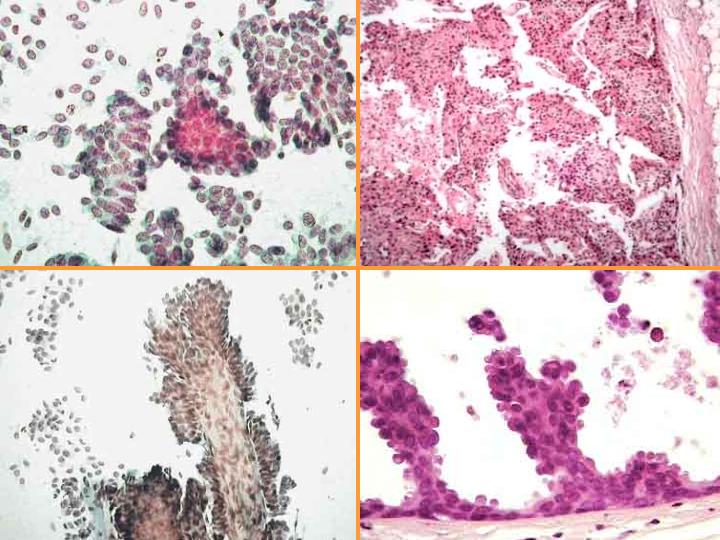 fiogf49gjkf0dFig 17.Carcinoma Papilar"> fiogf49gjkf0dFig 17.Carcinoma Papilar">
Carcinoma Papilar - fiogf49gjkf0d Fig 17.Carcinoma Papilar
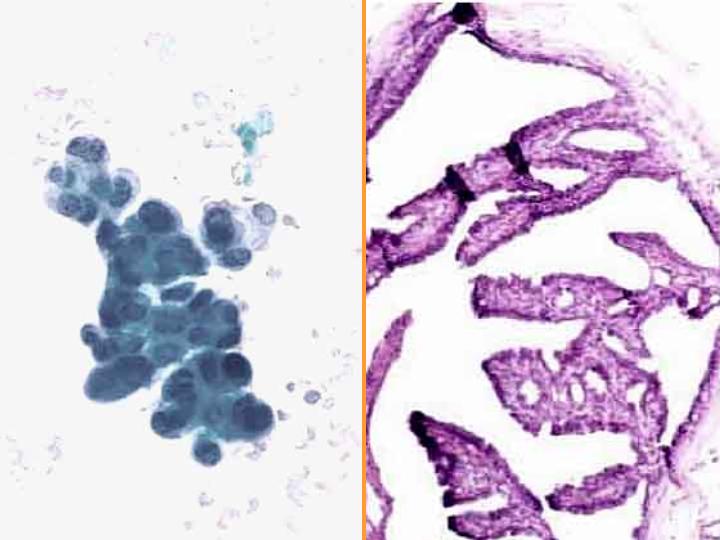 fiogf49gjkf0dFig 18.Carcinoma Papilar"> fiogf49gjkf0dFig 18.Carcinoma Papilar">
diapositiva31 - fiogf49gjkf0d Fig 18.Carcinoma Papilar
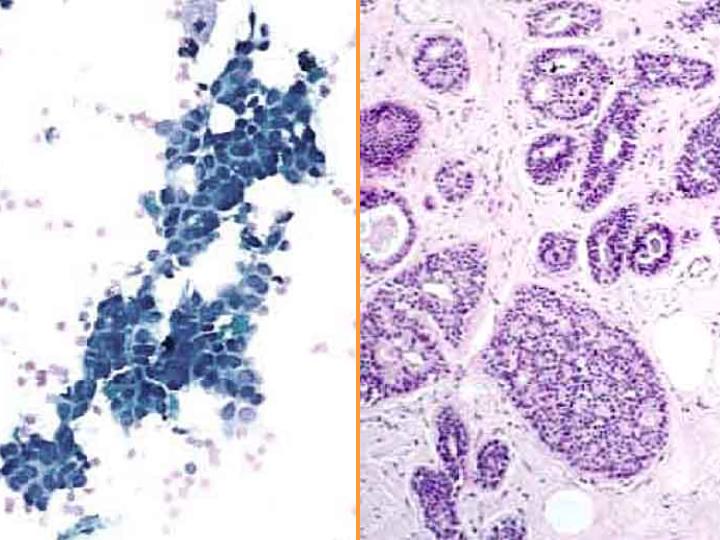 fiogf49gjkf0dFig 19.EFQ-hiperplasia-papilomatosis"> fiogf49gjkf0dFig 19.EFQ-hiperplasia-papilomatosis">
papilomatosis - fiogf49gjkf0d Fig 19.EFQ-hiperplasia-papilomatosis
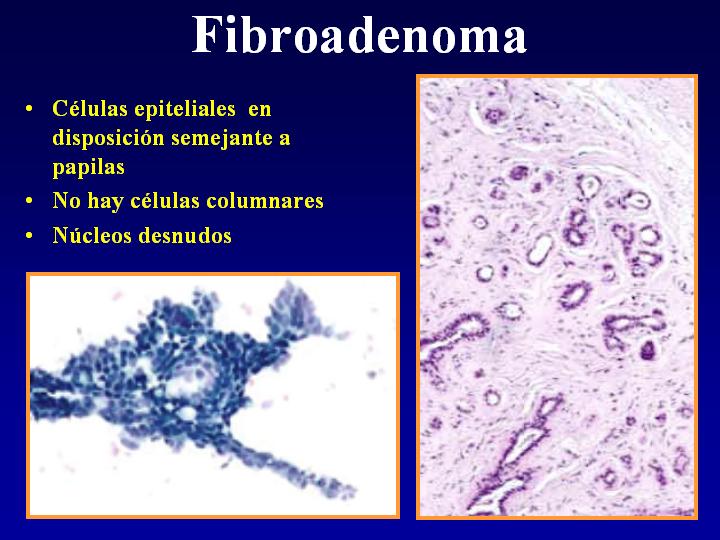 fiogf49gjkf0dFig 20.Fibroadenoma"> fiogf49gjkf0dFig 20.Fibroadenoma">
Fibroadenoma* - fiogf49gjkf0d Fig 20.Fibroadenoma
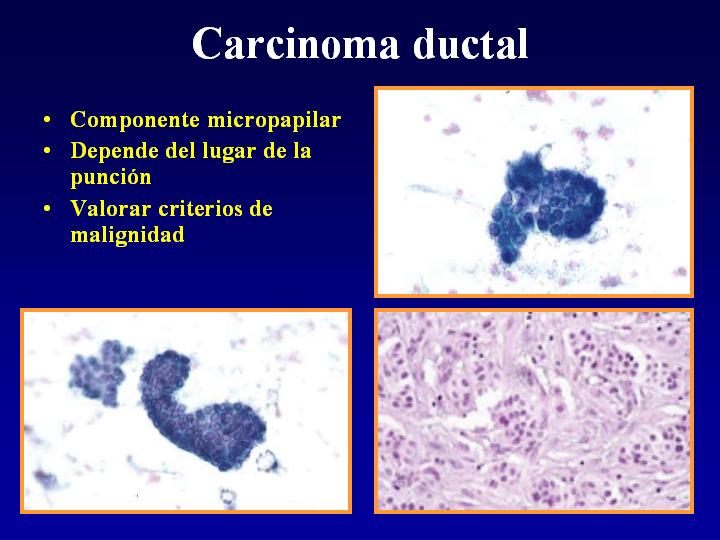 fiogf49gjkf0dFig 21.Carcinoma ductal"> fiogf49gjkf0dFig 21.Carcinoma ductal">
Carcinoma ductal - fiogf49gjkf0d Fig 21.Carcinoma ductal
|
|
C- Enfermedad fibroquística con hiperplasia
fiogf49gjkf0d EFQ - Hiperplasia - CDIS
- ¿Es práctico hacer la diferenciación entre hiperplasia atípica y CDIS en citología?
- En realidad se trata de un espectro continuo
- Lo IMPORTANTE desde el punto de vista citológico es diferenciar entre hiperplasia sin atipia y carcinoma. Hay que tener en cuenta que la interpretación es subjetiva y que además faltan los criterios arquitecturales
- Algunos procesos hiperplásicos benignos del epitelio de la mama cursan con grados de atipia citológica muy variables.
- Hay tumores tan diferenciados que son muy difíciles de distinguir de procesos hiperplásicos benignos.
- El porcentaje de carcinomas en hiperplasia atípica en relación al conjunto de pacientes con cáncer varia del 3,7 % al 22,2 % según autores
- La aparición de carcinoma tras el seguimiento de lesiones de hiperplasia atípica comprobadas en biopsia es del 5,1 % al 12,9 % según autores
Criterios generales a valorar en la EFQ
- Disposición de las células
- Pleomorfismo
- Anisonucleosis
- Células mioepiteliales
- Patrón de la cromatina
- Nucléolos
Gangopadhyay M, Nijhawan R, Joshi K, Gupta S.:Cytology of "significant" breast ductal proliferations.
Acta Cytol. 1997.41(4):1112-20.
EFQ- Hallazgos habituales (Figs 22 y 23)
- Poca celularidad
- Fragmentos de estroma y/o tejido adiposo
- Células en monocapa
- Células espumosas
- Células mioepiteliales
Hiperplasia sin atipias(Figs 24 y 25)
- Moderada celularidad
- Grupos con buena cohesión
- Ligera aumento del núcleo y pequeños nucléolos
- Células apocrinas, histiocitos y algunas calcificaciones
- Pérdida focal de la polaridad
- Algunas células mioepiteliales
Hiperplasia ductal. Otros criterios que pueden aplicarse (Fig 26)
- Grupos tridimensionales
- Crecimiento en “remolinos”
- Pequeñas luces. Pérdida de cohesión
- Moderada superposición nuclear
Gangopadhyay M, Nijhawan R, Joshi K, Gupta S.:Cytology of "significant" breast ductal proliferations. Acta Cytol. 1997.41(4):1112-20.
Hiperplasia con atipias (Figs 27 y 28)
- Muy celular
- Amoldamiento celular con superposición de los núcleos
- Anisocariosis
- Cromatina en grumos
- A veces nucléolos
- Células mioepiteliales
- Rara vez apocrinas y macrófagos
Hiperplasia con atipia. Otros criterios que pueden aplicarse
- Basado en criterios nucleares
- Anisocariosis
- Membrana nuclear irregular
- Cromatina en grumos
- Macronucléolos eosinófilos
- Disminución de las células mioepiteliales
Gangopadhyay M, Nijhawan R, Joshi K, Gupta S.:Cytology of "significant" breast ductal proliferations.Acta Cytol. 1997.41(4):1112-20.
EFQ-Hiperplasia. Frecuencia de aparición de estos criterios
- Grupos tridimensionales con células mioepiteliales, masas celulares en “remolino”y pequeñas hendiduras o luces irregulares y periféricas (65% de casos)
- Grupos irregulares de epitelio ductal con células mioepiteliales y proyecciones bulbosas encadenadas al epitelio ductal (29%)
- Diátesis con grupos de células ductales con bordes deshilachados (32%).
- Otros: moderado aumento de la celularidad, superposición nuclear, mínima atipia y pocas células aisladas
Dawson AE, Mulford DK, Sheils LA. :The cytopathology of proliferative breast disease. Comparison with features of ductal carcinoma in situ. Am J Clin Pathol. 1995.103(4):438-42.
Diagnóstico diferencial
A-CDIS no comedo
B-CDIS comedo
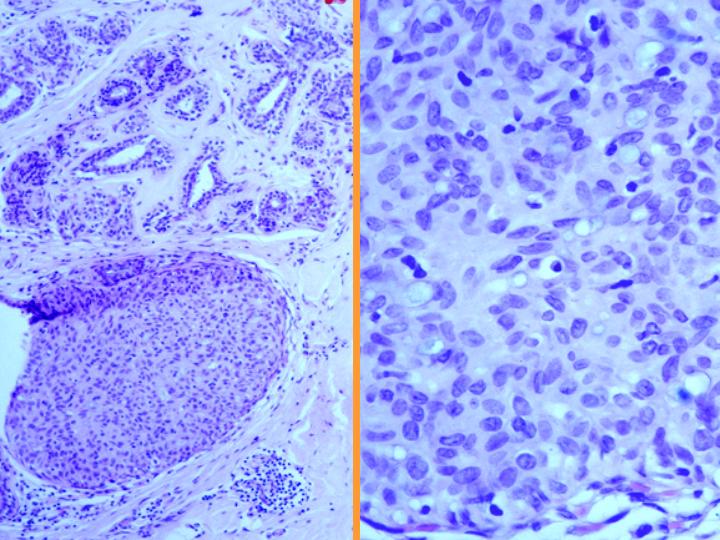
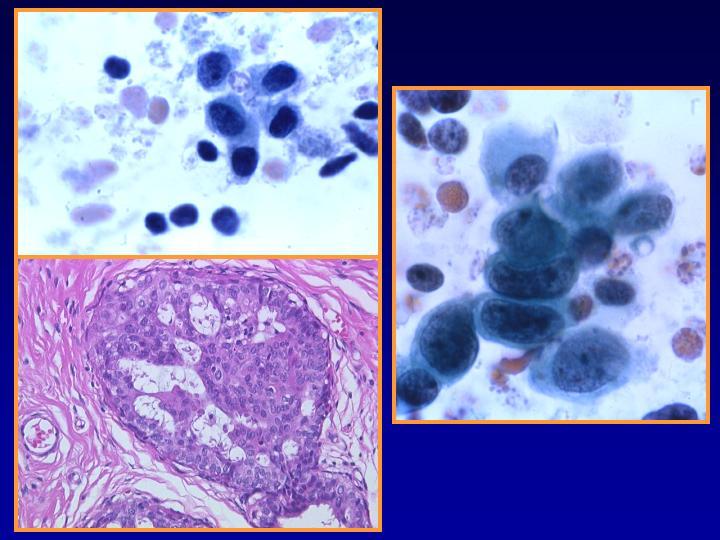
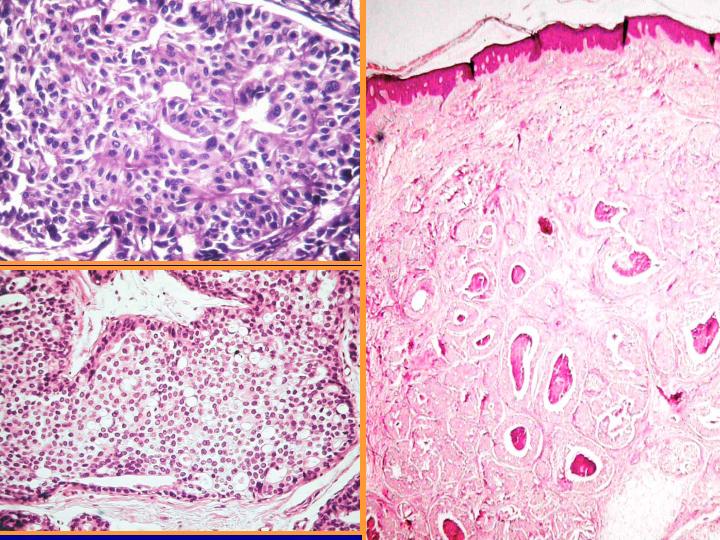
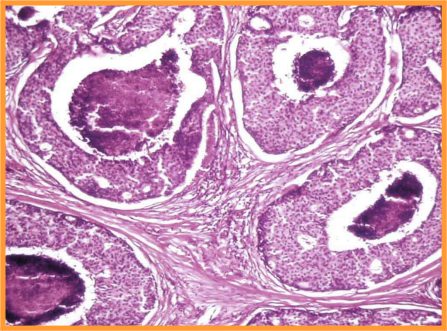
A-CDIS no comedo (Figs 29 y 30)
- Es la forma más similar a la hiperplasia atípica.
- Celularidad variable con células bastante monomorfas de tamaño pequeño o medio
- Se presentan en láminas o con patrón cribiforme o papilar.
- Ausencia de células mioepiteliales
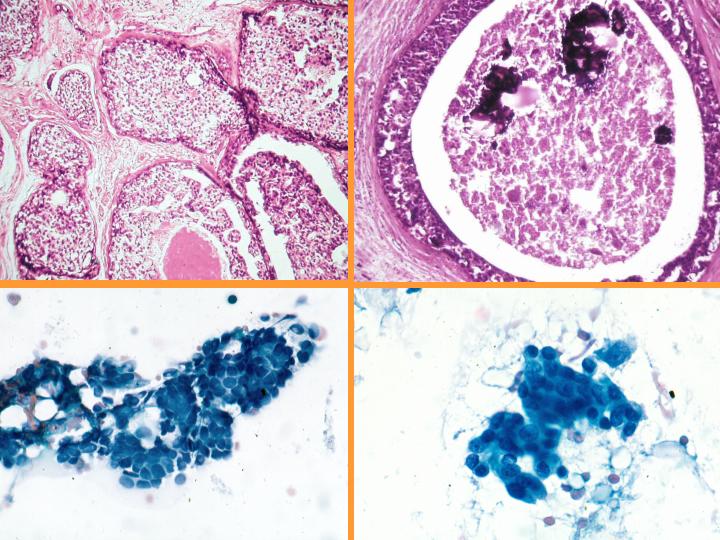
B-CDIS comedo(Figs 31 y 32)
- Diátesis con necrosis
- Abundante celularidad
- Células atípicas pleomorfas
- Necrosis celular individual
- Ausencia de células mioepiteliales
- Ocasionales mitosis
Tabla de criterios para el diagnóstico diferencial
|
Criterios |
Hiperplasia |
CDIS |
|
Celularidad |
++ o +++ |
+ o ++ |
|
|
|
|
|
Atipia |
Mínima |
Moderada-marcada |
|
|
|
|
|
Nucleolo |
No o mínimo |
Presente |
|
|
|
|
|
Células aisladas |
No o pocas |
Moderado |
|
|
|
|
|
Hendiduras |
Sí |
Raras |
|
|
|
|
|
Luces rígidas |
Raras |
Sí |
|
|
|
|
|
Remolinos |
Sí |
Raros |
|
|
|
|
|
Células mioepiteliales |
En grupos |
Raras |
|
|
|
|
|
Diátesis |
Limpia |
Necrosis |
Dawson, 1995
Aplicación de Score en el diagnóstico diferencial
|
Disposición celular |
Monocapa |
Superposición nuclear |
Agupaciones |
Pérdida de cohesión |
|
Pleomorfismo |
Ausente |
Ligero |
Moderado |
Llamativo |
|
Cels. mioepiteliales |
Muchas |
Moderado |
Pocas |
Ausente |
|
Anisonucleosis |
Ausente |
Ligera |
Moderada |
Llamativa |
|
Nucleolo |
Ausente |
Micronucleolo |
Micro o macro |
Micronucleolo |
|
Grumos de cromatina |
Ausente |
Raros |
Ocasionales |
Frecuentes |
|
Score |
1 |
2 |
3 |
4 |
Score total: No proliferativa (6-10), proliferativa sin atipia (11-14), proliferativa con atipia (19-24)
Masood S et al: Prospective evaluation of radiologically detected fine needle aspiration biopsy of nonpalpable breast lesions. Cancer 1990; 66:1480-87,
Referencias
-
Kanhoush R, Jorda M, Gomez-Fernandez C, Wang H, Mirzabeigi M, Ghorab Z, Ganjei-Azar P.:'Atypical' and 'suspicious' diagnoses in breast aspiration cytology.Cancer. 2004.25;102(3):164-7.
-
Sneige N, Staerkel GA.:Fine-needle aspiration cytology of ductal hyperplasia with and without atypia and ductal carcinoma in situ. Hum Pathol. 1994.25(5):485-92.
-
Abendroth CS, Wang HH, Ducatman BS.: Comparative features of carcinoma in situ and atypical ductal hyperplasia of the breast on fine-needle aspiration biopsy specimens Am J Clin Pathol. 1991.96(5):654-9.
-
Masood S, Frykberg ER, McLellan GL, Dee S, Bullard JB. :Cytologic differentiation between proliferative and nonproliferative breast disease in mammographically guided fine-needle aspirates.
Diagn Cytopathol. 1991;7(6):581-90.
 fiogf49gjkf0dFig 22.Enfermedad fibroquística"> fiogf49gjkf0dFig 22.Enfermedad fibroquística">
EFQ - fiogf49gjkf0d Fig 22.Enfermedad fibroquística
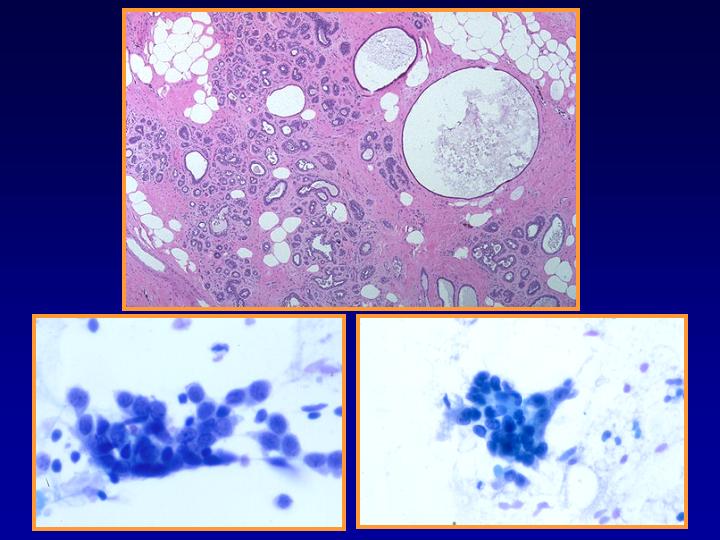 fiogf49gjkf0dFig 23.Enfermedad fibroquística"> fiogf49gjkf0dFig 23.Enfermedad fibroquística">
diapositiva43 - fiogf49gjkf0d Fig 23.Enfermedad fibroquística
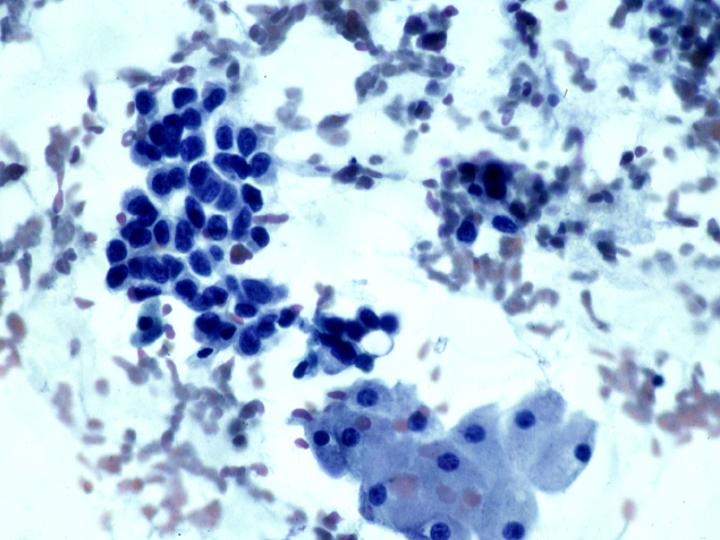 fiogf49gjkf0dFig 24.Hiperplasia sin atipias"> fiogf49gjkf0dFig 24.Hiperplasia sin atipias">
Hiperplasia - fiogf49gjkf0d Fig 24.Hiperplasia sin atipias
 fiogf49gjkf0dFig 25.Hiperplasia sin atipias"> fiogf49gjkf0dFig 25.Hiperplasia sin atipias">
diapositiva46 - fiogf49gjkf0d Fig 25.Hiperplasia sin atipias
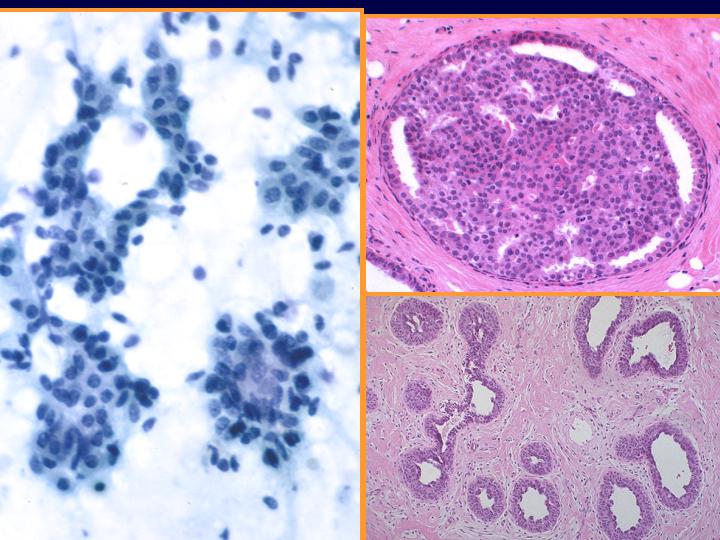 fiogf49gjkf0dFig 26.Hiperplasia ductal"> fiogf49gjkf0dFig 26.Hiperplasia ductal">
ductal - fiogf49gjkf0d Fig 26.Hiperplasia ductal
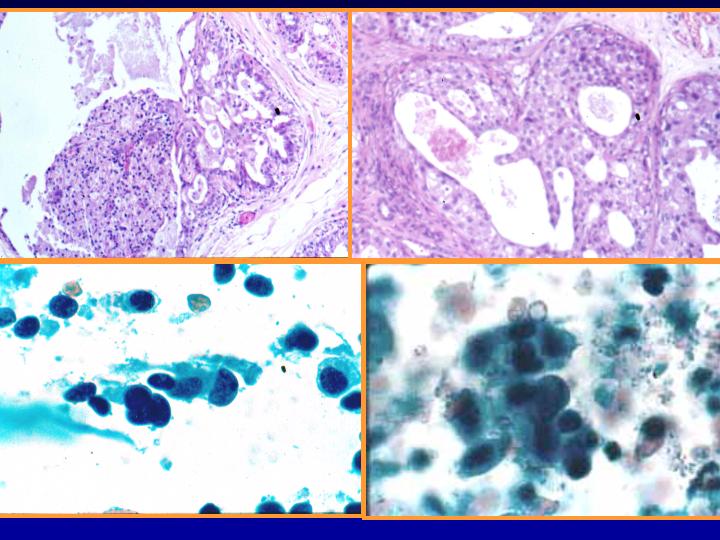 fiogf49gjkf0dFig 27.Hiperplasia con atipias"> fiogf49gjkf0dFig 27.Hiperplasia con atipias">
atipias - fiogf49gjkf0d Fig 27.Hiperplasia con atipias
 fiogf49gjkf0dFig 28.Hiperplasia con atipia"> fiogf49gjkf0dFig 28.Hiperplasia con atipia">
atipia - fiogf49gjkf0d Fig 28.Hiperplasia con atipia
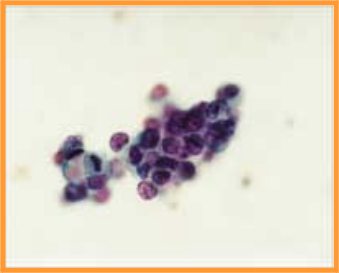 fiogf49gjkf0dFig 29.CDIS no comedo"> fiogf49gjkf0dFig 29.CDIS no comedo">
CDIS - fiogf49gjkf0d Fig 29.CDIS no comedo
 fiogf49gjkf0dFig 30.CDIS no comedo"> fiogf49gjkf0dFig 30.CDIS no comedo">
diapositiva55 - fiogf49gjkf0d Fig 30.CDIS no comedo
 fiogf49gjkf0dFig 31.CDIS comedo"> fiogf49gjkf0dFig 31.CDIS comedo">
comedo - fiogf49gjkf0d Fig 31.CDIS comedo
 fiogf49gjkf0dFig 32.CDIS comedo."> fiogf49gjkf0dFig 32.CDIS comedo.">
diapositiva57 - fiogf49gjkf0d Fig 32.CDIS comedo.
|
|
D- Carcinoma apocrino de bajo grado
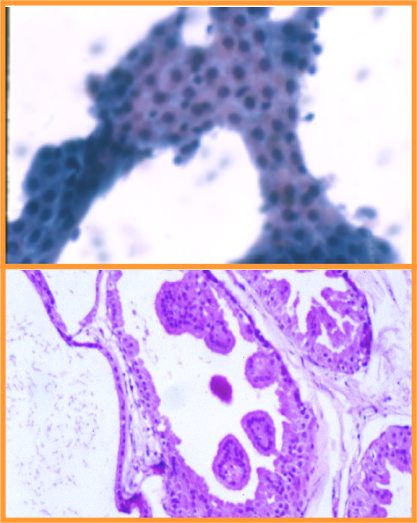
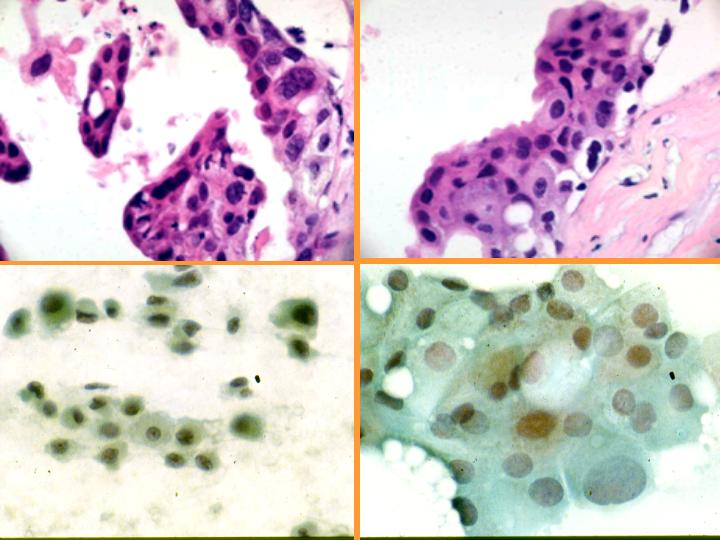
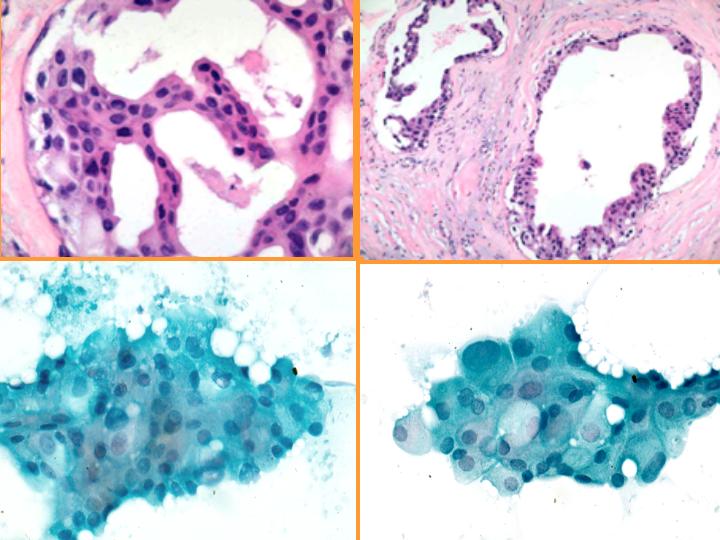
fiogf49gjkf0d Metaplasia apocrina. Se da con frecuencia en:(Figs 33,34 y 35)
- EFQ
- Adenosis apocrina
- Adenosis esclerosante
- Cicatrices radiales
- Papiloma
- Adenoma ductal
• No sobrevalorar la atipia cuando el aspirado se obtiene de una lesión no palpable
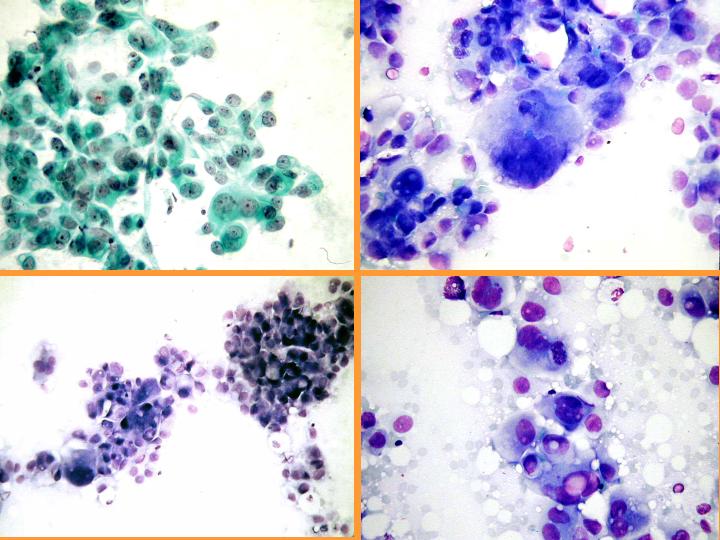
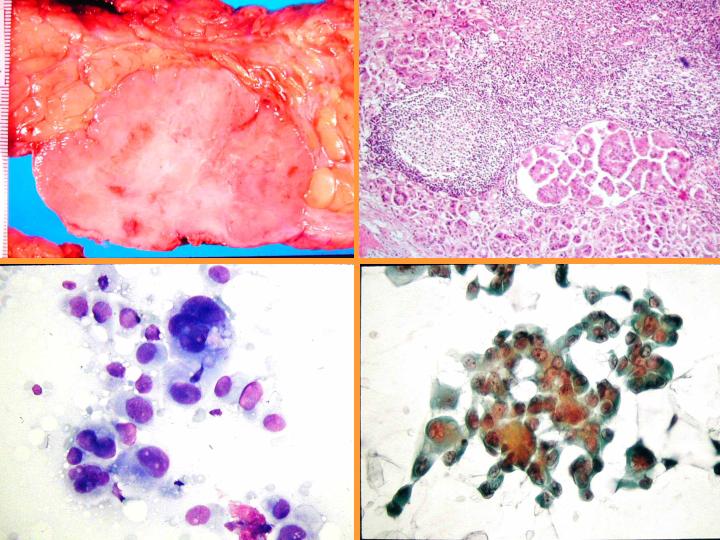
Carcinoma apocrino: características citológicas: (Figs 36 y 37)
- Células apocrinas atípicas con abundante citoplasma granular
- Núcleo grande e irregular
- Marcada anisocariosis
- Gran nucléolo - múltiple
- Diátesis inflamatoria
Ca apocrino. Diagnóstico diferencial
- EFQ con hiperplasia de células apocrinas (población polimorfa)
- Carcinoma secretor rico en lípidos (núcleos más uniformes y nucléolos menos visibles)
- Carcinoma ductal
Referencias
- O'Malley FP, Bane AL. The spectrum of apocrine lesions of the breast. Adv Anat Pathol. 2004;11(1):1-9.
Durham JR, Fechner RE. The histologic spectrum of apocrine lesions of the breast. Am J Clin Pathol. 2000;113(5 Suppl 1):S3-18.
- Seidman JD, Ashton M, Lefkowitz M.:Atypical apocrine adenosis of the breast: a clinicopathologic study of 37 patients with 8.7-year follow-up. Cancer. 1996;77(12):2529-37.
- O'Malley FP, Page DL, Nelson EH, Dupont WD.:Ductal carcinoma in situ of the breast with apocrine cytology: definition of a borderline category. Hum Pathol. 1994 Feb;25(2):164-8.
- Johnson TL, Kini SR.; The significance of atypical apocrine cells in fine-needle aspirates of the breast. Diagn Cytopathol. 1989;5(3):248-54.
- Yoshida K, Inoue M, Furuta S, Sakai R, Imai R, Hayakawa S, Fukatsu T, Nagasaka T, Nakashima N.:Apocrine carcinoma vs. apocrine metaplasia with atypia of the breast. Use of aspiration biopsy cytology. Acta Cytol;40(2):247-51.
- Ng WK, Kong JH, Wong WW.: Atypical apocrine metaplasia: a diagnostic pitfall in fine needle aspiration cytology of the breast. Acta Cytol. 2003 Jul-Aug;47(4):698-701.
- Gupta D, Wolf JA, Rubenchik IA, Middleton LP.:Diagnostic pitfalls in fine needle aspiration cytology of atypical apocrine metaplasia in a breast lesion. A case report. Acta Cytol. 2002;46(4):749-52.
 fiogf49gjkf0dFig 33.Metaplasia apocrina."> fiogf49gjkf0dFig 33.Metaplasia apocrina.">
Metaplasia - fiogf49gjkf0d Fig 33.Metaplasia apocrina.
 fiogf49gjkf0dFig 34.Metaplasia apocrina."> fiogf49gjkf0dFig 34.Metaplasia apocrina.">
diapositiva63 - fiogf49gjkf0d Fig 34.Metaplasia apocrina.
 fiogf49gjkf0dFig 35.Metaplasia apocrina."> fiogf49gjkf0dFig 35.Metaplasia apocrina.">
diapositiva64 - fiogf49gjkf0d Fig 35.Metaplasia apocrina.
 fiogf49gjkf0dFig 36.Carcinoma apocrino."> fiogf49gjkf0dFig 36.Carcinoma apocrino.">
diapositiva66 - fiogf49gjkf0d Fig 36.Carcinoma apocrino.
 fiogf49gjkf0dFig 37.Carcinoma apocrino."> fiogf49gjkf0dFig 37.Carcinoma apocrino.">
diapositiva67 - fiogf49gjkf0d Fig 37.Carcinoma apocrino.
|
|
Conclusiones
fiogf49gjkf0d
-
La zona “gris” abarca muchas lesiones de la citología de la mama.
-
La citología no refleja la arquitectura y es una limitación de la PAAF
-
El tipo de lesión histológica subyacente es muy variado
-
Gran complejidad en la valoración de las lesiones
-
Importante grado de subjetividad
-
Es precisa una nomenclatura uniforme
-
El fibroadenoma con atipia es una de las más frecuentes fuentes de error y debe ser valorada con precaución
-
El diagnóstico de neoplasia papilar debe ser interpretado como sospecha de malignidad
-
Marcadas dificultades en la categorización de las hiperplasias ductales
-
La diferenciación entre hiperplasia atípica-CDIS es imposible en la práctica
-
Valorar la metaplasia apocrina dentro del contexto global
La pregunta clave es: ¿cómo
informar la citología?
Descriptivo y de sospecha
SE RECOMIENDA SIEMPRE EL ESTUDIO HISTOLÓGICO
Ozkara SK, Ustun MO, Paksoy N.:The gray zone in breast fine needle aspiration cytology. How to report on it?Acta Cytol. 2002;46(3):513-8.
|
|
Agradecimientos
|
|
Bibliografía
· Al-Kaisi N: The spectrum of the “gray zone” in breast cytology. A review of 186 cases of atypical and suspicious cytology. The spectrum of the “gray”. Acta Cytol 1994, 38:898-908
· Stanley MW, Tani EM, Skoog L.: Fine-needle aspiration of fibroadenomas of the breast with atypia: a spectrum including cases that cytologically mimic carcinoma. Diagn Cytopathol. 1990;6(6):375-82.
· Ozkara SK, Ustun MO, Paksoy N.: The gray zone in breast fine needle aspiration cytology. How to report on it? Acta Cytol. 2002 May-Jun;46(3):513-8.
· Jeffrey PB, Ljung BM.:Benign and malignant papillary lesions of the breast. A cytomorphologic study. Am J Clin Pathol. 1994.101(4):500-7.
· Simsir A, Waisman J, Thorner K, Cangiarella J.M: Mammary lesions diagnosed as "papillary" by aspiration biopsy: 70 cases with follow-up. Cancer. 2003; 25;99(3):156-65.
· Dawson AE, Mulford DK.: Benign versus malignant papillary neoplasms of the breast. Diagnostic clues in fine needle aspiration cytology. Acta Cytol. 1994;38(1):23-8
· Michael CW, Buschmann B.: Can true papillary neoplasms of breast and their mimickers be accurately classified by cytology? Cancer. 2002.25;96(2):92-100.
· Kanhoush R, Jorda M, Gomez-Fernandez C, Wang H, Mirzabeigi M, Ghorab Z, Ganjei-Azar P.:'Atypical' and 'suspicious' diagnoses in breast aspiration cytology.Cancer. 2004.25;102(3):164-7.
· Sneige N, Staerkel GA.:Fine-needle aspiration cytology of ductal hyperplasia with and without atypia and ductal carcinoma in situ. Hum Pathol. 1994.25(5):485-92.
· Abendroth CS, Wang HH, Ducatman BS.: Comparative features of carcinoma in situ and atypical ductal hyperplasia of the breast on fine-needle aspiration biopsy specimens Am J Clin Pathol. 1991.96(5):654-9.
· Masood S, Frykberg ER, McLellan GL, Dee S, Bullard JB.: Cytologic differentiation between proliferative and nonproliferative breast disease in mammographically guided fine-needle aspirates.
Diagn Cytopathol. 1991;7(6):581-90.
· O'Malley FP, Bane AL. The spectrum of apocrine lesions of the breast. Adv Anat Pathol. 2004;11(1):1-9.
· Durham JR, Fechner RE. The histologic spectrum of apocrine lesions of the breast. Am J Clin Pathol. 2000;113(5 Suppl 1):S3-18.
· Seidman JD, Ashton M, Lefkowitz M.:Atypical apocrine adenosis of the breast: a clinicopathologic study of 37 patients with 8.7-year follow-up. Cancer. 1996;77(12):2529-37.
· O'Malley FP, Page DL, Nelson EH, Dupont WD.:Ductal carcinoma in situ of the breast with apocrine cytology: definition of a borderline category. Hum Pathol. 1994 Feb;25(2):164-8.
· Johnson TL, Kini SR.; The significance of atypical apocrine cells in fine-needle aspirates of the breast. Diagn Cytopathol. 1989;5(3):248-54.
· Yoshida K, Inoue M, Furuta S, Sakai R, Imai R, Hayakawa S, Fukatsu T, Nagasaka T, Nakashima N.: Apocrine carcinoma vs. apocrine metaplasia with atypia of the breast. Use of aspiration biopsy cytology. Acta Cytol;40(2):247-51.
· Ng WK, Kong JH, Wong WW.: Atypical apocrine metaplasia: a diagnostic pitfall in fine needle aspiration cytology of the breast. Acta Cytol. 2003;47(4):698-701.
· Gupta D, Wolf JA, Rubenchick IA, Middleton LP.: Diagnostic pitfalls in fine needle aspiration cytology of atypical apocrine metaplasia in a breast lesion. A case report. Acta Cytol. 2002: 46(4): 749-52
|
|



