|
|
Modelo de isquemia/reperfusión en ratones PARP knockout. Valoración de las alteraciones histopatológicas renales.
Prof. Francisco O'Valle Ravassa
,
Dr. David Martín Oliva
,
Dra Virginia Chamorro
,
Dra. Mercedes Gómez Morales
,
Dra. María del Carmen Benítez García
,
Prof. Felix Vargas Palomares
,
Dr. Francisco Javier Oliver Pozo
y
Prof. Raimundo García del Moral Garrido
Departamento de Anatomía Patológica.
Departamento de Fisiología.
Universidad de Granada
Instituto de Parasitología y Biomedicina López-Neyra.CSIC. Granada.
España
|
|
|
|
|
|
|
|
Resumen
|
|
|
|
Poli (ADP-ribosa) polimerasa (PARP-1) es un enzima nuclear que detecta específicamente las rupturas de ADN ocasionadas por diferentes genotóxicos. incluidas las especies reactivas de oxígeno (ROS). La sobreactivación de PARP-1 debido a la presencia masiva de daño en el ADN por radicales libres ha sido implicada en diversas condiciones fisiopatológicas renales como el daño por isquemia-reperfusión.
A pesar de todas las implicaciones que este enzima tiene en el daño por isquemia-reperfusión no se ha establecido un modelo en ratón para estudiar la posible repercusión que tiene su activación o bloqueo sobre el daño morfológico y funcional del riñón. Nuestro propósito ha sido diseñar un modelo para poder estudiar y conocer las lesiones histopatológicas achacables a la activación de PARP-1 en el parénquima renal.
Material y métodos: Fueron utilizados ratones machos C57/BJ parp-1+/+ y parp-1-/- de 24 semanas de edad con el siguiente protocolo de isquemia-reperfusión: tras anestesiar intraperitonealmente a los animales, clampar el pedículo vascular completo del riñón izquierdo durante 45 minutos seguido de 6 horas de reperfusión, los ratones fueron sacrificados. En todos los animales, el riñón contralateral fue utilizado como control. Las muestras fueron fijadas en formalina tamponada al 10%, incluidas en parafina y teñidas con hematoxilina-eosina y PAS.
Resultados: Los riñones control no presentaron ninguna anomalía morfológica cortical o medular, en ningún caso se observó daño glomerular, tubulointersticial ni vascular. Los ratones deficientes en PARP-1 -/- sólo mostraron leve e incipiente vacuolización celular en túbulos aislados. Los ratones PARP-1 +/+ por el contrario tras 6 horas de reperfusión presentaron moderada y difusa vacuolización en túbulos corticales, desprendimiento células tubulares con desestructuración del ribete en cepillo de túbulos contorneados proximales y numerosos glóbulos protéicos PAS+ (proteína de Tamm Horsfall) en túbulos corticales.
Conclusión: La presencia de lesiones parenquimatosas renales similares a la necrosis tubular aguda incipiente indica que el modelo experimental es adecuado para valorar el daño por isquemia-reperfusión. La escasas lesiones renales en ratones deficientes en PARP-1 sostienen la importancia de este enzima como mediador de lesión en la isquemia reperfusión renal.
|
|
|
|
|
|
|
Introducción
|
|
|
|
La isquemia renal es una de las causas más comunes de fallo renal agudo (Thadani et al., 1996). Aunque la reperfusión es sin duda esencial para la supervivencia del tejido isquémico hay suficientes evidencias de que por sí misma es inductora de daño parenquimatoso (daño por reperfusión) (Weight et al., 1996). Estas lesiones han sido atribuidas a diferentes factores entre los que se incluyen: la depleción de adenosina trifosfato (ATP), el aumento de la concentración de calcio intracelular, la activación de fosfolipasas de membrana, la disfunción del citoesqueleto, los mediadores químicos de la inflamación generados por el infiltrado inflamatorio agudo (PMN) y especialmente la generación de radicales libres derivados del oxígeno (Chatterjee et al., 2000).
En trasplante renal la necrosis tubular aguda de causa isquémica determina un retraso significativo en la recuperación de la función renal y se caracteriza histopatológicamente por zonas focales de necrosis que alternan con áreas tubulares aparentemente indemnes, tubulorrexis con ruptura de membranas basales en túbulos contorneados proximales, dilatación tubular, presencia de cilindros compuesto por células necróticas desprendidas, proteína de Tamm-Horsfall y pigmento (Pascual & Liaño, 2003).
La Poli (ADP-ribosa) polimerasa-1 (PARP-1) de 113 kDa es un miembro de la familia de enzimas PARP, un enzima nuclear abundante con dos motivos en dedo de zinc, que detecta específicamente las rupturas de ADN ocasionadas por diferentes genotóxicos como los radicales libres derivados del oxígeno. La activación de PARP-1 seguida a la lesión en el ADN por radicales libres ha sido implicada en diversas condiciones fisiopatológicas renales como el daño por isquemia-reperfusión. El estrés oxidativo induce sobreactivación de PARP consumo masivo de NAD+ y consecuentemente depleción de ATP que culmina con la disfunción o la necrosis celular (para más detalles consultar la reciente revisión de Virág & Szabó, 2002).
Diferentes evidencias resaltan la importancia de establecer un modelo experimental con ratones PARP-1+/+ “wild type” y PARP-1-/- “knockout”: 1) El daño por reperfusión juega un papel principal en el fallo renal; 2) la activación de PARP-1 ha sido implicada en el daño por isquemia-repercusión en diferentes órganos (cerebro, corazón, intestino…); y por último, 3) ha sido reconocido el beneficio de la inhibición farmacológica de PARP-1 en modelos no renales de daño por isquemia-reperfusión (Chatterjee et al., 2000).
A pesar de todas las implicaciones que este enzima tiene en el daño por isquemia-reperfusión no se ha establecido un modelo en ratón para estudiar la posible repercusión que tiene su activación o bloqueo sobre el daño morfológico y funcional del riñón. Nuestro propósito ha sido diseñar un modelo para poder estudiar y conocer las lesiones histopatológicas achacables a la activación de PARP-1 en el parénquima renal.
|
|
|
|
|
|
|
Material y Métodos
|
|
|
|
El modelo fue desarrollado empleando ratones machos C57/BJ PARP-1+/+ y PARP-1-/- deficientes de 24 semanas y 20-30 g de peso obtenidos según el procedimiento descrito por uno de los autores (OFJ), como se especifica en el apartado de resultados. Los ratones fueron controlados y mantenidos en el animalario del Instituto de Parasitología y Biomedicina López-Neyra del Consejo de Investigaciones Científicas de Granada en las condiciones adecuadas de estabulación con alimentación y agua ad libitum. Todos los procedimientos fueron realizados de acuerdo a las normativas reguladas por la Unión Europea y el Gobierno Español (Directiva CEE 86/609, RD 223/1988).
- Modelo de isquemia-reperfusión murino.
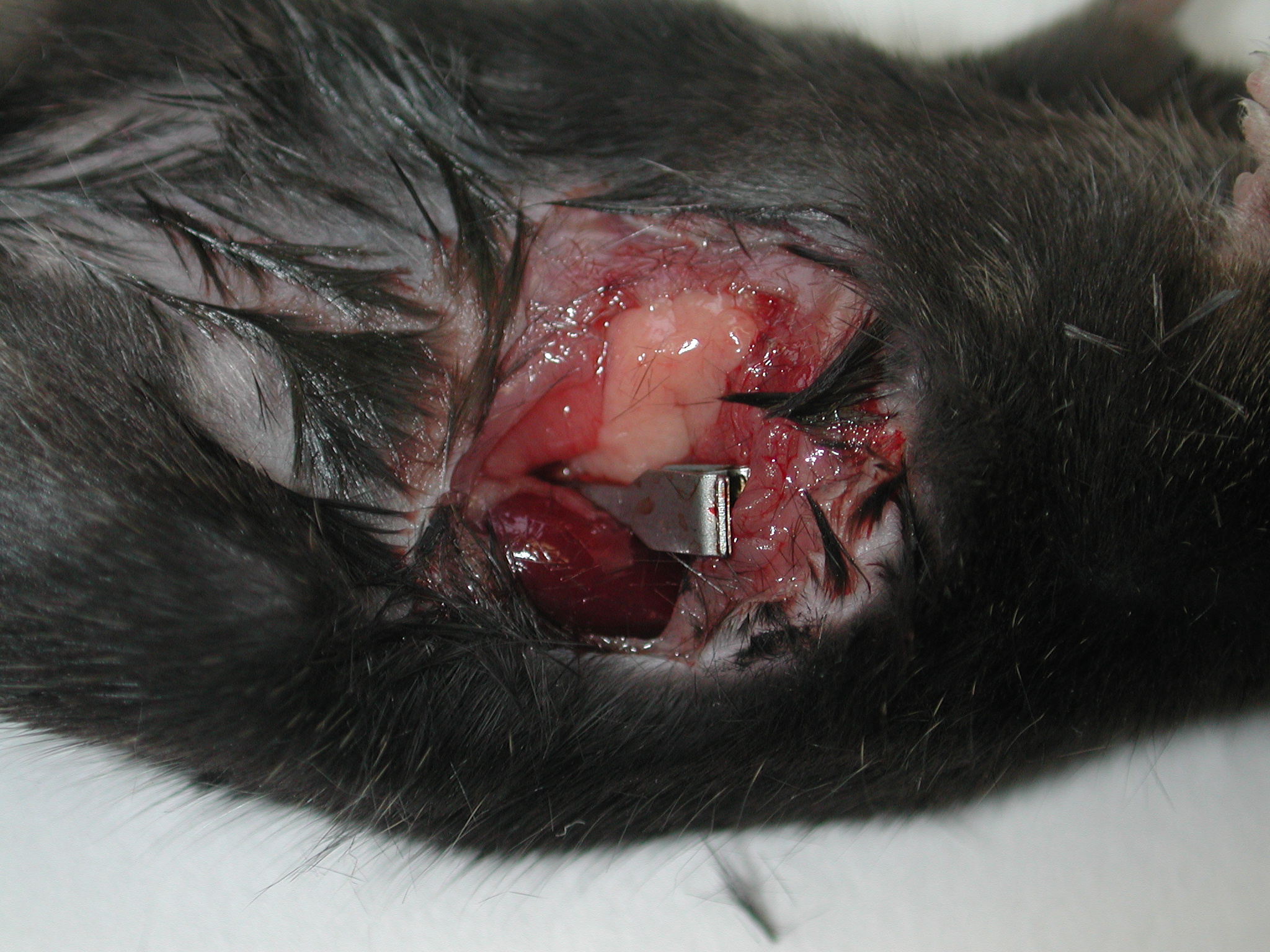
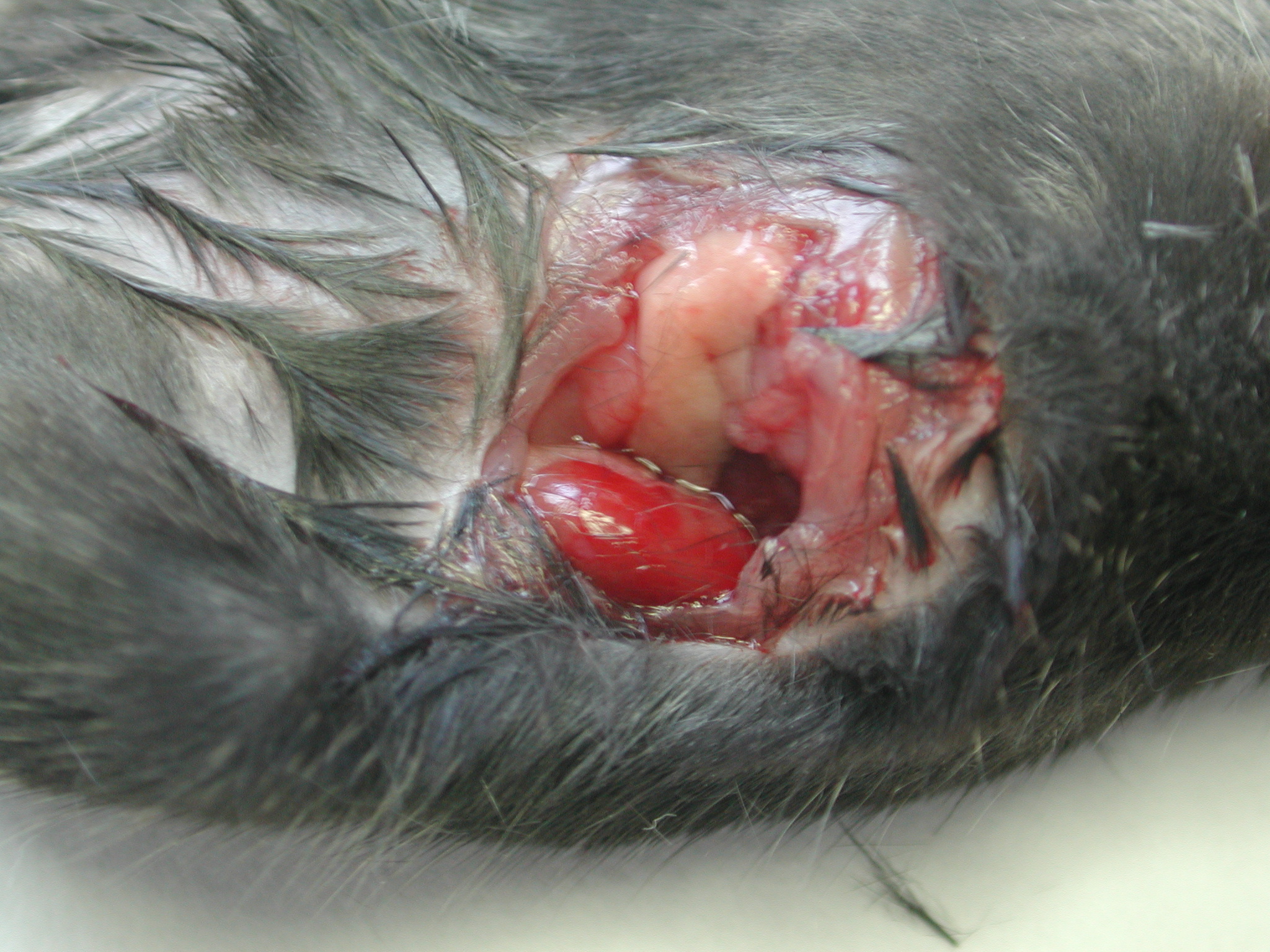
Los ratones fueron anestesiados mediante inyección intraperitoneal con equitensina 2UI/20g de peso y estabilizados en placa térmica regulada a 37ºC. Se procedió a realizar una incisión horizontal abdominal anterolateral izquierda de 1.5 cm por la que fue localizado el riñón y su pedículo vascular, que fue clampado totalmente durante 45 minutos (figura 1), transcurridos los cuales, fue eliminado el clip (figura 2) y suturado por planos peritoneo y piel. Tras 6 horas los animales fueron sacrificados con una sobredosis de pentotal sódico. No se produjo ninguna muerte intraoperatoria ni en el periodo de reperfusión.
- Toma de muestras renales.
Se establecieron dos grupos PARP-1+/+ y PARP-1-/-. De cada animal el riñón izquierdo fue sometido a isquemia/reperfusión por clampaje del pedículo vascular renal y el derecho fue utilizado como control. Las muestras renales una vez extraídas fueron fijadas inmediatamente en formalina tamponada al 10% durante 24 horas, posteriormente incluidas en parafina y teñidas con hematoxilina-eosina y PAS. El estudio microscópico se realizó sobre cortes longitudinales del riñón, valorándose las lesiones en corteza y médula sobre la totalidad de los glomérulos, vasos, túbulos e intersticio renal.
|
 Zoom Zoom
|
|
|
Aspecto mascroscópico del riñón de ratón C57/BJ tras colocar un clip obstruyendo el pedículo vascular renal. Nótese el aspecto congestivo de la corteza renal.
|
 Zoom Zoom
|
|
|
Aspecto macroscópico del riñón de ratón C57/BJ tras eliminar el clip del pedículo vascular renal. Nótese la recuperación de la coloración en la superficie renal.
|
|
|
|
|
|
|
|
Resultados
|
|
|
|
- Generación de ratones PARP-1-/-
Los ratones PARP-1 “knockout” fueron obtenidos por recombinación homóloga mediante la que se eliminaba el intrón 4 tal como se describe en el trabajo correspondiente (Ménissier de Murcia et al., 1997).
- Lesiones histopatológicas renales.
1. Riñones control de ratones PARP-1+/+ y PARP-1-/-
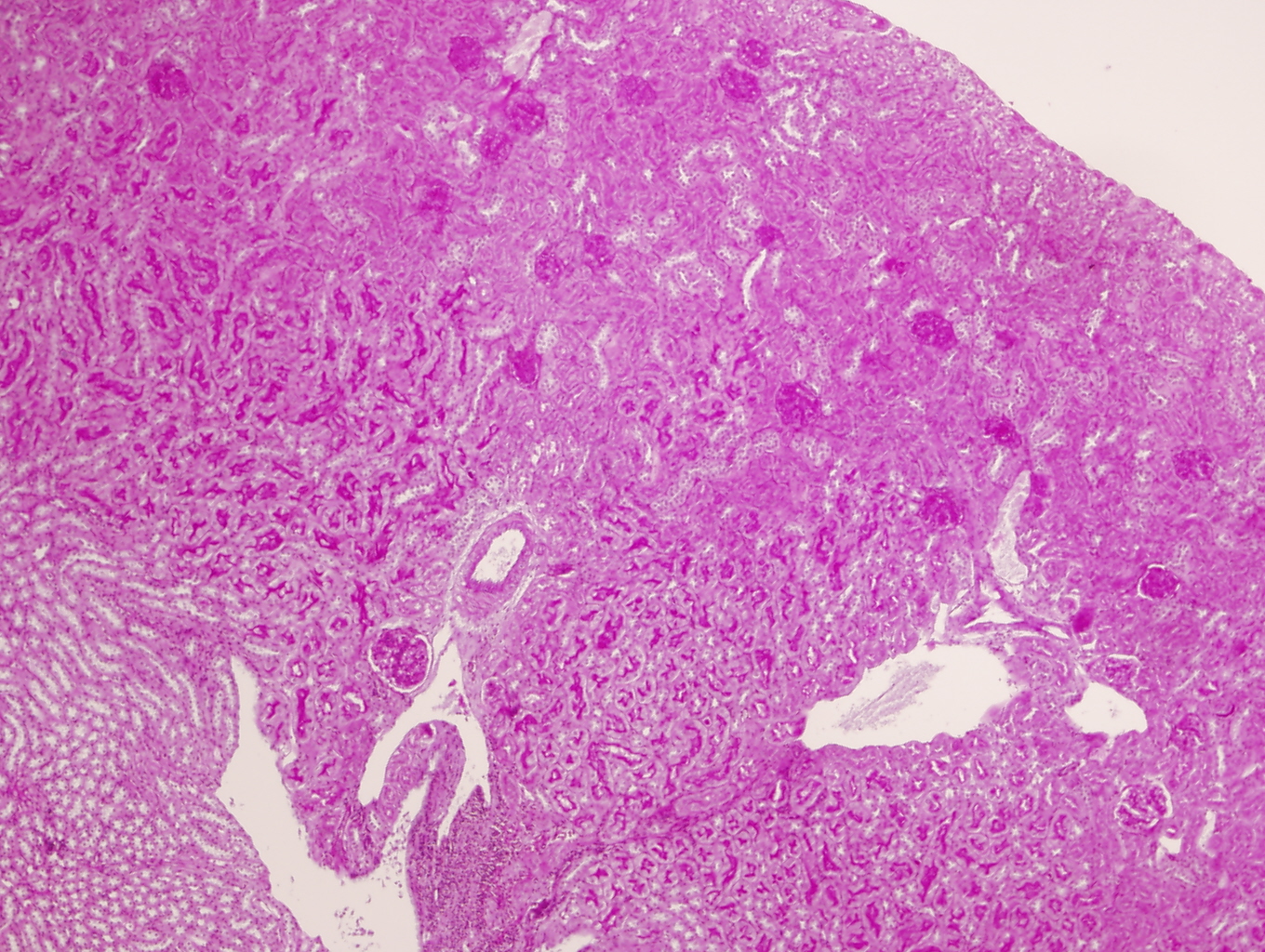
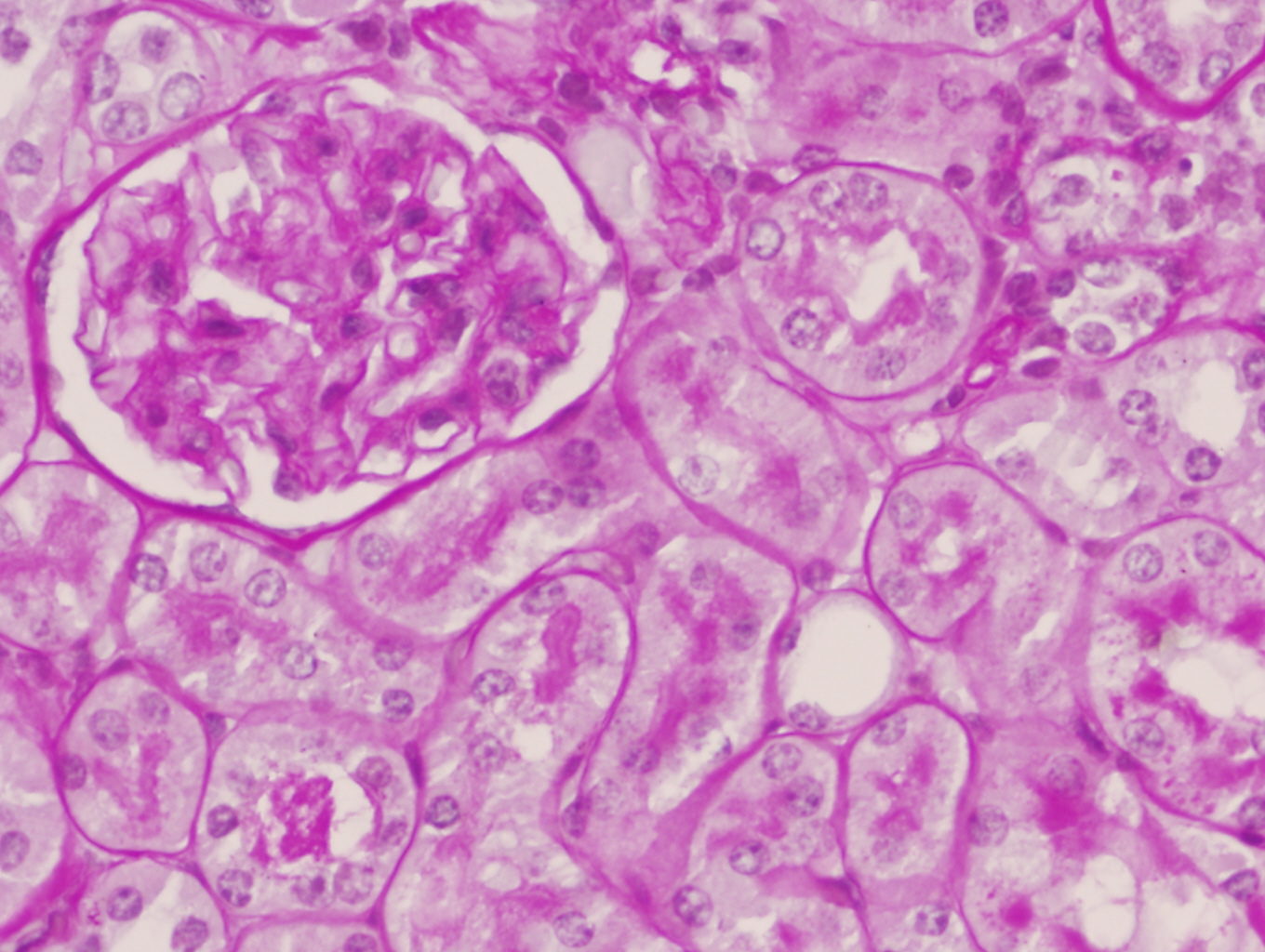
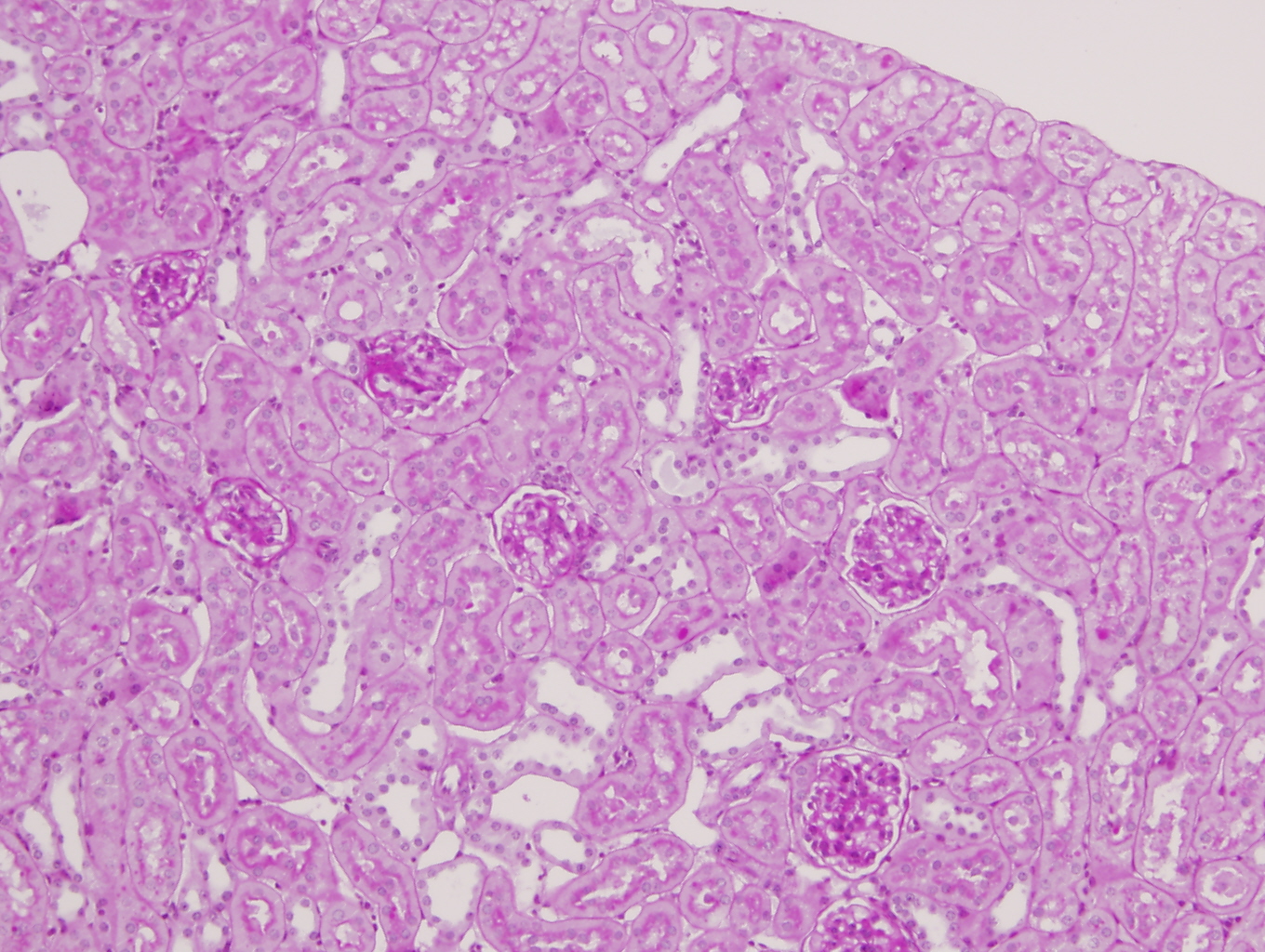
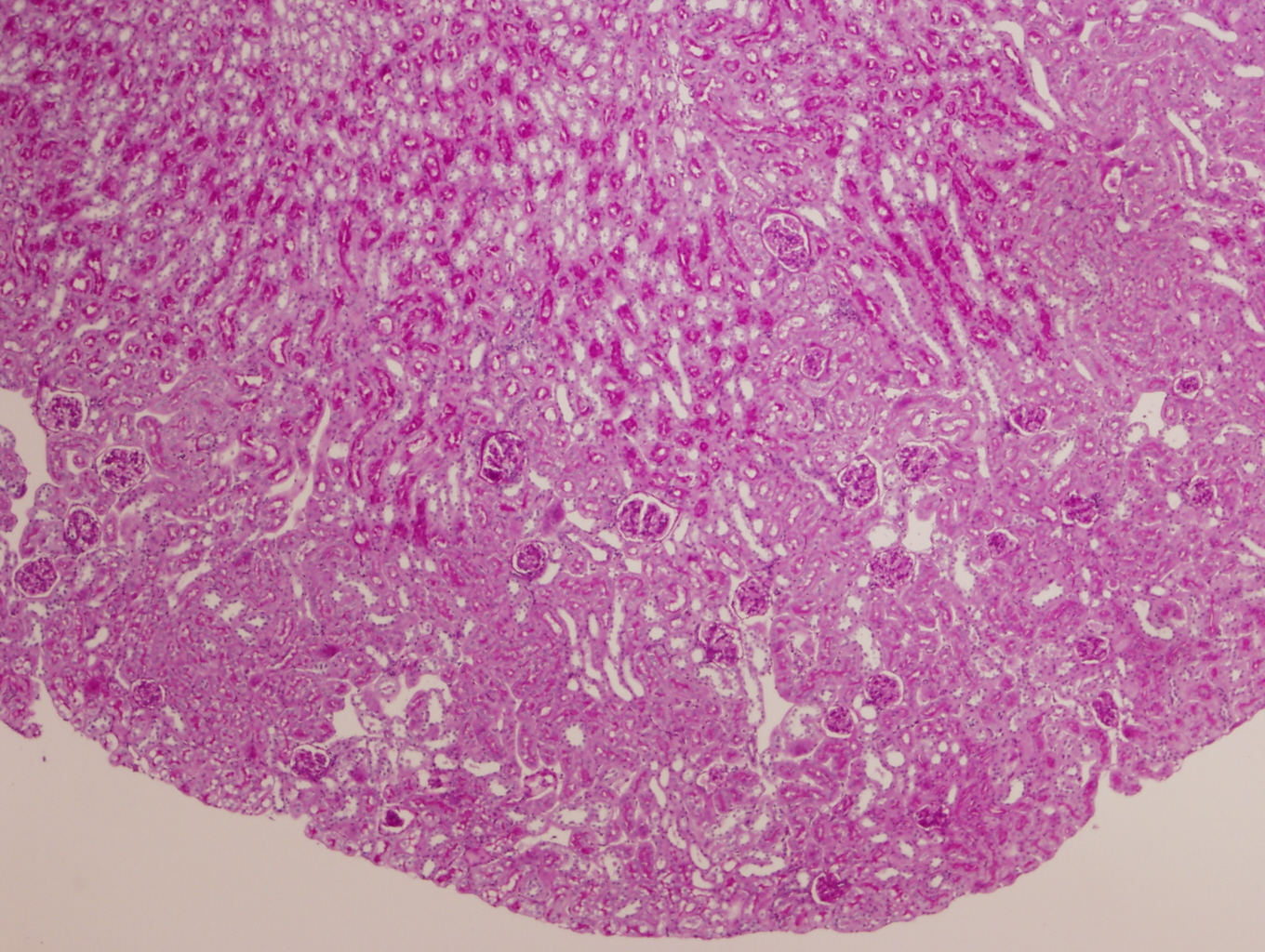
Los riñones control macroscópicamente eran de superficie lisa al corte se identificaba adecuamente la unión córtico-medular. Microscópicamente no presentaron ninguna anomalía morfológica cortical o medular y en ningún riñón se observó daño glomerular, tubulointersticial ni vascular (figuras 3 y 4).
2. Riñones de ratones PARP-1-/- deficientes
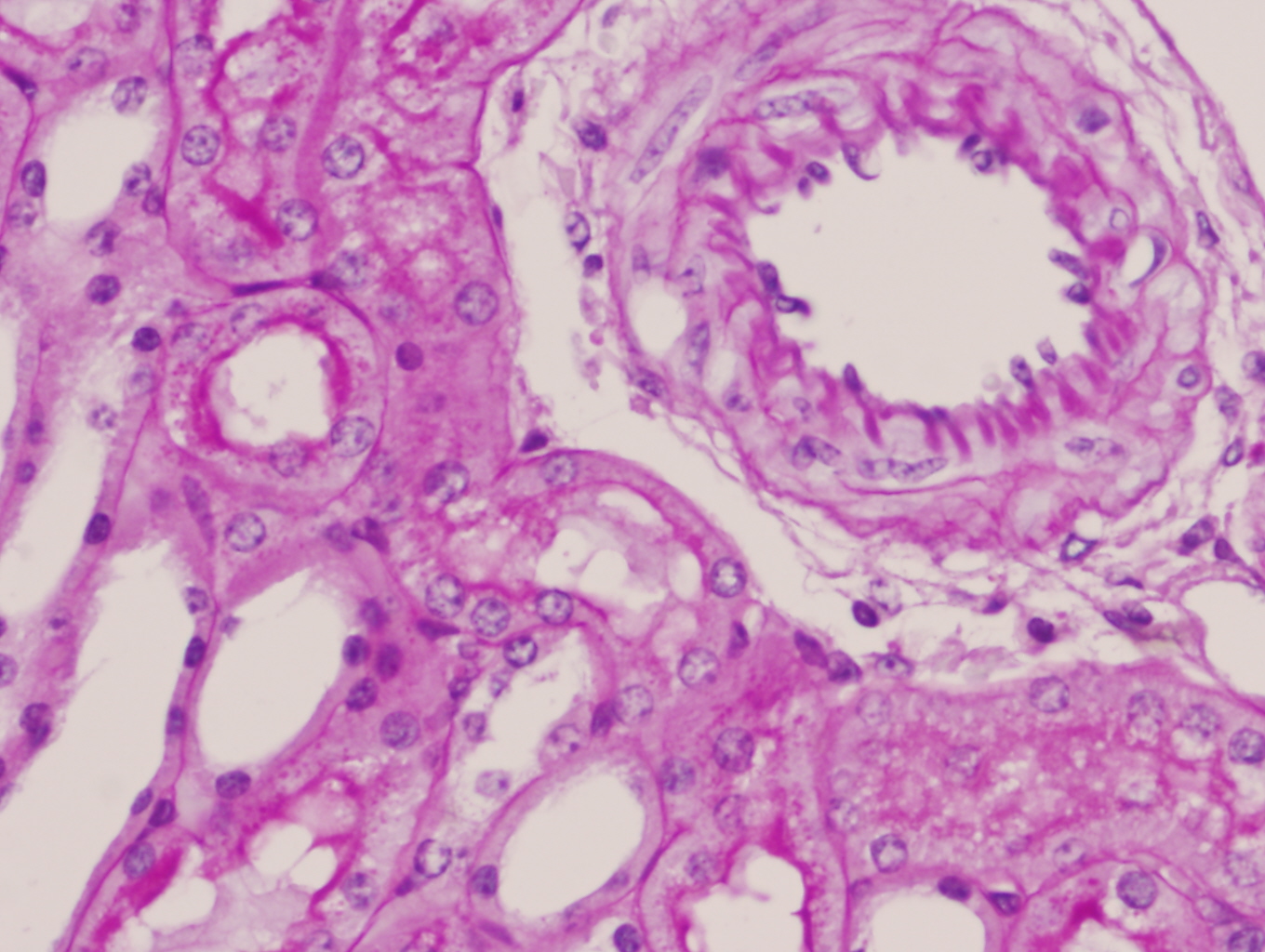
Los ratones carentes de PARP-1 mostraron leve e incipiente vacuolización celular en túbulos corticales aislados junto con ligera dilatación de su luz en el 25% de los riñones (figura 5). Los vasos desde la arteria renal hasta los arteriolas aferentes y eferentes carecían de anomalías estructurales, con un adecuado espesor de la pared y diámetro de su luz (figura 6). Los ovillos glomerulares eran permeables, de tamaño y celularidad normal y no se observaron fenómenos de necrosis, trombosis ni colapso flocular (figura 7). También se pudo constatar ausencia de infiltrado inflamatorio y de lesión en intersticio renal.
3. Riñones de ratones PARP-1+/+
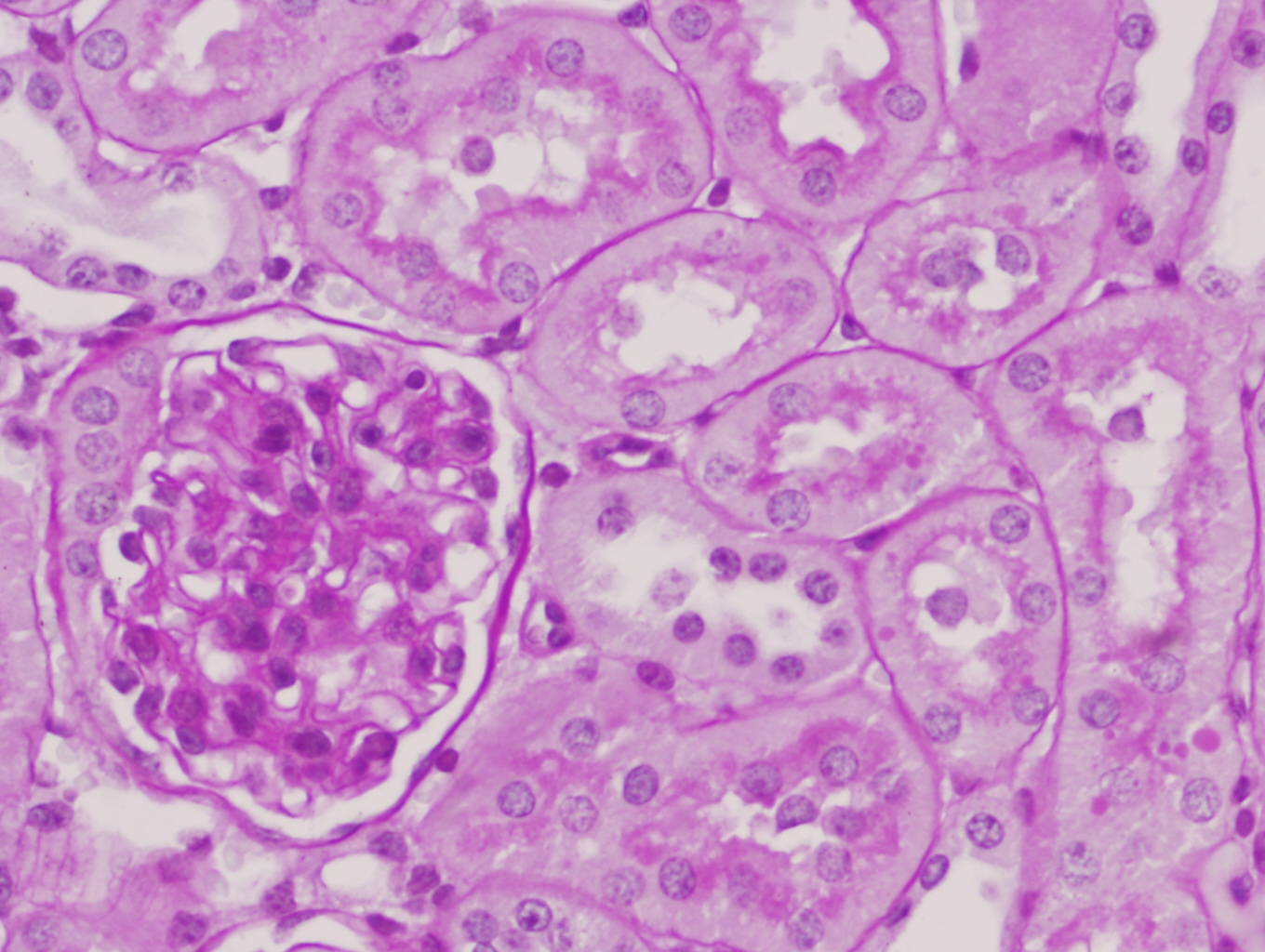
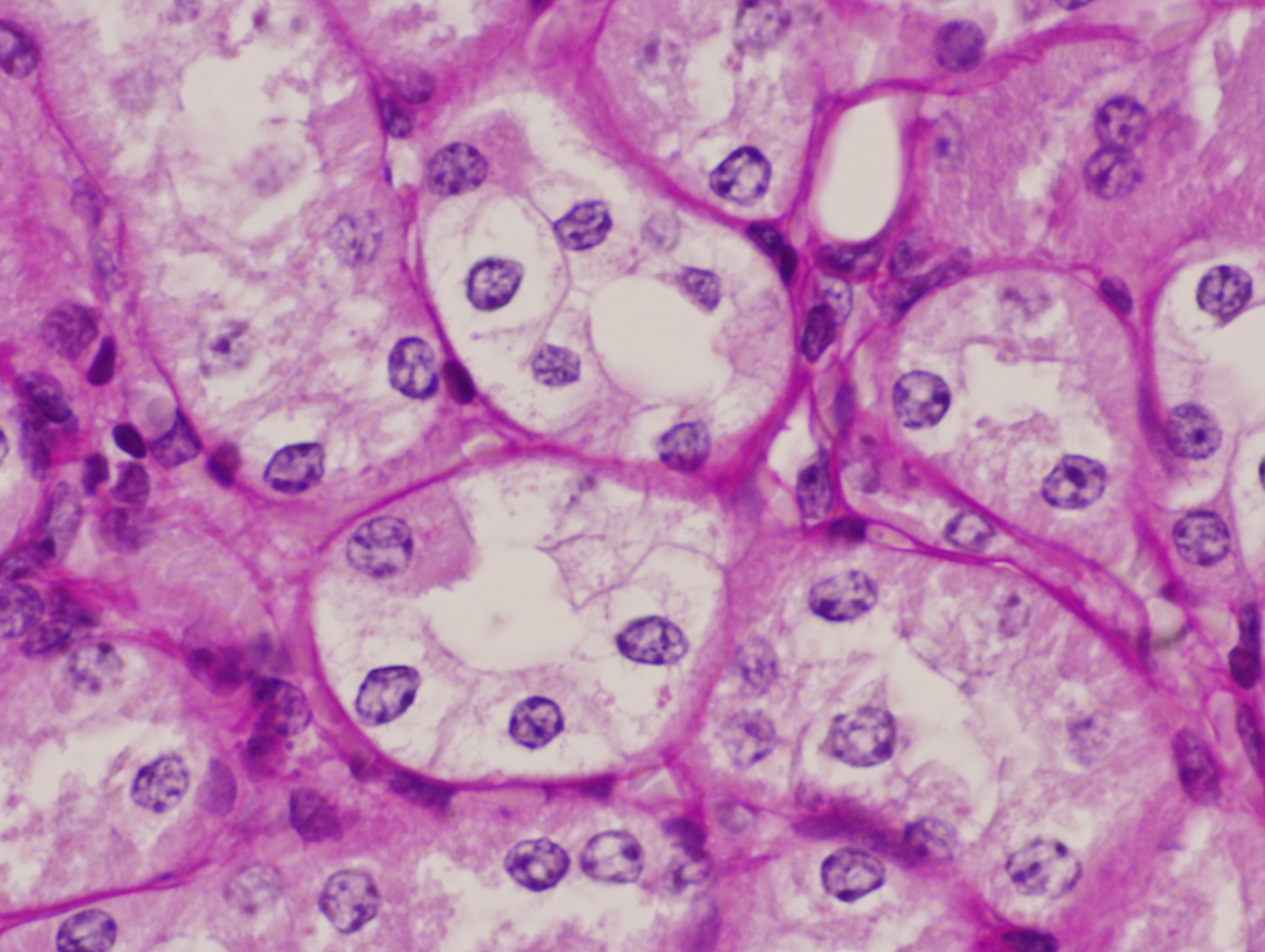
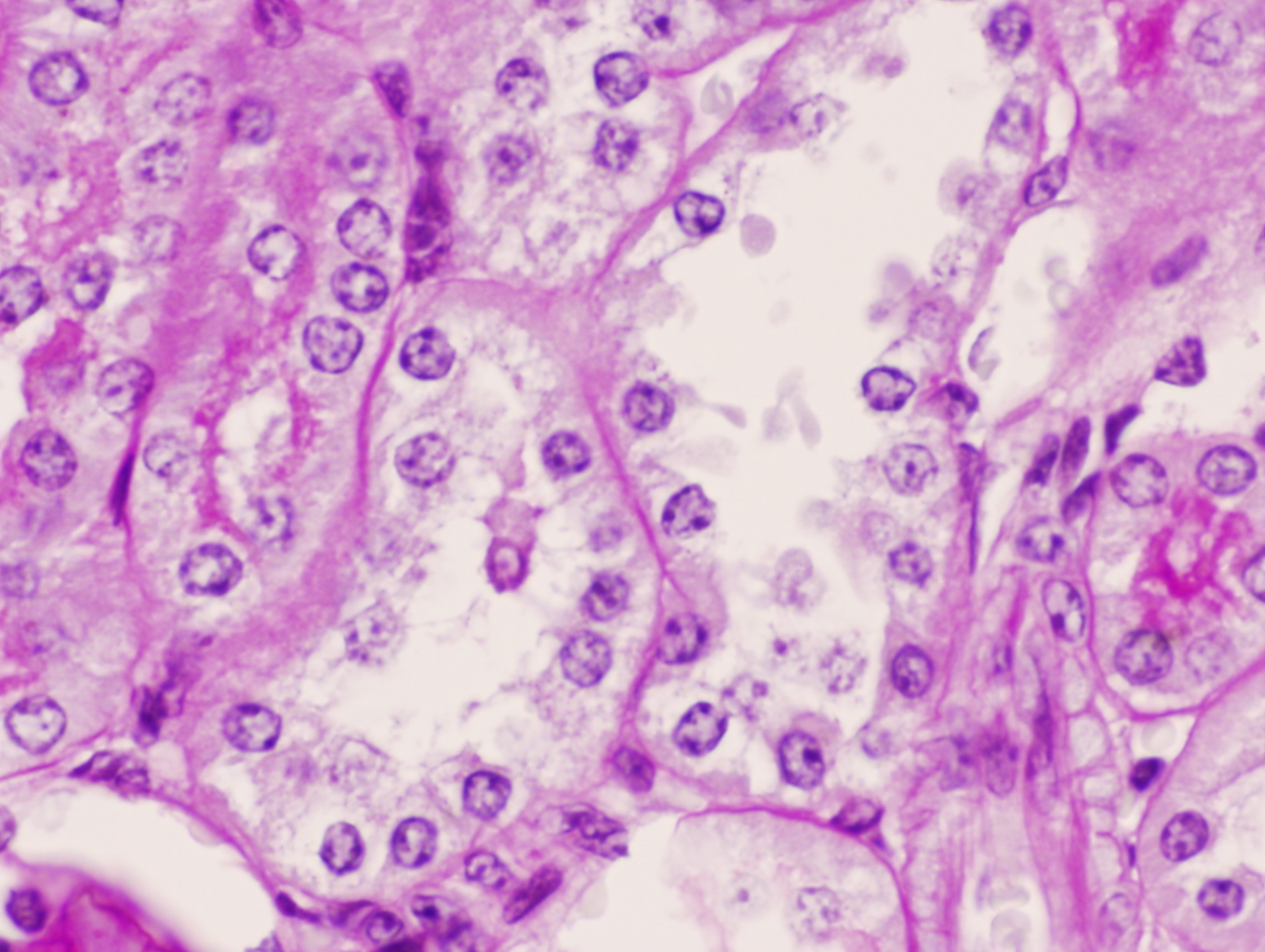
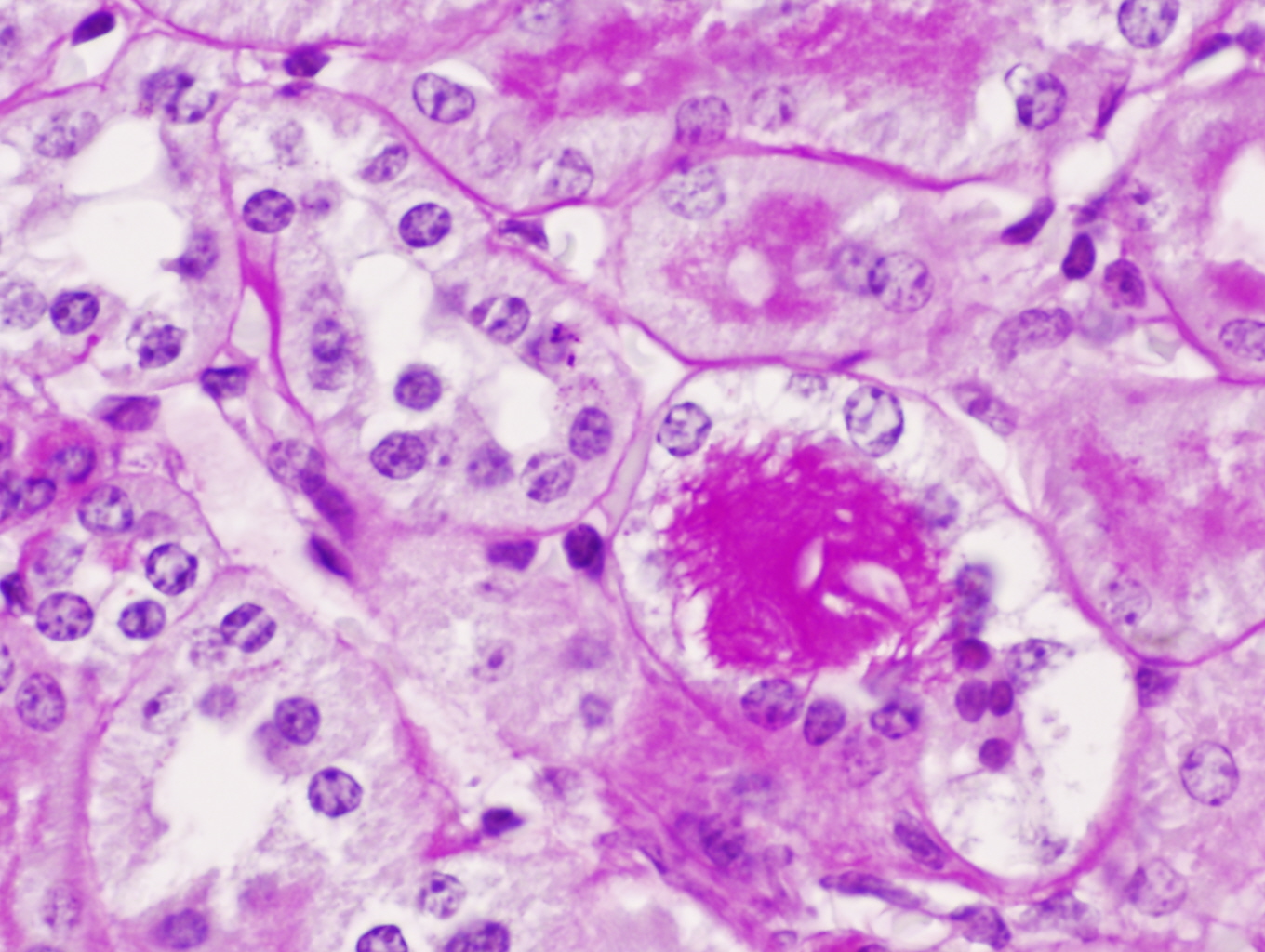
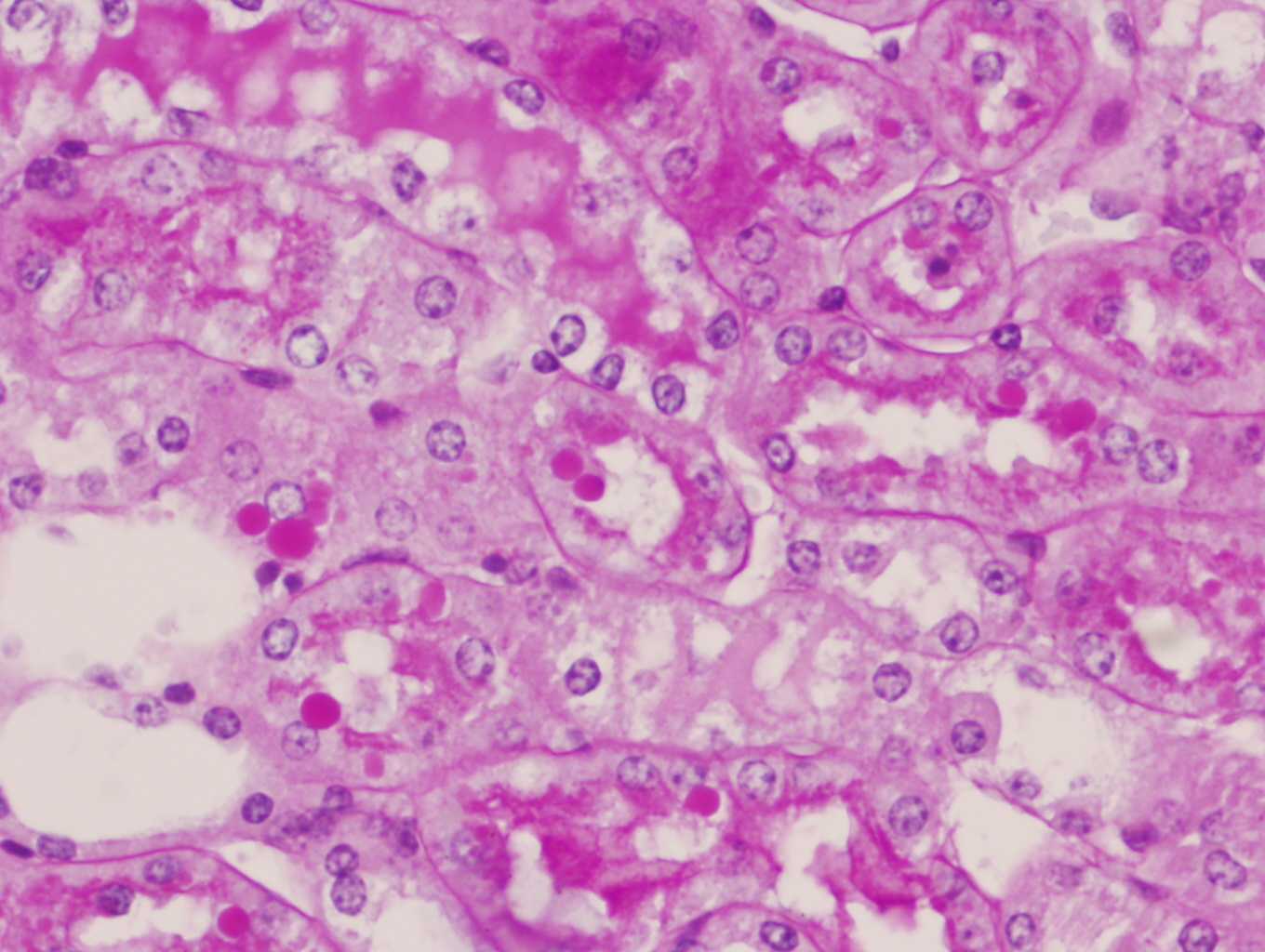
Los ratones PARP-1+/+ por el contrario tras 6 horas de reperfusión presentaron alteraciones morfológicas compatibles con lesión aguda reversible como la vacuolización de las células epiteliales de los túbulos corticales de forma difusa y con intensidad moderada en el 100% de los animales de este grupo. Además de la dilatación de la luz tubular, desprendimiento parcial de células tubulares, denudamiento incipiente de túbulos contorneados proximales con desestructuración del ribete en cepillo (figuras 8-11) también fueron observados en la corteza renal, pero con carácter más esporádico. No se detectaron imágenes sugerentes de muerte celular por apoptosis. En el 50% de los riñones se advirtió la presencia de numerosos glóbulos protéicos PAS+ (proteína de Tamm-Horsfall) en túbulos corticales y medulares (figura 12) fundamentalmente localizados en el interior del citoplasma y en vías de ser eliminados hacia la luz tubular por ruptura de membranas celulares. No se observaron cilindros hialinos tubulares. A diferencia de lo ocurrido en los túbulos, la isquemia-reperfusión no produjo alteración morfológica en vasos de mediano calibre ni en las estructuras glomerulares en las que no se observaron lesiones en el tiempo evaluado (figura 13). Igualmente no se detectaron acúmulos de células inflamatoria en el parénquima renal.
|
 Zoom Zoom
|
|
|
Panorámica microscópica de corteza y médula renal sin alteraciones morfológicas glomerulares, tubulares ni vasculares en un ratón C57/BJ PARP-1-/- control (PAS x2).
|
 Zoom Zoom
|
|
|
Parénquima renal conservado en un ratón C57/BJ PARP-1+/+ control (PAS x200).
|
 Zoom Zoom
|
|
|
Ligera dilatación de la luz tubular de la corteza renal en un ratón C57/BJ PARP-1-/- sometido a 45 minutos de isquemia y 6 horas de reperfusión (PAS x40).
|
 Zoom Zoom
|
|
|
Ausencia de alteraciones vasculares en un ratón C57/BJ PARP-1-/- sometido a 45 minutos de isquemia y 6 horas de reperfusión (PAS x200).
|
 Zoom Zoom
|
|
|
Flóculo renal permeable, túbulos conservados con presencia incipiente de glóbulos hialinos PAS positivos en un ratón C57/BJ PARP-1-/- sometido a 45 minutos de isquemia y 6 horas de reperfusión (PAS x200).
|
 Zoom Zoom
|
|
|
Panorámica de corteza y médula renal en un ratón C57/BJ PARP-1+/+ sometido a 45 minutos de isquemia y 6 horas de reperfusión. Obsérvese como las lesiones se limitan a las estructuras tubulares (PAS x2).
|
 Zoom Zoom
|
|
|
Vacuolización de las células del epitelio túbular en un ratón C57/BJ PARP-1+/+ sometido a 45 minutos de isquemia y 6 horas de reperfusión (PAS x400).
|
 Zoom Zoom
|
|
|
Vacuolización e inicio de necrosis y desprendimiento de las células del epitelio túbular en un ratón C57/BJ PARP-1+/+ sometido a 45 minutos de isquemia y 6 horas de reperfusión (PAS x400).
|
 Zoom Zoom
|
|
|
Vacuolización y desectructuación del ribete en cepillo de las células del epitelio túbular en un ratón C57/BJ PARP-1+/+ sometido a 45 minutos de isquemia y 6 horas de reperfusión (PAS x400).
|
 Zoom Zoom
|
|
|
Múltiples glóbulos hialinos (PAS positivos) en el citoplasma de las células del epitelio túbular, ruptura celular e inicio de eliminación hacia la luz tubular en un ratón C57/BJ PARP-1+/+ sometido a 45 minutos de isquemia y 6 horas de reperfusión (PAS x400).
|
 Zoom Zoom
|
|
|
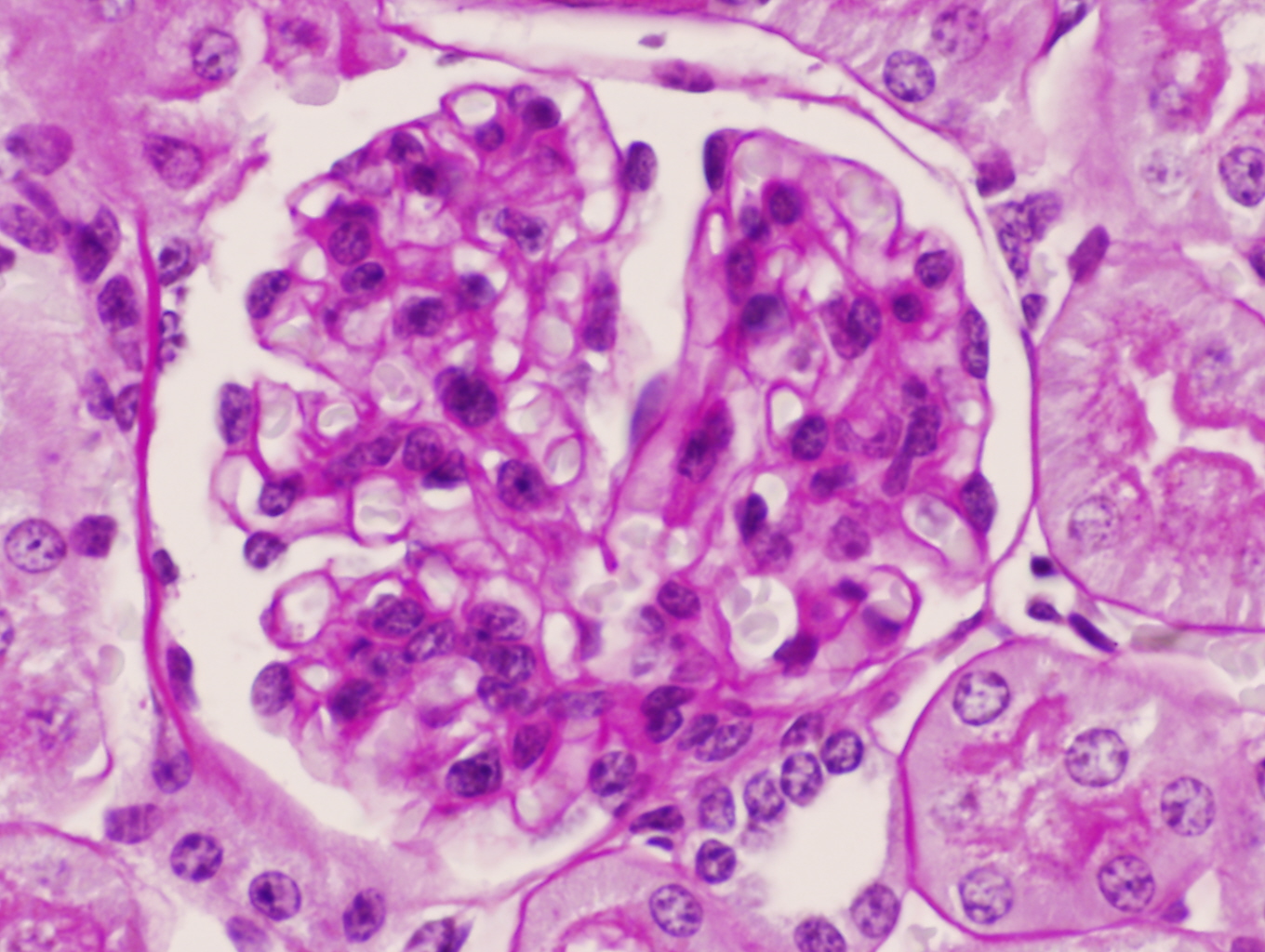
Conservación de la morfología glomerular en un ratón C57/BJ PARP-1+/+ sometido a 45 minutos de isquemia y 6 horas de reperfusión (PAS x600).
|
|
|
|
|
|
|
|
Discusión
|
|
|
|
PARP-1 juega un importante papel en la inducción de muerte celular por necrosis y por apoptosis. En el caso de un daño masivo del ADN, la sobreactivación de PARP-1 puede deplecionar las reservas de ATP, en un intento de resintetizar NAD+, y este proceso eventualmente conduce a la muerte celular por necrosis, teoría conocida como la “hipótesis de la PARP suicida” (Berger, 1985) que contempla la inducción de muerte por necrosis celular para evitar una reparación aberrante del ADN por el consiguiente riesgo de transformación maligna. En el proceso de isquemia-reperfusión se induce la producción de especies reactivas del oxigeno derivadas del metabolismo deficiente de las mitocondrias y por la elevada producción de óxido nítrico que inducen lesión celular a través de la peroxidación de membranas lipídica, desnaturalización proteica o por daño directo sobre el ADN (Kloner et al., 1989).
Los resultados obtenidos por Chatterjee confirman que la activación de PARP contribuye en parte a la disfunción renal y al daño producido tras el periodo de reperfusión, sobre el tejido renal sometido a isquemia previa, basándose en las siguientes evidencias experimentales: 1) tras la isquemia reperfusión renal se produce incremento en la expresión inmunohistoquímica de PARP; 2) el uso de análogos de la benzamina, sustancias inhibidoras selectivas de PARP, reducen significativamente los parámetros de función renal alterados (reducen los niveles de urea, de creatinina e incrementan el filtrado glomerula); 3) el ácido aminobenzoico y nicotínico, que no inhiben PARP, carecen de efecto sobre la disfunción renal causada por la isquemia-reperfusión (Chatterjee et al., 2000); 4) el empleo in vitro de de inhibidores de PARP protege los cultivos primarios de túbulos proximales de riñón de rata frente a la lesión y muerte celular mediada por estrés oxidativo (Chatterjee et al., 1999). Con nuestro modelo se evita el uso de agentes inhibidores al disponer de ratones PARP-1-/- deficientes y pueden ser comparadas directamente las lesiones renales en presencia o ausencia de los fenómenos reconocidos para la sobreactivación de PARP-1.
Las lesiones observadas en el modelo de isquemia (45 minutos)-reperfusión renal (6 horas) en ratones se corresponden con las alteraciones incipientes identificadas en la necrosis tubular aguda (vacuolización tubular, desprendimiento celular, proteína de Tamm-Horsfall) y reproducen con fidelidad las lesiones morfológicas observadas en la fase precoz de la necrosis tubular aguda en riñones humanos. Ha sido señalado que la isquemia-reperfusión renal causa disfunción y lesión glomerular y tubular. En un modelo experimental en ratas empleando los mismos tiempos, además de lesiones tubulares (dilatación tubular, vacuolización y necrosis tubular, congestión y eosinofilia) y a diferencia de nosotros encuentran lesión glomerular, pero que no detallan (Chatterjee et al., 2000). Por otro lado, las escasa lesiones presentes en los ratones PARP-1-/- y la ausencia de alteración parenquimatosa en los riñones control permiten establecer adecuadamente las lesiones atribuibles a la sobreactivación de PARP tras un periodo de isquemia-reperfusión.
Probablemente por su simplicidad se desarrolló en principio un modelo de isquemia reperfusión mesentérica en ratas por oclusión completa de arteria mesentérica superior y tronco celiaco, demostrando tras un periodo de reperfusión la presencia de peroxinitritos en plasma y la inducción de PARP y nitrotirosina en ileon mediante técnicas inmunohistoquímicas (Cuzzocrea et al, 1997; Liaudet et al, 2000); pero actualmente también han sido publicados modelos de isquemia-reperfusión ex vivo y en roedores reproduciendo las lesiones de infarto miocárdico y cerebral y demostrando el efecto beneficioso del bloqueo de PARP al disminuir la extensión del área necrótica y el efecto deletereo del infiltrado inflamatorio agudo de PMN acompañante (Szabados et al., 2000). En este sentido los ratones trangénicos con pérdida de la función de PARP han proporcionado una oportunidad única para definir de forma inequívoca el papel de PARP en la lesión miocárdica y para profundiza el los mecanismos celulares desencadenantes. Virág & Szabó empleando un modelo murino de daño miocárdico tras reperfusión precoz, encontraron que la ausencia de gen PARP previene del daño por reperfusión (reducción de los niveles de Creatinin fosfoquinasa, menor daño histopatológico, menor infiltrado de PMN y mejor supervivencia) (Virág & Szabó, 2002; Yang et al., 2000).
|
|
|
|
|
|
|
Bibliografia
|
|
|
|
Berger NA. Poly(ADP-ribose) in the cellular response to DNA damage. Radiat Res 101: 4-15, 1985.
Cuzzocrea S, Zingarelli B, Constantino G, Szabo A, Salzman AL, Caputi AP, Szabo C. Beneficial effects of 3-aminobenzamide, an inhibitor of poly (ADP-ribose) synthetase in a rat model of splanchnic occlusion and reperfusion. Br J Pharmacol. 121: 1065-1074, 1997.
Chatterjee PK, Cuzzocrea S, Thiemermann C. Inhibitor of poly(ADP-ribose) sythetase protect rat proximal tubular cells against hydrogen peroxide-mediated oxidant stress. Kidney Int. 56: 973-984, 1999.
Chatterjee PK, Zacharowski K, Cuzzocrea S, Otto M, Thiemermann C. Inhibitors of poly (ADP-ribose) synthetase reduce renal ischemia-reperfusion injury in the anesthetized rat in vivo. FASEB 14:641-651, 2000.
Kloner RA, Przyklenk K, Whittaker P. Deleterious effects of oxygen radicals in ischemia/reperefusion. Resolved and unresolved issues. Circulation 80: 1115-1127, 1989.
Liaudet L, Szabo A, Soriano FG, Zingarelli, Szabo C, Salzman AL. Poly(ADP-ribose) synthetase mediates intestinal mucosal barrier dysfunction after mesenteric ischemia. Shock 14: 134-141, 2000.
Ménissier de Murcia J, Niedergang C, Trucco C, Ricoul M, Dutrillaux B, Mark M, Oliver FJ, Masson M, Dierich A, LeMeur M, Walztinger C, Chambon P, De Murcia G. Requirement of poly(ADP-ribose) polymerase in recovery fron DNA damage in mice and in cells. Proc. Natl Acad. Sci. USA 94: 7303-7307, 1997.
Pascual J, Liaño F. Fracaso renal agudo parenquimatoso. En: Hernando L. Nefrología clínica. Ed. Panamericana pp 663-672. 2003.
Szabados E, Literati-Nagy P, Farkas B, Sumegi B. BGP-15, a nicotinic amidoxime derivate protecting heart from ischemia reperfusion injury through modulation of poly(ADP-ribose) polymerase. Biochem Pharmacol 59: 937-945, 2000.
Thadani R, Pacual M, Bonventre JV. Acute renal failure. N Engl. J. Med. 334: 1448-1460, 1996.
Virág L, Szabó C. The therapeutic potential of poly(ADP-ribose) polymerase inhibitors. Pharmacological Reviews 54: 375-429, 2002.
Weight SC, Bell PR, Nicholson ML. Renal ischemia-reperfusión injury. Br. J. Surg. 83: 162-170, 1996.
Yang Z, Zingarelli B, Szabó C. Effect of genetic disruption of poly (ADP-ribose) synthetase on delayed production of inflammatory mediators and delayed necrosis during myocardial ischemia-reperfusion injury. Shock 13: 60-66, 2000.
|
|
|
|
|
|
|
















