|
|
Proliferación celular y actividad de caspasa 3 y glutation-S-transferasa en próstata normal, atrofia inflamatoria, neoplasia intraepitelial prostática y adenocarcinoma de próstata. Estudio cuantitativo.
Prof. Luis Santamaría Solís1
,
Dra. Rocío Martín López2
,
Dr. Rafael Revestido García2
,
Dra. Consuelo López Elzaurdia2
,
Dr. Vicente Gómez Del Olmo1
y
Dr. Ildefonso Ingelmo Ingelmo1
(1)Dpto de Morfología. Facultad de Medicina, UAM, Madrid.
(2)Servicio de Anatomía Patológica. Hospital N. Sra de Sonsoles, Ávila.
España
|
|
|
|
|
|
|
|
Resumen
|
|
|
|
Además de las ya conocidas conexiones entre el adenocarcinoma prostático y la neoplasia intraepitelial prostática (PIN), últimamente diversos autores han introducido la entidad conocida como atrofia inflamatoria prostática (ATI) dentro del cuadro de posibles precursores del adenocarcinoma (Ca), ya sea de modo directo o a través de su transformación en PIN. Es interesante por lo tanto realizar un estudio comparativo de estas entidades y del epitelio prostático normal en relación con su estado proliferativo, capacidad de resistencia a la apoptosis y respuesta ante el stress oxidativo.
Para ello, en el presente trabajo y sobre material obtenido en biopsia transrectal: 10 casos controles sin alteraciones, 10 especímenes de PIN, 10 de ATI y otros 10 diagnosticados de Ca, se han efectuado inmunotinciones para KI67(proliferación celular) caspasa 3 (expresión de apoptosis) y glutation-S-Transferasa pi -GST- (indicadora de estress oxidativo). Utilizando metodología estereológica se ha cuantificado el indice de proliferación (LIki67) y las fracciones de volumen de epitelio inmunoreactivo para caspasa 3 y GST.
EL LIki67 se incrementó significativamente en el carcinoma con relación al resto de los grupos. La expresión de caspasa 3 es significativamente menor en PIN y Ca con relación a controles y ATI, no observándose diferencias entre Ca y PIN y controles y ATI. La expresión de GST decrece significativamente en Ca con relación a controles y ATI, pero es similar a la del PIN, a su vez, el PIN no muestra diferencias de expresión de GST con relación a controles y ATI.
Se concluye: El KI67, discrimina entre Ca y el resto en cuanto a proliferación, pero no indica una mayor proliferación en el PIN con relación a ATI y controles; Ca y PIN muestran mayor resistencia a la apoptosis que el resto; Ca muestra menos respuesta al estress oxidativo que el resto, observándose en el PIN una situación intermedia entre Ca y controles y ATI; Los parámetros evaluados no permiten sugerir que la ATI sea precursora del PIN o del Ca.
|
|
|
|
|
|
|
Introducción
|
|
|
El incremento llamativo del diagnóstico del cáncer de próstata en las últimas décadas se debe a los avances tecnológicos y al aumento de la vida media. Ocupa el cuarto lugar a escala mundial en cuanto al diagnóstico, aunque la incidencia y mortalidad varían con la raza y la distribución geográfica. La detección precoz y la determinación en biopsia de las lesiones consideradas precursoras, son fundamentales para aplicar un tratamiento curativo ( 1). Además de las ya conocidas conexiones entre el adenocarcinoma prostático (Ca) y la neoplasia intraepitelial prostática (PIN), se ha introducido la entidad conocida como atrofia inflamatoria prostática (ATI) dentro del cuadro de posibles precursores del Ca, ya sea de modo directo o a través de su transformación en PIN ( 2),( 3). La inflamación crónica de larga duración se ha ligado al desarrollo de carcinoma en varios órganos y sistemas ( 4). La atrofia glandular prostática que ha sido señalada como un precursor potencial del adenocarcinoma prostático, sucede en estrecha asociación con inflamación crónica ( 5),( 6). El término atrofia inflamatoria proliferativa designa focos de epitelio glandular proliferativo con la morfología de atrofia simple o hiperplasia postatrófica, ambas en relación con inflamación crónica( 3). En orden a establecer posibles relaciones etiopatogénicas, en el presente trabajo se efectuará un estudio comparativo de estas entidades y del epitelio prostático normal en relación con su estado proliferativo, resistencia a la apoptosis y respuesta ante el stress oxidativo ( 5),( 7).
|
|
|
|
|
|
|
Material y Métodos
|
|
|
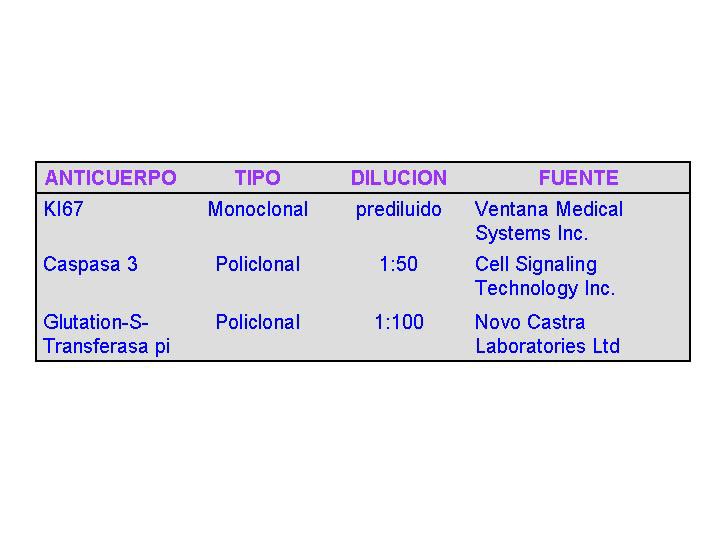
Material Todas las muestras fueron obtenidas por biopsia transrectal: 10 especímenes que no mostraban alteraciones fueron considerados como casos control. En otras 10 biopsias fué detectado PIN de alto grado. En 10 especímenes se observó presencia de atrofia inflamatoria (ATI) y otros 10 casos se diagnosticaron como adenocarcinoma prostático. Inmunohistoquímica El material se fijó en paraformaldehido al 10% tamponado con PBS pH 7.4, durante 24 hrs, a continuación se procesó el tejido para su inclusión en parafina y se efectuaron cortes seriados de 5 micras de grosor. Se efectuó tinción de rutina con hematoxilina-eosina. Se realizaron inmunotinciones para evidenciar el marcador de proliferación nuclear KI67, caspasa 3 y glutation-S-transferasa pi (GST). Los anticuerpos y diluciones empleados se indican en la tabla_1 Se emplearon segundos anticuerpos biotinilados (obtenidos en conejo para los primarios policlonales y en ratón para los monoclonales), que fueron detectados usando un complejo avidina-biotina-peroxidasa, seguido de revelado con diaminobencidina. Evaluación de la proliferación celular Los porcentajes de núcleos inmunoteñidos para KI67 (LiKI67) fueron calculados en cada corte seleccionado por muestreo sistemático con comienzo al azar ( 8) (5 secciones por caso en cada grupo) en controles, ATI, PIN y carcinoma, usando la fórmula: número de núcleos marcados x 100/número total de núcleos (marcados + no marcados). Las mediciones fueron efectuadas mediante an microscopio Olympus equipado con objetivos de inmersión de X100 a unos aumentos finales de X1200, empleando el software estereológico Cast-GRID (Interactivision, Silkeborg, Denmark). Cuantificación de las inmunotinciones para caspasa 3 y GST Para cuantificar la inmunoreactividad de estos dos anticuerpos, se estimó la fracción de volumen ( 9) (densidad de volumen: Vv caspasa3 y Vv GST) de citoplasma inmunoteñido por caspasa 3 o GST, empleando el programa Scion Image Beta 4.02, disponible en Internet SCIONCORP Las imágenes empleadas también se muestrearon sistemáticamente al azar siguiendo el mismo protocolo que el utilizado pora la evaluación de la proliferación. El resultado se expresó como porcentaje de epitelio inmunoteñido sobre el total de epitelio de cada biopsia. Análisis estadístico Se estimaron las medias ± SD de LiKI67, Vv caspasa3 y Vv GST, para cada grupo de estudio, realizándose a continuación ANOVA de un factor para analizar la influencia del grupo (controles, ATI, PIN y carcinoma) sobre los parámetros utilizados, comparándose las medias mediante un test de comparación múltiple (Student-Newman-Keuls). El nivel de significación fue p < 0.05. Los resultados se expresaron como diagramas de barras.
|
 Zoom Zoom
|
|
|
Tipos de anticuerpos empleados, dilución y fuente
|
|
|
|
|
|
|
|
Resultados
|
|
|
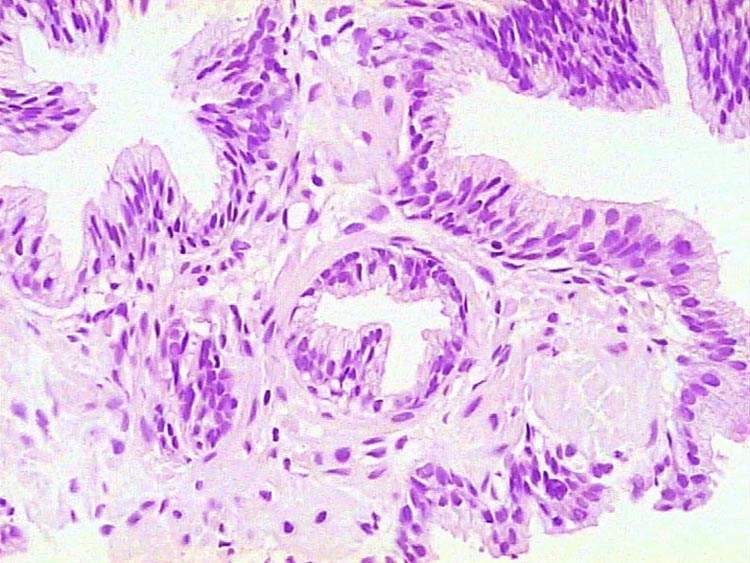
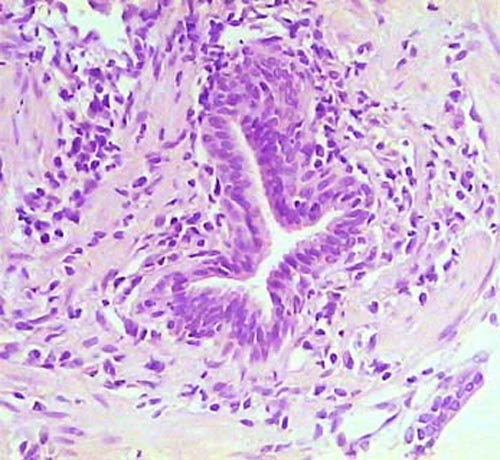
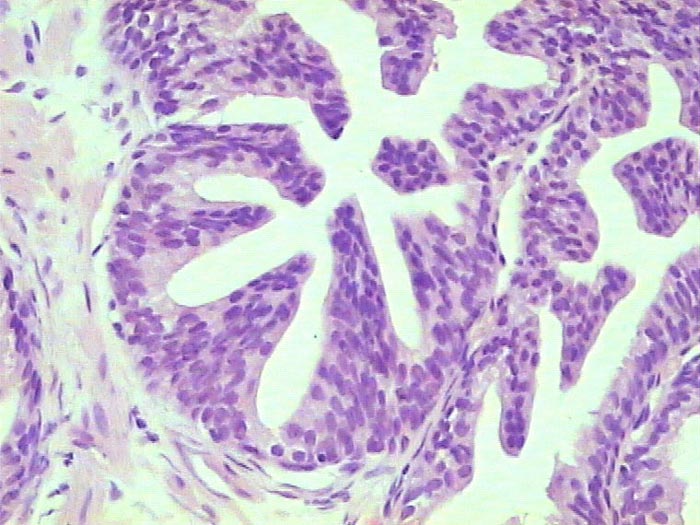
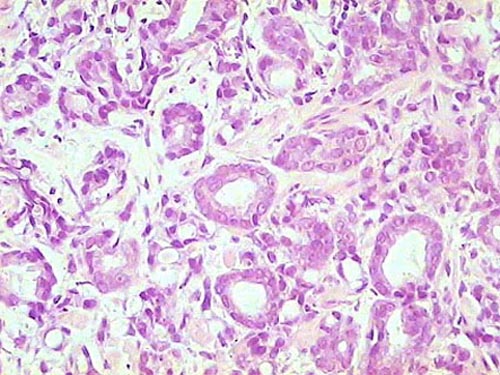
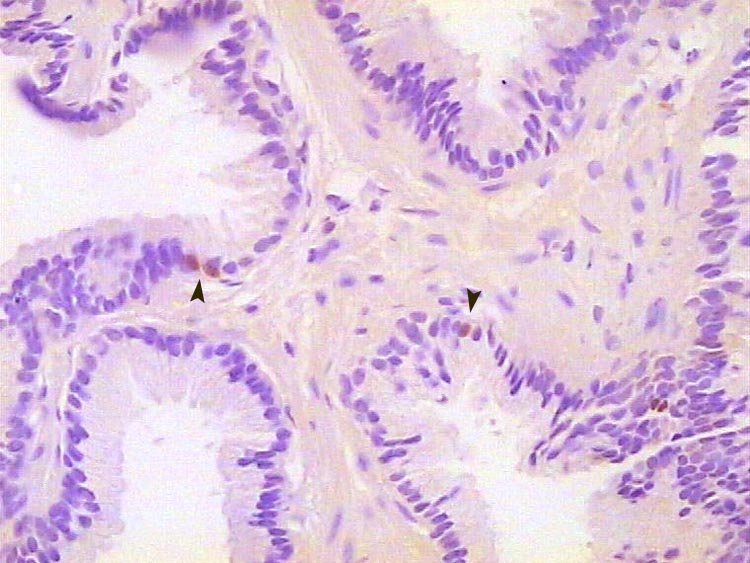
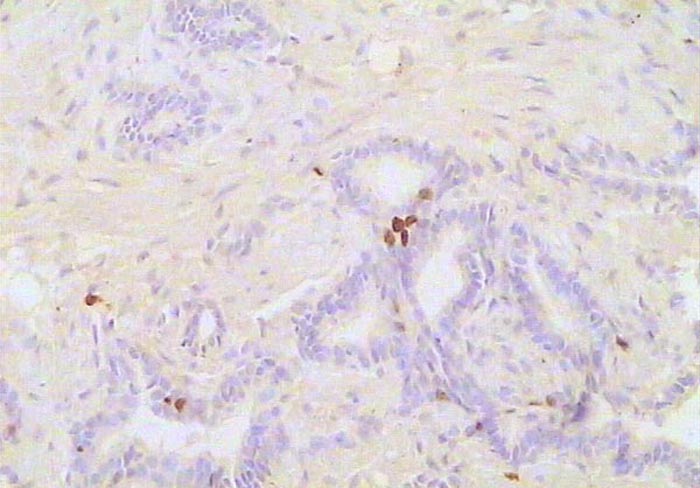
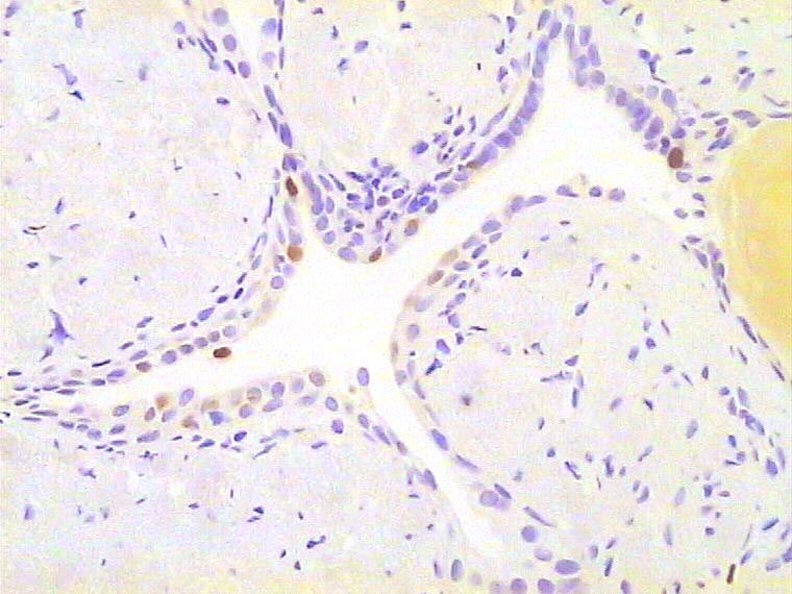
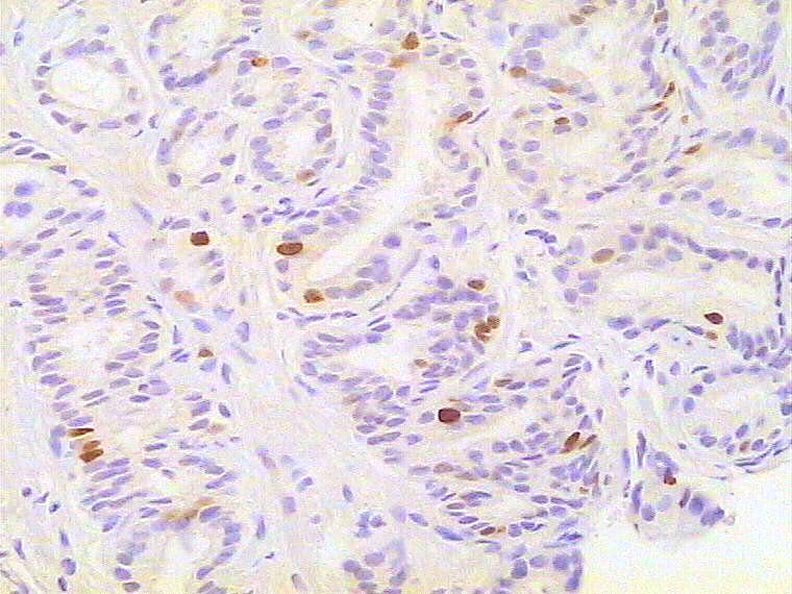
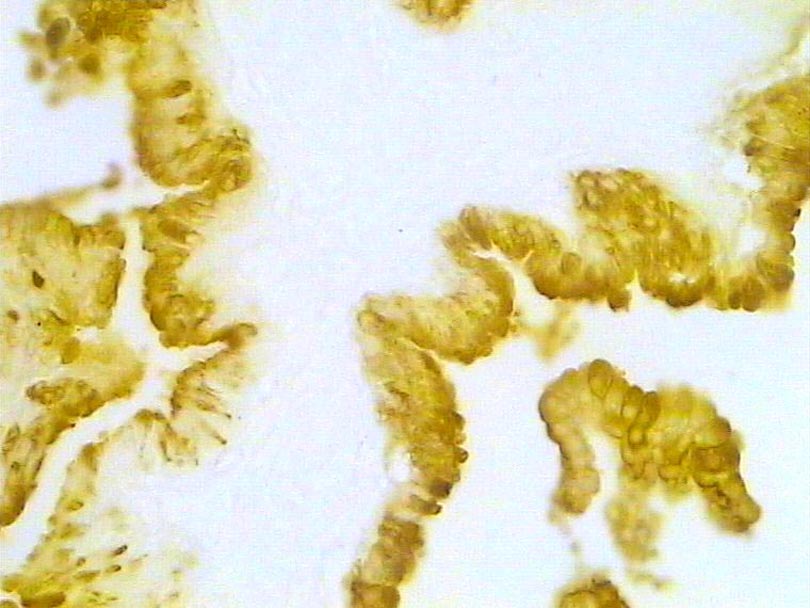
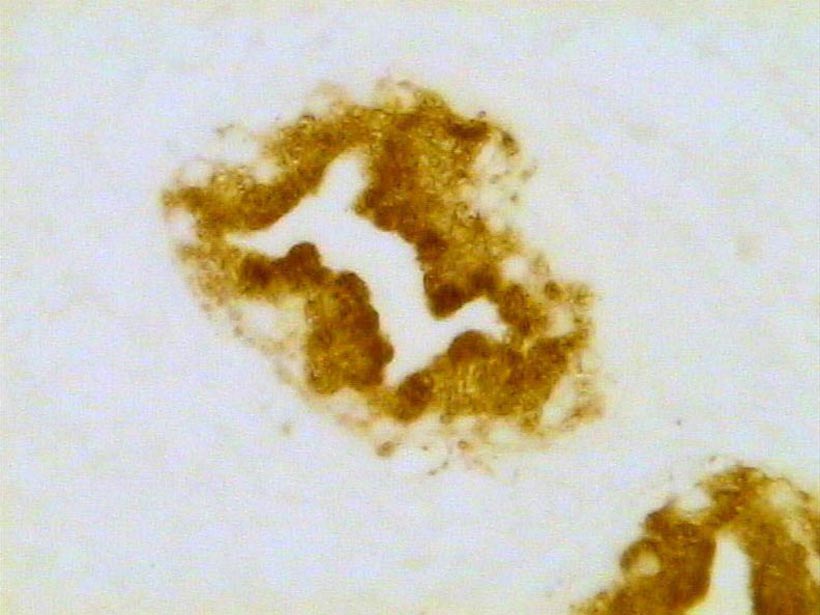
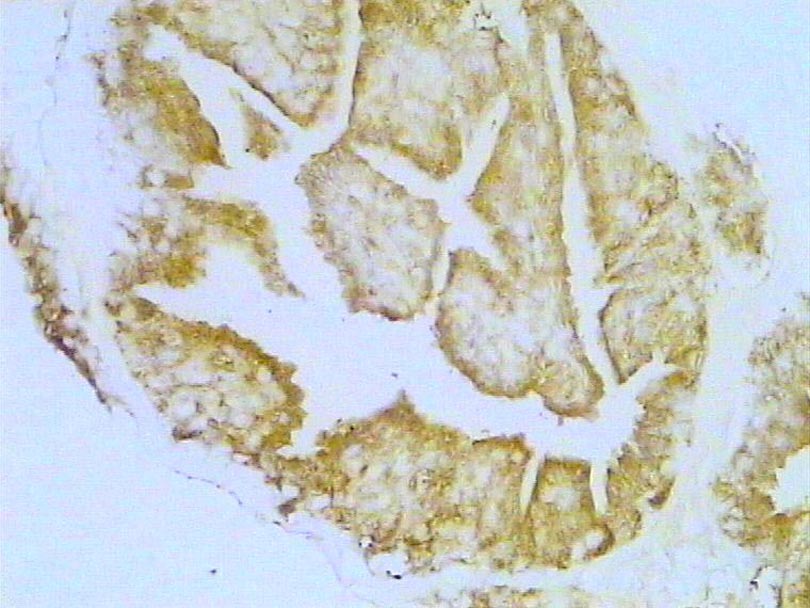
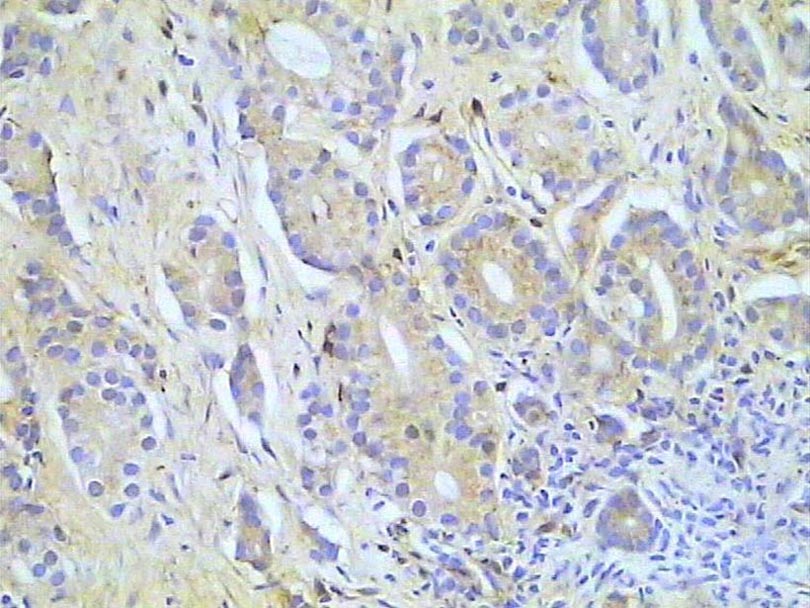
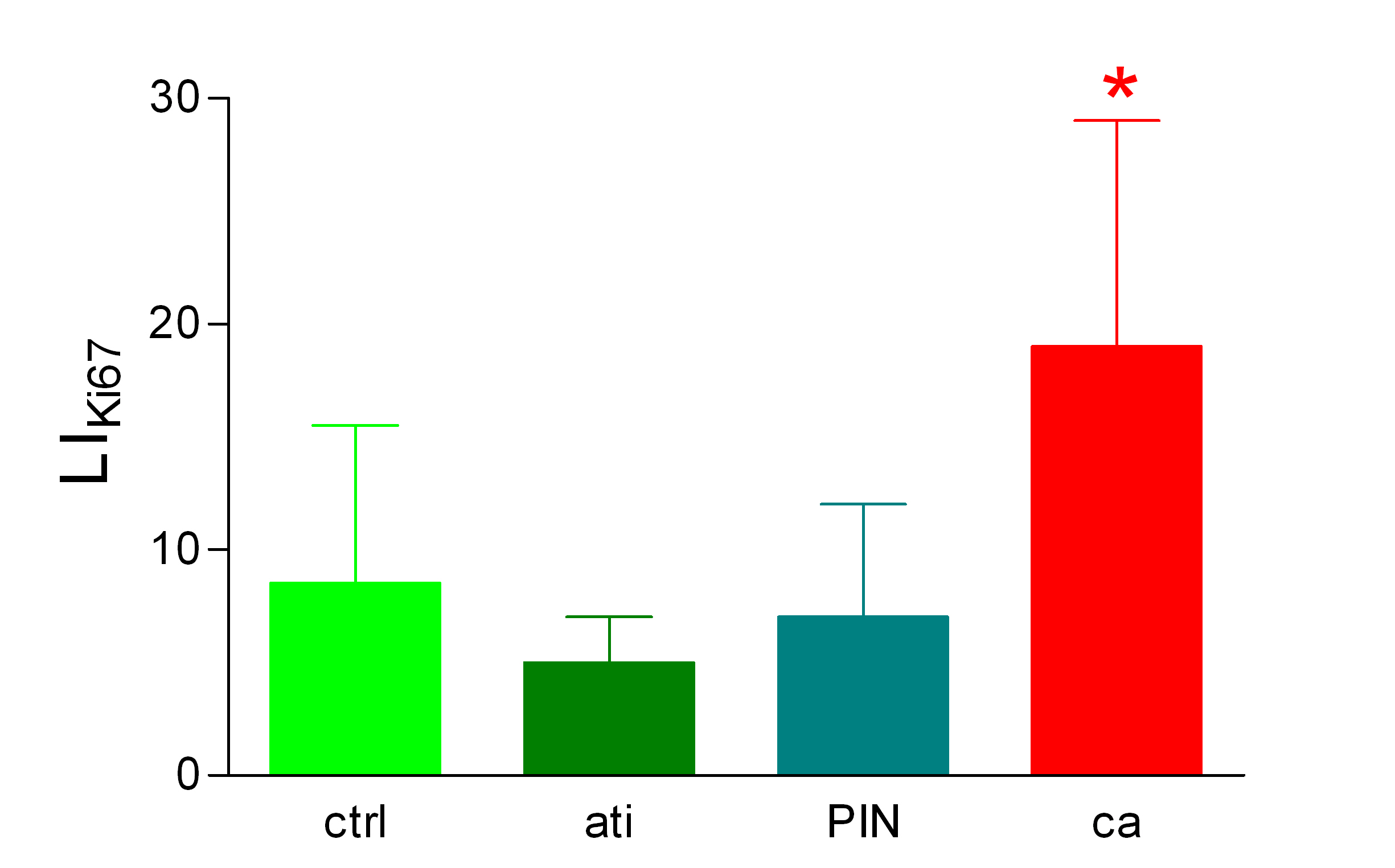
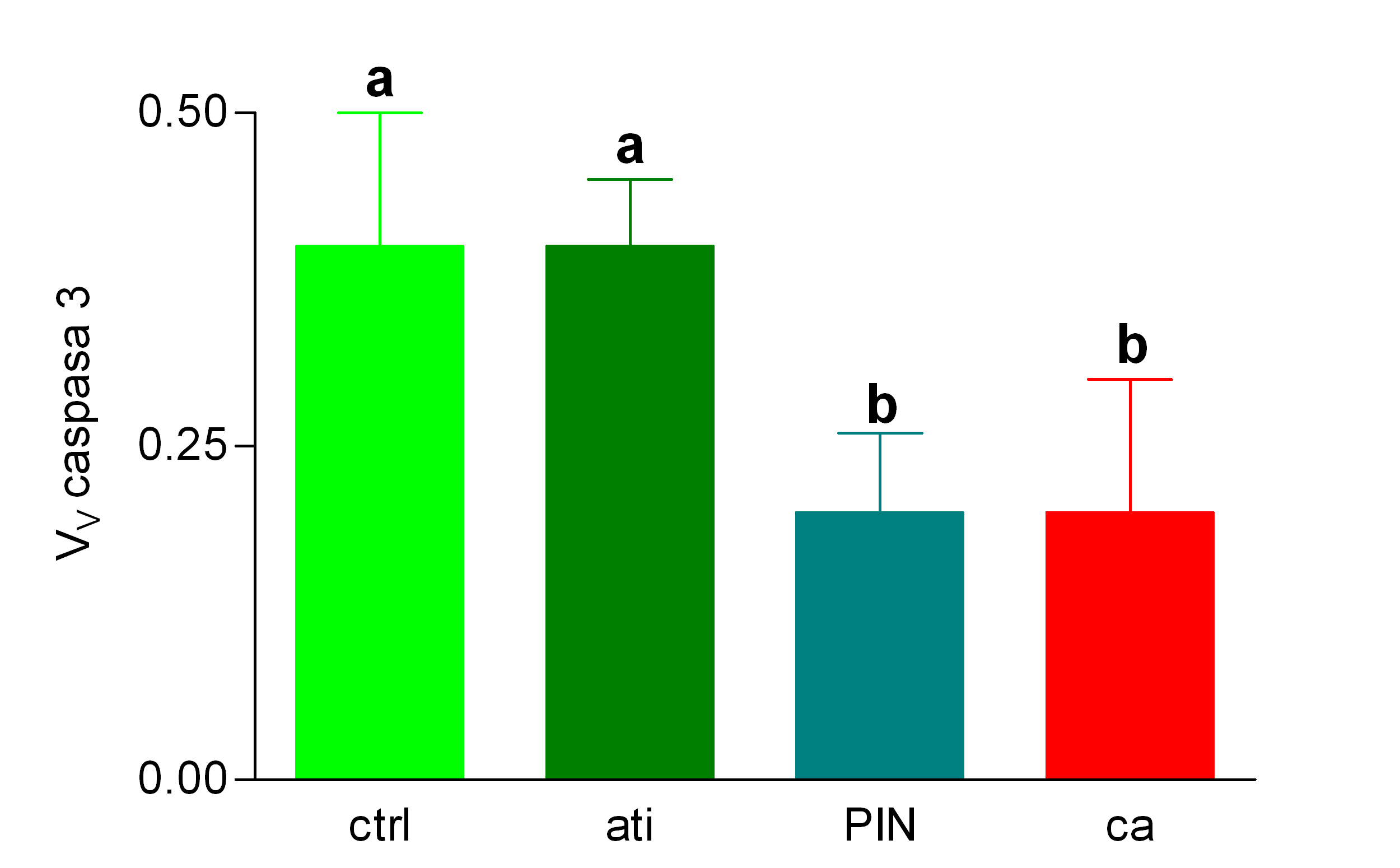
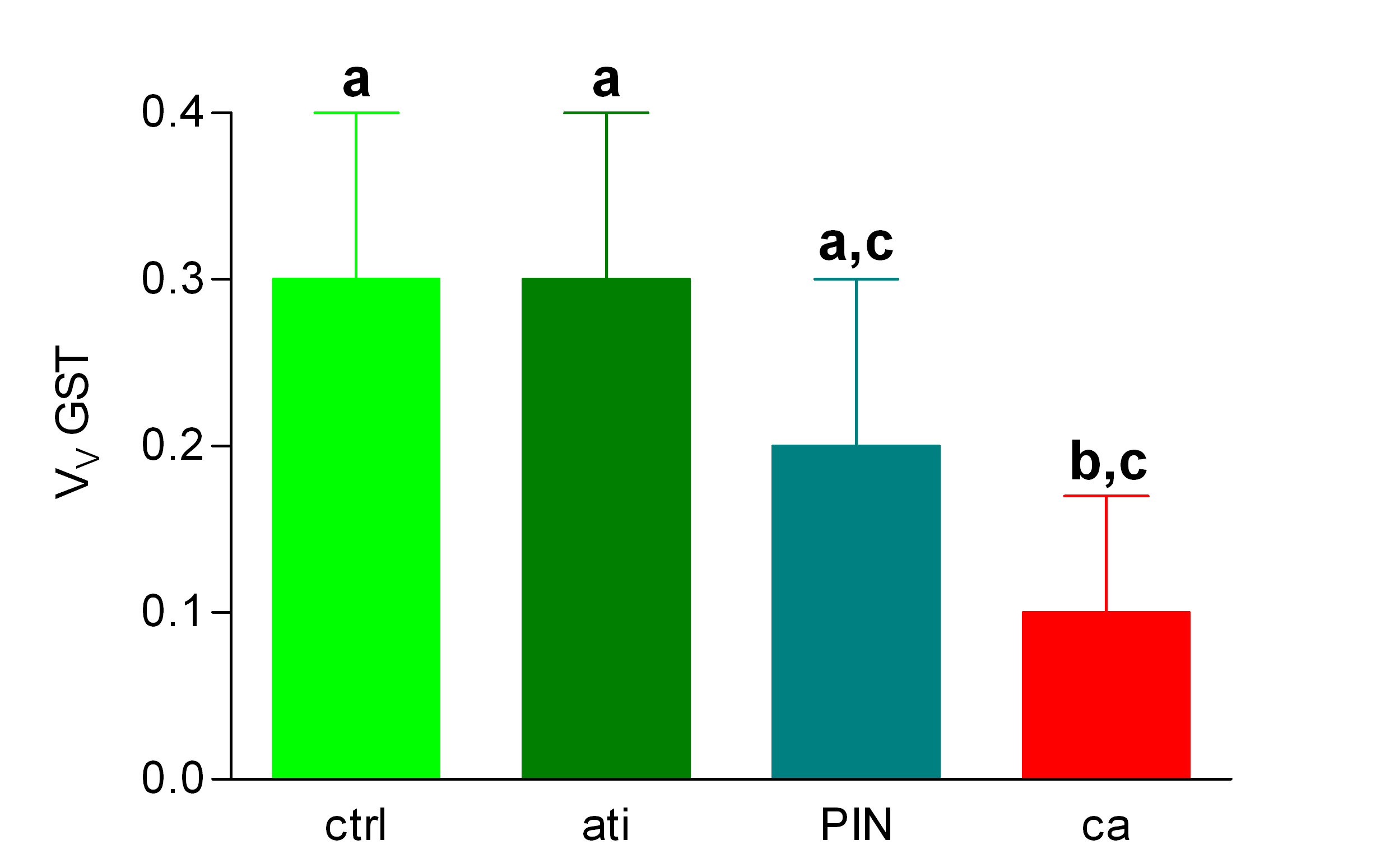
Histología Las biopsias control muestran acinos prostáticos sin alteraciones, de luces y calibres variables, revestidos por un epitelio donde se observan células columnares y células basales Fig_1. En los casos donde se localizaron lesiones de atrofia prostática inflamatoria se observa la presencia de glándulas pequeñas, revestidas por un epitelio cilíndrico bajo, casi cúbico, con células basales, el estroma que rodea a las glándulas aparece infiltrado por cantidades variables de linfocitos Fig_2. Los especímenes con PIN de alto grado evidencian la presencia de luces glandulares revestidas por un epitelio de altura variable y borde festoneado, de aspecto seudopapilar. Los núcleos se disponen seudoestratificadamente, apelotonados, son de tamaños variables y presentan la cromatina generalmente densa, observándose ocasionales nucleolos. El estrato basal se conserva parcialmente Fig_3. En los casos en los que se detectó adenocarcinoma se evidencia un estroma prostático infiltrado por luces glandulares de pequeño tamaño, frecuentemente adosadas entre sí, con una celularidad que muestra núcleos grandes de cromatina laxa y frecuentes nucleolos. Se observa también la presencia de nidos y cordones celulares con características citológicas similares a las descritas para las glándulas Fig_4. Inmunohistoquímica KI67 En los controles se observan ocasionales núcleos inmunoreactivos para KI67, localizados preferentemente en el estrato basal de los acinos prostáticos Fig_5. Así mismo en las glándulas de ATI se observan algunos núcleos inmunoteñidos para KI67, siendo difícil discriminar si pertenecen al estrato basal o al columnar Fig_6. En las glándulas de PIN se detecta un mayor número de núcleos inmunoteñidos tanto a nivel basal como columnar Fig_7, mientras que en el adenocarcinoma los núcleos inmunorreactivos para KI67 son claramente más abundantes Fig_8. Caspasa 3 La inmunorreactividad para caspasa 3 es abundante en los acini de los casos control y tiende a dejar libre el estrato basal, siendo más llamativa en el estrato columnar Fig_9. las glándulas de ATI muestran también una importante inmunorreactividad para caspasa 3 con idéntica distribución a la observada en los controles Fig_10. Sin embargo en PIN, y de modo más importante en el carcinoma, se evidencia un claro decrecimiento de inmunotinción para caspasa 3, cuya expresión queda confinada al extremo más apical del borde libre del epitelio Fig_11 y Fig_12. Glutation-S-Transferasa pi Tanto en controles como en ATI, la expresión de GST se observa en las células basales del epitelio, no detectándose diferencias importantes entre estos dos grupos Fig_13 y Fig_14. Sin embargo, en PIN, la inmunotinción para GST aparece claramente disminuida, detectándose también de modo exclusivo en las células del estrato basal Fig_15. En el carcinoma la inmunorreactividad para GST es muy débil y difusa en el citoplasma de las células tumorales Fig_16. Resultados cuantitativos El LiKI67 muestra un incremento significativo en los casos de adenocarcinoma, en comparación con el resto de los grupos, no detectándose diferencias significativas entre controles, ATI y PIN Fig_17. La Vv caspasa 3 evidencia una disminución significativa en carcinoma y PIN con respecto a controles y ATI. No se observan diferencias entre carcinoma y PIN o entre controles y atrofia inflamatoria Fig_18. La Vv GST muestra su menor expresión en el carcinoma, que difiere significativamente con los grupos restantes, salvo con el PIN. No se observan diferencias significativas entre controles y ATI Fig_19.
|
 Zoom Zoom
|
|
|
Próstata control sin alteraciones. HE, 300X
|
 Zoom Zoom
|
|
|
Atrofia inflamatoria prostática. Se observa una glándula pequeña, revestida por epitelio bajo y rodeada por infiltrado inflamatorio crónico. HE, 300X.
|
 Zoom Zoom
|
|
|
Neoplasia intraepitelial prostática (PIN) de alto grado. HE, 300X.
|
 Zoom Zoom
|
|
|
Adenocarcinoma prostático. HE, 300X.
|
 Zoom Zoom
|
|
|
Glándula prostática normal, inmunoteñida para KI67. se observan algunos núcleos inmunorreactivos en el estrato basal (cabezas de flecha). 300X.
|
 Zoom Zoom
|
|
|
Atrofia inflamatoria prostática. Inmunotinción para KI67. 300X.
|
 Zoom Zoom
|
|
|
Neoplasia intraepitelial prostática (PIN). Inmunotinción para KI67. 300X.
|
 Zoom Zoom
|
|
|
Carcinoma prostático. Inmunotinción para KI67. 300X.
|
 Zoom Zoom
|
|
|
Próstata control. Inmunotinción para caspasa 3. 300X.
|
 Zoom Zoom
|
|
|
Atrofia inflamatoria prostática. Inmunotinción para caspasa 3. 300X.
|
 Zoom Zoom
|
|
|
Neoplasia intraepitelial prostática. Inmunotinción para caspasa 3. 300X.
|
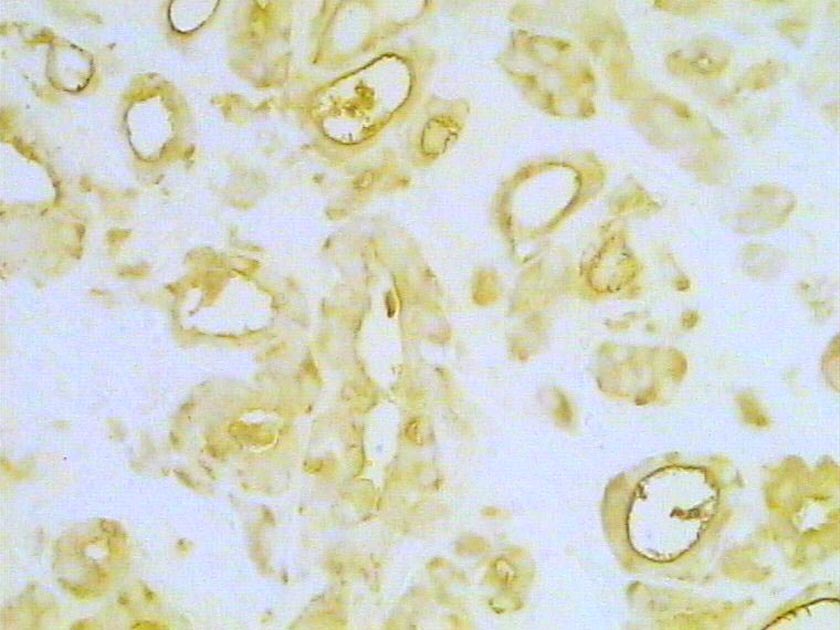 Zoom Zoom
|
|
|
Carcinoma prostático. Inmunotinción para caspasa 3. 300X.
|
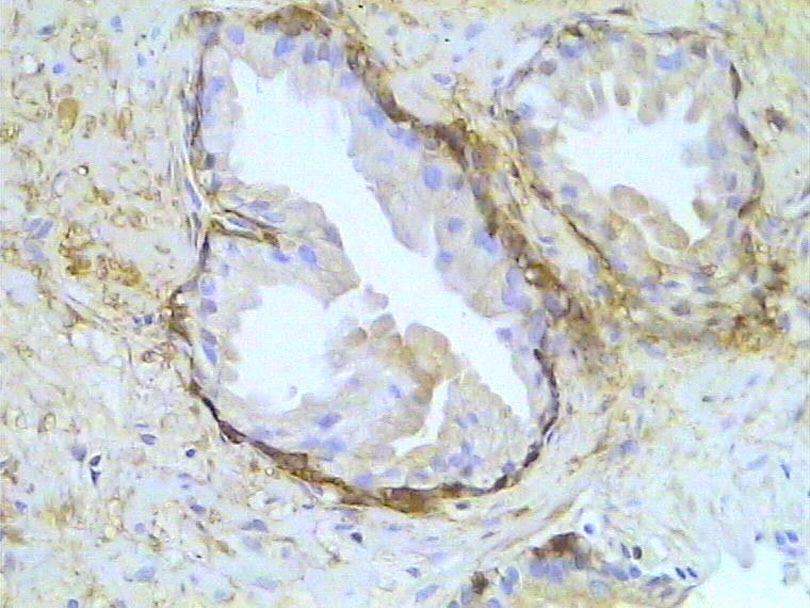 Zoom Zoom
|
|
|
Próstata control. Inmunotinción para GST. 300X.
|
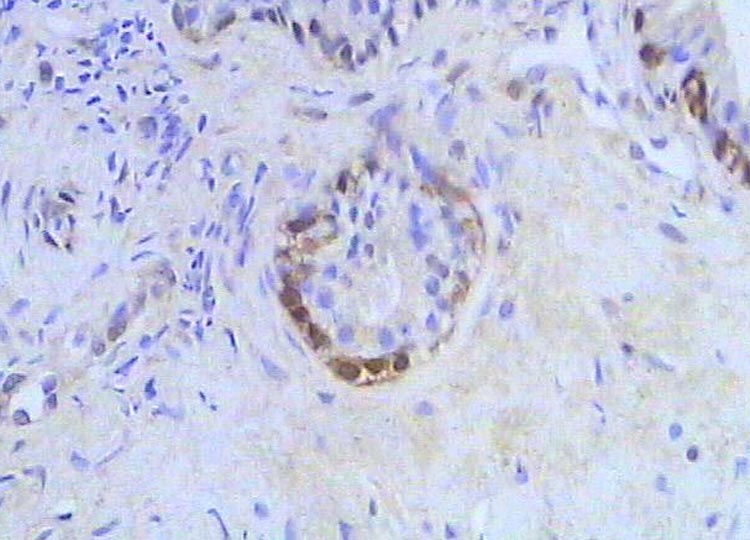 Zoom Zoom
|
|
|
Atrofia inflamatoria prostática. Inmunotinción para GST. 300X.
|
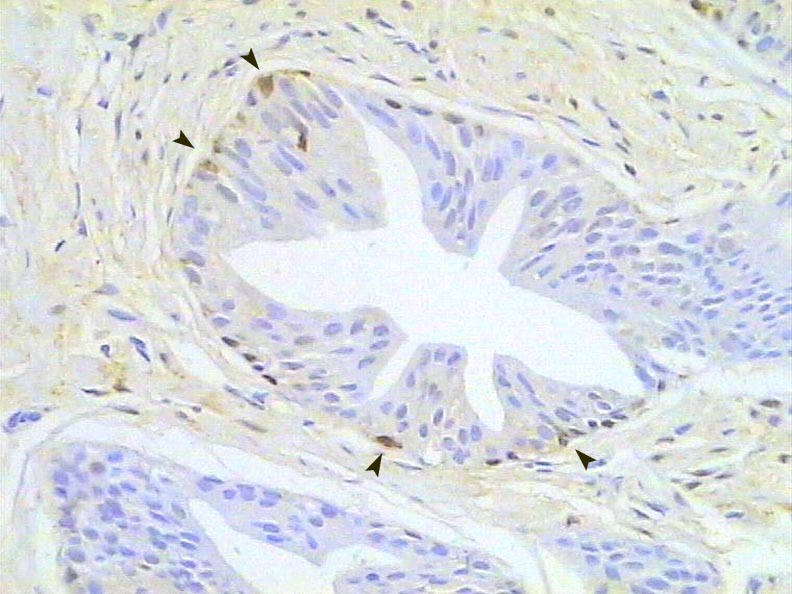 Zoom Zoom
|
|
|
Neoplasia intraepitelial prostática. Inmunotinción para GST. Se observan escasas células basales inmunorreactivas (cabezas de flecha). 300X.
|
 Zoom Zoom
|
|
|
Carcinoma prostático. Inmunotinción para GST. 300X.
|
 Zoom Zoom
|
|
|
Diagrama de barras que expresa como media +/- SD el LiKI67 en controles (ctrl); atrofia inflamatoria (ati); neoplasia intraepitelial prostática (PIN) y carcinoma prostático (ca). El asterisco sobre la barra de error de ca indica diferencia estadísticamente significativa (p<0.05) con respecto a los restantes grupos.
|
 Zoom Zoom
|
|
|
Diagrama de barras que expresa como media +/- SD la Vv caspasa 3 en controles (ctrl); atrofia inflamatoria (ati); neoplasia intraepitelial prostática (PIN) y carcinoma prostático (ca). Las letras situadas sobre las barras de error indican la significación. Los grupos cuyas barras aparecen marcadas por letras diferentes presentan diferencias estadísticamente significativa (p<0.05).
|
 Zoom Zoom
|
|
|
Diagrama de barras que expresa como media +/- SD la Vv GST en controles (ctrl); atrofia inflamatoria (ati); neoplasia intraepitelial prostática (PIN) y carcinoma prostático (ca). Las letras situadas sobre las barras de error indican la significación. Los grupos cuyas barras aparecen marcadas por letras diferentes presentan diferencias estadísticamente significativa (p<0.05).
|
|
|
|
|
|
|
|
Discusión
|
|
|
El incremento de proliferación observado en el carcinoma, en términos de inmunorreactividad para KI67, concuerda con lo descrito por otros autores ( 10), sin embargo en el presente trabajo no se ha descrito un aumento significativo de actividad proliferativa en el PIN en comparación con el epitelio normal, tampoco llama la atención la actividad proliferativa en la atrofia inflamatoria, a pesar de lo indicado en otros estudios ( 5). Se podría pensar, que una estimación más rigurosa del índice de marcaje para el KI67, en el sentido de un muestreo adecuado y sin sesgos, así como la evaluación estereológica del parámetro ( 8),( 11), producen unas estimaciones más rigurosas y realistas. La expresión de caspasa 3 es un buen indicador de actividad apoptótica en próstata, su disminución en PIN y carcinoma concuerda con lo descrito previamente ( 12) y parece indicar una mayor resistencia a la muerte celular programada como signo de premalignidad en el PIN y quizás con significado pronóstico en la progresión de la enfermedad tumoral prostática ( 12). De nuevo es llamativo que en la atrofia inflamatoria no se dé esta disminución, en contraposición con lo señalado por otros autores ( 2),( 5) que describen incremento de bcl-2 como signo de resistencia a la apoptosis en atrofia inflamatoria. La expresión de glutation-S-Transferasa se relaciona con la capacidad de respuesta al stress oxidativo, diversos autores indican que la disminución de la actividad de GST implica una menor defensa ante la aparición de radicales libres y por tanto pérdida de protección ante la transformación neoplásica ( 7), eso concuerda con el decrecimiento de densidad de volumen de epitelio inmunorreactivo para GST en PIN y sobre todo en carcinoma. Sin embargo, es de nuevo la atrofia inflamatoria la que no muestra concordancia con lo descrito en la literatura, en el sentido de que la expresión de GST en ese grupo es similar a la observada en los controles y no más elevada, como se decribe en otros trabajos ( 7). Hay que decir que en esas publicaciones, no parece que se haya desarrollado una cuantificación adecuada, de hecho se señala un aumento del número de células GST positivas, pero no se indica si varía la fracción de epitelio inmunorreactivo para GST. Como conclusiones del presente estudio se pueden señalar: (a) El KI67, discrimina entre el carcinoma prostático y el resto de los grupos en cuanto a proliferación, pero no indica una mayor proliferación en el PIN con relación a la atrofia inflamatoria y a los controles; (b) el carcinoma y PIN muestran mayor resistencia a la apoptosis que el resto; (c) el carcinoma muestra menos respuesta al stress oxidativo que el resto; (d) Los parámetros evaluados no permiten sugerir que la atrofia inflamatoria sea precursora del PIN o del carcinoma prostático. A este respecto conviene describir con mayor precisión el perfil histopatológico de la atrofia inflamatoria, ya que la discordancia de los datos obtenidos con lo indicado en otros trabajos, puede deberse a que lo que se define como ATI no se haga unívocamente por todos los autores.
|
|
|
|
|
|
|
Bibliografia
|
|
|
1. Helpap B. Prognostic factors of prostatic carcinoma. Pathologe 1998; 19: 42-52. 2. Shah R, Mucci NR, Amin A, Macoska JA, Rubin MA. Postatrophic hyperplasia of the prostate gland: neoplastic precursor or innocent bystander? Am J Pathol 2001; 158: 1767-1773. 3. De Marzo AM, Marchi VL, Epstein JI, Nelson WG. Proliferative inflammatory atrophy of the prostate: implications for prostatic carcinogenesis. Am J Pathol 1999; 155: 1985-1992. 4. Anim JT, Udo C, John B. Characterisation of inflammatory cells in benign prostatic hyperplasia. Acta Histochem 1998; 100: 439-449. 5. Ruska KM, Sauvageot J, Epstein JI. Histology and cellular kinetics of prostatic atrophy. Am J Surg Pathol 1998; 22: 1073-1077. 6. Gerstenbluth RE, Seftel AD, MacLennan GT, Rao RN et al. Distribution of chronic prostatitis in radical prostatectomy specimens with up-regulation of bcl-2 in areas of inflammation. J Urol 2002; 167: 2267-2270. 7. Parsons JK, Nelson CP, Gage WR, Nelson WG et al. GSTA1 expression in normal, preneoplastic, and neoplastic human prostate tissue. Prostate 2001; 49: 30-37. 8. Gundersen HJ, Osterby R. Optimizing sampling efficiency of stereological studies in biology: or 'do more less well!'. J Microsc 1981; 121: 65-73. 9. Gundersen HJ, Bagger P, Bendtsen TF, Evans SM et al. The new stereological tools: disector, fractionator, nucleator and point sampled intercepts and their use in pathological research and diagnosis. APMIS 1988; 96: 857-881. 10. Tamboli P, Amin MB, Schultz DS, Linden MD, Kubus J. Comparative analysis of the nuclear proliferation index (Ki-67) in benign prostate, prostatic intraepithelial neoplasia, and prostatic carcinoma. Mod Pathol 1996; 9: 1015-1019. 11. Gundersen HJ, Bendtsen TF, Korbo L, Marcussen N et al. Some new, simple and efficient stereological methods and their use in pathological research and diagnosis. APMIS 1988; 96: 379-394. 12. Winter RN, Kramer A, Borkowski A, Kyprianou N. Loss of Caspase-1 and Caspase-3 protein expression in human prostate cancer. Cancer Research 2001; 61: 1227-1232.
|
|
|
|
|
|
|
















