|
|
Carcinoma quístico hipersecretor intraductal. Presentación de un caso y breve revisión de la literatura.
Dr Walter Marcial Martínez RodríguezWM
,
Dra María de los Ángeles Miló AnilloMAM
,
Tec Ana Gloria Pérez Reyes
y
Dra Olga Forteza TrujilloOF
Servicio de Patología
Hospital Universitario 'León Cuervo Rubio'
Carretera Central y entronque a Viñales s/n 700,000
20200
Pinar del Río
Cuba
|
|
|
|
|
|
|
|
Resumen
|
|
|
|
Introducción:Esta variante de Carcinoma intraductal fue descrita en el 1984. La mayoría de los casos reportados eran intraductales. Existe una lesión benigna que semeja un carcinoma, que recibe el nombre de hiperplasia quística hipersecretora. Como era de esperar el carcinoma quístico hipersecretor no aparece en la clasificación de los tumores de mama publicada por la OMS en el 1982. La edad de distribución es a la del cáncer mamario en general. La paciente más joven reportada hasta el momento tiene 34 años y la más vieja 79. La edad media en las series más grandes fue de 56 años. La presentación clínica más frecuente fue el bulto o el nódulo mamario. La mamografía es inespecífica. Entre 10 tumores estudiados bioquímicamente, 8 tuvieron niveles negativos de estrógeno y de progesterona; mientras que 2 fueron positivos para ambos receptores
Presentación:WPC.48ª,F,B,HCL.223305.APP: Asma Bronquial, Hepatitis Viral. Presenta T de +/- 5 cm, móvil, en CSEMD, con el diagnóstico presuntivo de Fibroadenoma. Se realizó Punción Aspiración con Aguja Fina(PAAF) la cual fue informada como Fibroadenoma con Enfermedad proliferativa ductal atípica. Se le realiza biopsia y se envía material a Anatomía Patológica recibiéndose tejido mamario de color blanco grisáceo, consistencia fibro-elástica; al corte se observan múltiples quistes, entre 1 y 3 mm, de contenido coloide de color pardo grisáceo, con áreas hemorrágicas. Microscópicamente se observaron múltiples quistes que contenian un material que guardaba una gran parecido con el coloide tiroideo. La secreción era homogénea y virtualmente acelular, en algunas se retraía del epitelio que la rodeaba. No existía necrosis en el interior de los quistes y tampoco fueron observadas calcificaciones. Los quistes mayores estaban revestidos por una sola hilera de células cúbicas a planas pero otros más pequeños se encontraban revestidos por varias capas de epitelio y exhibían un franco patrón papilar, con amoldamiento nuclear, pérdida de la polaridad celular, anisonucleosis, hipercromatismo nuclear, núcleos gigantes, distribución irregular de la cromatina. No se apreció invasión de la membrana basal. En la periferia se apreció un cuadro que podía ser calificado de Hiperplasia quística hipersecretora.Se concluye el caso como Carcinoma quístico hipersecretor intraductal.
|
|
|
|
|
|
|
Introducción
|
|
|
|
El carcinoma quístico hipersecretor fue escrito por primera vez in 1984(1), la mayoría de los casos reportados se encontraban en estadio in situ. Una lesión proliferativa que semeja carcinoma quístico hipersecretor ha sido denominada hiperplasia quística hipersecretora (2).El carcinoma quístico hipersecretor no aparece en la Clasificación de la Organización Mundial de la Salud (OMS) de 1982.
La edad de distribución del carcinoma quístico hipersecretor es similar a la del cáncer mamario en general, la paciente más joven reportada tenía 34 años y la de mayor edad 79 años. La edad promedio en las series más grandes es de 56 años(2).Debutan como nódulo o como masa mamaria. La mamografía, en un caso (3), reveló un prominente patrón ductal y densidad irregular de la mama. Entre diez tumores estudiados bioquímicamente, 8 tuvieron niveles negativos de receptores de estrógeno y progesterona, mientras 2 especimenes fueron positivos para ambos receptores. Nuestro propósito, con este trabajo, es contribuir a ampliar el conocimiento que se tiene del carcinoma quístico hipersecretor.
|
|
|
|
|
|
|
Material y Métodos
|
|
|
|
Presentación del caso.
WPC.48ª,F,B,HCL.223305.APP: Asma Bronquial, Hepatitis Viral. Presenta T de +/- 5 cm, móvil, en CSEMD, con el diagnóstico presuntivo de Fibroadenoma. Se realizó Punción Aspiración con Aguja Fina(PAAF) la cual fue informada como Fibroadenoma con Enfermedad proliferativa ductal atípica. Se le realiza biopsia y se envía material a Anatomía Patológica recibiéndose tejido mamario de color blanco grisáceo, consistencia fibro-elástica; al corte se observan múltiples quistes, entre 1 y 3 mm, de contenido coloide de color pardo grisáceo, con áreas hemorrágicas. Microscópicamente se observaron múltiples quistes que contenian un material que guardaba una gran parecido con el coloide tiroideo. La secreción era homogénea y virtualmente acelular, en algunas se retraía del epitelio que la rodeaba. No existía necrosis en el interior de los quistes y tampoco fueron observadas calcificaciones. Los quistes mayores estaban revestidos por una sola hilera de células cúbicas a planas pero otros más pequeños se encontraban revestidos por varias capas de epitelio y exhibían un franco patrón papilar, con amoldamiento nuclear, pérdida de la polaridad celular, anisonucleosis, hipercromatismo nuclear, núcleos gigantes, distribución irregular de la cromatina. No se apreció invasión de la membrana basal. En la periferia se apreció un cuadro que podía ser calificado de Hiperplasia quística hipersecretora.Se concluye el caso como Carcinoma quístico hipersecretor intraductal
|
|
|
|
|
|
|
Resultados
|
|
|
|
Breve Revisión de la literatura
Aspecto macroscópico.
El tumor puede medir entre 1 y 10 cm de diámetro. La lesión es firme pero generalmente no es dura. La lesión se diferencia del parénquima mamario normal pero no está bien demarcada. La característica macroscópica más notable es la presencia de numerosos quistes dentro de la lesión. Muchos de estos tumores tienen un tinte pardo o pardo grisáceo, que refleja el contenido de los quistes. Los quistes varían considerablemente de tamaño, con algunos que pueden llegar hasta 1,5 cm. La secreción dentro de los quistes ha sido descrita como viscosa, mucinosa, gelatinosa, o semejante a coloide tiroideo.
Aunque las lesiones quísticas hipersecretoras tienen una apariencia característica, usualmente no es posible diferenciar macroscópicamente la hiperplasia quística hipersecretora del carcinoma quístico hipersecretor. Ambos procesos tienen esencialmente el mismo aspecto macroscópico. Sin embargo, el carcinoma quístico hipersecretor invasor puede distinguirse de los anteriores.
Apariencia microscópica.
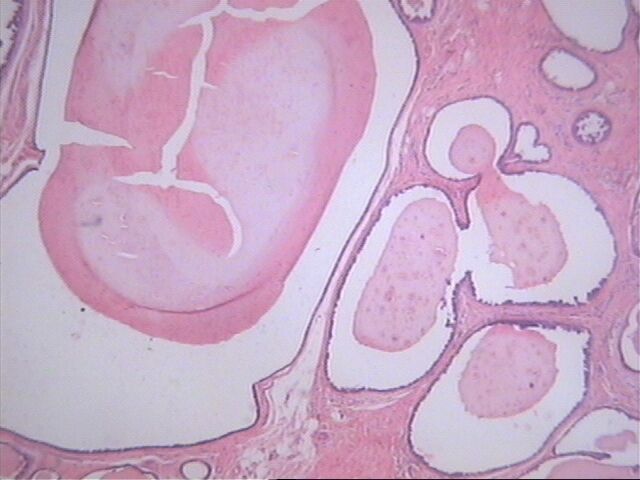
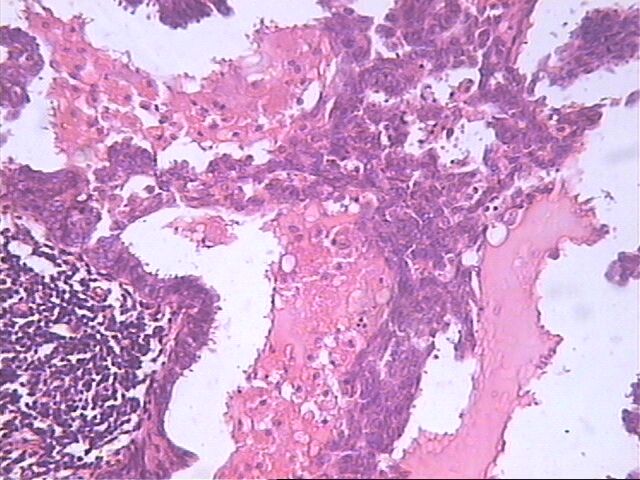
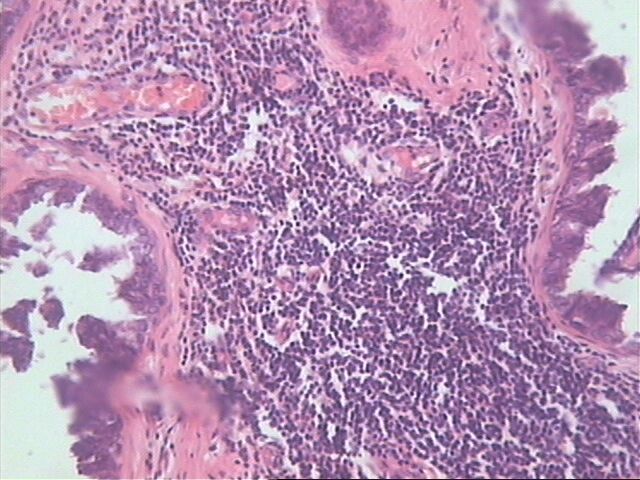
Microscópicamente, hay numerosos quistes que contienen secreción eosinófila que guarda una fuerte semejanza con el coloide tiroideo (Figura 1). La secreción es homogénea y virtualmente acelular, a menudo, el material se retrae y el borde adquiere un aspecto festoneado. La comedo necrosis y las calcificaciones no son frecuentemente encontradas en este tipo de carcinoma(Figura 2). No hay diferencias apreciables entre las características de la secreción en la hiperplasia quística hipersecretora y la secreción contenida en los quistes del carcinoma quístico hipersecretor. Desde el punto de vista inmunohistoquímicamente la secreción es positiva al: antígeno carcinoembrionico (CEA), alfalactoalbúmina, la mucina y el PAS; mientras que ha sido negativa a la tiroglobulina. La ruptura de los quistes produce escape de la secreción al estroma, lo cual provoca una intensa reacción inflamatoria de linfocitos e histiocitos (Figura 3).
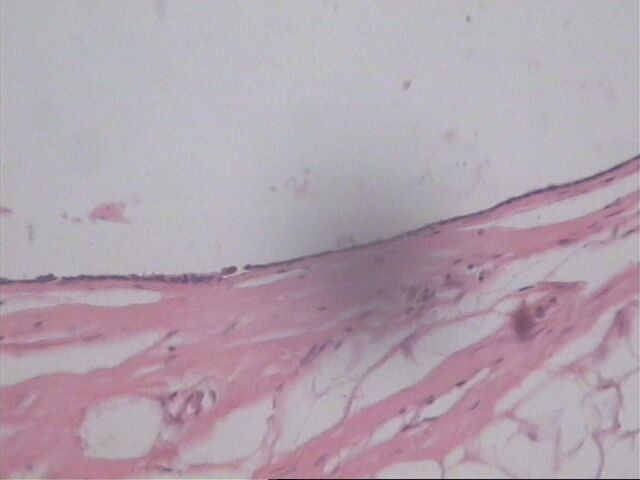
Muchos de estos quistes en las lesiones quísticas hipersecretoras están revestidos por una sola capa inconspicua de células planas, cúbica o columnar(Figura 1, 4). Cuando este es el único patrón epitelial, la lesión puede ser considerada una hiperplasia quística hipersecretora(2). Generalmente, las células en tales lesiones tienen núcleos uniformes de cromatina laxa y citoplasma escaso. La aparición de características atípicas está marcada por apiñamiento, hipercromasia y agrandamiento nuclear, el cual puede contener nucleolo. El apiñamiento celular en la hiperplasia quística hipersecretora, puede dar lugar a una hiperplasia micropapilar.
En el carcinoma quístico hipersecretor, de algunos quistes y conductos crece como un carcinoma ductal in situ con patrón micropapilar. En el mismo caso podemos encontrar un espectro de patrones arquitecturales; desde pequeñas protrusiones epiteliales hasta complejas frondas ramificadas que se extienden a través de la luz de todo el conducto(Figura 5). Sin embargo, los denominados arcos romanos, o el patrón de puentes rígidos, frecuentemente vistos en otras formas de carcinoma micropapilar, son infrecuentes en estas lesiones. El estroma fibrovascular es raramente encontrado dentro de las frondas papilares. Las células que se encuentran revistiendo los quistes o las micropapilas, presentan apiñamiento y superposición de los núcleos, el citoplasma es escaso. No hay secreción dentro del citoplasma, pero el aspecto deshilachado e irregular del borde luminal de la célula y el balonamiento celular son compatibles con algún grado de actividad secretora
Se han encontrado unos pocos ejemplos de carcinoma quístico hipersecretor en los cuales hay una pronunciada vacuolización y secreción del citoplasma del citoplasma de las células carcinomatosas. Este patrón de crecimiento es reminiscente de hiperplasia pseudolactante. La distinción entre las dos condiciones es algunas veces difícil. Los quistes de las lesiones quísticas hipersecretoras no son una característica la hiperplasia seudolactaante; ni tampoco la secreción tiene la apariencia de coloide tiroideo. Los lóbulos en, y alrededor de las áreas lesionales, en mujeres con lesiones quísticas hipersecretoras, a menudo, exhiben cambios hipersecretores que incluyen la acumulación de secreción(Figura 6). Esta anormalidad lobular puede ocurrir como un hallazgo aislado en la ausencia de una lesión completamente desarrollada. Esta observación sugiere que el proceso puede originarse en tales focos.
El carcinoma quístico hipersecretor invasor consiste de carcinoma quístico hipersecretor intraductal acompañado de un componente invasor. Todos los carcinomas invasores encontrados en este contexto Han sido carcinoma ductal invasor pobremente diferenciado con un patrón sólido de crecimiento. Los núcleos de las células del carcinoma invasor tienen una apariencia “abierta”, como los núcleos del carcinoma papilar del tiroides. Con el microscopio de luz se observa poca o ninguna actividad secretoria dentro de las células. Las metástasis en los ganglios axilares de una paciente tenían focos de áreas microquísticas que contenían material eosinofílico(2).
La microscopía electrónica ha sido poco revisada, Los dúctulos afectados estaban revestidos células epiteliales rodeadas por células mioepiteliales. Las células ductulares estaban desprovistas de microvillis; no se observa polarización de las vesículas secretorias o inclusiones. La presencia de gránulos secretorios grandes compuestos de material granular fino estaba limitada al extremo basal del citoplasma. La luz de los conductos contenía material amorfo o granular fino. . Estos hallazgos ultraestructurales difieren apreciablemente de los que se ven en el carcinoma secretor, el cual se caracteriza por abundantes gránulos secretorios intracitoplasmáticos así como luces glandulares intracitoplasmáticas. Carcinoma mucinoso también difiere del carcinoma quístico hipersecretor en tener abundante mucina extracelular y gránulos citoplasmáticos de mucina.
Pronóstico y tratamiento.
El diagnóstico del carcinoma quístico hipersecretor puede ser sospechado por PAAF(3). El fondo de la preparación contiene abundante material eosinofílico a basófilo que semeja coloide tiroideo. Las células tumorales se encuentran en grupos y sueltas, rodeadas por material secretor.
Se requiere biopsia escisional para el diagnóstico definitivo y especialmente para distinguir la hiperplasia quística hipersecretora del carcinoma quístico hipersecretor. En más de una ocasión, una lesión incompletamente escindida ha sido erróneamente diagnosticada como una condición fibroso quística(1,3), no descubriéndose la verdadera naturaleza de la lesión hasta que se convierte en una enfermedad recurrente.
Poco se sabe a cerca del curso clínico de esta entidad “recientemente” descrita. El hallazgo de áreas con las típicas características de la hiperplasia quística hipersecretora, algunas veces con atipia, en el carcinoma quístico hipersecretor; sugiere que estos procesos están relacionados, pero la evidencia convincente de progresión desde un estadio a otro hasta llegar al carcinoma; no ha sido demostrada. La revisión de biopsias previas, en mujeres a las que más tarde se le diagnóstico un carcinoma quístico hipersecretor; mostraron distintos patrones de enfermedad proliferativa: desde los no relacionados con el carcinoma quístico hasta hiperplasia quística hipersecretora y carcinoma quístico hipersecretor. En 8 mujeres con hiperplasia quística hipersecretora, seguidas durante varios años, reveló subsiguiente carcinoma mamario en dos casos. Una mujer desarrollo un carcinoma ductal infiltrante invasor contra lateral fatal que carecía de características de quísticas hipersecretoras. La otra mujer tenía un carcinoma intraductal anexo a una hiperplasia quística hipersecretora, en la biopsia y una hiperplasia quística hipersecretora en la mastectomía. Bogomoletz describe una mujer de 55 años que permanecía bien, sin recurrencias, 6 años después de la biopsia de una muestra de 7 cm, que contenía una hiperplasia quística hipersecretora (4).
El curso clínico del carcinoma quístico hipersecretor intraductal no difiere, así, del curso clínico de otras formas de carcinoma intraductal. No ha habido recurrencias en mujeres tratadas con mastectomía, después de un período de seguimiento promedio de 8 años. En ninguna hubo metástasis a ganglios axilares. De 4 mujeres con carcinoma quístico hipersecretor invasor, 2 tuvieron metástasis a ganglios axilares; y un tercer paciente presentó un carcinoma inflamatorio. Hasta hace algunos años, la única muerte debida a carcinoma quístico hipersecretor ocurrió en este último caso.
Las opciones terapéuticas para pacientes con carcinoma quístico hipersecretor son similares a las disponibles para pacientes con otras formas de carcinoma ductal. La mastectomía ha demostrado ser curativa para las pacientes con lesiones intraductales. Cuando el carcinoma es invasor, el vaciamiento axilar debe ser indicado. La quimioterapia adyuvante debe ser añadida en los pacientes en estadio clínico II; y debe ser considerada en los pacientes en estadio I ; en vista del carácter pobremente diferenciado de los tumores invasores.
|
 Zoom Zoom
|
|
|
Microscópicamente, hay quistes que contienen secreción eosinofílica que exhibe una fuerte semejanza con el colide tiroideo. La secreción es homogénea y virtualmente acelular.HE 10x4
|
 Zoom Zoom
|
|
|
Ni la comedonecrosis ni las calcificaciones son ordinariamente encontrados en este tipo de carcinoma. El epitelio de revestimiento presenta apiñamiento, superposición; y los núcleos: superposición,hipercromatismo y anisocariosis. HE 10x10
|
 Zoom Zoom
|
|
|
El escape del material del interior del quiste, como consecuencia de la disrupción epitelial, hacia el estroma; puede dar lugar a una fuerte reacción inflamatoria linfo histiocítica.HE 10x10
|
 Zoom Zoom
|
|
|
Muchos de estos quistes están revestidos por una sola capa de células aplanadas.HE 10x4
|
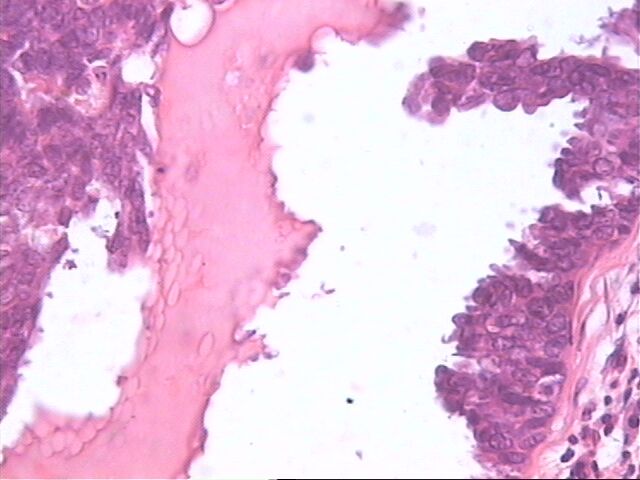 Zoom Zoom
|
|
|
El epitelio en algunos quistes y conductos crece como un carcinoma micropapilar intraductal. Encontramos desde simples proyecciones papilares digitiformes hasta complejas frondas papilares muy ramificadas, que atraviesan todo el conducto o el quiste. Sin embargo, los arcos romanos o los puentes rígido, frecuentemente encontrados en otras formas de carcinoma micropapilar, son infrecuentres. El estroma es raramente encontrado dentro de las frondas micropapilares. HE 10x20
|
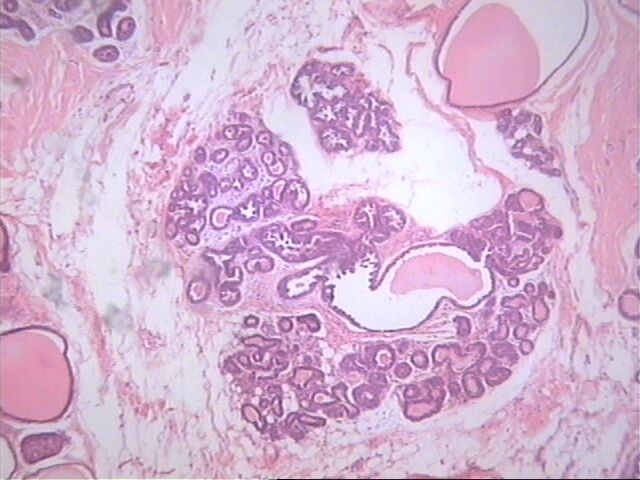 Zoom Zoom
|
|
|
Algunos lóbulos dentro y fuera de la lesión;a menudo, exhiben cambios hipersecretores que incluyen, la acumulación la acumulación de secreción. Se plantea que este cambio puede ser la lesión precursora.HE 10x4
|
|
|
|
|
|
|
|
Discusión
|
|
|
|
Las lesiones quísticas hipersecretoras se pueden clasificar en cuatro categorías:
Grado I. La hiperplasia quística hipersecretora sin atipia (HDQH)
Grado II. La hiperplasia quística hipersecretora con atipia (HDQHA)
Grado III El carcinoma intraductal quístico hipersecretor (CDISQH)
Grado IV. El carcinoma ductal invasor quístico hipersecretor(CDIQH)
En el grado I, los quistes están revestidos por una sola capa de células planas o cúbico bajas, dispuestas ordenadamente, con citoplasma eosinófilo, el núcleo redondo u oval, vesicular y netamente benigno; los quistes llenos con un material hialino, homogéneo, eosinófilo, coloide-like. Los cambios secretorios deben ser considerados aparte de los hiperplásicos y han sido descritos con distintos nombres pero que básicamente consisten en células más altas que lo normal, el núcleo más oval, y el citoplasma en el borde luminal se alarga más todavía como una “trompa”. Page y Kasami (5), consideran estos cambios análogos a los observados en el endometrio hipersecretor de la reacción Arias Stella (6).
En el grado II, a los cambios anteriores se le añade la atipia; consistentes en apiñamiento nuclear, superposición, hipercromatismo y anisonucleosis. Cambios similares a los observados en la HDQHA, han sido reportados por Fraser et al (7), y encuentran que tiene asociación con las alteraciones ductales atípicas convencionales. Similares observaciones relacionando las alteraciones columnares de los lóbulos con la hiperplasia lobular atípica y el carcinoma tubular han sido hechas por Rosen (8) y Goldstein et al. (9).
En el grado III, los cambios atípicos son de grado mayor y recuerdan al del carcinoma intraductal con patrón micropapilar.
En el grado IV, se observan los cambios del CDISQH acompañados de un componente invasor. Como el carcinoma ductal invasor quístico hipersecretor, descrito dentro de este contexto, es de alto grado, es conveniente estudiar muy bien las lesiones quísticas hipersecretoras para la detección temprana de la lesión en los grado del I al III, cuando el pronóstico de la paciente es bueno.
Finalmente nuestro caso es indudable que tenía una atipia marcada pero; sin embargo, no se observó invasión de la membrana basal de ninguno de los quistes ni conductos, por lo que se concluyó como carcinoma ductal in situ quístico hipersecretor.
Cambios similares a los descritos por Rosen et al(1), en su trabajo original;, dentro y fuera de la lesión; de lóbulos con cambios hipersecretores, incluyendo la acumulación de secreción; fueron observados. Los cambios descritos recuerdan los descritos en otros lugares como “ductal blunt adenosis”. No se ha podido determinar si estas alteraciones ocurren ciertamente en acinis o en conductos terminales intralobulares o extralobulares de la unidad lobular ductal terminal. Se ha inferido por el propio Rosen, que las lesiones quísticas hipersecretoras pueden originarse en tales focos.
|
|
|
|
|
|
|
Bibliografia
|
|
|
|
1). Rosen PP, Scott M. Cystic hypersecretory duct carcinoma of the breast. Am J Surg Pathol 1984;8:31-41.
2). Guerry P. Erlandson RA, Rosen PP. Cystic Hypersecretory hyperplasia and cystic hipersecretory duct carcinoma in situ of the breast. Pathology, therapy and follow –up of 39 cases. Cancer 1988;61:1611-20.
3). Colandrea JM, Shmookler BM, O Dowd GJ,Cohen MH. Cystic Hypersecretory duct carcinoma of the breast. Report of a case with fine needle aspiration. Arch Pathol Lab Med 1988; 112:560-63.
4). Bogomoletz W-V. Hyperplasia hipersecretoire kystique du sein. Un diagnostic rate en patologie mammaire. Ann Pathol 1994 ;14:131-32.
5)Page DL, Kasami M, Jensen RA: Hypersecretory hyperplasia withatypia in breast biopsies. Pathology Case Reviews 1:36-40,1996
6) Arias-Stella J: Abnormal endometrial changes associated with thepresence of chorionic tissue. Arch Pathol 58:112,1954
7)Fraser JL, Sughra R, Chorny K, et al: Columunar Alteration withprominent _ apical snouts and secretions. Am J Surg Pathol22:1521-1527,1998
8) RosenPP: Columnar cell hyperplasia is associated with lobularcarcinoma in situ and tubular carcinoma. Am J surg Pathol 23:1561,1999
9) Goldstein NS, O’Malley BA: Cancerization of small ectatic ductsof the breast by ductal carcinoma in situ cells with apocrine snouts.Am J Clin Pathol 107:561-566,1997
|
|
|
|
|
|
|
Comentarios
|
|
|
El 22/3/2004 11:48, DR JORGE SAINZ BALLESTEROS dijo:
TRABAJO MUY INTERESANTE Y MUY BIEN ESTUDIADO, INCLUYENDO LA MICROSCOPIA ELECTRONICA. NOS GUSTARIA SABER SI SE EFECTUARON LAS COLORACIONES DE A. BLUE HIERRO COLOIDAL MUCICARMIN DE MAYER FELICIDADES POR TAN EXCELENTE TRABAJO.
El 26/3/2004 12:00, Dr. Walter Marcial Martínez Rodríguez dijo:
Damos las gracias al Dr. Zainz por su comentario. Existe un pequeño error e interpretación, al caso no se le hizo estudio con ME.Lo que ha suceido es que en caso de patologías como la que nos ocupa en que existen pocos casos reportados, cuando se habla, se habla de todos en general, como lo hace Rosen PP. Los estudios inmunohistoquímicos no han podido hacerse, aunque en breve serán llevados a cabo. En este caso, es muy importante demostrar la negatividad para la tiroglobulina. Por otra parte, se refiere en la literatura revisada que mientras que en el caso del carcinoma quiístico hipersecretor, el material del interior de los quistes es PAS + diastasa resistente; mientras que en la hiperplasia quística hipersecretora el epitelio de revestimiento de los quistes es S-100 +; en el núcleo y en el citoplasma. Inmunofenotipaje aparte, resulta innegable que los detalles citoqrquitecturales de nuestro caso se corresponden, en todos sus detalles, con la descripción original del carcinoma quístico hipersecretor, por Rosen PP y Scott M, 1984 (1)
El 26/3/2004 18:12, DR JORGE SAINZ BALLESTEROS dijo:
LA ACLARACION DEL DR. WALTER ES ADECUADA, PERO QUISIERA SABER SI LAS COLORACIONES DE A.BLUE, HIERRO COLOIDAL FUERON HECHAS O NO PARA PRECISAR MUCOPOLISACARIDOS ACIDOS. FELICITO DE NUEVO A LOS AUTORES.
El 27/3/2004 15:36, Dr. Walter Marcial Martínez Rodríguez dijo:
Estimado profesor: En breve le haremos las coloraciones para mucopolisacáridos ácidos recomendadas, aunque sentimos gran curiosidad por conocer el interés tan marcado mostrado por Ud. en estas coloraciones, en particular Saludos cordiales, en el nombre de los autores y en el mio propio; le damos las gracias nuevamente Walter
Hacer un comentario a este Trabajo
|
|
|
|
















