
ISBN: 978-84-692-76778
 COMUNICACIONES
COMUNICACIONES
Nº 1598. Patología Quirúrgica
|
Carmen Nieves Hernández León[1], Rosa Nieves Rodríguez Rodríguez[1], Sonia García Hernández[1], Candelaria García Castro[1], María del Carmen Martín Corriente[1], Josefina Cruz Jurado[1], Manuel Jerez Herrera[1], María del Pino García Suarez[2], Hugo Alvarez-Argüelles[1], Antonio Isaac Martín Herrera[1] |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
lexapro side effects after stoppinglexapro side effects headache falsificator.com lexapro side effects appetiteantabuseantabuse transeo.sevenlafaxine and alcohol ukvenlafaxine alcohol use disorderIntroducción: El tumor estromal gastrointestinal (GIST) representa una neoformación mesenquimal poco frecuente (0.2 % de los tumores gastrointestinales). Está descrita su asociación a diferentes entidades (Neurofibromatosis, Sindrome de Carney). Además hay algunos casos descritos en los que se asocia a otros tumores, no necesariamente mesenquimales. Descripción del caso: Paciente varón de 65 años que se diagnóstica de adenocarcinoma de próstata. Posteriormente, en meses, se interviene por un tumor intestinal con características morfológicas de GIST. A los 6 meses debuta con un nódulo pulmonar que histológicamente se corresponde con un adenocarcinoma pulmonar. Siete meses más tarde presenta una masa hepática cuyo diagnóstico es de metástasis de un GIST. Comentario del caso: Presentamos este caso por tratarse de un paciente con 3 neoplasias diferentes, dos de ellas epiteliales y una mesenquimal, siendo esta última la que da metástasis. Cuando se describe un GIST en un paciente con otro tumor, generalmente es un hallazgo incidental y una lesión pequeña, poco agresiva clínicamente. En nuestro caso se trata de un GIST de alto riesgo, con metástasis hepática. Hay que tener en cuenta que cada vez la incidencia de varias neoplasias en un mismo paciente es mayor, por lo que se debe conocer y realizar todas las técnicas inmunohistoquímicas y moleculares posibles y siempre valorar la posibilidad de un GIST incidental asociado.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
El término GIST define un grupo heterogéneo de neoplasias constituido por células fusiformes o epitelioides, que tiene su origen en la célula intersticial de Cajal. Al principio se consideraban tumores de músculo liso y su nomenclatura fue variada (Leiomioma epitelioide, Leiomiosarcoma epitelioide o Leiomioblastoma). Representa el 0.2 % de los tumores gastro-intestinales. Para que se desarrollen estos tumores es preciso una mutación, que en la mayoría de los casos (80%) se produce del gen kit. Con la implantación de las técnicas inmunohistoquímicas, de microscopia electrónica y el estudio molecular, se ha reconocido como una entidad clínico-patológica diferente para la cual existen terapias dianas dirigidas contra el receptor c-kit. Está descrita la asociación de los GISTs a diferentes entidades, tales como la Neurofibromatosis y el Sindroma de Carney y cada día se describen más casos de coexistencia de GISTs con otros tumores. Presentamos este caso por tratarse de un paciente con 3 neoplasias diferentes, dos de ellas epiteliales y una mesenquimal tipo GIST, siendo esta última agresiva y con metástasis en poco tiempo.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
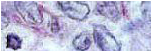
Paciente varón de 65 años diagnosticado de adenocarcinoma de próstata (Score de Gleason 3+3=6), con afectación de ambos hemisferios prostáticos, respetando la cápsula así como las vesículas seminales (pT2c) (fig. 1). Posteriormente, en meses, se interviene por un tumor intestinal de 8.5x7.5 cm, vegetante con zonas excavadas y de aspecto ulcerado. Al corte la consistencia era moderada con áreas quísticas y necróticas. Histológicamente se correspondía con una proliferación de células de fusiformes, de patrón fascicular. El citoplasma de las células era eosinófilo y los núcleos elongados, en ocasiones pleomórficos y con frecuentes figuras de mitosis (>5/50 CGA). Presentaba áreas de necrosis (fig. 2). Las células neoplásicas demostraban positividad inmunohistoquímica para Vimentina, CD-34 y CD-117, así como focal para Actina (figs. 3 y 4). La neoformación ulceraba la mucosa y perforaba la serosa. Los bordes de la pieza estaban libres de signos tumorales. El diagnóstico fue tumor estromal gastrointestinal (GIST) de intestino delgado, de 8.5 cm, que ulceraba la mucosa, con signos de necrosis, >5 mitosis/50 CGA y bordes laterales libres. A los pocos meses debuta con un nódulo pulmonar de 3.9 cm de diámetro mayor, en lóbulo inferior derecho, que histológicamente se correspondía con un adenocarcinoma pulmonar, moderadamente diferenciado de patrón acinoso-papilar, con metástasis ganglionares linfáticas en 2 adenopatías paraesofágicas (pT2N2) (fig. 5). A los 7 meses presenta una masa hepática. Se realiza una biopsia y se observa proliferación mesenquimal cuyas características morfoinmunohistoquímicas eran similares a las de la lesión del intestino delgado, y cuyo diagnóstico fue de metástasis de un GIST (figs. 6 y 7).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
La coexistencia de tumores del estroma gastrointestinal (GIST) con otros tumores sincrónicos o metacrónicos, predominantemente adenocarcinomas, representa un fenómeno que ha ido aumentando en los últimos 5 años (1y 2). Lo más frecuente es la asociación con adenocarcinomas del tubo digestivo, bien gástricos o intestinales, pero hay algunos casos publicados donde se demuestra la asociación con carcinomas de otras localizaciones, tales como con el carcinoma de próstata hasta en un 9% de los casos de una revisión de 4813 casos, publicados en un artículo en el 2006 por Agaimy A. et al (3). En este mismo articulo se comenta que la asociación con carcinoma de pulmón ocurre en un 5 % de los casos. Otros tumores a los que se describe asociación es a linfoma / leucemia (7%), carcinoma de mama (9%), carcinoma de riñón (6%), tumores del tracto genital femenino (5%), tumor carcinoide (3%), sarcomas óseos y de partes blandas (3%), melanoma (2%) y seminoma (1%). Se define como GIST microscópico aquel que no tiene clínica y cuyo tamaño no supere 1 cm. En las series revisadas esto ocurre hasta en un 10% de los pacientes operados por carcinomas esofágicos y en un 35% de los pacientes operados por carcinoma gástrico. Así mismo, en las autopsias realizadas a pacientes con GIST, un 10% son variante microscópica (4 y 5). Como se sabe los sitios más comunes de localización de GIST son el estómago (50%) y el intestino delgado (25%), y los demás se reparten entre esófago, colon, omento, retroperitoneo y mesenterio, estos últimos llamados extragastrointestinales o EGIST (6, 7). Histológicamente se presentan con un patrón fusocelular (2/3 partes de los casos), epitelioide (8%) o mixto (15%). Pueden aparecer cambios microquísticos, hialinización sobretodo perivascular, o incluso la presencia de fibras esquenoides, así como infiltrado inflamatorio. Las metástasis suelen asemejar al patrón inicial, pero con mayor índice mitótico. Inmunohistoquímicamente la batería que se debe realizar para el diagnóstico de un GIST debe comprender CD-117, CD-34, Actina, Desmina, Proteina S-100 y Ki-67 para valorar el índice proliferativo. El CD-117 es la técnica más sensible y específica pero es importante tener en cuenta que hay otros tumores que también demuestran positividad para CD-117 como son el Melanoma, Angiosarcoma, Seminoma, Mastocitoma, etc. Un 5% de los GIST son CD-117 negativos, hecho más frecuente en los localizados en estómago o los EGIST y aquellos que tiene apariencia epitelioide. Con frecuencia, estos casos demuestran mutación en PDGFRA, en lugar de en el gen kit. Nuevas proteinas que se expresan en los GIST son la proteinquinasa C theta y el DOG 1. Como se ha comentado la mutación genética más frecuente en los GIST es la del gen c-kit, representando un 80-95% de los casos. Las mutaciones pueden ocurrir en los exones 11 o 9, y con menos frecuencia 13 y 17. Lo más común es la mutación del exon 11 (70% de los GISTs con mutación c-kit). Cuando no se demuestra mutación del gen kit, debe estudiarse la mutación PDGFRA, que ocurre en un 5-8% de los casos. En ocasiones no se demuestra mutación alguna, en cuyo caso se habla de Wild-type, representando hasta un 15% de los GIST (8, 9). En cuanto a su comportamiento y la estratificación del riesgo, en el año 2001 se llegó a un Consenso del Instituto Nacional de La Salud , basado en el grupo de trabajo de los GIST. En este consenso se tiene en cuenta, para estratificar estos tumores, el número de mitosis, así como el tamaño tumoral (tabla 1) (10). Estudios posteriores, algunos de ellos realizados por el Instituto de Patología de Las Fuerzas Armadas (11 y 12), con largas series de Cohortes, destacan la importancia de la localización del tumor para el pronóstico, así como de la ulceración de la mucosa o afectación del peritoneo y la diseminación a la cavidad abdominal. Intentan destacar, que los GIST gástricos tienen mejor pronóstico que los no gástricos y sobretodo que los intestinales, a igual tamaño y actividad mitótica (tabla 2) (13). Además refieren que los GIST con síntomas clínicos, aquellos que presentan una morfología epitelioide o mixta y los GISTs altamente celulares, tienen peor pronóstico. En cuanto a su base genética, concluyen que los tumores con mutaciones en los exones 11 y 13 del gen kit, tienen peor pronóstico post-tratamiento. Es importante la estratificación del riesgo, ya que cada día hay más tratamientos adyuvantes sistémicos, que se administran a los pacientes de mayor riesgo. Todos los GISTs tienen un cierto potencial maligno, pero esta hipótesis está cambiando con estudios que indican que los GISTs gástricos microscópicos, relativamente comunes en la población general, tienen poco o incluso que no tienen potencial maligno.
Tabla 1. Criterios de clasificación de los GISTs del consenso de NIH. 2001
Tabla 2. Propuesta de modificación de la clasificación del consenso de NIH, para seleccionar pacientes con GIST para terapía adyuvante. 2008
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
(1): Christopher K et al. Synchronous colorectal Adenocarcinoma and gastrointestinal stromal tumor in Merckel`s diverticulum; an unusua l association. World J Surg Oncol 2009;7:33 (2): Yan-Jun Liu et al. Synchronous incidental gastrointestinal stromal and epitelial malignant tumors. World J Gastroenterol 2009; 15: 2027-2031. (3): Agaimy A et al. Ocurrence of other malignancies in patient with gastrointestinal stromal tumors. Semin Diagn Pathol 2006; 23(2):120-129. (4): Abraham et al. Seeding mesenchymal tumors (gastrointestinal stromal tumors and leomyomas) are common incidental tumors of the esophagogastric. Am J Surg Pathol 2007;31:1629-35. (5): Nilsson et al. Gastrointestinal stromal tumors: the incidence, prevalence, clinical course, and prognostication in the pre-imatinib mesylate era-a population-based study in western Sweden. Cancer 2005;103:821-29. (6): Miettinen et al. Gastrointestinal stromal tumours: recent advances in understanding of their biology. Hum Pathol 1999; 30:1213-20. (7): Emoly TS et al. Prognosis of gastrointestinal smooth muscle (stromal) tumor. Am J Pathol 1999;23:82 (8): Corless CL et al. Annu Rev Pathol 2008;3:557-586 (9): Corless CL et al. J Clin Oncol 2004;22: 3813-25 (10): Flecher et al. Diagnosis of gastrointestinal stromal tumors: a consensus aproach. Hum Pathol 2002;33:459. (11): Miettinen et al. Gastrointestinal stromal tumors of the stomach: a clinicopathology, inmunohistochemical, and molecular genetic study of 1765 cases with long-term folow-up. Am J Surg Pathol 2005;29:52-68. (12): Miettinen et al. Gastrointestinal stromal tumors of the yeyunum and ileum: a clinicopathologic, inmunohistochemical, and molecular genetic study of 906 cases before imatinib with long-term folow-up. Am J Surg Pathol 2006; 30:477-89. (13): Heikki Joensuu. Risk stratification of patients diagnosed with gastrontestinal stromal tumor. Hum Pathol 2008; 39:1411-19.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
- NIEVES Maira MAIRA GONZALEZ - ESPAÑA (02/11/2009 16:58:07)
- MARIA LUISA GOMEZ DORRONSORO - ESPAÑA (02/11/2009 17:27:22)
- Carmen Nieves Hernández León - ESPAÑA (Autor) (04/11/2009 9:40:34)
- NIEVES Maira MAIRA GONZALEZ - ESPAÑA (05/11/2009 16:55:22)
- Mª Auxiliadora Aparicio Vaquero - ESPAÑA (13/11/2009 22:33:34)
- Victor Leonel Argueta Sandoval - GUATEMALA (24/11/2009 17:04:43)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
Web mantenido y actualizado por el Servicio de informática uclm. Modificado: 16/06/2015 11:37:37
